高效纖維素降解真菌的分離鑒定
宋艷雨 等
摘要:經過剛果紅染色法初篩和秸稈失重率測定復篩從腐爛的樹木樣品中分離到一株高效纖維素降解菌CBSX2。根據其形態學及遺傳分析鑒定CBSX2菌株為鏈格孢屬(Alternaria ochroleuca)。關于鏈格孢菌屬的纖維素分解菌的研究相對較少,CBSX2鑒定為纖維素的生物降解提供了新的菌種資源。
關鍵詞:纖維素 真菌 鑒定 鏈格孢屬
在自然領域,纖維素是貯存數量最多、分布范圍最廣的能夠再生的天然碳水化合物,其大多分布在木頭、秸稈等物質的細胞壁中,每一年利用光合作用能夠產生纖維素將近十億噸。但是纖維素很難分化,以致其的應用有很大的制約性。長時間以來,纖維素的分化大多是酸水解,在十九世紀的二十年代,人們就知道了酸水解能夠用來制造糖漿,運用到工業的各個領域。酸水解包括兩種方式,一種是稀酸水解,另外一種是濃酸水解。前者的運用環境是較高的壓力與較高的氣溫,水解反應的時長區間為幾秒至幾分鐘,較多運用到連續生產過程中;后者則與其相反,其的運用環境是較小的壓力與較低的氣溫,和前者比較,其的水解反應時長更長。在酸水解時會有主要要素影響單糖的得率,重點包含氣溫、壓力、生物物質顆粒的體積、酸濃度、液態與固態的比重等。在酸水解時,木糖非常迅速的分化為糠醛,葡萄糖分化為羥甲醇糠醛,部分抑制因子因此形成,導致了糖源的無謂浪費,并且限制了乙醇的發酵過程,所以,酸水解纖維素工業依舊需要持續的健全。
當前的探究大部分集聚在數量不多的菌株上,譬如里氏木霉等。但是此菌株依舊存有產酶費用高、酶活性不穩固、作用PH范疇較窄等不足。所以尋求更多、更有效、影響范疇更大的新菌種是特別重要的。
本文從腐爛樹木中分離到幾株高效降解纖維素的微生物菌株,其中菌株CBSX2纖維素降解能力最強,鑒定CBSX2菌株為鏈格孢屬(Alternaria ochroleuca)。我國及其他國家針對鏈格孢菌屬的纖維素酶的探究寥寥無幾,為纖維素的分化提供了全新的菌種資源。
1 材料與方法
1.1 實驗材料
樣品采自長白山野生腐爛樹木,裝入自封袋,4℃保存。
1.2 培養基
升級之后的剛果紅平板培養基:(NH4)2SO4 2g,MgSO4 0.5g,K2HPO4 1g,NaCl 0.5g,纖維素粉2g,剛果紅0.4g,瓊脂20g,純凈水1000mL,自然pH值。
1.3 實驗方法
1.3.1 纖維素降解作用真菌的分離
1.3.1.1 具備纖維素分解性能的菌株的初次選擇
能夠分解纖維素的微生物類型眾多,學者們探究較多的是細菌與真菌,可是因為前者形成的纖維素酶大部分是胞內酶,因此后者變為學者們探究的焦點,在探究過程中,纖維素酶的檢測方式特別繁雜,而運用平板菌落選擇能夠大致判定纖維素酶的活動,進而降低試驗的工作數量,經過升級以后的平板培養基,其中,纖維素粉以每升0.1mol的濃度鹽酸處置二十四小時以后,水洗到酸堿值為中性,之后過濾,讓其干燥。經流水沖洗二十四小時以后烘干,不但菌落發育優良,大小合適,并且紅色水解圈邊緣清楚,大小清晰,效果十分理想。
稱取10g樣品到90ml無菌水中,在搖床中震蕩30min。然后靜置吸取1ml上清液到9ml無菌水中,以此一直稀釋到102,103,104,105濃度,吸取0.1ml涂布于剛果紅纖維素瓊脂平板上,在28℃恒溫培養箱中培養2到7天,篩選出在平板上發育較為迅速的紅色的濃度較大的透明水解圈的菌落,且測量其水解圈的體積實施劃線分隔,認定是比較單純的單菌落以后,栽種到保藏培養基上儲存。
1.3.1.2 根據秸稈失重率進行復篩
①將5毫升菌液接種到50毫升復篩培養基中,常溫28攝氏度震蕩培養,馴化三到四次,分解時間逐步減少,來提升菌株對天然纖維素的分解水平。
②把1毫升菌液接種到50毫升復篩培養基中,常溫28攝氏度震蕩培養,分別在0天,第4天,第8天,第12天,第16天的時候測驗其秸稈重量的變化狀況,記錄秸稈的失重水平,從中篩選出失重水平高的菌株作為復篩菌株。
秸稈失重率核算方式:把上文提到的五個時間的培養物,用無菌的水清洗,使用兩百目的尼龍網過濾,反復沖洗,之后瀝干水分,到105°烤箱進行烘干。
1.3.2 具有纖維素分解作用的真菌的鑒別
1.3.2.1 形態學觀察
對已經分離的纖維素分解真菌的類型鑒別依據宏觀的培養形狀菌落特點,微觀層面的個體外形特點和部分生物層面的特點加以表述與經典類型劃分鑒別。把菌接種在固態培養基上,采用點植的方法進行接種,也就是以接種針選取少些的菌絲點植在平板的核心的地方,之后在28度的氣溫下培養一些天數,進行觀察,查看菌落特點。分別從菌落的邊際與核心位置選擇少些的菌絲,放到顯微鏡的下面,進行普通的顯微鏡檢驗。
1.3.2.2 菌種的分子鑒別
運用CTAB法對選出的有催芽成效的真菌實施基因組DNA的選擇,而且用使用概率較高的物質ITS4和ITS5實施基因的增加與秩序的測量。
ITS4 5TCCTCCGCTTATTGATATGC 3
ITS5 5GGAAGTAAAAGTCGTAACAAGG 3
PCR反應機制是50μL,PCR buffering(Mg2+)加1/10,dNTPs各200μM,引物各0.2μM,taqDNA聚合酶 1-2.5U,模板100ng,無菌雙蒸水補足。反應要求是 94度預變性10分鐘, 94度變性45秒, 55度退火45秒, 72度延伸2分鐘,共計三十五個循環,72度延伸10分鐘,將回收后的PCR產物送往測序公司進行測序,得到的序列以blast搜索為基礎,選擇和探究菌株次序最為類似的種亦或最相似的進化分支代表菌株的序列加以比較,使用Mega6.0工具通過ML算法,利用bootstrap 1000次建樹結果建立進化樹。
2 結果與分析
2.1 具有纖維素分解能力的真菌篩選
2.1.1 具有纖維素分解能力的菌株的初篩
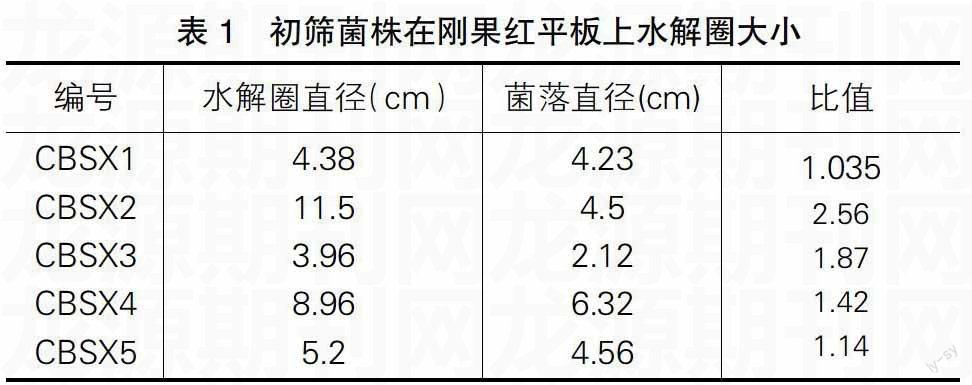
從采集的樣品中在初篩剛果紅培養基上有透明圈的菌株有5株,分別命名為CBSX1,CBSX2,CBSX3,CBSX4,CBSX5
表1 初篩菌株在剛果紅平板上水解圈大小
[編號\&水解圈直徑(cm)\&菌落直徑(cm)\&比值\&CBSX1
CBSX2
CBSX3
CBSX4
CBSX5\&4.38
11.5
3.96
8.96
5.2\&4.23
4.5
2.12
6.32
4.56\&1.035
2.56
1.87
1.42
1.14\&]
2.1.2 具有纖維素分解能力的菌株的復篩結果
通過測定初篩菌株的秸稈降解率,進一步通過對秸稈降解效果的測定,復篩出對纖維素降解最好的菌株,未接種纖維素降解菌的CK其降解率僅為10%,CBSX2表現出的效果最好達到了23%。
2.2 具有纖維素分解作用的真菌的鑒定
2.2.1 形態學鑒定結果
篩選出的高效纖維素降解真菌CBSX2菌落形態為灰色絨毛狀,質地緊致,在PDA上漲勢很快。邊際整齊,表現出波浪形狀或者裂片形狀,在培養基的層面能夠見到有黑顏色的孢子堆出現。發育完成的分生孢子包括4到8個橫膈膜,1到5個總隔膜,呈現出卵形、橢圓形等等,沒有發育成熟的孢子是沒有顏色的,發育成熟以后變為黑色。
2.2.2 菌種分子鑒定結果
本文以ITS4和ITS5為引物,對從樣品中分離的真菌菌株進行了擴增,并對擴增產物進行了測序。依托blast搜索,選擇和探究菌株次序最相近的種亦或最相似的進化分支代表菌株的序列加以比較,使用Mega6.0工具通過ML算法,利用bootstrap 1000次建樹結果建立進化樹。結果表明CBSX2真菌與鏈格孢屬(Alternaria ochroleuca)的同源相似性達到99%,氨基酸序列的相似性也達到了92%。
3 討論
當前,瑞氏木霉是全球探究與運用最多的纖維素工業微生物。美國的能源署提供了1000萬美金的幫助,在瑞氏木霉的纖維素生產開發方面獲得了顯著的探究成果,申請了很多項專利。中國在此方面的開發是大幅度滯后于全球領先水平的,因此在將來瑞氏木霉的纖維素生產開發過程中,極有可能遇到技術壁壘。
國內外關于鏈格孢菌屬的纖維素酶的研究較少,又為其的應用方向增添了一筆。為纖維素的分解提供了全新的菌種類型,為得到自主知識產權的纖維素分解提供了條件。
本文雖然確定了纖維素降解的能力,但其作用機理并未深入研究,是否產生較為完整的纖維素酶系和種類還有待進一步研究。
參考文獻:
[1]岳耀峰,黃曉艷,龔明福.纖維素分解菌篩選方法初步研究[J].安徽農業科學,2010,38(4):1667-1668,1779.
[2]王得武,姚拓,楊巧麗,等.高效穩定纖維素分解菌群篩選及其分解特性研究[J].草業學報,2014,23(2):253-259.
[3]崔宗均,李美丹,樸哲,等.一組高效穩定纖維素分解菌復合系MC1的篩選及功能[J].環境科學,2002,23(3):36-39.
[4]陳洪章.纖維素生物技術[M].北京:化學工業出版社,2011:90.
[5]許玉林,鄭月霞,葉冰瑩,等.一株纖維素降解真菌的篩選及鑒定[J]微生物學通報,2013,40(2):220-227.
[6]張超,李艷賓,張磊,等.纖維素-剛果紅培養基鑒定產纖維素酶真菌的機理研究[J].纖維素科學與技術,2007,15(2):39-44.
[7]熊格生,劉志,吳莎莎,等.一株高效稻草纖維素降解真菌的篩選與鑒定[J].湖南師范大學自然科學學報,2011,34(4):64-68.
[8]Yoon J J,Kim Y K. Degradation of crystalline cellulose by the brown-rot basidiomycete Fomitopsis palustris[J].J Microbiol,2005,43(6):487-492.
[9]Adsul M G,Bastawde K B,Varma A J,etal.Strain improvement of Penicillium janthinellum NCIM 1171 for increased cellulose production[J].Bioresource Technol,2007,98(7):1467-1473.
[10]Sanchez C.Lignocellulosic residues:biodegradation and bioconversion by fungi[J].Biotechnology Advances,2009,27:185-194.