電解質溶液中粒子濃度大小比較
張紅衛


摘要:聯系教學實際,從定性、定量兩個角度認識電離平衡與水解平衡,從外因、內因兩個角度認識影響平衡移動的因素。對三個守恒定律的來龍去脈、注意事項進行闡述,突…電解質溶液中粒子濃度大小比較所需的主十知識。介紹并分析了快速處理問題的解題策略。
關鍵詞:電解質;粒子;濃度大小;解題策略
文章編號:1005 - 6629(2015)5 - 0086 - 04
中圖分類號:G633.8
文獻標識碼:B
粒子濃度大小比較是電解質溶液的教學重點、考試熱點,它涉及弱電解質的電離、溶液的酸堿性、鹽類的水解等知識點。因綜合性強,也就成了學生學習的難點。
本文在系統性理清主干知識的基礎上,介紹解題策略,讓學生看到什么問題,就用什么方法,見招拆招,以便學生能快速解決問題。
1 從定性到定量,認識兩個基本理論
1.1 電離理論
弱電解質(弱酸、弱堿)在水溶液中的電離程度很小,主要以分子形態存在。
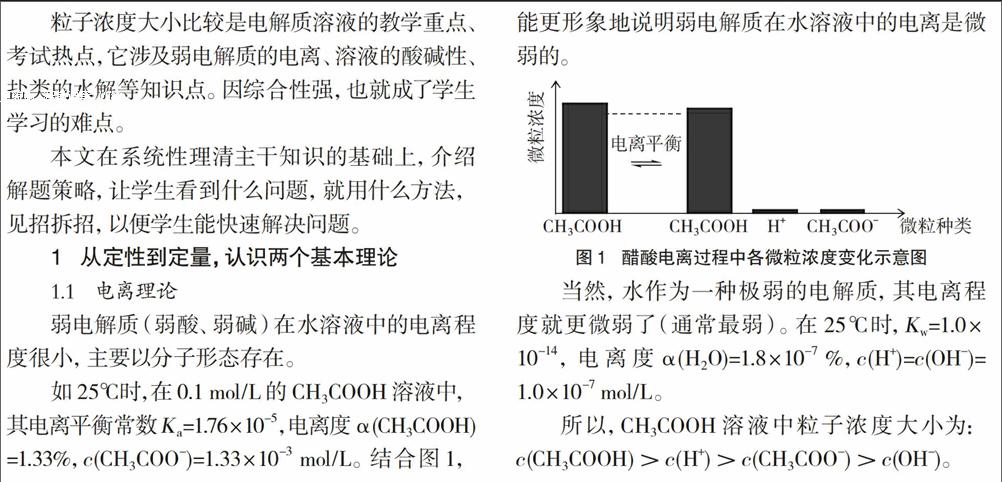
如25℃時,在0.1 mol/L的CH3COOH溶液中,其電離平衡常數Ka=l.76×10-5,電離度α(CH3COOH)=1.33%,c(CH3C00-)=1.33×10-3 mol/L。結合圖1,能更形象地說明弱電解質在水溶液中的電離是微弱的。
當然,水作為一種極弱的電解質,其電離程度就更微弱了(通常最弱)。在25℃時,Kw=1.0×10-14,電離度α (H20)=1.8×10-7%,c(H+)=c(OH一)=1.0×10-7 mol/L。
所以,CH3COOH溶液中粒子濃度大小為:c(CH3COOH)>c(H+)>c(CH3COO-)>c(OH-).
1.2 水解理論
在水溶液中,鹽電離出的弱離子(弱酸根離子或弱堿陽離子)進行水解反應的程度很小,它們主要以離子形態存在。
如25℃時,在0.1 mol/L的CH3COONa溶液中,其水解平衡常數Kh=5.68 x10 -10,水解度h(CH3COONa)=0.0075%,c(CH3COOH)=7.5×10-6 mol/L。結合圖2,能更形象地說明鹽電離出的弱離子在水溶液中的水解是微弱的。
所以,溶液中粒子濃度大小為:c(Na+)>c(CH3COO-)>c(OH-)>c(CH3COOH)>c(H+)。
在教學過程中,還可以用“西瓜與芝麻”、“九牛一毛”等詞語,來加深對弱電解質電離、鹽類水解程度比較微弱的認識。
2 從外因到內因,判斷正逆主次關系
2.1 當不同電解質溶液中存在同一平衡時,通常要從外因出發,判斷其他離子對同一比較對象所在平衡的影響:是促進,還是抑制
如在25℃時,濃度均為0.1 mol/L的下列四種溶液:①(NH4)2S04②NH4C1③NH4HS04④CH3COONH4,其c(NH+/4)的大小比較如下:
根據溶質的構成以及NH+/4的水解是微弱的,故有c(NH+/4):①>②③④。
NH+/4在溶液中有下列水解平衡:NH+/4+H20NH3.H20+H+,NH4HS04電離出的H+使上述平衡逆向移動,其剩余的c(NH+/4)相對于NH4C1略多;CH3COONH4電離出的CH3COO-水解呈堿性,使上述平衡正向移動,其剩余的c(NH+/4)相對于NH4C1略少,所以,c(NH+/4):③>②>④。
綜上所述,四種溶液中c(NH+/4):①>③>②>④。
2.2 當同一電解質溶液中存在多個平衡時,通常要從內因出發,判斷它們之間的主次(相對強弱)關系
(1)多元弱酸的電離是分步的,且以一級電離為主(一級電離產生的H+對二級電離平衡有抑制作用)。
如在H2S03溶液中,粒子濃度的大小關系由下列三個平衡決定:
(3)在等濃度的一元弱酸與該酸的強堿鹽混合溶液,或二元弱酸的酸式鹽(見例題B項)的溶液中,電離與水解并存,其主次關系,決定了溶液的酸堿性。反之,溶液的酸堿性也反映了電離與水解的主次關系。注意:溶液的酸堿性可由信息或事實進行判斷。
如在25℃時,濃度均為0.1 mol/L的CH3COOH與CH3COONa混合溶液,pH=4.75。其粒子濃度的大小關系由下列三個平衡決定:
平衡時,根據信息pH=4.75,有:O.lα1+c>O.lα2+c,即:α1>α2。也就是說,CH3COOH電離大于CH3COONa水解。義因為兩者都是微弱的,有:c (CH3COOH)=O.l-0.1αl+0.1α2略小于0.1;c(CH3COO-)=O.l+O.lαl-O.lα2略大于0.1。
所以,溶液中粒子濃度大小為:c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-).
在教學過程中,對于初學者或基礎一般的學生,此處不宜解釋為:因為“電離大于水解”,所以"c(CH3COO-)>c(Na+)>c(CH3COOH)”。這樣解釋過于籠統,對此難點,建議列式比較。
3 從過程到結果,理解三個守恒定律
3.1 電荷守恒定律
電解質溶液中,不論存在多少種離子,溶液總呈電中性。即所有陽粒子所帶正電荷總量等于所有陰粒子所帶負電荷總量。
如:Na2C03溶液中的電荷守恒式:____________________________
注解:(1)寫電荷守恒式時,首先要能找全溶液中的陰、陽離子,其方法是寫全溶液中溶質與溶劑的電離、水解方程式。
(2)“
”前添“2”的理由:“
”表示“
”的物質的量,而電荷守恒式描述的是正、負電荷總量之間的守恒關系,乘以“2”,才能把離子的物質的量轉化為離子所帶負電荷的物質的量。同樣,上式中的其他離子,它們前面都已乘以“1”,只不過“1”可以省去,但“2”不能省。這點特別要注意。
(3)電解質溶液中通常不用物質的量而用濃度來表示電荷總量之間的守恒關系,上式兩邊除以V溶液,即得用離子濃度表示的電荷守恒式:________________________________ 。
3.2 物料守恒定律
電解質溶于水后,某一粒子因為部分電離或水解,最終它會以多種形式存在。該粒子的起始濃度等于它在溶液中各種形式粒子的濃度和。
如:Na2CO3溶液中的物料守恒式:c(Na+)=____________________________。
注解:物料守恒式實際上是質量守恒定律的一種具體應用。此式中特別要注意:為什么有2倍關系,誰是誰的2倍,碳元素的存在形式有哪些?有三種存在形式。根據質量守恒定律有:____________________________________________,等式兩端除以V溶液,即得用離子濃度表示的物料守恒式。
3.3 質子守恒定律
電解質溶液中,各種粒子失去的質子( H+)總量等于得到的質子總量。
如:Na2C03溶液中的質子守恒式:c(0H-)=c(H+)+________________ 注解:(1)快速書寫質子守恒的方法一一圖解法。
第一步:找出電解質溶液中能發生質子得失的粒子(基準態物質)。
第二步:寫出基準態物質得失質子后的粒子。
第三步:根據得失質子的量(對應粒子的系數,這點特別要注意),寫出質子守恒式。
Na2C03溶液中質子守恒式的圖解法如圖3所示。
(2)除了用圖解法,還可用加減法書寫質子守恒式。
Na2C03溶液中,電荷守恒式與物料守恒式相減(或相加),消去c(Na+)項,因為強離子(強酸根離子或強堿陽離子)既不得質子也不失質子,同樣可得其物料守恒式。
4 從知識到方法,掌握四個解題策略
學生在把知識點掌握到位后,還需掌握解題策略。根據粒子濃度大小比較的常見題型,筆者確定“兩者反應定溶質、單個比較找來源,看見等號用守恒,對照答案再替換”為解題策略,供學生參考應用。下面舉一例說明。
例25℃時,下列有關溶液中微粒的物質的量濃度關系正確的是(
)
A.pH=3的CH3COOH溶液與pH=11的NaOH溶液等體積混合:
c(CH3COO-)>c(Na+)>c(CH3COOH)
B.0.1 mol/L的NaHCO3溶液:
解析:A項,“兩者反應定溶質”,不僅要確定反應后溶質的類別,還要確定溶質間濃度的相對大小。已電離的CH3COOH和NaOH恰好完全反應生成CH3COONa,由于醋酸的電離是微弱的,所以反應后的溶質為少量的CH3COONa和大量的CH3COOH。根據內因:CH3COOH電離大于CH3COONa水解,且兩者都是微弱的;外因:c(CH3COOH)》c(CH3COONa)。再模仿本文2.2(3)的列式比較法,得:c(CH3COOH)>c(CH3COO-)>c(Na+),即可判斷A項錯。
B項,“單個比較找來源”,就是書寫相應的電離、水解方程式,找出比較對象的來源,然后根據電離、水解的程度再進行大小比較。________、c(H2C03)的大小取決于下面兩個平衡的主次關系:
根據溶液呈堿性的事實,有c(OH一)>c(H+)。即HC03的水解大于電離。再結合水解、電離都是微弱的,即可判斷B項正確。
C項,“看見等號用守恒”,若守恒式某邊的微粒含有同一種特定元素(非氫、氧元素),如“碳”元素,考慮物料守恒,又因為:________,即可判斷C項錯誤。
D項,若守恒式兩邊的微粒分別為全陽、全陰離子,則考慮電荷守恒式,不必再考慮質子守恒式。當然,在解答過程中,還需“對照答案再替換”。這就是常說的逆向思維或拐一、二個彎。根據電荷守恒得:____________________________,對照答案,只需____________,即可判斷D項正確。
正確答案為:B、D
當然,沒有哪一種方法能全面覆蓋。電解質溶液中粒子濃度大小比較作為教學的重點、難點,教師還要通過后續教學精選、精析例題,做到具體問題具體分析,才能讓學生更加全面掌握、靈活運用。
參考文獻:
[1]北京師范大學等.無機化學(第三版)[M].北京:高等教育出版社,1992
[2]劉樹領.電解質溶液教學中常見疑難點的探究[J].化學教學,2013,(6):74~76
[3]田益明.溶液粒子濃度大小比較的解題策略[J].化學教學,2012,(7):72~74

