海水酸化對中華哲水蚤全蛋白表達的影響
張達娟,郭東暉,王桂忠,李少菁*
(1. 天津農學院 水產學院 天津市水產生態及養殖重點實驗室,天津 300384;2. 廈門大學 海洋與地球學院,福建 廈門 361005)
海水酸化對中華哲水蚤全蛋白表達的影響
張達娟1,郭東暉2,王桂忠2,李少菁2*
(1. 天津農學院 水產學院 天津市水產生態及養殖重點實驗室,天津 300384;2. 廈門大學 海洋與地球學院,福建 廈門 361005)
運用蛋白質組學相關技術對暴露于酸化海水中的中華哲水蚤全蛋白進行分析,結果表明,對照組、CCO20.08%和CCO20.20%處理組中華哲水蚤的雙向電泳圖譜上可以分別分辨出1 191、1 117和946個蛋白點,選取其中43個差異蛋白進行MALDI-TOF/TOF質譜鑒定,成功鑒定出23個差異蛋白,這些蛋白主要與蛋白合成和分解、能量代謝、DNA分子修復以及解毒過程有關。
二氧化碳;酸化;中華哲水蚤;蛋白質組學
1 引言
由于人類活動,尤其是礦物燃料燃燒、植被破壞導致大量溫室氣體排放,二氧化碳(CO2)作為其重要組成部分,在大氣中的濃度已達到0.038%[1],至本世紀末,將升至0.075%。海洋作為重要的碳匯,每年可以吸收CO2排放量的1/3,大量CO2溶于海水,導致其碳酸鹽系統及其他化學性質的改變,海水pH已由工業化前的8.20下降至2007年的8.10,至本世紀末將繼續降低0.3~0.5個單位[2—3],這種海水二氧化碳分壓升高、pH降低,碳酸鹽系統發生改變的現象即為海水酸化(ocean acidification)。
近年來,很多學者已開展海水酸化對生物(主要為個體較大的生物或鈣化生物)影響的研究工作,酸化不僅影響生物的種群組成、群落結構,還影響其生長、繁殖等一系列生理、生化過程,并具有一定的種類特異性[4—7]。橈足類作為海洋浮游動物的重要組成部分,在海洋物質循環和能量流動過程中起承上啟下的作用,而關于海水酸化對橈足類影響的報道十分稀少。Kurihara等[8—9]以及Zhang等[10—12]對酸化條件下幾種橈足類的存活率、產卵率、孵化率以及抗氧化能力進行過研究,而橈足類對海水酸化響應的分子作用機制卻未見報道。本研究運用蛋白質組學的相關技術,選取我國近岸橈足類的典型代表種類——中華哲水蚤(Calanussinicus)作為受試對象,研究其在酸化條件下機體全蛋白表達情況,尋找并鑒定特異性蛋白及其功能,對揭示橈足類對海水酸化響應的分子機制具有重要意義。
2 材料與方法
2.1 樣品采集
中華哲水蚤采自廈門港附近。樣品用大型 (網孔直徑 505 μm)浮游生物網于夜間水平拖網采得。將采集好的樣品在2 h內帶回實驗室,立即進行挑選、分離,挑選成熟雌性個體 (挑選標準:活潑、雌性生殖節飽滿),經解剖鏡 (SMZ-140,Motic)鏡檢確定后,暫養于結晶皿中。實驗海水取自廈門大學海洋與地球學院海洋生物科學與技術系活體培養室,經砂濾后,用0.45 μm微孔濾膜過濾,其鹽度為29~30,pH為8.10~8.24。
2.2 酸化海水制備
將經過0.45 μm微孔濾膜過濾的海水充分曝氣后分裝到5個500 mL大小的細口瓶中,其中1瓶作為對照,不進行通氣處理,實驗開始前利用酸堿滴定法測定海水總堿度、用pH測定計測定pH,其平均pH為(8.17±0.02)。另外2組海水分別通入混合氣體 (廈門空分特氣實業有限公司提供),其中一組CO2、氮氣和氧氣含量分別為0.08%、78.92%和21.0%;另一組分別為0.20%、78.80%和21.0%。氣體流量用流量計 (ZBWJ-90,正博)控制在300 mL/min左右,運用pH控制器 (pH/ORP-101,HOTEC)控制海水pH,當其達到穩定后通氣自動停止。
2.3 實驗設計
本實驗共設置CCO20.08%和0.20%兩個處理組和一個對照組 (CCO20.038%)。實驗在500 mL的細口玻璃瓶中進行。添加扁藻 (Platymonassp.)和中肋骨條藻 (Skeletonemacostatum)的混合藻液作為中華哲水蚤的餌料,餌料密度分別為0.5 × 104cell/mL和4 × 104cell/mL。每瓶分別投放50只中華哲水蚤成熟雌體,在自然光照控溫 (16℃)條件下連續培養4 d,第3 d用相應CCO2的海水換水,不添加餌料,并挑出死亡個體。實驗結束時,將收集到的中華哲水蚤用MilliQ水清凈后分裝于2 mL離心管中 (每管約50只),-80℃儲存,待提取總蛋白。
2.4 蛋白的提取與定量
2.4.1 蛋白的提取
(1)向收集到的中華哲水蚤中加入1 mLTrizol裂解液,冰浴超聲波破碎;
(2) 加入三氯甲烷,每使用1 mLTrizol加入200 μL三氯甲烷,震蕩15s后,室溫放置5 min;
(3) 4℃,12 000 g離心15 min,去掉無色上清液以及乳白色中層沉淀;
(4) 加入300 μL100%乙醇震蕩混勻,4℃,2 000 g離心5 min,取上清液;
(5) 將上清液轉移到新的離心管中,按樣品∶異丙醇=1∶3的量加入異丙醇,震蕩混勻后,-20℃過夜;
(6) 4℃,14 000 g離心10 min取沉淀;
(7) 向上述沉淀中加入1 mL95%乙醇,震蕩重懸浮后4℃,14 000 g離心10 min,取沉淀,本步驟重復操作兩遍;
(8) 上述操作結束后獲得的沉淀即為蛋白,干燥后將其重溶于相應量的[7 mol/L尿素,2 mol/L硫脲,4% CHAPS (質量體積比)]重溶液中,溶解時間約為1 h;
(9) 蛋白完全溶解后于16℃,20 000 g離心5 min,取上清液,分裝保存。
2.4.2 蛋白的定量
采用Amersham公司的PlusOneTM2-D Quant Kit進行蛋白定量。
2.5 蛋白雙向電泳
2.5.1 等電聚焦電泳
第一向等電聚焦電泳使用18 cm,pH4-7的IPG膠條。按蛋白量為80 μg計算所需樣品體積,將蛋白樣品與0.003 4 g二硫蘇糖醇(0.01 μg/μL)、1.8 μL IPG緩沖液以及重溶液混合至340 μL 。利用IPGphor3 聚焦儀(GE公司,美國)完成等電聚焦過程。等電聚焦參數設置:50 V,13 h;100 V,2 h;200 V,2 h;500 V,1 h;1 000 V,2 h;4 000 V,2 h;8 000 V,50 000 Vhrs。
2.5.2 膠條平衡和SDS-PAGE垂直電泳
等電聚焦完成后,將膠條轉移到裝有平衡緩沖液Ⅰ (5 mL平衡液中含有二硫蘇糖醇 0.05 g)中,15 min后,移入至平衡緩沖液Ⅱ(5 mL平衡液中含有0.125 g 碘乙酰胺)中,15 min后,用TGS (25 mmol/L Tris,192 mmol/L Glycine和0.1% SDS,pH 8.6)潤洗膠條后轉移至12.5%SDS聚丙烯酰胺凝膠上端,0.5%瓊脂糖封頂液封頂,進行第二向SDS-PAGE電泳。電泳參數為:25 mA,30 min;50 mA至電泳結束 (2張膠)。
2.6 凝膠染色、圖像掃描與數據分析
采用硝酸銀染色法對凝膠進行染色[13]。凝膠用ImageScanner掃描儀(GE公司,美國)采集圖像。掃描后的圖像用ImageMaster凝膠圖像分析軟件(GE公司,美國)分析蛋白點。
2.7 酶解
(1)將挖取所得的差異單白點用MilliQ水沖洗2次后加入200 μL脫色液 (0.16 g硫代硫酸鈉和0.1 g 鐵氰化鉀溶于10 mLMilliQ水中),于室溫條件下脫色,脫色時間一般不超過10 min;
(2)脫色后用MilliQ水沖洗3次,每次10 min;
(3)沖洗后向離心管中加入乙腈200 μL,室溫條件下脫水約10 min,直至膠粒變成白色顆粒;
(4)干燥:將上述乙腈吸出后,于超凈工作臺中干燥20 min;
(5) 酶解:加入適量的濃度為10 ng/μL的酶液 (溶于10 mmol/L碳酸氫銨的胰蛋白酶),讓膠粒溶脹,置于4℃冰箱中反應30 min;
(6)孵化過夜:向每個離心管中加入5~10 μL 10 mmol/L碳酸氫銨溶液,于37℃條件下過夜,用于質譜分析。
2.8 質譜分析及蛋白鑒定
0.6 μL樣品與0.6 μL基質液(100 mmol/L α-氰基-4-羥基肉桂酸溶解于含有50%乙腈和0.1%的三氟乙酸)充分混合后,加至點樣板上。利用MALDI-TOF/TOFTM5800質譜串聯飛行時間質譜儀(ABI,美國)進行質譜分析。
將所得的質譜數據通過Matrix Science Ltd公司提供的本地NCBInr數據庫進行搜索和匹配。
3 結果
3.1 不同酸化條件下中華哲水蚤蛋白的表達
利用雙向電泳技術獲得了酸化條件下中華哲水蚤總蛋白的雙向電泳圖譜,蛋白點呈圓形或橢圓形,大部分點與點之間界限清晰,略有橫向拖尾現象,說明雙向電泳譜圖質量較高(見圖1)。對照組、CCO20.08%處理組和CCO20.20%處理組蛋白點數分別為1 191、1 117和946個,對照組與CCO20.08%和CCO20.20%的差異蛋白點數分別為74和245個,從中選取表達差異顯著的43個點進行質譜分析。
不同酸化條件細胞蛋白質組的表達存在差異:一些蛋白的表達量在不同酸化條件下發生明顯變化,甚至消失。各差異蛋白點的變化如圖2所示。在CCO20.08%條件下,中華哲水蚤體內1號蛋白的表達量有所上升,不過在CCO20.20%時,表達量明顯下降。2、3、6、11、12、13、14、16、18、21、22、23、25、30號蛋白在對照組和CCO20.08%中表達量基本一致,不過在CCO20.20%中表達量顯著下降。4、34和43號蛋白在對照組中基本不表達,但隨著CCO2的升高,它們的表達量明顯升高。42號蛋白在對照組中不表達,在CCO20.08%和CCO20.20%處理組中表達量略有升高。35、36和37號蛋白的表達量在對照組中最高,隨著CCO2的升高,它們的表達量下降,甚至不表達。
3.2 差異蛋白的質譜鑒定結果
43個差異蛋白中,8個蛋白不能被質譜儀檢測到信號;12個蛋白未能搜索到與其相匹配的蛋白,為未知蛋白;其他23種蛋白則發現了與之同源的蛋白 (其中包括未知功能的假設蛋白質),其表達情況見圖2,質譜鑒定結果見表1。根據功能可將檢測到的蛋白分為以下幾類:與蛋白合成和分解有關的蛋白,如1、4和34號蛋白;與新陳代謝相關的蛋白,如35和36號,主要在機體能量和物質代謝過程中起作用;與機體DNA和分子修復過程、細胞周期以及解毒過程有關的蛋白,如3、9、13、16、21和30號蛋白;與肌肉活動有關的蛋白,如23和37號蛋白等。
4 討論
CCO20.08%處理組與對照組的差異蛋白點 (74個)比CCO20.20%處理組與對照組的差異蛋白點 (214個)少,這說明CCO20.08%的酸化海水對橈足類的影響相對較小,這與我們其他研究結果相似[10—12]。由于缺乏對應的基因組和蛋白質組庫,本研究中中華哲水蚤的差異蛋白有些為未知蛋白或未知功能蛋白,本文重點針對已知的幾種蛋白進行討論。
橈足類的蛋白合成過程是機體正常活動的保障,在這個過程中,翻譯起始因子和延長因子起著十分重要的調節作用。在本研究中,34號和1號蛋白分別為真核翻譯起始因子4A和翻譯延長因子2,前者解旋酶活性被認為是與打開mRNA5′端非編碼順序的次級結構以便募集核糖體有關;后者可以催化初步形成的肽段發生構象變化,而進入下一輪的延長過程[14]。酸化條件下,34號蛋白的表達量明顯上調,而1號蛋白表達量顯著下降,說明中華哲水蚤的蛋白合成收到影響,這一結果符合Seibel 和Walsh[15—16]的推論。橈足類蛋白合成量的降低可引起其生長和繁殖的變化,尤其需要大量蛋白合成與積累的繁殖過程受到的影響可能更劇烈。這在一定程度上印證了橈足類產卵率隨酸化水平的加劇而降低的現象[10—12]。14號蛋白為羧基末端蛋白酶,它是一種蛋白翻譯后修飾蛋白。酸化條件下其表達量明顯下降,可能會導致蛋白得不到應有的加工和修飾而缺失相應的功能,從而影響機體的正常生命活動。 Fabry[17]指出,機體可以通過抑制一些高耗能過程來完成其對海水酸化的耐受,而其中最為重要的過程之一即為蛋白合成,本文的結果支持這一觀點。在酸化條件下,與橈足類蛋白合成有關的蛋白表達量明顯下降,這可以作為蛋白合成降低的一個顯著標志。
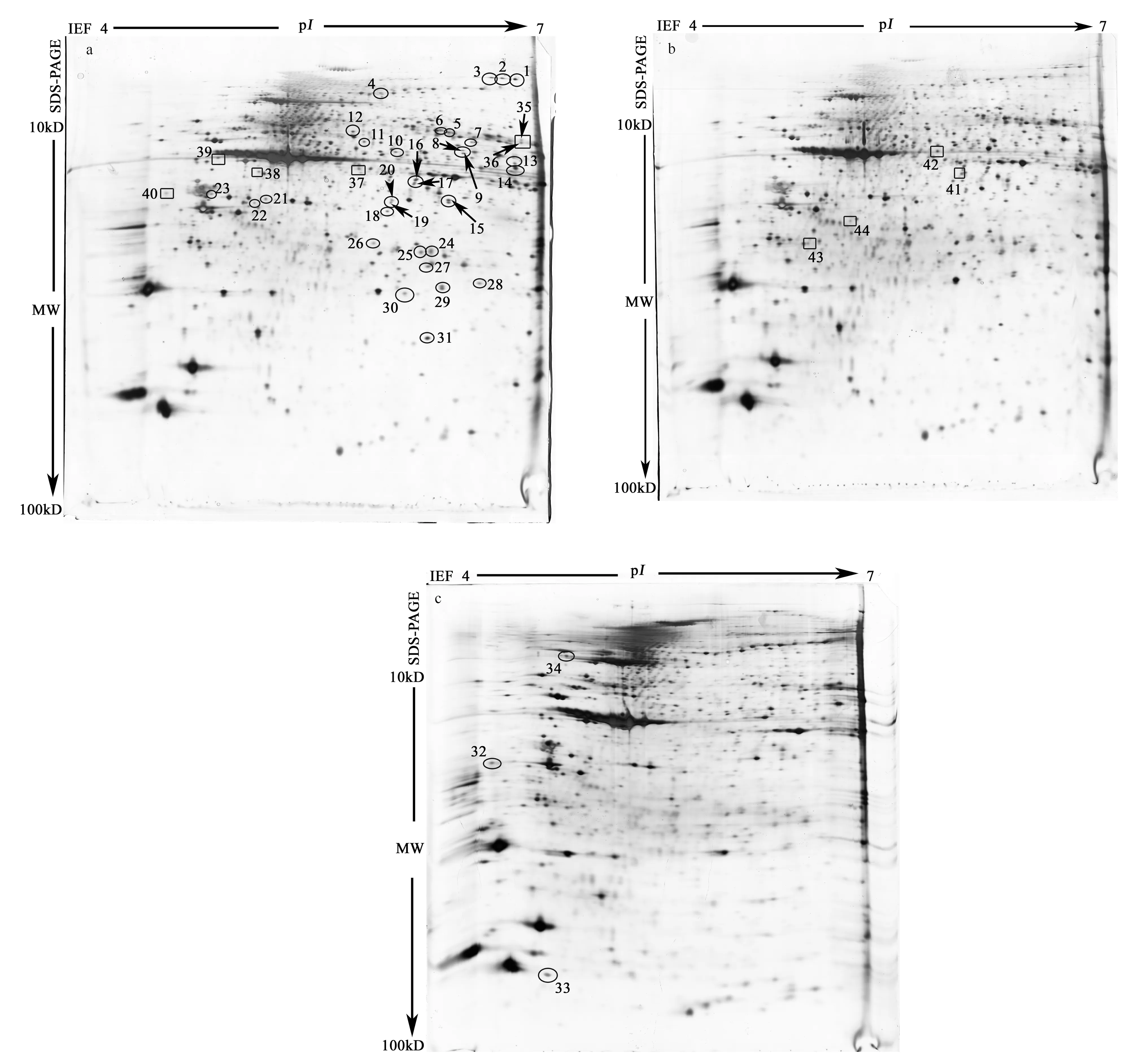
圖1 中華哲水蚤全蛋白雙向電泳圖Fig.1 2D-PAGE analysis of total soluble proteins from C.sinicus
本研究中35號蛋白是以NADP為輔酶的異檸檬酸脫氫酶(NADP-IDHs),參與三羧酸循環過程,是其4個關鍵氧化-還原步驟之一[18]。朱國萍等[19]指出,NADP-IDHs的最適pH通常略偏堿性,隨著pH的降低,IDHs脫羧酶的活性趨于減弱。35號蛋白的表達量在酸化條件下顯著下降,可能是因為酸化對機體正常的物質代謝具有抑制作用。36號蛋白是甘油醛-3-磷酸脫氫酶 (GAPDH),是糖酵解過程中的重要催化劑,并可以促進有絲分裂過程中膜融合,并具有修復DNA的作用。本研究中,其表達量在酸化條件下明顯下降。如上所述,參與三羧酸循環和糖酵解主要過程的兩種蛋白質的表達均在酸化條件下降低,這說明酸化對機體的物質代謝和能量代謝均產生影響,造成機體能量產量的降低。不過Hauton等[20]研究指出,酸化 (pH 7.6)條件下培養至成體的鉤蝦,體內甘油醛-3-磷酸脫氫酶的表達量顯著高于在正常海水中培養的個體。是何原因導致不同物種相同蛋白的表達量在相似條件下呈現不同情況,還需要深入研究。在酸化條件下,17β-羥基類固醇脫氫酶 (6號蛋白)的表達量也明顯降低。最初將這種蛋白歸為類固醇代謝酶,不過最近發現其在線粒體的脂肪酸合成過程中具有重要作用[21]。其表達量的降低在一定程度上說明橈足類脂肪酸合成可能受到酸化的影響,機體積累能量的能力降低。此外,43號蛋白是脂酰CoA硫酯水解酶,主要參與磷脂的新陳代謝過程并可以催化水解高能硫酯鍵,使ADP磷酸化成ATP。其表達量在酸化條件下明顯升高,說明中華哲水蚤機體在酸化條件下不能維持正常的能量代謝,需要磷脂類的大量參與,進而保證機體的正常活動。
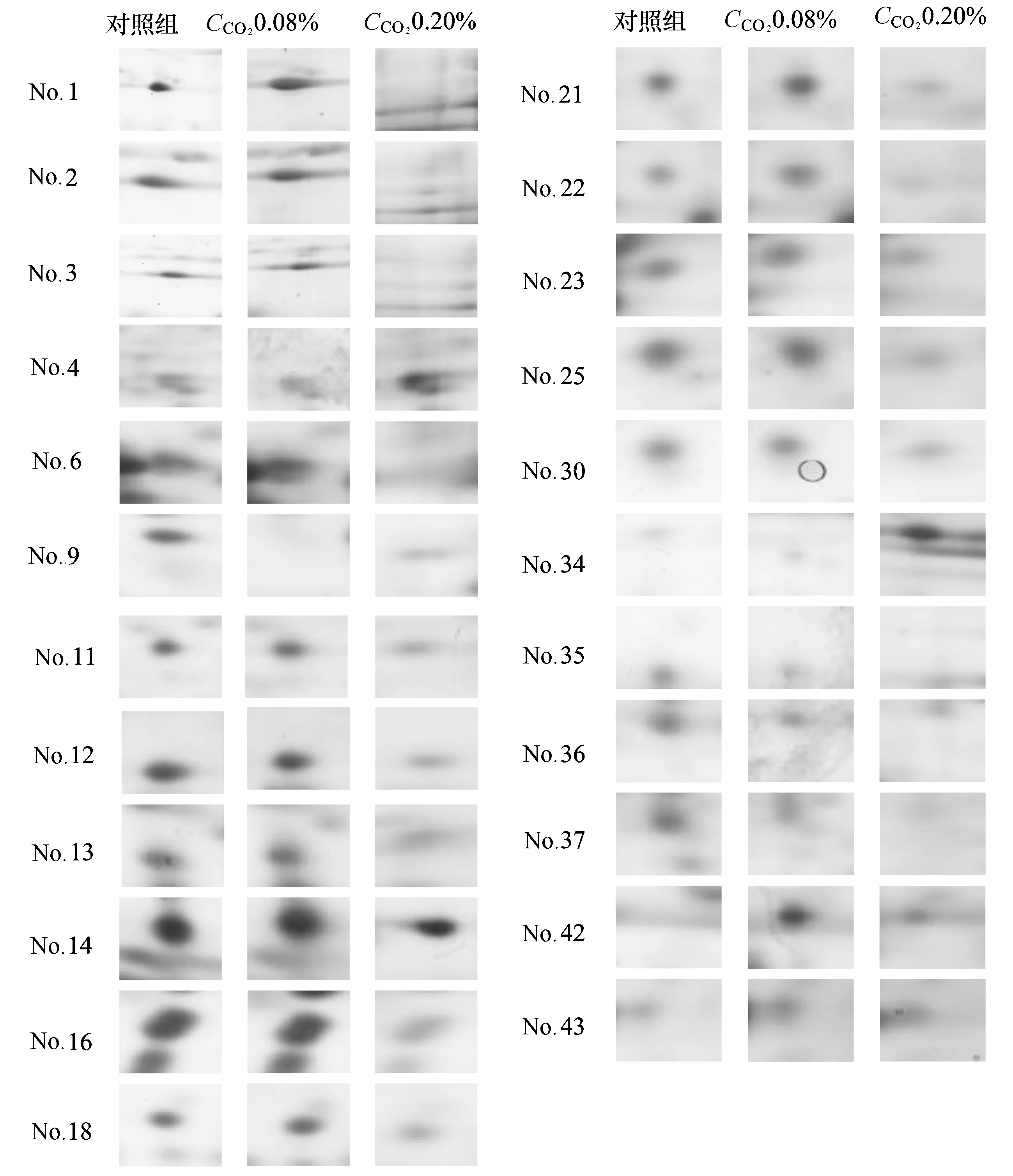
圖2 酸化條件下中華哲水蚤特異蛋白點的差異表達Fig.2 Different expression of specific proteins spots of C.sinicus in acidified-seawater
表1 酸化條件下中華哲水蚤差異蛋白的質譜分析
Tab.1 Different expression proteins indentified by MALDI-TOF/TOF inC.sinicusexposed to acidified-seawater
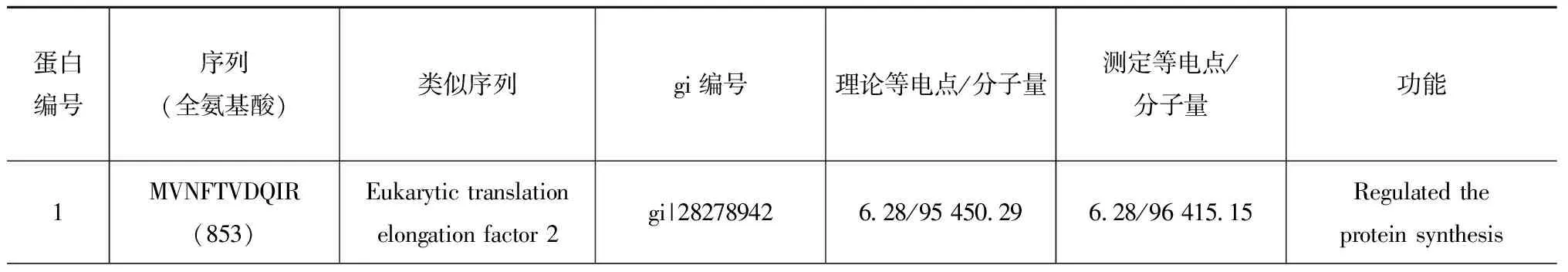
蛋白編號序列(全氨基酸)類似序列gi編號理論等電點/分子量測定等電點/分子量功能1MVNFTVDQIR(853)Eukarytictranslationelongationfactor2gi|282789426 28/95450 296 28/96415 15Regulatedtheproteinsynthesis
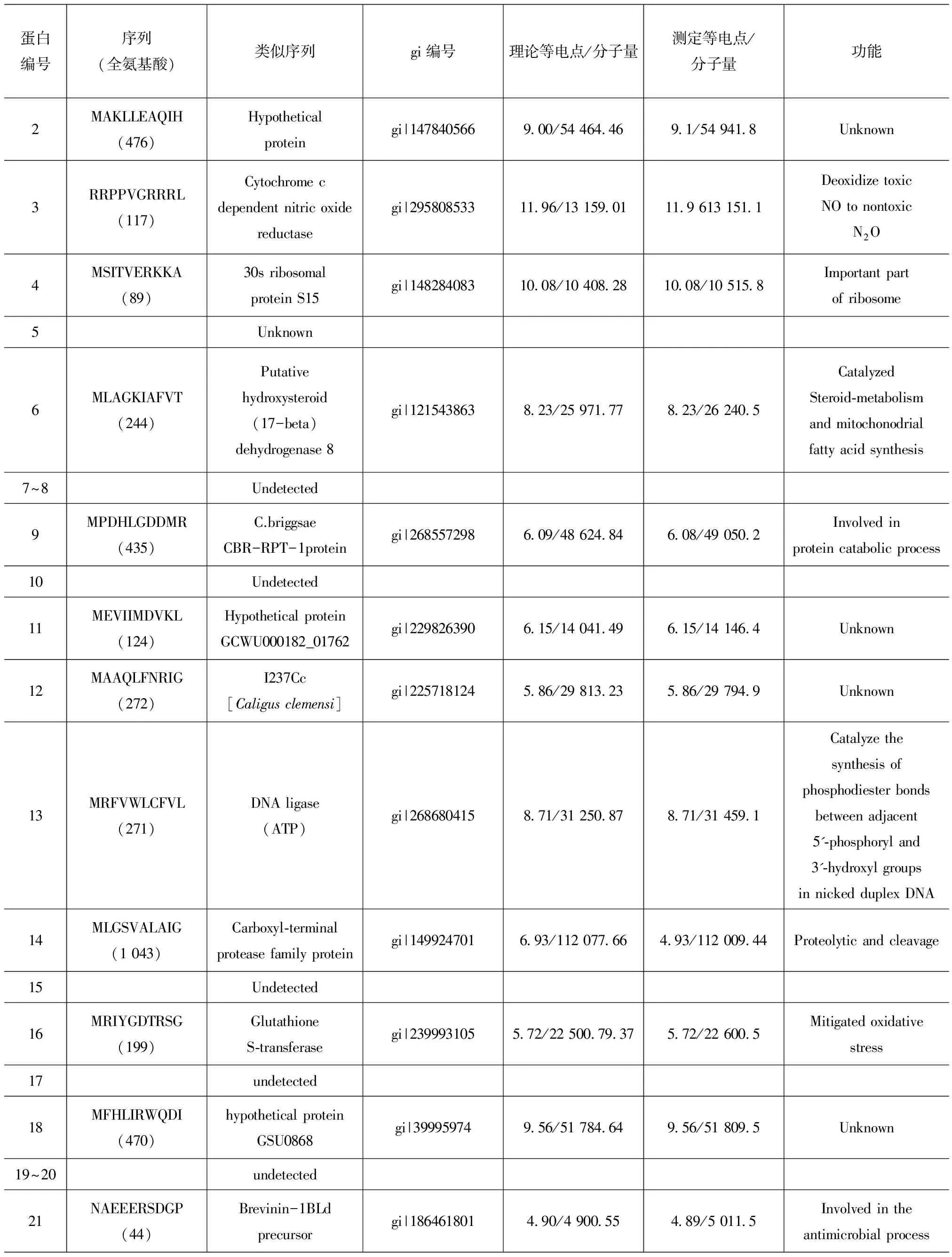
續表1
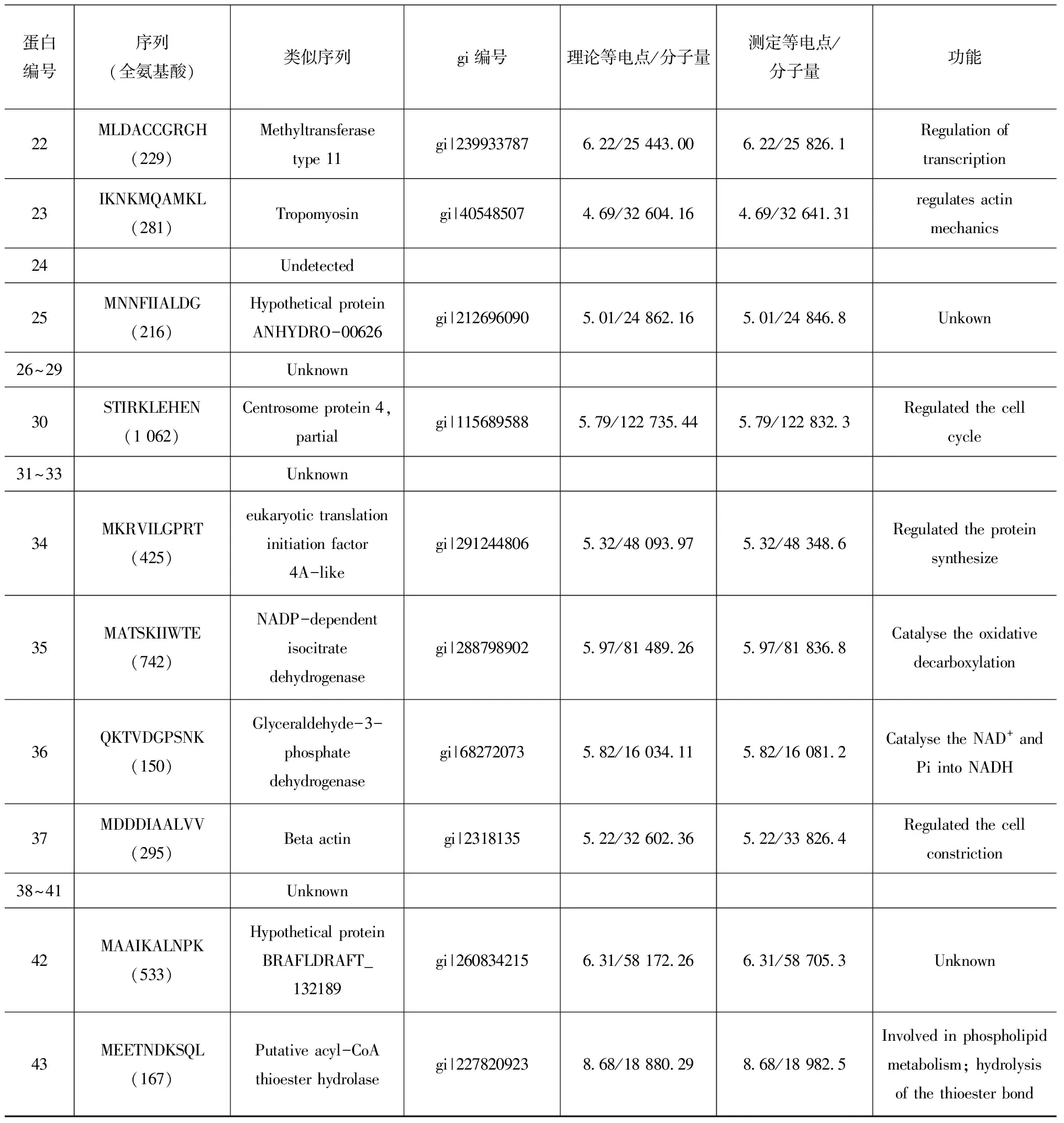
續表1
除上述與機體蛋白合成和基本代謝有關的蛋白受到酸化影響外,其他一些與細胞修復和解毒能力有關的蛋白的表達量也有明顯變化。3號蛋白是基于細胞色素C的一氧化氮還原酶,將有毒的一氧化氮 (NO)催化還原為無毒的氧化亞氮 (N2O),從而消除NO對細胞的毒害作用。在酸化條件下,這種蛋白的表達量顯著下降,在一定程度上說明,橈足類機體受到酸化的脅迫作用。16號蛋白為谷胱甘肽過氧化物酶,這是一種小分子水溶性蛋白,是機體內重要的Ⅱ相解毒代謝酶,其在酸化條件下的表達量明顯下調,解毒能力會下降,這與我們其他研究結果相似[10—11]。Todgham和Hofmann[22]對暴露在酸化海水中96 h后海膽幼體體內GST mRNA表達量進行分析后指出,這種解毒酶的mRNA表達量顯著下降,本文的結果與此相似。由此可見,酸化會對橈足類個體產生氧化損傷,從而對其他生命過程產生影響。13號蛋白為DNA連接酶,在DNA復制、重組和修復中起著重要的作用[23]。酸化條件下,這種蛋白的表達量明顯下調說明機體分子水平的修復能力可能降低。上述幾種蛋白均是橈足類防御系統中不可缺少的重要蛋白,它們的表達量下降直接說明酸化條件會明顯降低橈足類對環境脅迫的抵御能力。根據相關研究,酸化對紫貽貝的噬菌能力有顯著的抑制作用,貽貝持續的從海水中吸收CO2使其免疫系統逐漸惡化[24];血碳酸濃度升高導致凡納濱對蝦處于缺氧狀態,并降低血細胞和組織的抑菌能力,使機體較容易感染細菌[25]。由此可見,酸化對生物的影響不僅體現在其對蛋白合成和新陳代謝的抑制上,而且可以通過對其他抵御系統的破壞來降低其對環境變化的耐受能力。
[1] Scheffer M,Carpenter S,Foley J A,et al. Catastrophic shifts in ecosystems[J]. Nature,2001,413(6856): 591-596.
[2] IPCC. A contribution of Working Groups Ⅰ,Ⅱ and Ⅲ to the third assessment report of the intergovernmental panel on climate change[M]. Cambridge: Cambridge University Press,2001.
[3] Royal Society. Ocean acidification due to increasing atmospheric carbon dioxide[M]. London: The Royal Society,2005: 60.
[4] Clark D,Lamare M,Barker M. Response of sea urchin pluteus larvae (Echinodermata: Echinoidea) to reduced seawater pH: a comparison among a tropical,temperate,and a polar species[J]. Marine Biology,2009,156(6): 1125-1137.
[5] Zippay M L,Hofmann G E. Effect of pH on gene expression and thermal tolerance of early life history stages of red abalone (Haliotisrufescens)[J]. Journal of Shellfish Research,2010,29(2): 429-439.
[6] Bradassi F,Cumani F,Bressan G,et al. Early reproductive stages in the crustose coralline algaphymatolithonlenormandiiare strongly affected by mild ocean acidification[J]. Marine Biology,2013,160(8): 2261-2269.
[7] Wall C B,Fan T Y,Edmunds P J. Ocean acidification has no effect on thermal bleaching in the coralSeriatoporacaliendrum[J]. Coral Reefs,2014,33(1): 119-130.
[8] Kurihara H. Effects of CO2-driven ocean acidification on the early developmental stages of invertebrates[J]. Marine Ecology Progress Series,2008,373: 275-284.
[9] Kurihara H,Ishimatsu A. Effects of high CO2seawater on the copepod (Acartiatsuensis) through all life stages and subsequent generations[J]. Marine Pollution Bulletin,2008,56(6): 1086-1090.
[10] Zhang D J,Li S J,Wang G Z,et al. Impacts of CO2-driven seawater acidification on survival,egg production rate and hatching success of four marine copepods[J]. Acta Oceanologica Sinica,2011,30(6): 86-94.
[11] Zhang D J,Li S J,Wang G Z,et al. Biochemical responses of the copepodCentropagestenuiremisto CO2-driven acidified seawater[J]. Water Science & Technology,2012,65(1): 30-37.
[12] 張達娟,李少菁,王桂忠,等. 二氧化碳酸化對兩種橈足類肌肉和卵母細胞超微結構的影響[J]. 海洋學報,2012,34(3): 127-133.
Zhang Dajuan,Li Shaojing,Wang Guizhong,et al. Impacts of CO2-driven acidified seawater on the muscle and oocyte ultrastructure of two marine copepods[J]. Haiyang Xuebao,2012,34(3): 127-133.
[13] Wang D Z,Lin L,Chan L L,et al. Comparative studies of four protein preparation methods for proteomic study of the dinoflagellateAlexandriumsp. using two-dimensional electrophoresis[J]. Harmful Algae,2009,8(5): 685-691.
[14] Redpath N T,Foulstone E J,Proud C G. Regulation of translation elongation factor-2 by insulin via a rapamycin-sensitive signalling pathway[J]. EMBO Journal,1996,15(9): 2291-2297.
[15] Seibel B A,Walsh P J. Potential impacts of CO2injection on deep-sea biota[J]. Science,2001,294(5541): 319-320.
[16] Seibel B A,Walsh P J. Biological impacts of deep-sea carbon dioxide injection inferred from indices of physiological performance[J]. The Journal of Experimental Biology,2003,206(4): 641-650.
[17] Fabry V J. Ocean science: marine calcifiers in a high-CO2ocean[J]. Science,2008,320(5879): 1020-1022.
[18] Hurley J H,Dean A M,Koshland D E,et al. Catalytic mechanism of NADP+-dependent isocitrate dehydrogenase: implications from the structures of magnesium-isocitrate and NADP+complexes[J]. Biochemistry,1991,30(35): 8671-8678.
[19] 朱國萍,黃恩啟,趙禙軍. NADP-異檸檬酸脫氫酶的結構與功能[J]. 安徽師范大學學報: 自然科學版,2007,30(3): 366-371.
Zhu Guoping,Huang Enqi,Zhao Beijun. Structure and function of NADP-Isocitrate dehydrogenase[J]. Journal of Anhui Normal University: Natural Science,2007,30(3): 366-371.
[20] Hauton C,Tyrrell T,Williams J. The subtle effects of sea water acidification on the amphipodGammaruslocusta[J]. Biogeoscience,2009,6: 1479-1489.
[21] Chen Z J,Kastaniotis A J,Miinalainen I J,et al. 17β-Hydroxysteroid dehydrogenase type 8 and carbonyl reductase type 4 assemble as a ketoacyl reductase of human mitochondrial FAS[J]. The FASEB Journal,2009,23(11): 3682-3691.
[22] Todgham A E,Hofmann G E. Transcriptomic response of sea urchin larvaeStrongylocentrotuspurpuratusto CO2-driven seawater acidification[J]. The Journal of Experimental Biology,2009,212(16): 2579-2594.
[23] Tomkinson A E,Vijayakumar S,Pascal J M,et al. DNA ligases: structure,reaction mechanism,and function[J]. Chemical Reviews,2006,106(2): 687-699.
[24] Bibby R,Widdicombe S,Parry H,et al. Effects of ocean acidification on the immune response of the blue musselMytilusedulis[J]. Aquatic Biology,2008,2(1): 67-74.
[25] Burgents J E,Burnett K G,Burnett L E. Effects of Hypoxia and hypercapnic hypoxia on the localization and the elimination ofVibriocampbelliiinLitopenaeusvannamei,the pacific white shrimp[J]. Biological Bulletin,2005,208(3): 159-168.
Proteomic study of the effects of acidified seawater onCalanussinicus
Zhang Dajuan1,Guo Donghui2,Wang Guizhong2,Li Shaojing2
(1.CollegeofFisheries,TianjinAgriculturalCollege,TianjinKeyLaboratoryofAqua-ecologyandAquaculture,Tianjin300384,China; 2.CollegeofOcean&EarthScience,XiamenUniversity,Xiamen361005,China)
This study compared proteim profiles ofCalanussinicuscultured underCCO20.08% andCCO20.20% CO2-acidified seawater for 4 days using a proteomic approach,and identified the differentially expressed proteins. The results are shown that,1 191,1 117 and 946 protein spots ofC.sinicusin control,CCO20.08% andCCO20.20% groups were detected in the two-dimensional electrophoresis gels,respectively. The 43 protein spots were selected based on their differential expression between control andCCO20.08% group,CCO20.20% group,and 23 proteins of which were identified by MALDI-TOF/TOF mass spectrometry. The data demonstrated that these differentially expressed proteins were associated with protein synthesize and proteolysis,energy metabolism,DNA repaired and detoxified of organisms.
carbon dioxide; ocean acidification;Calanussinicus; proteome
10.3969/j.issn.0253-4193.2015.06.010
2014-09-23;
2015-03-27。
國家自然科學基金“不同生態類型的海洋橈足類對硅藻的利用與適應的生態遺傳學研究”面上項目(41276132)。
張達娟(1981—),女,天津市人,博士,實驗師,主要從事浮游生物生理生態學研究。E-mail:dajuanzhang@163.com
*通信作者:李少菁(1931—),男,福建省安溪市人,教授,博士生導師,主要從事海洋浮游生物學研究。E-mail:zoopecol@xmu.edu.cn
Q178.53
A
0253-4193(2015)06-0097-09
張達娟,郭東暉,王桂忠,等. 海水酸化對中華哲水蚤全蛋白表達的影響[J].海洋學報,2015,37(6):97—105,
Zhang Dajuan,Guo Donghui,Wang Guizhong,et al. Proteomic study of the effects of acidified seawater onCalanussinicus[J]. Haiyang Xuebao,2015,37(6):97—105,doi:10.3969/j.issn.0253-4193.2015.06.010

