固體酸Amberlyst-15催化甘油-乙酸酯化動力學研究
賈玉巖,周利民,2,羅太安,鄒麗霞,彭 娟
(1.東華理工大學 核資源與環境國家重點實驗室培育基地, 江西 南昌330013; 2. 天津大學 化工學院, 天津 300072)
固體酸Amberlyst-15催化甘油-乙酸酯化動力學研究
賈玉巖1,周利民1,2,羅太安1,鄒麗霞1,彭 娟1
(1.東華理工大學 核資源與環境國家重點實驗室培育基地, 江西 南昌330013; 2. 天津大學 化工學院, 天津 300072)
以Amberlyst-15為催化劑,利用甘油與乙酸的酯化反應將生物柴油生產副產物甘油轉化為高附加值酯化產物。考察了乙酸/甘油(AA/G)摩爾比及反應溫度對該反應產物分布的影響。結果表明,產物分布達到平衡所需時間隨AA/G摩爾比增加而延長,但隨反應溫度升高而縮短;甘油轉化率隨AA/G摩爾比及反應溫度升高而增加,但AA/G摩爾比對二乙酸甘油酯(DAG)和三乙酸甘油酯(TAG)總產率的影響比反應溫度更顯著。Amberlyst-15的主要作用是增加目標產物(DAG和TAG)產率。甘油與乙酸酯化最優反應條件為AA/G摩爾比9、反應溫度110℃。在此條件下反應120 min后,甘油轉化率達到97%,DAG和TAG總收率達到90%。利用擬均相一級連續模型進行動力學分析,得到甘油逐步生成單乙酸甘油酯、二乙酸甘油酯、三乙酸甘油酯的表觀反應速率常數k1、k2、k3及其相應的反應活化能E1、E2、E3,即,k1=2.07×106β0.274exp(-6890/T),E1=57.26 kJ/mol;k2=18.66β1.82exp(-3830/T),E2=31.87 kJ/mol;k3=1.16β-0.474exp(-1670/T),E3=13.90 kJ/mol。
固體酸催化;酯化;反應動力學;生物柴油
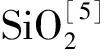
Amberlyst-15(磺化聚苯乙烯-二乙烯苯共聚物)是一種強酸性大孔型陽離子交換樹脂,具有價廉易得、催化活性高、選擇性高、可重復利用等優點[7-8]。現有的研究[3-9]多側重于考察反應條件對甘油-乙酸酯化反應產物TAG收率的影響,對其他產物(如DAG)的收率則很少涉及;此外,動力學研究是揭示反應機理和設計化學反應器的基礎[10],而關于Amberlyst-15催化甘油-乙酸酯化反應動力學尚缺乏深入研究[11]。基于此,筆者旨在明確乙酸/甘油摩爾比和反應溫度對甘油-乙酸酯化反應產物分布的影響規律及動力學特征,以高取代產物(DAG和TAG)為目標產物優化反應條件,并獲得不同酯化產物的表觀反應速率常數及其相應的反應活化能。
1 實驗部分
1.1 原料
Amberlyst-15,水含量低于1.6%,酸位(以H+計)4.7 mmol/g;酸性沸石(HZSM-5和HUSY);甘油(G)、乙酸(AA),分析純。上述原料均為Sigma-Aldrich公司產品。
1.2 實驗方法及產物分析
采用配有水冷凝回流裝置的250 mL不銹鋼攪拌反應器進行甘油-乙酸酯化反應,油浴加熱,攪拌速率1100 r/min。Amberlyst-15用量2.645 g(82.86 mol H+/L),n(AA)/n(G)范圍3~9,反應溫度范圍80~110℃,反應液體積150 mL。按配比加入乙酸及催化劑,升溫達到預定反應溫度后,加入甘油,每隔一定時間取樣。樣品經0.45 μm膜過濾分離固相(催化劑)后,取液相樣20~60 μL經1 mL乙醇稀釋,采用Shimadzu公司GC-17A型氣相色譜儀分析其組成,DB-1毛細管色譜柱(30 m×0.25 mm),以10℃/min升溫至250℃后停留5 min,根據GC峰面積與標準溶液峰面積計算各產物濃度。GC分析時并未檢測到乙醇與乙酸之間的反應產物(系因時間短且無催化劑)。
2 結果與討論
2.1 乙酸/甘油摩爾比(n(AA)/n(G))和反應溫度對甘油-乙酸酯化反應的影響
2.1.1n(AA)/n(G)的影響
n(AA)/n(G)對甘油-乙酸酯化反應產物分布的影響示于圖1。由圖1可以看出,反應開始40 min內反應速率較快,甘油濃度迅速下降,約300 min趨于穩定,而反應達到平衡則需更長時間。隨著n(AA)/n(G)的增加,甘油轉化率升高(cG/cG0下降),并且有利于生成高取代產物,因此(DAG+TAG)產率增加。n(AA)/n(G)提高有利于降低反應體系黏度,從而促進相間傳質(AA水相和G油相),并且促使平衡向右移動,提高轉化率和高取代物產率。但因為甘油-乙酸酯化反應是連續可逆反應,受熱力學平衡限制,n(AA)/n(G)即使達到9,也未使甘油完全轉化。利用蒸餾移去反應產生的水,可使甘油轉化更完全,并得到更多的高取代物(DAG和TAG)[12-13]。n(AA)/n(G)為9及反應溫度為95℃時,甘油最終轉化率達到94.9%,產物MAG、DAG、TAG最終產率分別達8%、47%、43%。較高的甘油轉化率可在較短時間內取得,但取得較高的(DAG+TAG)產率卻需要較長時間;同時圖1(a)~(c)顯示,TAG產率隨時間單調上升,而MAG和DAG產率則存在最大值,符合連續反應的特征。
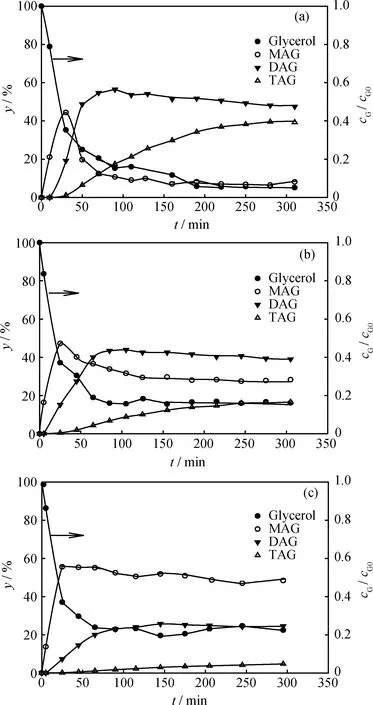
圖1 n(AA)/n(G)對甘油-乙酸(G-AA)酯化產物分布的影響
2.1.2 反應溫度的影響
反應溫度對甘油-乙酸酯化反應產物分布的影響示于圖2。由圖2可見,隨反應溫度升高,反應速率加快,反應達到平衡所需時間更短,并且yDAG達到其峰值的時間縮短,反應溫度為80、95、110℃時,yDAG峰值對應時間分別為210、70、40 min。隨反應溫度升高,甘油轉化率和(DAG+TAG)產率也會提高,110℃時甘油轉化率達到97%,(DAG+TAG)產率達到90%。隨反應溫度升高,反應體系黏度下降,相間傳質和反應速率加快,同時促進平衡向右移動,有利于提高甘油轉化率和高取代物產物產率。溫度低于120℃時,Amberlyst-15保持穩定,因此本實驗中采用的最高反應溫度為110℃。在實驗范圍內,未發現反應溫度對生成高取代物的抑制作用。
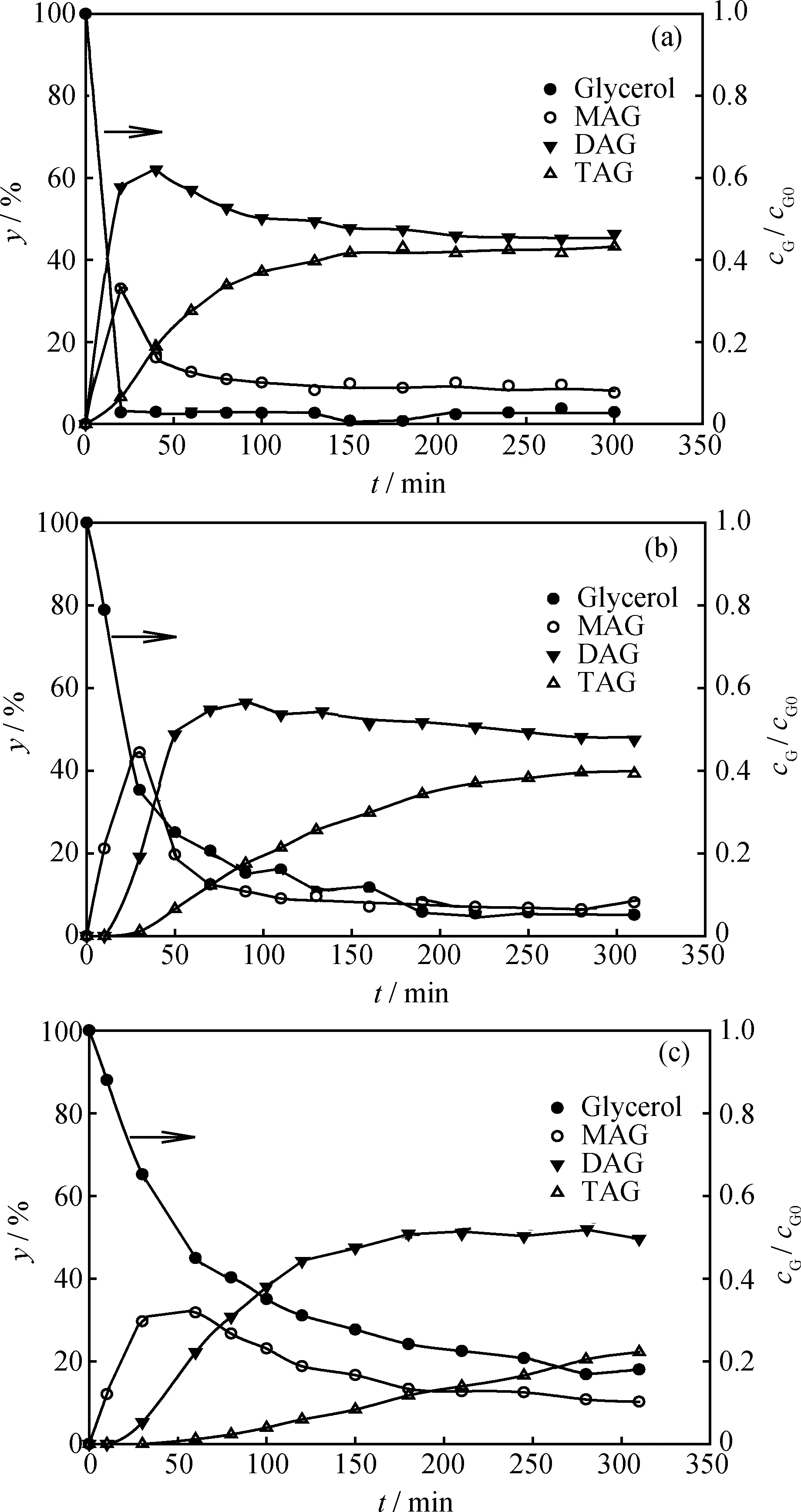
圖2 反應溫度(T)對甘油-乙酸(G-AA)酯化產物分布的影響
對比圖1和圖2還可以看出,相比反應溫度,n(AA)/n(G)對甘油-乙酸酯化產物分布的影響更顯著,隨n(AA)/n(G)由3升至9,(DAG+TAG)產率由30%增至86%,而反應溫度由80℃升至110℃,(DAG+TAG)收率僅由71%增至89%。
以DAG+TAG為目標產物,Amberlyst-15催化甘油-乙酸酯化反應最優反應條件為n(AA)/n(G)=9、T=110℃。在此條件下反應120 min,甘油轉化率為97%,DAG和TAG總產率為90%。說明Amberlyst-15對該反應有較高的催化性能,其綜合性能均好于其他固體酸催化劑[5-6,12-13]。
圖3為無催化劑時甘油-乙酸酯化的產物分布。由圖3可見,此時的酯化產物以MAG為主(yMAG>60%),只生成極少量的DAG和TAG(yDAG+TAG<14%),但甘油轉化率仍可達到73%,與Liao等[7-8]的研究結果相符。使用催化劑Amberlyst-15時,產物以DAG和TAG為主(yDAG+TAG約90%),只有少量MAG(yMAG<8%),表明Amberlyst-15催化劑的主要作用是選擇性生成DAG和TAG,從而提高其產率。
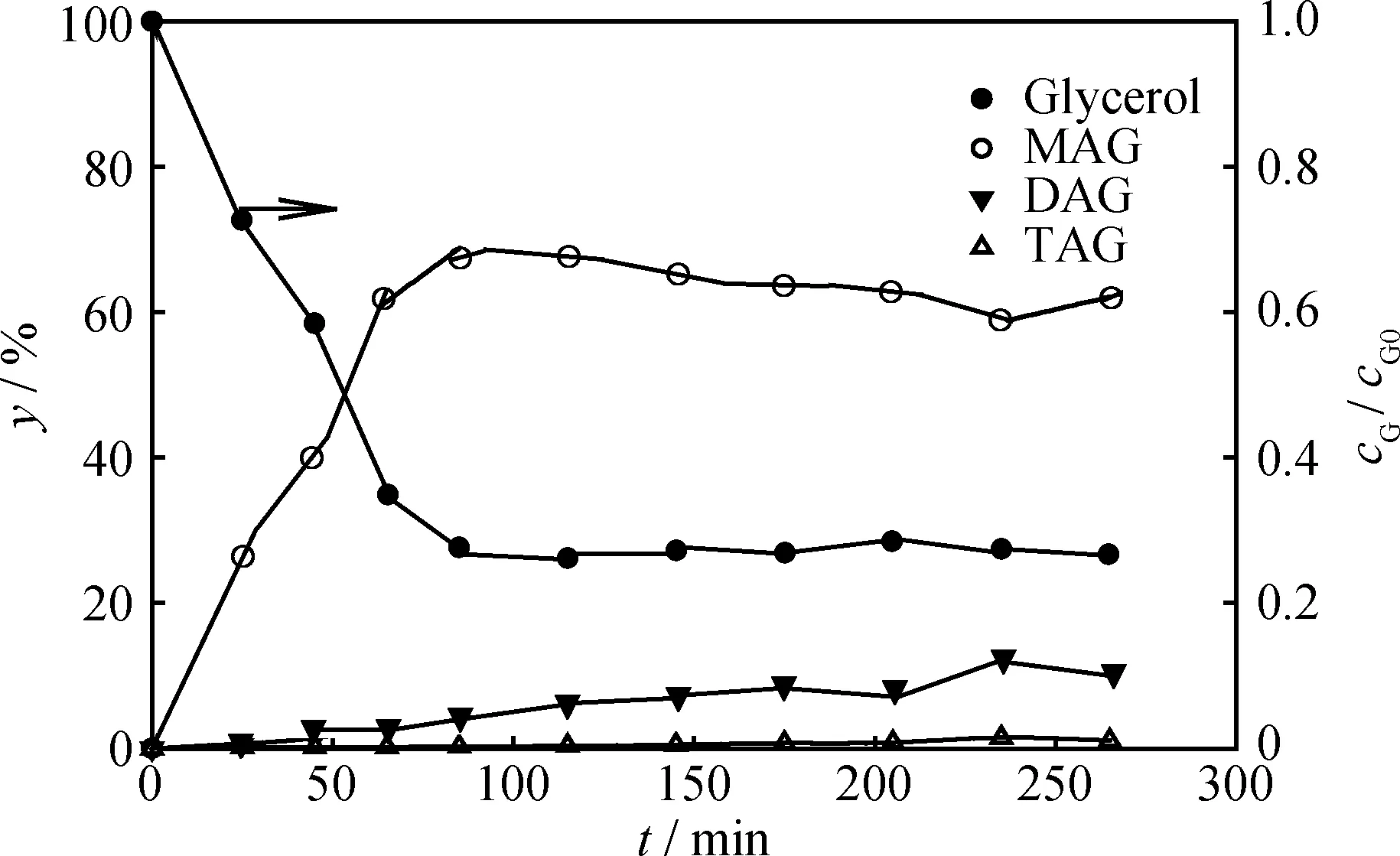
圖3 無催化劑時甘油-乙酸(G-AA)酯化反應產物分布
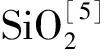
2.2 酸催化甘油-乙酸酯化反應的動力學分析
酯化反應(表面反應控制)速率方程可用Langmuir-Hinshelwood-Hongen-Watonl (LHHW)模型描述[14]。假設反應體系中各組分在催化劑酸位吸附較弱,則可忽略該模型中阻力項;甘油-乙酸酯化反應中正反應速率遠高于逆反應速率,則可不考慮逆反應,以方便動力學計算;乙酸過量,實驗發現乙酸轉化率為28%~74%,表明催化活性位附近有足夠的乙酸,因此其濃度基本不變。這樣可用連續反應來描述甘油-乙酸酯化反應,如式(1)所示。
(1)
式(1)中,G、R、S、T分別表示甘油、MAG、DAG和TAG;k1、k2、k3分別表示相應反應的速率常數。反應速率方程分別如式(2)~(4)所示。
(2)
(3)
(4)
式(2)~(4)中,rG、rR和rS分別表示G→R,R→S和S→T的反應速率,mol/(min·L);cG、cR、cS和cT分別表示G、R、S和T的濃度,mol/L,并且存在式(5)的關系。
cG0=cG+cR+cS+cT
(5)
將式(2)~(4)積分,得到式(6)~(8),結合式(5)則得到式(9)。
(6)
(7)
(8)
(9)
利用Polymath 7.0對每組實驗數據進行非線性擬合,可得k1、k2和k3值,結果列于表1。一定n(AA)/n(G)下,k值隨反應溫度變化的關系可用Arrhenius方程描述。比如,n(AA)/n(G)=9時,k-T關系如式(10)~(12)所示。
k1=exp[25.07-(10534/T)],
E1=87.58 kJ/mol,R2=0.9853
(10)
k2=exp[11.49-(5467/T)],
E2=45.45 kJ/mol,R2=0.9775
(11)
k3=exp[-0.436-(1857/T)],
E3=15.44 kJ/mol,R2=0.9548
(12)
式(10)~(12)中,E1、E2、E3為活化能,R2為線性化Arrhenius方程的相關系數。通常認為k值僅與反應溫度有關,而與n(AA)/n(G)(反應物濃度)無關。但由表1可知,k1、k2、k3值隨n(AA)/n(G)及反應溫度均發生變化,這可能與相變化有關。隨著反應的進行,水相乙酸及油相甘油及乙酸甘油酯體積會發生變化,顯然水相及油相難以混溶,從而導致非均相反應體系,使k計算值為表觀(非本征)反應速率常數。
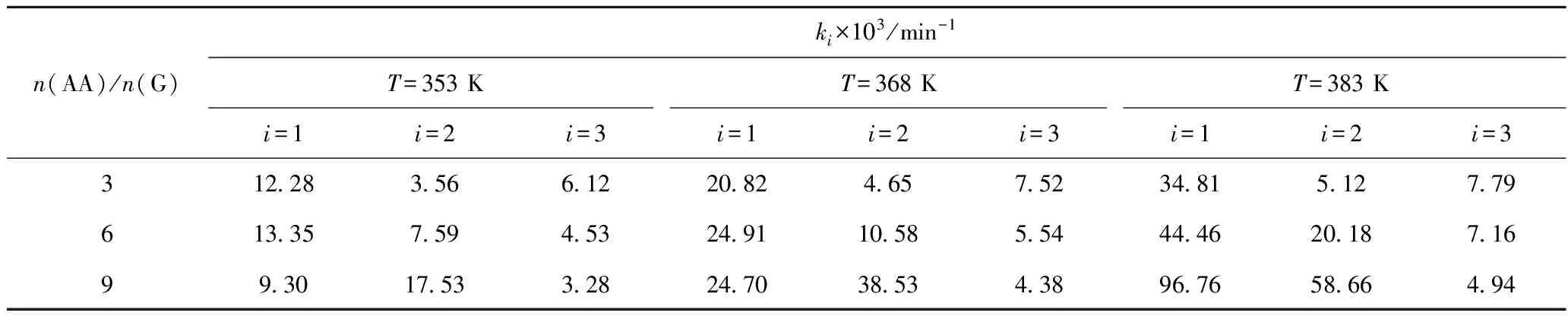
表1 不同n(AA)/n(G)及反應溫度(T)下的甘油-乙酸酯化反應表觀反應速率常數(ki)
Catalyst loading amount of 82.86 mmol H+/L in equivalent
表觀反應速率常數ki隨n(AA)/n(G)(為簡便起見,以下公式中,將n(AA)/n(G)記為β)及反應溫度(T)的變化可用式(13)描述[15]。
ki=ki0βniexp(-Ei/RT)
(13)
式(13)中,Ei為反應活化能,kJ/mol;ki0和ni均為常數。
利用式(13)對表1中數據(ki、n(AA)/n(G)、T)進行擬合,可得動力學參數ki0、ni、Ei的值,擬合結果如式(14)~(16)所示。
k1=2.07×106β0.274exp(-6890/T),
E1=57.26 kJ/mol
(14)
k2=18.66β1.82exp(-3830/T),E2=31.87 kJ/mol
(15)
k3=1.16β-0.474exp(-1670/T),E3=13.90 kJ/mol
(16)
注意到由式(13)擬合得到的反應活化能E值(13.90~57.26 kJ/mol)與n(AA)/n(G)=9時計算所得的E值(15.44~87.58 kJ/mol)差別不大,表明E值在合理范圍內。圖4表明,由式(13)計算得到的ki值和表1中的ki值均位于對角線附近,說明二者基本接近。
3 結 論
(1)對于甘油與乙酸酯化反應,AA/G摩爾比及反應溫度升高有利于提高甘油轉化率及二乙酸甘油酯(DAG)和三乙酸甘油酯(TAG)總產率,AA/G摩爾比對產物分布的影響比反應溫度更顯著。甘油與乙酸酯化最優反應條件為AA/G摩爾比9、反應溫度110℃。在此條件下反應120 min后,甘油轉化率達到97%,DAG和TAG總產率達到90%。
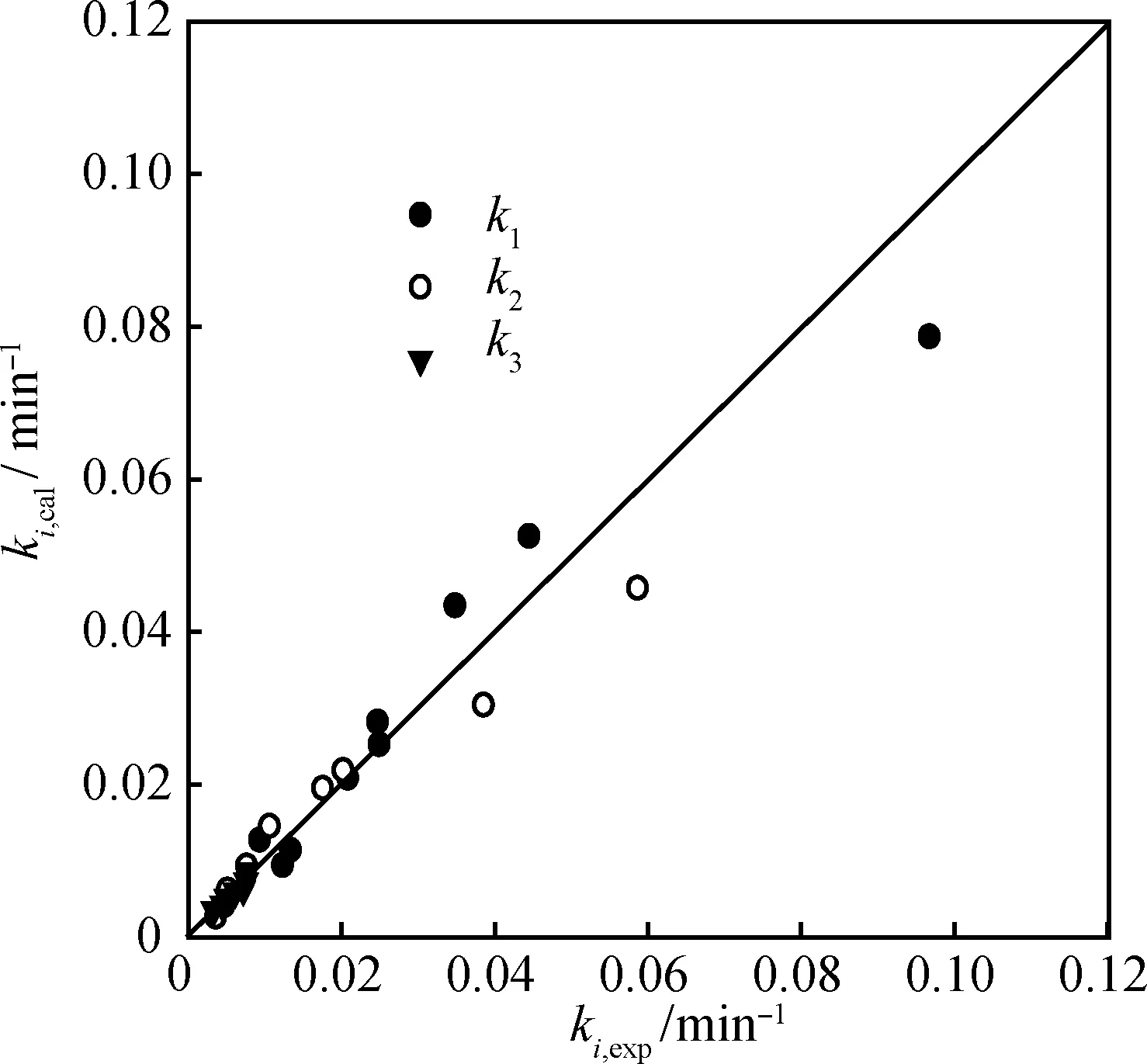
圖4 式(13)計算ki值(ki,cal)與表1中ki值(ki,exp)比較
(2)在甘油與乙酸酯化反應中,催化劑Amberlyst-15的主要作用是選擇性生成DAG和TAG,由于其酸位濃度高及具有豐富的大孔結構,有利于DAG和TAG的擴散和生成。
(3)利用擬均相一級連續模型對甘油與乙酸酯化反應進行動力學分析,得到甘油逐步生成單乙酸甘油酯、二乙酸甘油酯、三乙酸甘油酯的表觀反應速率常數k1、k2、k3及其相應的反應活化能E1、E2、E3,即k1=2.07×106β0.274exp(-6890/T),E1=57.26 kJ/mol;k2=18.66β1.82exp(-3830/T),E2=31.87 kJ/mol;,k3=1.16β-0.474exp(-1670/T),E3=13.90 kJ/mol。
[1] PRAMANIK T, TRIPATHI S. Biodiesel: Clean fuel of the future[J]. Hydrocarbon Processing, 2005, 84(2):49-54.
[2] FERREIRA P, FONSECA I M, RAMOS A M, et al. Acetylation of glycerol over heteropolyacids supported on activated carbon [J]. Catalysis Communications, 2011, 12(7):573-576.
[3] 馬慧媛,武躍, 劉秀梅,等. 無溶劑條件下Br?nsted酸離子液體催化丙三醇與乙酸的酯化反應[J].石油學報(石油加工), 2012, 28(3):399-406. (MA Huiyuan, WU Yue, LIU Xiumei, et al. Br?nsted acidic ionic liquids catalytic performance for esterification of glycerol and acetic acid under solvent-free condition[J]. Acta Petrolei Sinica (Petroleum Processing Section), 2012,28(3):399-406.)
[4] 郭曉亞, 慈冰冰, 于晶露, 等. 生物柴油生產廢液中甘油的提取及三乙酸甘油酯的合成[J]. 上海大學學報 (自然科學版), 2010, 16(5):522-525. (GUO Xiaoya, CI Bingbing, YU Jinglu, et al. Synthesis of glycerol triacetate by glycerol extracted from waste water[J]. Journal of Shanghai University (Natural Science), 2010, 16(5):522-525.)
[5] MELERO J, GRIEKEN R, MORALES G, et al. Acidic mesoporous silica for the acetylation of glycerol: Synthesis of bioadditives to petrol fuel [J]. Energy & Fuels, 2007, 21(3):1782-1791.
[6] GON?ALVES V, PINTO B P, SILVA J C, et al. Acetylation of glycerol catalyzed by different solid acids [J]. Catalysis Today, 2008, 133(2):673-677.
[7] LIAO X, ZHU Y, WANG S G, et al. Producing triacetylglycerol with glycerol by two steps:Esterification and acetylation [J]. Fuel Processing Technology, 2009, 90(7):988-993.
[8] LIAO X, ZHU Y, WANG S G, et al. Theoretical elucidation of acetylating glycerol with acetic acid and acetic anhydride [J]. Applied Catalysis B:Environmental, 2010, 94(1):64-70.
[9] REZAYAT M, GHAZIASKAR H S. Continuous synthesis of glycerol acetates in supercritical carbon dioxide using Amberlyst 15 [J]. Green Chemistry, 2009, 11(5):710-715.
[10] 黃國文, 任杰. 苯與長鏈烯烴烷基化固體酸催化反應動力學[J]. 石油學報(石油加工), 2011, 27(3):399-404. (HUANG Guowen, REN Jie. Alkylation reaction kinetics of benzene with long chain olefins over solid acidic catalysts[J]. Acta Petrolei Sinica (Petroleum Processing Section), 2011, 27(3):399-404.)
[11] 劉 群, 肖國民, 高李璟. 硫鋯催化合成三乙酸甘油酯的反應動力學[J]. 過程工程學報, 2009, 9(1):43-46.
(LIU Qun, XIAO Guomin, GAO Lijing. Kinetic study on synthesis of glycerol triacetate catalyzed by zirconium-loaded sulfuric acid [J]. The Chinese Journal of Process Engineering, 2009, 9(1):43-46.)
[12] FERREIRA P, FONSECA I M, RAMOS A M, et al. Esterification of glycerol with acetic acid over dodecamolybdophosphoric acid encaged in USY zeolite [J]. Catalysis Communications, 2009, 10(5): 481-484.
[13] LUQUE R, BUDARIN V, CLARK J H. Glycerol transformations on polysaccharide derived mesoporous materials [J]. Applied Catalysis B:Environmental,2008, 82(3-4):157-62.
Kinetics of the Esterification Between Acetic Acid and Glycerol Over Solid Acidic Catalyst Amberlyst-15
JIA Yuyan1,ZHOU Limin1,2,LUO Taian1,ZOU Lixia1,PENG Juan1
(1.StateKeyLaboratoryBreedingBaseofNuclearResourcesandEnvironment,EastChinaInstituteofTechnology,Nanchang330013,China;2.SchoolofChemistryandChemicalEngineering,TianjinUniversity,Tianjin300072,China)
Glycerol acetylation was conducted over Amberlyst-15 to convert glycerol, a byproduct of biodiesel production, into high value-added esterification products. The influences of the acetic acid(AA) to glycerol(G) molar ratio and the reaction temperature on the product distribution of the glycerol acetylation were investigated. It was found that the reaction time for reaching the equilibrium of the product distribution prolonged at higher AA/G molar ratio but shortened at higher reaction temperature. The conversion of glycerol increased with both the AA/G molar ratio and the reaction temperature, however, the AA/G molar ratio was the more effective factor on the total yield of diacetylated glycerol(DAG) and triacetylated glycerol(TAG) than the temperature. The main function of Amberlyst-15 in this reaction was to increase the yield of the desired products (DAG and TAG). The optimal conditions were the AA/G molar ratio of 9 and the temperature of 110℃, under which the glycerol conversion of 97% and total yield of 90% for DAG and TAG were obtained after 120 min reaction. The overall apparent reaction rate constants (k1,k2andk3) and corresponding reaction activation energy (E1,E2andE3) for glycerol esterification to monoacetylated glycerol, diacetylated glycerol, triacetylated glycerol, step by step, estimated by using the homogeneous fist-order consecutive reaction model werek1=2.07×106β0.274exp(-6890/T),E1=57.26 kJ/mol;k2=18.66β1.82exp(-3830/T),E2= 31.87 kJ/mol;k3=1.16β-0.474exp(-1670/T),E3=13.90 kJ/mol.
solid acid catalysis; esterification; reaction kinetics; biodiesel
2013-12-17
國家自然科學基金項目(21366001和21166001)和江西省教育廳科技項目(GJJ14310)資助 第一作者: 賈玉巖,男,碩士研究生,從事催化材料的研究;E-mail:278969952@qq.com
周利民,男,教授,博士,從事新能源化工研究;E-mail:minglzhecit@yahoo.com
1001-8719(2015)01-0160-06
O643.32
A
10.3969/j.issn.1001-8719.2015.01.025

