納米銀在水環境中的環境行為和毒性效應研究進展
衣俊,黃俊,程金平,2,*
1. 華東師范大學河口海岸學國家重點實驗室,上海200062 2. 香港城市大學深圳研究院,深圳518057
納米銀在水環境中的環境行為和毒性效應研究進展
衣俊1,黃俊1,程金平1,2,*
1. 華東師范大學河口海岸學國家重點實驗室,上海200062 2. 香港城市大學深圳研究院,深圳518057
納米材料的環境行為和生態效應是目前國內外研究的熱點,其中納米銀顆粒(AgNPs)是使用量最高的納米材料。本文主要總結了AgNPs在水環境中的賦存、AgNPs的環境行為、AgNPs對不同種類微生物的毒性效應以及影響AgNPs毒性效應的因素,最后對AgNPs在河口區的研究進行了展望。
納米銀顆粒;微生物;環境行為;毒性效應
當Richard Feynman在1959年的美國物理學會(American Physical Society)上首次提出用近似原子的尺度合成并控制物質的概念時,納米技術開始逐漸被人們關注[1]。納米材料被定義為維度小于100 nm的材料,而納米顆粒被定義為至少有2維在1~100 nm的材料,它們特殊的理化性質使其應用廣泛[2]。根據伍德羅威爾遜數據庫的統計,截止到2013年10月,全世界有1 628種消費品中含納米材料,其中含有納米銀顆粒(AgNPs)的產品占383種,是使用量最高的納米材料[3]。
Ag自身有強殺菌抑菌作用,這使得AgNPs在衛生和醫療等方面有著廣泛應用[4-6]。但是隨著該類產品的大量使用,進入水環境中的AgNPs對水生生態系統中的生產者和分解者,如微生物、藻類和無脊椎動物等產生很強的毒性。Choi等[7]的研究表明AgNPs能夠抑制硝化細菌的生長,在1 mg·L-1的濃度下,AgNPs對自養硝化細菌的呼吸抑制率高達約86%;Miao等[8]通過研究證明人工合成的AgNPs嚴重抑制海洋硅藻(Thalassiosira weissflogii)的細胞生長、光合作用以及葉綠素合成;Griffitt等[9]發現AgNPs對枝角水蚤(Daphnia pulex)、網紋水蚤(Ceriodaphnia dubia)和羊角月牙藻(Pseudokirchneriella subcapitata)有很強的毒性,其半致死濃度(LC50)分別是0.040 mg·L-1、0.067 mg·L-1和0.19 mg·L-1。同時,含有AgNPs的產品會向環境中釋放Ag+[10-11]。盡管Ag+在環境中的背景濃度極低,在自然水體中的濃度范圍僅達到0.03~500 ng·L-1[12],但是Ag+在環境中具有持久性和生物積累效應,對水生生物有很強的毒性。有研究表明,一些微型浮游植物在受50~100 ng·L-1的Ag污染后,其生殖能力受到抑制[13]。而90~170 ng·L-1的Ag+就能導致鱒魚慢性中毒[14]。因此在這個緩慢積累和持續的過程中,AgNPs給環境造成的不利影響無法預計。
微生物是生態系統的基礎,也是食物網的基礎,同時調控全球生物地球化學循環。水環境中的微生物如細菌、藻類、真菌等容易在水中形成生物膜(biofilm),生物膜是微生物細胞附著在固體表面形成的生物與非生物群體,對水中污染物有吸附和降解功能,在水體自凈方面起著重要作用[15-16]。近年來隨著長江流域經濟的飛速發展,大量污染物通過河口輸入至水環境,對水質造成了嚴重污染,對河口環境的生態系統的結構和功能造成不良影響,并且在一定程度上對長江流域戰略水源地青草沙水庫造成威脅。除此以外,在水環境中的納米顆粒不但自身有較強的毒性效應,其特殊的理化性質和吸附性,使其能與水中其他污染物相互作用,成為污染物的傳輸工具,通過自身的遷移轉化改變其他污染物的環境行為,進一步產生污染物復合毒理效應。本文簡介了AgNPs在水環境中的賦存和環境行為,重點闡述了AgNPs對水中微生物的毒性效應,為新型納米顆粒物的環境風險評價提供科學參考。
1 AgNPs在水環境中的賦存和環境行為
在AgNPs的生產、加工和使用等過程中,AgNPs不可避免地進入環境中。水環境中AgNPs的“源”主要有污水排放和大氣沉降,排放的污水是最大的污染源,從河口流入的AgNPs在水環境中會經歷一系列遷移轉化(圖1),環境條件如光照、溶解氧、天然有機質等同樣影響AgNPs的環境行為,主要過程包括AgNPs團聚和沉降、價態轉變、絡合作用和生物利用等過程。納米顆粒在海水中的環境行為與其在淡水中不同,海水離子強度更高,更容易導致納米顆粒團聚現象,團聚的納米顆粒最終會聚集在沉積物中,對附著或棲息在沉積物中的底棲生物帶來潛在影響[2]。
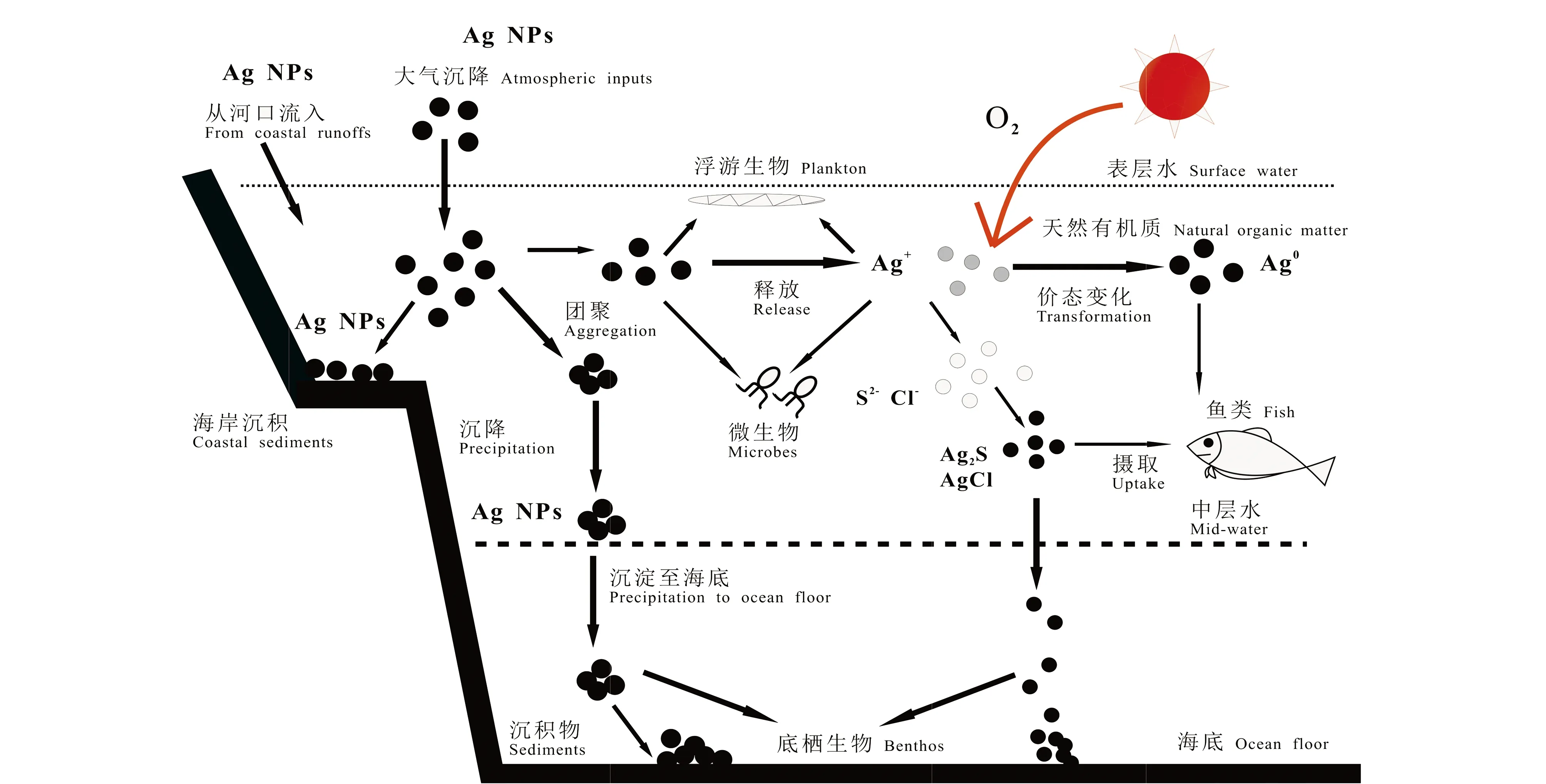
圖1 納米銀顆粒(AgNPs)在水環境中的環境行為和歸趨[2,17-18]Fig. 1 Environmental behavior and fate of silver nanoparticles (AgNPs) in the aquatic environment[2,17-18]
1.1 AgNPs在水環境中的賦存
Ag是地殼中極其稀缺的元素,環境背景濃度極低。因此由于人類活動所導致的水中Ag濃度的變化,即便是細微的變化,也能導致偏離自然條件的巨大波動,Benn等[19]的研究表明在清洗納米銀襪子的水中可檢測到Ag的濃度高達1.3 μg·mL-1。
水環境中AgNPs的潛在風險很大程度上由其濃度決定,并且AgNPs在生產、加工、運輸、消費和處置的整個生命周期中可能以不同的形式進入環境中。人工合成的AgNPs已經廣泛存在于水環境中。英國生態與水文中心(Centre for Ecology and Hydrology)的報告表明英國污水處理廠排放的污水中膠體態Ag(包括AgNPs)的平均濃度是6 ng·L-1,總顆粒態Ag的濃度為78 ng·L-1[20]。Flegal和Sanudo-Wilhelmy[21]通過分析圣地亞哥灣和南舊金山灣的金屬濃度發現Ag+濃度范圍是7~33 ng·L-1。即使在開放的海洋中,也有研究證明Ag的存在,Ranville和Flegal[22]認為海洋中Ag處于生物地球化學循環狀態,由于亞洲地區工業排放,導致北太平洋表層水中檢測到Ag的最高濃度可達到1.296 ng·L-1,比背景濃度(0.027 ng·L-1)高出近50倍。Ag在污水中的濃度比在自然水體中要高得多,Wen等[23]在美國科羅拉多州5個城市收集水樣,其研究結果顯示其中3個城市的污水中,Ag+濃度范圍是64.1~327 ng·L-1,遠超過在上游地區Ag+的濃度;而科羅拉多州的一家影像公司排出的廢水中,Ag的濃度竟高達33 400 ng·L-1。Hoque等[24]對加拿大彼得伯勒一家污水處理廠排放的污水進行分析,結果顯示AgNPs的粒徑是9.3 nm,濃度是1 900 ng·L-1。Matzke等[25]的研究表明,AgNPs對惡臭假單胞菌的EC05為0.13~3.41 μg·L-1,而AgNO3對其的EC05為0.043 μg·L-1。V?lker等[26]研究發現,在21 d的長期暴露中,AgNPs對大型溞(Daphnia magna)的EC10為0.92 μg·L-1。從上述世界各地檢測到的Ag濃度范圍可知,Ag在水環境中不斷積累,而其較強的急性或慢性毒性效應將給環境與健康帶來一定的風險。
目前分析環境中AgNPs含量的相關研究在國內外都鮮有報道,Maynard等[27]科學家曾表示,追求合理化安全的納米科技面臨著5大挑戰,而現階段挑戰的內容就包括運用模型預測環境中和人體內人工合成納米材料的行為。所以目前大部分文獻中出現的AgNPs濃度基本都是模型預測的結果。即便如此,在復雜的環境條件或是生物作用下,由于缺少檢測、定量以及表征AgNPs的方法,AgNPs暴露模型的研究存在瓶頸。所以,今后的發展方向很可能是綜合多種方法,側重環境中AgNPs的痕量分析[28-29]。
Gottschalk等[30]通過模型計算了歐洲、美國和瑞士等國家和地區的AgNPs環境預測濃度(predicted environmental concentrations)(表1)。但Boxall等[31]指出即使用最保守的模型預計,天然水環境中AgNPs的濃度同樣是痕量級,濃度遠低于產生毒性效應的濃度范圍。但由于模型本身存在局限,同時缺乏詳細實測數據的比對,因此AgNPs的潛在風險不可忽視。
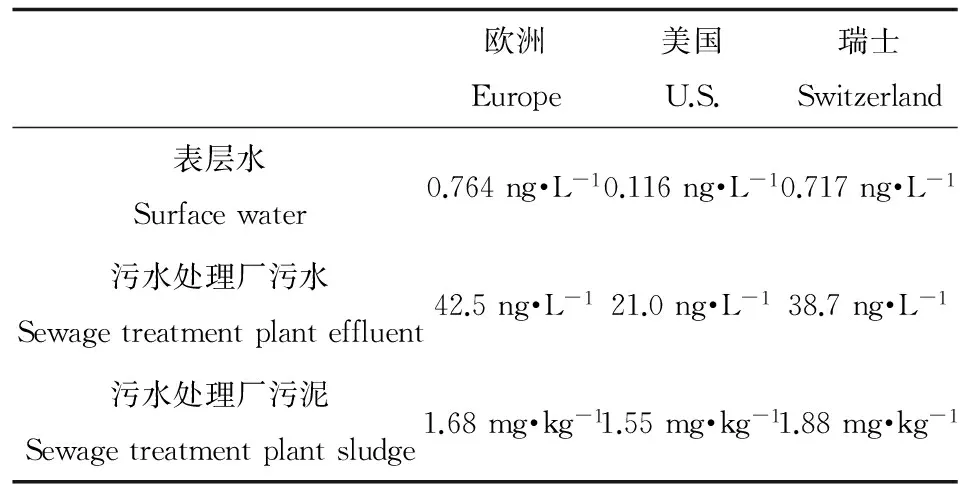
表1 AgNPs環境濃度預測值[30]
1.2 AgNPs在水環境中的環境行為
在海洋或河口環境中,Ag化學性質和生物可利用性決定Ag的毒性。海水中的Cl-結合Ag+能力很強,同時形成的氯化銀類化合物有很強的生物可利用性,能被魚類攝入體內。所以相比于河流湖泊這類淡水域,海洋中的生物對Ag利用性更高,對Ag的環境承載能力更弱[29, 32]。
近年來分析水環境中AgNPs行為的相關研究成為熱點和難點[33],其中很大的難題在于區分Ag的形態(Ag+和AgNPs),因為環境中Ag+能與陰離子如S2-、Cl-形成Ag2S、AgCl,此外環境中存在的天然有機配體如腐殖酸(HA)等也能與Ag+絡合,所以上述過程將給AgNPs的分析帶來干擾。另外,在富含溶解有機質(DOM)的水體中,溶解氧(DO)在光照條件下能產生超氧陰離子(O2·-),進一步將Ag+轉化成AgNPs[18],這表明環境中AgNPs不僅來源于人為活動,也可能來自環境中Ag+的轉化。因此,對不同形態的Ag進行區分,是分析AgNPs濃度不可輕視的問題之一。目前分析和表征AgNPs的方法主要包括掃描電鏡、透射電鏡、動態光散射、紫外可見吸收光譜、電感耦合等離子質譜(或發射光譜)等方法[24,28,34-35]。
由于AgNPs有不同的形狀,不同的電荷,這使得它與其他物質的結合方式也有所不同,因此每一個因素都有可能改變AgNPs的環境行為和毒性[12]。比如,AgNPs釋放Ag+的過程受AgNPs粒徑的影響,粒徑小(<10 nm)的AgNPs釋放Ag+速率較快,粒徑較大的AgNPs(>50 nm)釋放Ag+速率慢,但持續時間長,所以更像是一個穩定的Ag+排放源。同時,AgNPs表面包裹物不同,對整個釋放過程也有影響[11],進一步影響AgNPs顆粒的毒性[36]。Kittler等[37]的研究也表明AgNPs釋放Ag+的速率和程度取決于溫度、AgNPs濃度及其表面基團功能;并且AgNPs放置時間越長,釋放Ag+含量越高,產生的毒性越強。
AgNPs具有極大的比表面積,有很強的吸附能力。同時水體中大多數顆粒物帶負電荷,能吸附水中帶正電荷的金屬陽離子,因此AgNPs可能與水體中的顆粒物發生相互作用。Kaegi等[38]認為從污水處理廠中排放的AgNPs能有效地在廊道中傳輸,并最終沉降至底泥。因為AgNPs更能吸附在水體中懸浮物(TSS)上面而不是在污水生物膜上面。所以在河口區這種含沙量較大的環境中,水中的泥沙和懸浮顆粒可能會影響AgNPs的環境行為和歸趨。
雖然近年來國內外學者對水環境中AgNPs的環境行為開展了探索性研究,但天然水體理化條件復雜多變,AgNPs的形態和行為更具有差異性,這使得要想進一步研究AgNPs的環境行為,就需要新的分析技術和方法。Glover等[39]提出一個新方法分析固體表面AgNPs的轉變,通過實驗發現銀制品暴露在濕潤的空氣或水中能產生AgNPs,整個過程包括3部分:(1) Ag0離子化以及Ag+溶解;(2) Ag+擴散至吸附水層;(3) Ag+在周圍環境條件下被還原。這不但使AgNPs的表面動力學重新被認識,并且暗示人類在長時間接觸納米材料后可能成為環境中納米材料的潛在來源。Zhou等[40]發現AgNPs直接碰撞電極后產生的電氧化結果可以量化,可用于表征并定量AgNPs,該研究正在繼續深入并計劃用于公共衛生和環境監測中。
AgNPs在生態系統中的生物和非生物作用下會產生復雜的環境行為,有學者發現人工合成的納米材料與在自然環境中形成的納米顆粒相差無幾,意味著在復雜的自然環境中納米物質普遍存在。水環境中AgNPs的行為例如氧化還原反應、團聚、溶解及其與生物大分子的作用等,可能改變AgNPs的毒性效應,所以相關研究對解釋AgNPs毒理機制有科學指導意義[41-43]。
2 AgNPs對水環境中微生物和生物膜的毒性效應
早在20世紀,Ag及其化合物對水環境中微生物(如藻類、細菌等)的生物積累效應和毒性效應已有研究,同時由于環境條件(尤其是海洋環境)的不同,Ag的毒性效應也隨之發生變化[44]。同樣在含有納米顆粒的環境介質中,微生物也很可能扮演著調節納米顆粒遷移轉化和毒性效應的角色[17]。因此,對納米材料的微生物毒性的深入研究,既能推動納米技術的發展,又能幫助設計安全合理的納米材料,在提升材料功能的同時降低環境風險。
2.1 水環境中的微生物和生物膜的作用
生物膜中包含多種微生物如細菌、原生動物、真菌以及藻類等,微生物之間處于競爭與合作的平衡狀態[45]。生物膜中豐度最高的是細菌,因此細菌是生物膜的一個重要組成組分。與懸浮狀態的浮游細菌相比,附著在生物膜中的浮游細菌由于生物膜的保護作用,更能抵抗吞噬細胞、抗生素和抗體的攻擊[46]。生物膜中有一個重要組成部分是胞外聚合物(EPS),EPS中含有蛋白質、多糖、脂質和核酸等,為微生物細胞提供天然屏障[47]。復雜的生命結構使得生物膜能夠吸附甚至降解無機污染物和有機污染物[48-49]。
AgNPs進入細胞內的過程可能是由AgNPs的粒徑和細胞膜的通透性和孔隙度決定的。有研究表明,粒徑小于80 nm的AgNPs能進入綠膿桿菌細胞中,并且隨著細胞膜的通透性和孔隙度的增加,AgNPs在細胞中的積累也隨之增加[50]。但Kloepfer等[51]嘗試用腺嘌呤和單磷酸腺苷(AMP)標記枯草桿菌和大腸桿菌,發現只有在量子點(QDs)小于5 nm的情況下,細菌才能被標記。
2.2 AgNPs對微生物和生物膜的毒性效應
若評價AgNPs對微生物和生物膜的毒性效應,要考慮的因素之一便是AgNPs在其中的擴散情況。Peulen和Wilkinson[52]選取包括AgNPs在內的3種納米顆粒,研究AgNPs在熒光假單胞菌生物膜中的擴散規律,結果發現,納米顆粒在環境中的遷移很大程度上受生物膜的影響,AgNPs容易富集在更密集的生物膜上。Martinez-Gutierrez等[53]則證明AgNPs能抑制綠膿桿菌生物膜的形成,并且能殺死生物膜內的細菌。Fabrega等[54]以天然海洋生物膜為研究對象,發現當AgNPs的暴露濃度達到200 μg·L-1,生物膜的體積和生物量明顯減少,進一步通過分子水平分析證明AgNPs能抑制生物膜的形成與進化。
早在2004年就有實驗證明AgNPs有很強的抗菌能力,Sondi等[55]發現當AgNPs的暴露濃度達到10 mg·L-1時,70%的大腸桿菌生長受到抑制;暴露在AgNPs中的大腸桿菌細胞壁遭到破壞,形成了凹陷(pits),這些納米顆粒富集在細胞壁上,增強細胞壁的滲透性,使其不能有效調節質膜運輸,從而導致細胞死亡。
AgNPs在水環境中可以游離出Ag+,Ag+有很強的毒性,因此有關AgNPs抑菌性的文章,得到的結論是Ag+起到決定性的作用[56]。Xiu等[57]通過對比AgNPs商品和Ag+對大腸桿菌的毒性,發現Ag+的毒性明顯高于AgNPs。但是,也有研究將AgNO3與AgNPs對藻類的毒性作用進行對比,發現AgNPs對藻類的毒性比AgNO3強,即使在比環境中Ag+濃度低的條件下,AgNPs也有同等效果的抑制效率[58]。但是Burchardt等[59]的研究表明當AgNPs的暴露濃度達到10 μmol·L-1時,聚球藻(Synechococcus sp.)在72 h后生長完全受到抑制,而達到同樣抑制效果所對應的AgNO3暴露濃度為2 μmol·L-1。Kim等[60]的研究表明AgNPs能抑制大腸桿菌和枯草芽孢桿菌菌落的生長,當AgNPs的暴露濃度為10 mg·L-1時,大腸桿菌和枯草芽孢桿菌的菌落形成比例與對照組相比分別為0.5%和77.5%,同時實驗明確證實AgNPs存在于細菌細胞內并破壞細菌細胞膜,這是其產生毒性效應的主要原因。有研究者認為,AgNPs是間接產生毒性效應,因為檢測到的Ag+濃度不足以解釋毒性效應,所以這可能是一個連續的緩慢的釋放過程。但是如果沒有AgNPs的存在,產生的毒性不會那么明顯[61]。
近期不斷有研究探討AgNPs抗菌特性的可能機制,Radzig等[62]認為AgNPs會吸附在細菌細胞膜表面,破壞細胞滲透性,抑制細胞呼吸,孔蛋白(porin)可能在這個過程中起到關鍵性作用。該實驗選取生物膜中革蘭氏陰性菌(大腸桿菌AB1157、銅綠假單胞菌PAO1、沙雷菌94)作為研究對象,結果表明:(1)納米銀(Ag0/Ag+)抑制細菌生長和生物膜的形成。(2)上述抑制結果的原因不單單是Ag+的作用,過程中出現的DNA氧化損傷也可能有所貢獻。(3)Ag+的產生可能是生物膜釋放的H2O2(產生·OH)與AgNPs相互作用的結果。(4)孔蛋白參與Ag+的傳輸,與對照組相比,突變組中細菌對AgNPs的抵抗力更強,分子水平的分析表明參與合成孔蛋白的基因表達上調。孔蛋白形成的氣孔直徑(約1 nm)比實驗中所用AgNPs直徑(約8.6 nm)小,這表明AgNPs的抗菌機制是Ag+透過細胞壁進入細胞引起的。Xiu等[63]也通過實驗證明Ag+是明確的分子毒物,實驗通過設置嚴格的厭氧條件限制Ag0的氧化以及Ag+的釋放,結果顯示AgNPs在厭氧狀態下對大腸桿菌的毒性明顯低于需氧狀態,并且AgNPs的毒性效應與Ag+濃度呈一定的劑量效應關系。但是,目前有關AgNPs的抗菌機制還沒有確鑿的結論,需要進一步實驗證明。
2.3 影響AgNPs對微生物和生物膜毒性效應的因素
AgNPs對微生物的毒性效應可能因為環境條件的變化而受到影響,絕大多數水環境中都存在天然有機質(NOM),能和AgNPs發生相互作用。Wirth等[64]發現腐殖酸(HA)能緩解Ag對熒光假單胞菌生物膜的毒性,原因是HA能結合Ag+,降低Ag+的毒性,但是HA對穩定的膠體態Ag的毒性短期內沒有顯著影響,反而增加了其對生物膜的接觸,導致慢性毒性的變化。Fabrega等[65]依據薩旺尼河的富里酸(SRFA)設定對照實驗,結果表明在含有SRFA的實驗組中,惡臭假單胞菌細胞脫落的速率降低,并且SRFA提升了生物膜攝取以及富集AgNPs的可能性。在后續的實驗中,Fabrega等[66]進一步通過實驗證明天然有機大分子 (humic substances, HS)能夠短期緩解AgNPs對熒光假單胞菌的毒性。Levard等[67-68]通過實驗證明,AgNPs的硫化作用能降低自身毒性。與對照組相比,在AgNPs發生硫化作用的實驗組中,4種受試生物的EC50和LC50都有明顯的下降。除上述條件以外,García-Alonso等[69]的研究表明處于生命周期早期的海洋生物沙蠶(Platynereis dumerilii)相對于成熟期,在AgNPs暴露下出現更多的死亡或發育異常現象。
在與微生物的相互作用中,AgNPs自身的特征如形狀、尺寸和表面包裹物等,同樣對整個過程起著重要作用。Jose Ruben等[34]發現只有粒徑為1~10 nm的AgNPs才能直接與微生物相互作用,這樣的顆粒能吸附在細菌細胞膜上并破壞其功能。Park等[71]的研究表明Ag表面包裹物不同,對細菌的毒性也不同,用蛋白質包裹的Ag(Biogenic-Ag)毒性明顯高于化學合成的膠態Ag(Colloidal-Ag)。Zhou等[72]通過比較AgNPs和AuNPs對大腸桿菌和卡介苗(Bacillus Calmette-Guérin, BCG)的抑制作用發現,2種納米顆粒均表現出有效的抗菌能力。相同形狀和粒徑的AuNPs,用PAH包裹能導致細胞溶解,而用檸檬酸鹽包裹的納米顆粒則沒有該現象。此外,光照強度、水體溫度和pH值等環境條件有可能影響AgNPs的微生物毒性效應。綜上所述,影響AgNPs對微生物和生物膜毒性效應的因素可能主要有2方面,一是AgNPs所處的環境條件因素,包括自然環境條件如光照、溫度、溶解氧、pH值、鹽度、陰離子和天然有機質等;也包括實驗條件如不同種類的培養基、營養鹽溶液和受試生物選擇等。二是AgNPs自身的特征因素,包括AgNPs的形狀、粒徑、表面包裹物或是修飾物等。
3 問題與展望
隨著納米科技的不斷發展以及含AgNPs商品的廣泛使用,其對生態系統的危害以及對人類健康的潛在風險逐漸得到關注。目前國內外有關AgNPs在水環境中的環境行為及其對微生物的毒性效應研究已經取得了較大進展。但是仍然存在著一些問題沒有被解決或證實,具體表現在以下幾個方面:
(1) AgNPs對微生物的毒性機制。目前針對AgNPs抗菌機制的研究沒有明確結論,有觀點證明Ag+在其毒性效應中起主要作用,但另有觀點證明AgNPs的毒性機制是進入微生物體內NPs導致的。因此,今后相關研究需要探索新的實驗方法和技術,結合不同學科(如化學的成分分析和生物的基因表達分析等)研究AgNPs抗菌機制。
(2) AgNPs慢性毒性實驗研究。Ag具有持久性和生物富集性,并且納米顆粒的自身特性使得AgNPs能長期積累在生物體內,因此AgNPs慢性或長期毒性效應不容忽視。然而目前研究多針對AgNPs的急性毒性,缺乏慢性毒性實驗數據的對比,如果低濃度(ng·L-1)AgNPs長期暴露對受試生物產生毒性效應或抑制作用,同樣對環境風險評價有重要借鑒意義,因此亟待開展相關研究。
(3)評價天然水體中AgNPs的環境行為和毒性效應。目前多數AgNPs的毒理研究所得結論是建立在特定實驗條件基礎上的,但AgNPs在相對復雜的自然環境下的環境行為和毒性效應很可能發生變化,因此有必要開展相關研究。
此外,有關AgNPs進入環境后,在生態系統中的遷移轉化規律和潛在危害的研究比較有限,特別作為地球上最富有生機、具有獨特生態價值和資源潛力的河口濱岸生態系統,相關研究更是稀缺。因此這方面的研究也有待開展。
[1] Feynman R P. There's plenty of room at the bottom [J]. Engineering and Science, 1960, 23(5): 22-36
[2] Klaine S J, Alvarez P J J, Batley G E, et al. Nanomaterials in the environment: Behavior, fate, bioavailability, and effects [J]. Environmental Toxicology and Chemistry, 2008, 27(9): 1825-1851
[3] Woodrow Wilson International Center for Scholars. The project on emerging nanotechnologies [DB]. [2014-03-14]. http://www.nanotechproject.org
[4] Bryaskova R,Pencheva D,Nikolov S, et al. Synthesis and comparative study on the antimicrobial activity of hybrid materials based on silver nanoparticles (AgNps) stabilized by polyvinylpyrrolidone (PVP) [J]. Journal of Biological Chemistry, 2011, 4(4): 185-191
[5] Silver S. Bacterial silver resistance: Molecular biology and uses and misuses of silver compounds [J]. FEMS Microbiology Reviews, 2003, 27(2-3): 341-353
[6] Hamouda I M. Current perspectives of nanoparticles in medical and dental biomaterials [J]. Journal of Biomedical Research, 2012, 26(3): 143-151
[7] Choi O, Deng K K, Kim N J, et al. The inhibitory effects of silver nanoparticles, silver ions, and silver chloride colloids on microbial growth [J]. Water Research, 2008, 42(12): 3066-3074
[8] Miao A J, Schwehr K A, Xu C, et al. The algal toxicity of silver engineered nanoparticles and detoxification by exopolymeric substances [J]. Environmental Pollution,2009, 157(11): 3034-3041
[9] Griffitt R J, Luo J, Gao J, et al. Effects of particle composition and species on toxicity of metallic nanomaterials in aquatic organisms [J]. Environmental Toxicology and Chemistry, 2008, 27(9): 1972-1978
[10] Geranio L, Heuberger M, Nowack B. The behavior of silver nanotextiles during washing [J]. Environmental Science & Technology, 2009, 43(21): 8113-8118
[11] Dobias J, Bernier-Latmani R. Silver release from silver nanoparticles in natural waters [J]. Environmental Science & Technology, 2013, 47(9): 4140-4146
[12] Luoma S N. Silver nanotechnologies and the environment: Old problem or new challenges [R]. Washington D C, USA:Woodrow Wilson International Center for Scholars, 2008: 72
[13] Hook S E, Fisher N S. Sublethal effects of silver in zooplankton: Importance of exposure pathways and implications for toxicity testing [J]. Environmental Toxicology and Chemistry, 2001, 20(3): 568-574
[14] Hogstrand C,Wood C M. Toward a better understanding of the bioavailability, physiology, and toxicity of silver in fish: Implications for water quality criteria [J]. Environmental Toxicology and Chemistry, 1998, 17(4): 547-561
[15] 王文軍, 王文華, 張學林, 等. 水環境中生物膜對污染物環境化學行為的影響[J]. 環境科學進展, 1999, 7(6): 58-65
Wang W J, Wang W H, Zhang X L, et al. Effect of biofilms in the aquatic environment on the environmental chemical behavior of pollutants [J]. Advancesin Environental Science, 1999, 7(6): 58-65 (in Chinese)
[16] 張金蓮, 吳振斌. 水環境中生物膜的研究進展[J]. 環境科學與技術, 2007, 30(11): 102-106, 121
Zhang J L, Wu Z B. Progress on biofilm studies [J]. Environmental Science and Technology, 2007, 30(11):102-106, 121
[17] Wiesner M R, Lowry G V, Alvarez P, et al. Assessing the risks of manufactured nanomaterials [J]. Environmental science & technology, 2006, 40(14): 4336-4345
[18] Yin Y, Liu J, Jiang G. Sunlight-induced reduction of ionic Ag and Au to metallic nanoparticles by dissolved organic matter [J]. ACS Nano, 2012, 6(9): 7910-7919
[19] Benn T M,Westerhoff P. Nanoparticle silver released into water from commercially available sock fabrics [J]. Environmental Science & Technology, 2008, 42(11): 4133-4139
[20] Centre for Ecology and Hydrology. Exposure assessment for engineered silver nanoparticles throughout the rivers of England and Wales (CB0433)[R/OL]. (2011-11-06) [2014-03-14]. http://randd.defra.gov.uk
[21] Flegal A R, Sanudo-Wilhelmy S A.Comparable levels of trace metal contamination in two semienclosed embayments: San Diego Bay and south San Francisco Bay [J]. Environmental Science & Technology, 1993, 27(9): 1934-1936
[22] Ranville M A, Flegal A R. Silver in the North Pacific Ocean [J]. Geochemistry, Geophysics, Geosystems, 2005, 6(3): Q03M01
[23] Wen L S, Santschi P H, Gill G A, et al. Silver concentrations in Colorado, USA, watersheds using improved methodology [J]. Environmental Toxicology and Chemistry, 2002, 21(10): 2040-2051
[24] Hoque M E, Khosravi K, Newman K, et al. Detection and characterization of silver nanoparticles in aqueous matrices using asymmetric-flow field flow fractionation with inductively coupled plasma mass spectrometry [J]. Journal of Chromatography A, 2012, 1233: 109-115
[25] Matzke M, Jurkschat K, Backhaus T. Toxicity of differently sized and coated silver nanoparticles to the bacterium Pseudomonas putida: Risks for the aquatic environment? [J]. Ecotoxicology, 2014: 1-12
[26] V?lker C, Boedicker C, Daubenthaler J, et al. Comparative toxicity assessment of nanosilver on three Daphnia species in acute, chronic and multi-generation experiments [J]. PloS one, 2013, 8(10): e75026
[27] Maynard A D, Aitken R J, Butz T, et al. Safe handling of nanotechnology [J]. Nature, 2006, 444(7117): 267-269
[28] Hassell?v M, Readman J, Ranville J, et al. Nanoparticle analysis and characterization methodologies in environmental risk assessment of engineered nanoparticles [J]. Ecotoxicology, 2008, 17(5): 344-361
[29] Fabrega J, Luoma S N, Tyler C R, et al. Silver nanoparticles: Behaviour and effects in the aquatic environment [J]. Environment International, 2011, 37(2): 517-531
[30] Gottschalk F,Sonderer T,Scholz R W, et al. Modeled environmental concentrations of engineered nanomaterials (TiO2, ZnO, Ag, CNT, Fullerenes) for different regions [J]. Environmental Science & Technology, 2009, 43(24): 9216-9222
[31] Boxall A, Chaudhry Q, Sinclair C, et al. Current and future predicted environmental exposure to engineered nanoparticles [R]. Central York, UK: Science Laboratory, 2007
[32] Luoma S N, Ho Y B, Bryan G W. Fate, bioavailability and toxicity of silver in estuarine environments [J]. Marine Pollution Bulletin, 1995, 31(1-3): 44-54
[33] Cherrie M W, Matteo Dalla V, Kevin C J, et al. Challenges in assessing the environmental fate and exposure of nano silver [J]. Journal of Physics: Conference Series, 2011, 304(1): 012070
[34] Jose Ruben M, Jose Luis E, Alejandra C, et al. The bactericidal effect of silver nanoparticles [J]. Nanotechnology, 2005, 16(10): 2346
[35] Liu J F, Chao J B, Liu R, et al. Cloud point extraction as an advantageous preconcentration approach for analysis of trace silver nanoparticles in environmental waters [J]. Analytical Chemistry, 2009, 81(15): 6496-6502
[36] Yang X, Gondikas A P, Marinakos S M, et al. mechanism of silver nanoparticle toxicity is dependent on dissolved silver and surface coating in Caenorhabditis elegans [J]. Environmental Science & Technology, 2011, 46(2): 1119-1127
[37] Kittler S, Greulich C, Diendorf J, et al. Toxicity of silver nanoparticles increases during storage because of slow dissolution under release of silver ions [J]. Chemistry of Materials, 2010, 22(16): 4548-4554
[38] Kaegi R,Voegelin A,Ort C, et al. Fate and transformation of silver nanoparticles in urban wastewater systems [J]. Water Research, 2013, 47(12): 3866-3877
[39] Glover R D,Miller J M,Hutchison J E. generation of metal nanoparticles from silver and copper objects: Nanoparticle dynamics on surfaces and potential sources of nanoparticles in the environment [J]. ACS Nano, 2011, 5(11): 8950-8957
[40] Zhou Y G, Rees N V, Compton R G. The electrochemical detection and characterization of silver nanoparticles in aqueous solution [J]. Angewandte Chemie International Edition, 2011, 50(18): 4219-4221
[41] Bone A J, Colman B P,Gondikas A P, et al. Biotic and abiotic interactions in aquatic microcosms determine fate and toxicity of Ag nanoparticles: Part 2 toxicity and Ag speciation [J]. Environmental Science & Technology, 2012, 46(13): 6925-6933
[42] Unrine J M, Colman B P, Bone A J, et al. Biotic and abiotic interactions in aquatic microcosms determine fate and toxicity of Ag nanoparticles. Part 1. aggregation and dissolution [J]. Environmental Science & Technology, 2012, 46(13): 6915--6924
[43] Lowry G V,Gregory K B, Apte S C, et al. Transformations of nanomaterials in the Environment [J]. Environmental Science & Technology, 2012, 46(13): 6893-6899
[44] Ratte H T. Bioaccumulation and toxicity of silver compounds: A review [J]. Environmental Toxicology and Chemistry, 1999, 18(1): 89-108
[45] Nadell C D,Xavier J B,Foster K R. The sociobiology of biofilms [J]. FEMS Microbiology Reviews,2009, 33(1): 206-222
[46] Costerton J W, Stewart P S, Greenberg E P. Bacterial biofilms: A common cause of persistent infections [J]. Science, 1999, 284(5418): 1318-1322
[47] Sutherland I W.Biofilm exopolysaccharides: A strong and sticky framework [J]. Microbiology, 2001, 147(1): 3-9
[48] 董德明, 紀亮, 花修藝, 等. 自然水體生物膜吸附Co, Ni和Cu的特征研究[J]. 高等學校化學學報, 2004, 25(2): 247-251
Dong D M, Ji L, Hua X Y, et al. Stuies on the characteristics of Co, Ni and Cu adsorption to natural surface coatings [J]. Chemical Journal of Chinese Universities, 2004, 25(2): 247-251
[49] Bohuss I, Rékasi T, Szikora S, et al. Interaction of acetochlor and atrazine with natural freshwater biofilms grown on polycarbonate substrate in lake Velence (Hungary) [J]. Microchemical Journal, 2005, 79(1-2): 201-205
[50] Xu X-H N, Brownlow W J, Kyriacou S V, et al. Real-time probing of membrane transport in living microbial cells using single nanoparticle optics and living cell imaging [J]. Biochemistry, 2004, 43(32): 10400-10413
[51] Kloepfer J A, Mielke R E, Nadeau J L. Uptake of CdSe and CdSe/ZnS quantum dots into bacteria via purine-dependent mechanisms [J]. Applied and Environmental Microbiology, 2005, 71(5): 2548-2557
[52] Peulen T-O, Wilkinson K J. Diffusion of nanoparticles in a biofilm [J]. Environmental Science & Technology,2011, 45(8): 3367-3373
[53] Martinez-Gutierrez F, Boegli L, Agostinho A, et al. Anti-biofilm activity of silver nanoparticles against different microorganisms [J]. Biofouling, 2013, 29(6): 651-660
[54] Fabrega J, Zhang R, Renshaw J C, et al. Impact of silver nanoparticles on natural marine biofilm bacteria [J]. Chemosphere, 2011, 85(6): 961-966
[55] Sondi I, Salopek-Sondi B. Silver nanoparticles as antimicrobial agent: A case study on E. colias a model for Gram-negative bacteria [J]. Journal of Colloid and Interface Science, 2004, 275(1): 177-182
[56] Lok C-N,Ho C-M,Chen R, et al. Silver nanoparticles: Partial oxidation and antibacterial activities [J].Journal of Biological Inorganic Chemistry, 2007, 12(4): 527-534
[57] Xiu Z M, Ma J, Alvarez P J J. Differential effect of common ligands and molecular oxygen on antimicrobial activity of silver nanoparticles versus silver ions [J]. Environmental Science & Technology, 2011, 45(20): 9003-9008
[58] Navarro E, Piccapietra F,Wagner B, et al. Toxicity of silver nanoparticles to Chlamydomonas reinhardtii [J]. Environmental Science & Technology, 2008, 42(23): 8959-8964
[59] Burchardt A D, Carvalho R N,Valente A, et al. Effects of silver nanoparticles in diatom Thalassiosira pseudonanaand cyanobacterium Synechococcus sp. [J]. Environmental Science & Technology, 2012, 46(20): 11336-11344
[60] Kim S, Baek Y-W, An Y-J. Assay-dependent effect of silver nanoparticles to Escherichia coli and Bacillus subtilis [J]. Applied Microbiology and Biotechnology, 2011, 92(5): 1045-1052
[61] Lubick N. Nanosilver toxicity: Ions, nanoparticles or both? [J]. Environmental Science & Technology, 2008, 42(23): 8617--8617
[62] Radzig M A, Nadtochenko V A, Koksharova O A, et al. Antibacterial effects of silver nanoparticles on Gram-negative bacteria: Influence on the growth and biofilms formation, mechanisms of action [J]. Colloids and Surfaces B: Biointerfaces, 2013, 102: 300-306
[63] Xiu Z M, Zhang Q B, Puppala H L, et al. Negligible particle-specific antibacterial activity of silver nanoparticles [J]. Nano Letters, 2012, 12(8): 4271-4275
[64] Wirth S M, Lowry G V, Tilton R D. Natural organic matter alters biofilm tolerance to silver nanoparticles and dissolved silver [J]. Environmental Science & Technology, 2012, 46(22): 12687-12696
[65] Fabrega J, Renshaw J C, Lead J R. Interactions of silver nanoparticles with Pseudomonas putida biofilms [J]. Environmental Science & Technology, 2009, 43(23): 9004-9009
[66] Fabrega J, Fawcett S R, Renshaw J C, et al. Silver nanoparticle impact on bacterial growth: Effect of pH, concentration, and organic matter [J]. Environmental Science & Technology, 2009, 43(19): 7285-7290
[67] Levard C, Hotze E M, Lowry G V, et al. Environmental transformations of silver nanoparticles: Impact on stability and toxicity [J]. Environmental Science & Technology, 2012, 46(13): 6900-6914
[68] Levard C, Hotze E M, Colman B P, et al. Sulfidation of silver nanoparticles: Natural antidote to their toxicity [J]. Environmental Science & Technology, 2013, 47(23): 13440-13448
[69] García-Alonso J, Rodriguez-Sanchez N, Misra S K, et al. Toxicity and accumulation of silver nanoparticles during development of the marine polychaete Platynereis dumerilii [J]. Science of the Total Environment, 2014, 476 477: 688-695
[70] Li M, Zhu L, Lin D. Toxicity of ZnO nanoparticles to Escherichia coli: Mechanism and the influence of medium components [J]. Environmental Science & Technology, 2011, 45(5): 1977-1983
[71] Park H-J, Park S, Roh J, et al. Biofilm-inactivating activity of silver nanoparticles: A comparison with silver ions [J]. Journal of Industrial and Engineering Chemistry,2013, 19(2): 614-619
[72] Zhou Y, Kong Y, Kundu S, et al. Antibacterial activities of gold and silver nanoparticles against Escherichia coliand bacillus Calmette-Guérin [J]. Journal of Nanobiotechnology, 2012, 10(1): 1-9
◆
Review of Environmental Behavior and Toxicity of Silver Nanoparticles in the Aquatic Environment
Yi Jun1,Huang Jun1,Cheng Jinping1,2,*
1. State Key Laboratory of Estuarine and Coastal Research, East China Normal University, Shanghai 200062, China 2. City University of Hong Kong Shenzhen Research Institute, Shenzhen 518057, China
14 March 2014 accepted 7 May 2014
The environmental behaviour and ecological impact of nano-materialshave attracted increasing attention in recent years. Silver nanoparticles (AgNPs) are the most frequently used nano-materials. This review summarizes research progress on the behavior and toxicity of AgNPs in the aquatic environment. Occurrence, environmental behavior, toxicity to various microorganisms, and the factors influencing toxicity of AgNPs are summarized. Finally, perspectives for future research regarding AgNPs in estuarine environment are discussed.
silver nanoparticles; microorganisms; environmental behavior; toxicity
國家自然科學基金(41101489);廣東省自然科學基金(s2012010010847);教育部新世紀優秀人才計劃項目(NECT-12-0181);華東師范大學高層次人才經費(No.79631916);河口海岸學國家重點實驗室自主課題(2012RCDW-01)
衣俊(1990-),男,碩士,研究方向為生態毒理學,E-mail: 51132601029@ecnu.cn
*通訊作者(Corresponding author),E-mail: jpcheng@sklec.ecnu.edu.cn
10.7524/AJE.1673-5897.20140314003
2014-03-14 錄用日期:2014-05-07
1673-5897(2015)1-101-09
X171.5
A
程金平(1978—),女,博士,研究員,主要研究方向為生態毒理學。
衣俊, 黃俊, 程金平. 納米銀在水環境中的環境行為和毒性效應研究進展[J]. 生態毒理學報, 2015, 10(1): 101-109
Yi J, Huang J, Cheng J P. Review of environmental behavior and toxicity of silver nanoparticles in the aquatic environment [J]. Asian Journal of Ecotoxicology, 2015, 10(1): 101-109 (in Chinese)

