乳鏈菌肽生物合成及高產菌株選育的研究進展
倪志堅,王紹花,劉飛,朱希強,Δ
(1.山東大學 藥學院,山東 濟南 250012;2.山東省藥學科學院 博士后工作站,山東 濟南 250101)
?
乳鏈菌肽生物合成及高產菌株選育的研究進展
倪志堅1,王紹花2,劉飛2,朱希強1,2Δ
(1.山東大學 藥學院,山東 濟南 250012;2.山東省藥學科學院 博士后工作站,山東 濟南 250101)
乳鏈菌肽(Nisin)是乳酸乳球菌(Lactococcuslactis,L.lactis)的某些亞種在生長過程中產生的一種天然活性多肽類細菌素。由于其具有優越的抑菌活性,現已作為一種高效、無毒的綠色食品添加劑廣泛應用于食品工業。然而目前Nisin主要通過乳酸菌發酵生產,其工業化產率較低,尚不能滿足龐大的市場需求,因此合理構建高產Nisin菌株意義重大。本文主要綜述了以Nisin生物合成關鍵基因的功能表達及其調控機制為主線的分子成熟途徑,并對Nisin高產菌株的研究狀況作了概述,為實踐進一步高產菌株的研究提供了方向,對Nisin的工業化放大生產具有一定指導意義。
乳鏈菌肽;生物合成;關鍵基因;調控;高產菌株
乳鏈菌肽,又稱乳酸鏈球菌素,屬于羊毛硫抗生素(lantibiotics)家族。成熟的活性Nisin單體分子由34個氨基酸組成,其典型特征是分子結構中含有多種稀有氨基酸,這些非編碼氨基酸的存在不僅側面反映了Nisin形成過程的特殊性,而且與Nisin穩定性及其生物功能密切相關[1]。一般情況下,Nisin對大多數革蘭氏陽性菌及其芽孢的生長和繁殖具有強烈的抑制作用,而且在人體消化道內蛋白酶作用下能夠被迅速降解而不影響腸道內正常菌落結構,現已成為一種公認的安全天然生物食品添加劑,并在全球范圍廣泛應用于食品行業,同時在生物醫藥和輕工業等領域也極具廣闊的應用前景[2]。
1 Nisin生物合成的關鍵基因分析
1988年,Buchman等[3]首次克隆出編碼Nisin的基因并開始對其合成機理進行了深入研究。現已基本確定Nisin生物合成的基因由一段控制其合成、成熟、調控及免疫的nisABTCIPRKFEG基因簇所構成,約14kb,位于染色體的1個約70kb的接合型轉座子上。這11個基因的表達各不相同,且功能復雜,但活性Nisin的產生需要該基因簇中所有基因的共同作用[4]。
1.1 Nisin的結構基因 nisA是Nisin前體的結構基因,負責編碼Nisin前體肽。該肽分子由57個氨基酸構成,包括N-端23個氨基酸組成的前導序列和C-端34個氨基酸組成的成熟Nisin分子的前身(見圖1A)。Nisin前體的前導肽可以被修飾和轉運蛋白所識別,即Nisin前體分子必須在其前導肽的引導下經歷翻譯后修飾和加工過程,才能形成成熟活性Nisin分子[4]。1993年Kuipers等[4]通過構建一個缺失4bp的結構基因(△nisA),研究了Nisin在nisA缺失和完整存在下的表達情況,結果nisA缺失菌株沒有生成Nisin的任何結構,這表明了nisA的表達依賴于其自身結構的完整性。但向培養基中加入少量活性Nisin后,nisA的轉錄又能開始;隨后又通過構建nisA啟動子與報道基因gusA的融合子,并轉入適當受體,結果得到了gusA基因的表達產物,且表達水平與加入Nisin的量直接相關,從而證實了nisA啟動子的可誘導性,并提示了Nisin合成系統潛在的復雜調控機制。此外,Sailaja等[5]報道指出nisA啟動子還可以被外加半乳糖誘導啟動,進一步研究表明該誘導機制是通過一個結合在轉錄起始點-107bp處TCT重復序列上的轉錄調節因子所介導的,且這個轉錄調節因子與Nisin介導的誘導機制也有關聯。
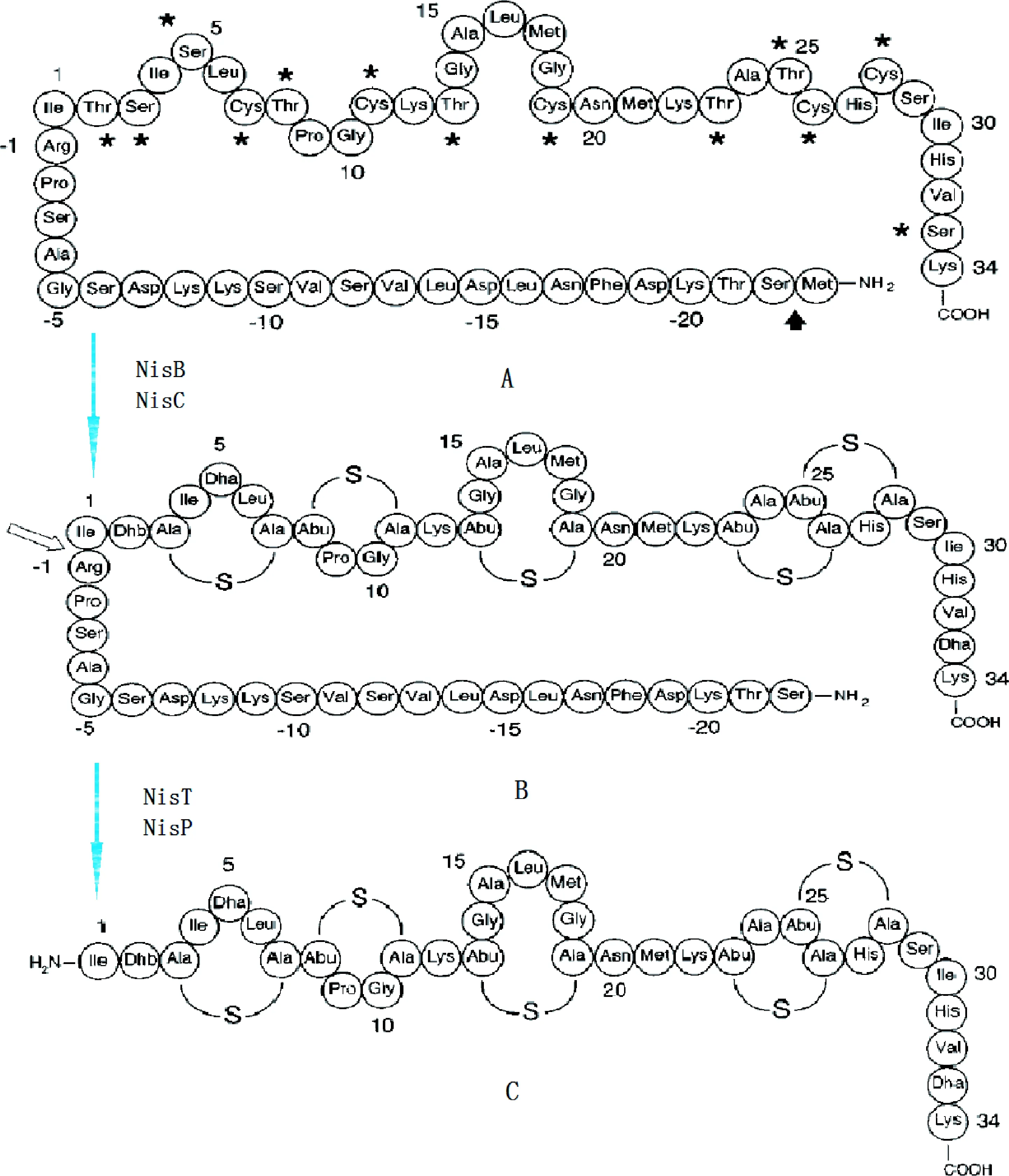
圖1 Nisin結構變化圖A:Nisin前體;B:完全修飾的Nisin前體;C:成熟Nisin★:可被修飾的氨基酸;黑色箭頭:N-端氨基酸的加工;白色箭頭:前導肽的切割位點Fig.1 Schematic changes of Nisin structureA:Nisin precursor;B:fully modified Nisin precursor;C:mature Nisin★:residues that will be modified;Black arrow:processing of the N-terminal residue;white arrow:the processing site of the leader peptide
1.2 Nisin的成熟基因
1.2.1 nisBC基因:nisBC是Nisin前體的修飾基因。其中nisB編碼1個脫水酶蛋白(NisB),由993個氨基酸組成。NisB具有兩性跨膜的α-螺旋結構,該區域可以和細胞膜結合,使NisB定位于細胞膜上,從而發揮其特定功能:將Nisin前體分子中的絲氨酸脫水形成脫氫丙氨酸,同時將蘇氨酸脫水形成β-甲基脫氫丙氨酸。Ra等[6]實驗表明,nisB基因的缺失會直接造成Nisin產物的消失及菌株免疫力的急劇降低。
nisC編碼一個含414個氨基酸的環化酶蛋白(NisC),它主要參與Nisin前體分子中脫水氨基酸殘基與半胱氨酸形成硫醚橋的過程。NisC也定位于細胞膜上,它對Nisin前體的翻譯后修飾作用至關重要,敲除nisC基因后,經NisB脫水處理后的Nisin前體就不能形成硫醚橋,導致Nisin抑菌活性完全喪失。Li等[7]對nisC基因進行體內過表達并純化后發現NisC在水中能以單體形式存在,光譜分析顯示該蛋白含有鋅元素,這種異源產生的NisC蛋白在體外也能使已脫水的Nisin前體肽成環,并且產物切掉前導肽后具有完全成熟的Nisin活性。而鋅元素的存在,可能與NisC的環化功能密切相關,這一點在后來Okeley的研究[8]中已經得到證實。
1.2.2 nisT基因:nisT位于nisB的下游,編碼1個含600個氨基酸的轉運蛋白(NisT),負責完全修飾的Nisin前體的跨膜運輸。NisT與ABC(ATP-binding cassette)轉運蛋白家族有強烈的同源性,是耗能運輸蛋白,含2個結構域:其C-端含有ATP結合的特征結構序列,可以結合ATP;N-端的α-螺旋形成跨膜結構域,能使NisT鑲嵌在細胞膜上。Siegers等[9]發現NisB對NisT的跨膜轉運功能有輔助作用,進一步研究顯示NisB、NisC和NisT之間不僅有相互作用,而且在細胞質膜內側形成了一個膜相關的酶復合體(NisBC2T2),包含1分子的NisB,2分子的NisC和2分子的NisT,從而保證了Nisin前體的翻譯后修飾及分泌工作的高效性。nisT敲除實驗顯示[6]培養基中檢測不到Nisin活性,細胞不能將經過修飾的Nisin前體分泌到胞外,同時菌體的生長受到了很大抑制,從而證明了nisT在Nisin轉運過程中的關鍵程度。然而,Fang等[10]研究表示,在沒有生物膜結構和nisT基因或NisT存在的體外Nisin合成系統中,同樣可以形成完全修飾的Nisin分子,這表明不同的合成體系中,NisT對Nisin成熟過程的關鍵程度不同,且NisT的功能發揮具有一定獨立性。
1.2.3 nisP基因:nisP編碼1個枯草桿菌蛋白酶樣的胞外絲氨酸蛋白酶(NisP)[11],含682個氨基酸殘基,負責完全修飾的Nisin前體上前導序列的切割,形成成熟活性Nisin分子(見圖1C)。該蛋白酶肽鏈N-端是由220個殘基構成的pre-pro序列,包括1個分泌性信號肽區,負責將NisP分泌到細胞外,和1個信號肽酶切割位點,在NisP成熟過程中信號肽會被切掉;其C-端是1段含110個氨基酸的保守序列,它是細胞表面的膜錨著點,這表明NisP錨定在細胞外膜上;中間殘基部分就是該酶的功能催化區。葉嗣穎等[12]成功構建了一個nisP缺失的突變株,此菌株能分泌完整的Nisin前體肽,卻不能分泌成熟的活性Nisin分子。利用Nisin產生菌的菌體胞膜蛋白處理該Nisin前體后,才能形成有活性的成熟Nisin分子,從而證實了nisP基因在Nisin生物合成最后成熟階段的決定性作用。
1.3 Nisin的表達調控基因 Nisin的生物合成由雙組分調控系統nisRK基因表達調控[4],位于nisP基因下游。其中nisR編碼1個含228個氨基酸的應答調節蛋白(NisR),是Nisin生物合成中的轉錄激活因子。該蛋白發生磷酸化后能結合到nisA和nisF的啟動子區,誘導其下游相關基因的轉錄。nisK編碼1個含446個氨基酸的組氨酸感應激酶(NisK),錨定于胞外膜上,能與成熟Nisin分子發生結合。當胞外環境中出現成熟Nisin、Nisin突變體或Nisin類似物時,它會結合到NisK上并激發下游信號轉導[4]。研究顯示[13]nisR或nisK的敲除都能夠使nisA轉錄缺陷,導致L.lactis菌株不能正常表達Nisin,體現了nisRK在Nisin生物合成中的重要作用。然而nisRK操縱子自身的表達是獨立于Nisin調控的,由組成型啟動子nisR啟動表達。據報道[14],雖然nisR啟動子強度相對較大,但其起始密碼子是GTG,且nisK上缺乏高效的核糖體結合位點,導致nisRK轉錄效率較低,因此一般野生型Nisin產生菌中nisRK的表達水平都不高。汪蕊等[15]通過構建重組質粒pMG76e-nisRK,替換了原啟動結構,并轉入宿主菌后,獲得的重組菌株使Nisin的產量明顯提高,這為高產Nisin工程菌的構建了可靠依據。
1.4 Nisin的免疫抗性基因 Nisin作為一種天然生物防腐劑,對大多數革蘭氏陽性細菌均有抑制作用。一般認為[16]它能與細菌細胞膜上LipidII分子結合形成Nisin-LipidII孔洞復合物,在納摩爾級濃度下便使細胞膜穿孔,造成細胞內小分子內容物的流失,同時LipidII分子也是細菌細胞壁生物合成的重要中間體,因此Nisin對LipidII分子的“劫持”會干擾細胞壁的正常合成,從而導致細胞的死亡。而在Nisin產生菌中,這種抑菌效應顯然能被菌株自身所免疫,這主要是Nisin生物合成基因簇上的4個基因共同決定的,即nisI和nisFEG。它們能編碼相應的免疫物質,防止產物Nisin對細胞自身的毒害作用。其中nisFEG基因分別編碼3個疏水性蛋白[17]:NisF(225個氨基酸,24.7 kDa)、NisE(247個氨基酸,28.2 kDa)和NisG(214個氨基酸,24.2 kDa)。其中NisE、NisF與ABC轉運蛋白家族有很強的同源性,且NisF是胞質ATP結合蛋白,而NisG含有3~4個跨膜結構域,能定位于胞膜上。這3個蛋白可組成一個類ABC的轉運蛋白復合體nisFEG,該復合體能夠把入侵細胞膜的Nisin轉運到細胞外部環境,防止由于Nisin濃度過高而形成孔洞,因此在免疫機制中發揮著重要的作用。nisF、nisE和nisG中任一基因的缺失都會導致細胞Nisin產量的下降以及細胞對Nisin敏感性的提高。
nisI基因位于nisC下游,編碼1個含245個氨基酸的NisI前體蛋白分子[18],其N-端存在1段高保守信號序列,是胞質膜的膜錨著點,在轉運過程中會發生修飾并切除,從而形成NisI的2種存在形態:分泌到胞外的游離形態和膜結合形態。這2種形態的NisI都能直接與Nisin發生特異性結合作用,因此NisI可以作為Nisin的“攔截”分子,阻止其與細胞膜上lipidII分子結合而造成穿膜的孔洞,從而使細胞自身免受Nisin的侵害作用,形成了自我免疫的第一道防線。同樣,nisI基因缺失研究表明細胞仍能產生活性Nisin,但其產量和對Nisin的敏感水平均有顯著變化。最近有報道指出[19],可能還存在其他細胞成分也參與了菌體的Nisin免疫抗性。Froseth等[20]鑒定到了1個Nisin抗性基因(nsr),能編碼一個膜結合蛋白(NSR),其C-端存在一段保守的末端特異性蛋白酶結構域。該蛋白介導的Nisin抗性就是通過破壞Nisin分子的第28位甲基羊毛硫氨酸和第29位絲氨酸之間結構,導致Nisin分子降解而增強菌體自身免疫。它是L.lactis中首個被鑒定并闡明的直接由蛋白酶降解Nisin而形成的Nisin免疫抗性機制。
2 Nisin的生物合成途徑概述
成熟活性Nisin的產生需要該生物合成基因簇上所有基因的共同作用,而這11個基因序列分別由nisA、nisR、及nisF啟動子控制其轉錄。其中nisR啟動子是組成型表達的,而nisA和nisF啟動子由nisRK所形成的雙組分調控系統調控表達。Nisin具體合成途徑如下[4](見圖2):①首先胞外信號(如活性Nisin)與細胞膜上的NisK結合,使NisK迅速發生自我磷酸化并將磷酸基團轉移給NisR;②磷酸化的NisR作為轉錄激活因子,結合到nisA和nisF啟動子上,激活轉錄,并啟動下游基因表達,從而在核糖體上合成Nisin前體肽和相應的一系列蛋白(NisB、NisC、NisT、NisP及脂蛋白NisI和轉運蛋白復合體NisFEG);③Nisin前體分子經NisB的脫水作用及NisC的環化作用,形成5個分子內硫醚橋,完成Nisin前體的翻譯后修飾的過程;④NisT水解胞質內ATP提供能量,將經過翻譯后修飾的Nisin前體跨膜轉運至胞外;⑤錨定于胞膜上的NisP對完全修飾的Nisin前體進行胞外加工,切去前導肽序列,釋放出有活性的成熟Nisin分子,完成Nisin整個生物合成的最后一步。而脂蛋白NisI和轉運蛋白復合體NisFEG雖未直接參與Nisin合成過程,但它們與菌體自身對Nisin的免疫性密切相關,一直負責保護著生產菌自身免受胞外Nisin的傷害,從而為菌體的一切生命活動提供了安全保障。
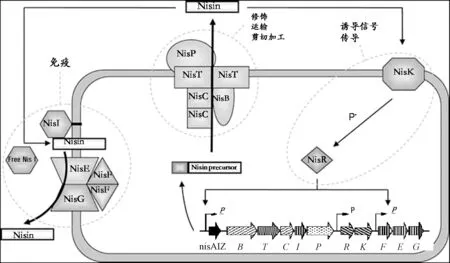
圖2 Nisin生物合成路徑模型P*:磷酸基團;P:誘導型啟動子;P:組成型啟動子Fig.2 The model of Nisin biosynthesis pathwayP*:phosphate group;P:inducible promoter;P:constitutive promoter
3 Nisin高產菌株的研究進展
Nisin作為一種安全環保型天然抗菌素,具有非常廣闊的市場價值和經濟效益。隨著商品市場的發展,Nisin的市場需求日益擴大,而Nisin主要是通過乳酸菌發酵方法生產,且一般天然菌種的性能差、生產能力較低,因此構建穩定高產Nisin菌株以滿足實際需求日益迫切。
3.1 傳統誘變育種 誘變育種指利用某些理化誘變劑處理微生物細胞,使其發生突變,再通過某些特定的方法篩選出具有目標特性的突變菌株。常用誘變劑主要有物理誘變劑,如紫外線、X射線、宇宙射線、微波、高能電子流等、化學誘變劑如烷化劑、羥化劑等;還有生物誘變劑,包括能夠引起DNA突變的病毒。長期以來,人們在利用誘變育種提高Nisin產量方面已經進行了大量研究,并取得了一些成效。早在1973年,Kalra等[21]就嘗試利用紫外線照射的方式對Streptococcuslactis-6菌株進行誘變,結果Nisin的效價較原始菌株提高了2倍;姜麗艷等[22]采用硫酸二乙酯(DES)對L.lactis ATCC11454進行誘變處理,篩選到了一株遺傳特性穩定的Nisin抗性菌株,其效價最高達到2570IU/mL,比原始菌株提高了2.13倍;申斐等[23]采用微波對Nisin產生菌進行誘變處理以提高Nisin產量,獲得一突變菌株,但沒有達到預期誘變效果;還連棟等[24]利用紫外線、LiCl、60Co及8-MOP+NUV等多種理化誘變劑對原始菌株進行多次單因子和復合誘變處理,獲得一Nisin高產突變株,其效價能穩定在2300~2500 IU/mL;隨后,陳洪衛等[25]利用低能氮離子注入聯合紫外線照射的方法進行原始菌株的誘變處理,也獲得一高產突變菌株,其Nisin效價達到2291.75 IU/mL;李海娜等[26]采用紫外線、微波和亞硝酸鈉對出發菌株進行復合誘變處理,并結合Nisin抗性篩選機制選育出一遺傳性狀穩定的高產菌株Nis123,其Nisin產量高達5250 U/mL,比出發菌株提高了4.3倍。由此可以看出,傳統誘變育種方法選擇范圍比較廣泛,在選育Nisin高產菌株方面具有一定的實效性。
3.2 Genome shuffling技術育種 Genome shuffling技術又稱基因組重組技術,是20世紀末提出的一種將傳統誘變與原生質體融合的新興菌種改良技術,其原理是首先通過傳統誘變篩選獲得若干正向突變菌株,然后以這些突變菌株作為遞推式原生質體融合的出發菌株庫,經過多次原生質體融合后,株內基因組間發生隨機重組,最終通過適當的篩選方法獲得具備目標性狀的改良菌株。1996年,Stoyanova等[27]將2個同源的低產Nisin產生菌L.lactis729和L.lactis1605進行原生質體融合,篩選出融合子的Nisin產量比融合前提高了10~14倍;張旭等[28]采用超聲波和DES對原菌株先后進行單因素和復合誘變處理,獲得的突變株S-1、D-1、F-1作為出發菌株,經過2輪原生質體融合后,成功選育出一Nisin高產菌株,其Nisin產量較原始菌株提高了69.8%;Zhang等[29]對原始菌株進行紫外誘變和DES兩輪化學誘變處理后,利用genome shuffling技術對初步獲得Nisin突變菌株再進行研究,最終收獲菌株的Nisin產量大約是原始菌株的2.43倍,同時其耐受性也得到很大的提升。實踐表明,genome shuffling技術在選育高產Nisin菌株方面成效顯著,這為進一步應用該技術選育優良菌種提供了參考。
3.3 基因工程方法育種 近年來,隨著分子生物學理論與技術的日益成熟,以及對Nisin的生物合成途徑和代謝調節認識的深入,在利用基因工程技術對Nisin產生菌進行遺傳改造而獲得高產菌株方面也取得一定進展。目前主要通過對Nisin生物合成的相關基因進行過表達或增加其拷貝數來提高Nisin合成能力。1998年Kim等[30]將Nisin生物合成相關的調控和免疫基因nisRK、nisFEG融合在同一載體pND300上,再導入受體菌中進行過表達,結果獲得的工程菌Nisin產量比原產生菌提高了20%左右,且其生長速度也明顯加快;2005年Cheigh等[31]試圖通過構建表達載體pOri23-nisZ、pOri23-nisRK、pOri23-nisFEG,并轉入Nisin生產菌中以此獲得nisZ、nisRK和nisFEG過表達的工程菌,結果nisRK和nisFEG過表達菌株的Nisin產量均提高了約50%,但菌體的生長速度受到一定影響,而nisZ過表達菌株的預期效果不明顯;2014年Kong等[32]構建了nisA的單獨多拷貝載體和nisin合成基因簇的過表達載體共轉化的工程菌,能使Nisin產量提高3.4倍,但菌體生長明顯受限。后又將nisA片段與Nisin合成基因簇整合到同一表達載體上,同時優化了nisA啟動子和發酵條件,最終得到工程菌的nisin產量達到原始菌株的6倍多。
國內對于Nisin基因工程方面的研究起步較晚,1995年中國科學院微生物研究所率先完成了對乳鏈菌肽的基礎研究,并將選育出的Nisin高產菌株投入生產,實現了2500 L發酵罐的放大實驗及中試產品的應用試驗[33];樊苗苗等[34]通過構建nisA游離型和nisA整合型表達載體以實現nisA的過表達,結果游離型表達載體菌株的NisinA產量提高了31%,而整合型菌株的NisinA產量雖也有一定程度的提高,但其生物量明顯降低;Hu等[35]通過增加Nisin產生菌中nisI基因的表達水平來研究Nisin產量變化,結果Nisin的產量最多提高了32%,而且工程菌對Nisin的抗性水平也顯著提高;汪蕊等[36]通過構建表達載體pMG76e-nisRK、pMG76e-nisI-RK以及pmsp3535H4-nisI-nisR-nisK,合成重組菌,結果前兩組重組菌株的Nisin產量均提高了45%左右,但后一組重組菌株Nisin產量增幅略低,反映了載體啟動子表達效率的相對強弱對Nisin產率的直接影響。后來他們又構建了含表達載體pMG76e-nisZBTCI的工程菌,這使Nisin產量提高了約70%。通過RT-PCR檢測分析了原菌株與重組菌株中Nisin合成基因簇中11個基因的表達情況,結果顯示工程菌的大部分基因都不同程度地上調了,表達上調的基因對Nisin合成效率的提高具有關鍵意義。
4 展望
在全社會都在崇尚綠色安全食品的今天,天然防腐劑乳鏈菌肽日益受到人們的關注。面對多年來的理論研究與實踐應用,Nisin作為一種天然食品添加劑的安全性和高效性已經無可置疑。同時,隨著研究的深入,Nisin的應用目前已擴展到造紙、食品包裝、畜牧業、生殖、醫療等領域,其優質性未來必定還會受到更多行業的親睞。鑒于目前Nisin的工業化產量與實際應用之間的不協調狀況,在選擇合適的育種方法以獲得優質高效的Nisin表達菌株方面,以上技術手段已為相關研究者提供了一些有益的參考,相信隨著生化科技的進步和工業化生產的發展,實現Nisin規模化生產必將指日可待。
[1] McAuliffe O,Ross RP,Hill C.Lantibiotics:structure,biosynthesis and mode of action[J].FEMS Microbiol Rev,2001,25(3):285-308.
[2] Joo NE,Kathryn R,Pachiyappan K.Nisin,an apoptogenic bacteriocin and food preservative,attenuates HNSCC tumorigenesis via CHAC1[J].Cancer Med,2012,1(3):295-305.
[3] Buchman GW,Banerjee S,Hansen JN.Structure,expression and evolution of a gene encoding the precursor of Nisin,a small protein antibiotic[J].J Biol Chem,1988,263(31):16260-16266.
[4] Kuipers OP,Beerthuyzen MM,de Ruyter PG.Autoregulation of nisin biosynthesis in Lactococcus lactis by signal transduction[J].J Biol Chem,1995,270(45):27299-27304.
[5] Sailaja C,Daniel J.Characterization of the promoter regions involved in galactose- and Nisin-mediated induction of the nisA gene in Lactococcus lactis ATCC11454[J].Mol Microbiol,2002,2(2):467-477.
[6] Ra R,Beerthuyzen MM,de Vos WM,Saris PE,et al.Effects of gene disruptions in the Nisin gene cluster of Lactococcus lactis on Nisin production and producer immunity[J].Microbiology,1999,145(Pt 5):1227-1233.
[7] Li B,Yu JP,Brunzelle JS,et al.Structure and mechanism of the lantibiotic cyclase involved in Nisin biosynthesis[J].Science,2006,311(5766):1464-1467.
[8] Okeley NM,Paul M,Stasser JP,et al.SpaC and NisC,the cyclases involved in subtilin and Nisin biosynthesis,are zinc proteins[J].Biochemistry,2003,42(46):13613-13624.
[9] Siegers K,Heinzmann S,Entian KD.Biosynthesis of lantibiotic Nisin.post-translational modification of its prepeptide occurs at a multimeric membrane-associated lanthionine synthetase complex[J].J Biol Chem,1996,271(21):12294-12301.
[10] Fang C,Takala TM,Saris Per EJ.Nisin Biosynthesis in vitro[J].J Mol Microbiol Biotechnol,2007,13(4):248-254.
[11] Van Der Meer JR,Polman J,Beerthuyzen MM,et al.Characterization of the Lactococcus lactis Nisin A operon genes nisP,encoding a subtilisin-like serine protease involved in precursor processing and nisR,encoding a regulatory protein involved in Nisin biosynthesis[J].J Bacteriol,1993,175(9):2578-258.
[12] 葉嗣穎,蔡昌學,鄭華英,等.nisP基因在Nisin生物合成終末成熟過程中的控制作用[J].中國微生態學雜志,1997,9(2):5-7.
[13] Cheigh CI,Pyun YR.Nisin biosynthesis and its properties[J].Biotechnol Lett,2005,27(21):1641-1648.
[14] De Ruyter PG,Kuipers OP,Beerthuyzen MM,et al.Functional analysis of promoters in the Nisin gene cluster of Lactococcus lactis[J].J Bacteriol,1996,178(12):3434-3439.
[15] 汪蕊,杜超,左芳雷,等.nisRK和nisIRK超表達對Nisin合成的影響[J].生物技術,2013,23(6):30-37.
[16] 劉文營,王飛,趙維高,等.乳鏈菌肽的制備及應用研究進展[J].安徽農業科學,2012,29:14478-14480.
[17] Siegers K,Entian KD.Genes involved in immunity to the lantibiotic Nisin produced by Lactococcus lactis 6F3[J].Appl Environ Microbiol,1995,61(3):1082-1089.
[18] Stein T,Heinzmann S,Solovieval I,et al.Function of Lactococcus lactis Nisin immunity genes nisI and nisFEG after coordinated expression in the surrogate host Bacillus subzilis[J].J Biol Chem,2003,278(l):89-94.
[19] 初曉東,林宇恒,還連棟,等.乳鏈菌肽(Nisin)抗性機制的研究進展[J].微生物學報,2010,50(9):1129- 1134.
[20] Froseth BR,McKay LL.Molecular characterization of the nisin resistance region of Lactococcus lactis subsp.lactis biovar diacetylactis DRC3[J].Appl Environ Microbiol,1991,57(3):804-811.
[21] Kalra MS,Kuila RK,Ranganathan B.Activation of Nisin production by UV-irradiation in a Nisin-producing strain of Streptococcus lactis[J].Specialia,1973,15(5):624-625.
[22] 姜麗艷,閆國棟,張宏宇,等,乳鏈菌肽高產菌株的推理選育[J].食品與機械,2009,25(4):38-40.
[23] 申斐,張賀迎,武金霞,微波誘變對乳酸乳球菌Nisin產量的影響[J].食品研究與開發,2006,27(11):26-28.
[24] 還連棟,陶勇,何松,等,乳鏈菌肽高產菌株的選育及其基因定位[J].微生物學報,1995,35(5):364-367.
[25] 陳洪衛,張國只.低能氮離子注入誘變選育乳鏈菌肽產生菌的研究[J].食品科學,2009,30(7):177-180.
[26] 李海娜,朱希強,郭學平,等.復合誘變選育乳鏈菌肽高產菌株[J].中國生化藥物雜志,2011,32(5):378-381.
[27] Stoyanova LG,Egorov NS.Obtaining Bacterial Nisin Producers by Protoplast Fusion of Two Related Strains of Lactococcus lactis subsp.lactis with Weak Ability to Synthesize Nisin[J].Microbiology,1998(67):47-54.
[28] 張旭,張惠文,徐明愷.基因組重排技術選育乳鏈菌肽高產菌株[J].中國生物制品學雜志,2010,23(10):1067-1073.
[29] Zhang YF,Liu SY,Du YH,et al.Genome shuffling of Lactococcus lactis subspecies lactis YF11 for improving Nisin Z production and comparative analysis[J].J Dairy Sci,2014,97(5):2528-2541.
[30] Kim WS,Hall RJ,Dunn NW.Improving Nisin production by increasing Nisin immunity/ resistance genes in the producer organism Lactococcus lactis [J].Appl Microbiol Biotechnol,1998(50):429-433.
[31] Cheigh CI,Park H,Choi HJ,et al.Enhanced Nisin production by increasing genes involved in Nisin Z biosynthesis in lactococcus lactis subsp.lactis A164 [J].J Biotechnol,2005,27(3):155-160.
[32] Kong W,Lu T.Cloning and optimization of a nisin biosynthesis pathway for bacteriocin harvest[J].ACS Synth Biol,2014,3(7),439-445.
[33] 還連棟,陳秀珠,董可寧,等.天然食品防腐劑-乳鏈菌肽(Nisin)[J].中國食品添加劑,1995,(1):8-13.
[34] 樊苗苗,邱一敏,劉晨,等.NisinA前體基因nisA的過量表達對NisinA產量的影響[J].生物工程學報,2012,28(10):1175-1183.
[35] Hu HM,Jiang LK,Lin YH,et al.Enhanced Nisin production by overexpression of Nisin immunity gene nisI in the Nisin-producing strain[J].Acta Microbiol Sin,2010,50(10):1341-1346.
[36] 汪蕊,劉秀麗,左芳雷,等.NisinZ部分操縱子基因超表達對NisinZ合成的影響[J].生物技術,2014,24(4):20-27.
(編校:王儼儼)
Research progress on Nisin biosynthesis and breeding of high-yield strains
NI Zhi-jian1, WANG Shao-hua2, LIU Fei2, ZHU Xi-qiang1,2Δ
(1. College of Pharmacy, Shandong University, Ji’nan 250012, China; 2. Postdoctoral Workstation, Pharmaceutical Academy of Sciences of Shandong Province, Ji’nan 250101, China)
Nisin, produced by several strains in the growth process ofLactococcuslactis, is a natural antimicrobial polypeptide.Now, Nisin has served as an effective and safe food additive extensively used in food industry in many countries and regions because of its excellent antimicrobial activity.However, the current production of Nisin is largely fermented by lactobacillus and its industrialized production still can not meet enormous market needs, therefore establishing reasonably high-yield Nisin strains is of great significance.This review mainly summarizes the development pathway of molecule based on the functional expression of Nisin biosynthetic genes and regulation of gene expression, and also the study status on high Nisin-producing strains which provides practical foundation for further study on expected strains as well as some useful guidance for large-scale industrialized production of Nisin.
Nisin; biosynthesis; key genes; regulation; high-yield strains
倪志堅,男,碩士在讀,研究方向:生化技術藥物及發酵工程,E-mail:mars_pharma@163.com;朱希強,通訊作者,男,博士,研究員,研究方向:生化技術藥物,E-mail:xistrong@sina.com。
Q939.9
A
1005-1678(2015)06-0171-06

