基于假病毒的人乳頭瘤病毒小鼠感染模型的建立及HPV16 VLP疫苗保護性評價
王大寧,張麗,劉亞靜,魏希,夏寧邵,4,李少偉,4Δ
(1.廈門大學 公共衛生學院/分子疫苗學與分子診斷學國家重點實驗室,福建 廈門 361102;2.廈門大學 醫學院,福建 廈門 361102;3.廈門萬泰滄海生物技術有限公司,福建 廈門 361000;4.廈門大學 生命科學學院/國家傳染病診斷試劑與疫苗工程技術研究中心,福建 廈門 361102)
?
基于假病毒的人乳頭瘤病毒小鼠感染模型的建立及HPV16 VLP疫苗保護性評價
王大寧1,張麗2,劉亞靜1,魏希3,夏寧邵1,4,李少偉1,4Δ
(1.廈門大學 公共衛生學院/分子疫苗學與分子診斷學國家重點實驗室,福建 廈門 361102;2.廈門大學 醫學院,福建 廈門 361102;3.廈門萬泰滄海生物技術有限公司,福建 廈門 361000;4.廈門大學 生命科學學院/國家傳染病診斷試劑與疫苗工程技術研究中心,福建 廈門 361102)
目的 建立基于假病毒的人乳頭瘤病毒(human papillomavirus,HPV)小鼠感染模型并應用于HPV16 VLP疫苗的保護性評價。方法 利用293FT細胞制備攜帶Luc報告基因的HPV16假病毒,純化后檢測HPV16假病毒滴度和性質;利用醋酸甲羥孕酮和β-雌二醇處理雌性BAL B/c小鼠,然后用壬苯醇醚-9(N-9)化學損傷BALB/c小鼠陰道,6 h后用HPV16假病毒感染小鼠陰道,48 h后使用活體檢測儀檢測小鼠陰道中Luc報告基因的表達情況;最后,利用該感染模型評價HPV16 VLP疫苗的保護能力。結果 獲得了含有Luc報告基因的HPV16假病毒,建立了HPV假病毒純化方法;Western blot結果顯示HPV16假病毒中含有L1和L2蛋白;建立了HPV假病毒感染小鼠模型,并通過不同劑量的假病毒感染實驗表明,該感染模型所需的最低假病毒劑量是1.7×104TRLU;利用該模型獲知HPV16 VLP疫苗具有較強的抵抗HPV16假病毒感染的能力,當中和抗體滴度為256時即可阻礙HPV假病毒感染。結論 本研究成功地建立了HPV假病毒小鼠感染模型,并運用該模型評價了HPV16 VLP疫苗的保護作用,為HPV中和抗體研究和候選疫苗的免疫保護評價提供了有效工具。
人乳頭瘤病毒;假病毒;小鼠感染模型;中和保護
人乳頭瘤病毒(human papillomavirus,HPV)感染能引起宮頸癌、尖銳濕疣等多種疾病,嚴重威脅人類的健康[1]。人乳頭瘤病毒疫苗是預防HPV感染以及相關疾病的有效手段[2]。目前世界上已有3種HPV疫苗上市,即Merck公司Gardasil(HPV6/11/16/18四價疫苗)和Gardasil 9(HPV6/11/16/18/31/33/45/52/58九價疫苗)以及GSK公司Cervarix(HPV16/18二價疫苗[3]。國內也有企業正在積極進行HPV預防性疫苗的研制,并有多家企業產品進入了臨床試驗階段[4-6]。
免疫原性評價是HPV預防性疫苗臨床研究中的重要內容。目前廣泛采用的假病毒-細胞中和法能夠直接檢測具有中和活性的所有抗體,且不受抗原表達系統來源的影響[7-8]。但該方法使用人腎細胞作為受體細胞,只能在細胞水平上檢測血清是否具有阻礙假病毒感染的能力。無法真實模擬在體內復雜的陰道、子宮頸等微環境中,具有組織特異性的HPV感染及其被中和的情況,對疫苗的臨床評價具有一定的局限性。因此,亟需發展一種能更真實模擬HPV感染的動物體內模型,用于HPV預防性疫苗免疫保護評價、HPV中和抗體研究、HPV疫苗的主動免疫和HPV感染研究。
本研究旨在以假病毒-細胞中和法為基礎制備以luc基因作為報告基因的HPV16假病毒,并對該假病毒進行了性質檢測以及定量;并基于該假病毒建立HPV假病毒感染小鼠陰道模型,以進一步優化假病毒感染小鼠陰道的假病毒用量,另使用該方法評價不同劑量HPV16疫苗的保護能力。
1 材料與方法
1.1 材料
1.1.1 菌株、質粒和細胞: DH5α株大腸桿菌為本實驗保藏;AAV-HPV16 L1、AAV-HPV16 L2和pN31-EGFP質粒由J.T.Schiller教授惠贈[9];表達luciferase質粒(PST-luc)由本實驗室構建;293FT細胞購自美國Invitrogen公司;HPV16 L1抗體PD4和8A9 以及HPV16 L2抗體14H6由本實驗室構建;HPV16 VLP疫苗與鋁佐劑為本實驗室制備[10]。
1.1.2 實驗動物:選取4~6周齡,體質量約20g的BALB/c小鼠(購自上海斯萊克實驗動物有限公司),飼養于廈門大學分子疫苗學與分子診斷學國家重點實驗室SPF級動物房內。本實驗遵循《實驗動物保護條例》,得到本校實驗動物倫理委員會批準,廈門大學實驗動物許可證號:SCXK(閩)2013-0001。
1.1.3 試劑: PEI轉染專用試劑購自美國Invitrogen公司;DMEM培養基購自美國GIBCO公司;優級胎牛血清(Fetal Calf Serum,FBS)購自德國PAA公司;牛血清白蛋白(Bovine Serum Albumin,BSA)購自AppliChem公司;三磷酸腺苷(Adenosine Triphosphate,ATP)、熒光素酶(D-luciferase)、β-雌二醇(β-Estradiol)、壬苯醇醚(Nonoxynol-9,N-9)和羥甲基纖維素(Carboxymethylcellulose,CMC)均購自美國Sigma-Aldrich公司;醫用醋酸甲羥孕注射液(DepoProvera)購自廈門中山醫院。
1.1.4 儀器:AKTA純化設備, AKTA purifier,美國GE公司;透射電鏡,Tecnai G2 Spirit,美國FEI公司;酶標儀,PHOMO,安圖實驗儀器(鄭州)有限公司;Xenogen可見光小動物活體成像系統,Ivis LuminaⅡ,Caliper Life Science。
1.2 方法
1.2.1 HPV16假病毒制備及性質鑒定
① 聚醚酰亞胺(Polyetherimide,PEI)轉染法生產HPV16假病毒:HPV假病毒制備方法參考已有報道[8,11-12]。簡述如下:將293 FT細胞鋪于10 cm細胞培養板中,當細胞密度長至80%后,將10 μg AAV-HPV16 L1、1 μg AAV-HPV16 L2和10 μg pN31-EGFP或PST-Luc質粒充分混勻,與PEI混合(質粒與PEI質量比為1:3)震蕩10s;靜置10~20 min后,將上述混合液均勻的加入預鋪的293FT細胞中,輕輕搖勻,37 ℃培養箱中培養4 h;4 h后更換培養基,轉染72 h后,收集細胞,用相同體積的裂解液在37 ℃條件下裂解16 h,收集上清并轉移至無菌Ep管中,再加入0.19倍(體積比)的5M NaCl,4 ℃保存備用。
② HPV16假病毒純化:收獲假病毒后,使用AKTA純化設備和Core 700層析介質純化HPV16假病毒。純化緩沖液為10 mM PB 6.5+0.5 M NaCl,Core 700層析柱經緩沖液平衡后,將2 mL假病毒泵入層析介質中,分段收集樣品峰進行濃度檢測。
③ 透射電鏡觀察HPV16假病毒顆粒: 取15 μL HPV16假病毒吸附在鍍碳的通網上,吸附5 min,干燥,用2%pH6.4磷鎢酸染色5 min;使用FEI Tecnai G2透射電鏡觀察HPV假病毒形態結構。
④ 雙抗夾心ELISA檢測HPV16假病毒:基于本實驗室建立的HPV VLP雙抗檢測方法,采用HPV16 L1 構象性雙抗夾心系統(PD4:8A9-HRP)測量假病毒的濃度。HPV16 L1抗體PD4包被96孔ELISA板,將HPV16 VLP稀釋至1 μg/mL,加入首孔,雙孔重復,2倍梯度系列稀釋;HPV16假病毒稀釋100倍后加入首孔,2倍梯度系列稀釋,37 ℃溫育45 min,1×PBST清洗5次;加入二抗8A9-HRP(1:2000)37 ℃溫育45 min,1×PBST清洗5次;加入A,B顯色底物(北京萬泰生物股份有限公司)在37 ℃溫育10 min后加入終止液,放置酶標儀中使用450 nm和620 nm雙波長進行檢測。根據HPV16 VLP在線性范圍內的OD值與濃度關系繪制標準曲線,將HPV16假病毒反應的OD值帶入標準曲線計算出假病毒的濃度(用L1蛋白濃度(μg/mL)表示)。
⑤ Western blot分析HPV16假病毒:取100 μL純化后的HPV16假病毒,加入20 μL 6×蛋白上樣緩沖液(100 mM pH6.8 Tris-HCl,200 mM BME,4%SDS,0.2%溴酚藍和20%甘油),80 ℃加熱10 min,10%SDS-PAGE電泳;電泳結束后將蛋白轉移至醋酸纖維素膜上,加入5%脫脂奶封閉1 h,加入HPV16 L1抗體21A5和HPV16 L2抗體14H6[12]室溫反應1 h,加入含0.2%Tween-20的PBS清洗3次;加入二抗(HRP標記的驢抗鼠)反應1 h,清洗3次,曝光顯色。
1.2.2 HPV16假病毒滴度鑒定:收獲假病毒后將其感染293FT細胞進行滴度鑒定,細胞感染在96孔細胞培養板中進行。①含GFP報告基因的假病毒滴度鑒定:采用TCID50法進行檢測,假病毒10倍梯度倍稀,稀釋6個梯度, 每個稀釋倍數8孔重復,熒光Elispot檢測每孔感染情況,計算出假病毒的TCID50;② 含luc報告基因的假病毒滴度鑒定:首孔將假病毒稀釋至50 g/mL,8孔重復,依次2倍倍稀釋,感染細胞48 h后用活體成像儀檢測,計算假病毒稀釋前滴度,滴度單位為TRLU/mL。TRLU(transducing relative light units)是能使細胞產生熒光信號的假病毒最高稀釋濃度的倒數。
1.2.3 假病毒感染小鼠陰道模型的建立及不同假病毒用量對感染的影響
① 假病毒感染小鼠陰道模型的建立:假病毒感染小鼠陰道之前,先用β-雌二醇和醋酸甲羥孕酮(DepoProvera)使小鼠進入動情期。即每只小鼠皮下注射0.1 μg β-雌二醇,24 h后每只小鼠再皮下注射3 mg 醋酸甲羥孕酮。12 h后,用氣體麻醉系統(XGI-8)麻醉小鼠,將50 μL 4%(v:v)N-9灌入小鼠陰道內進行化學損傷。6 h后,取25 μL HPV16假病毒與15 μL 4%CMC的混合物灌入小鼠陰道內進行感染,對照組小鼠只灌入40 μL 4%CMC進行處理;假病毒感染48 h之后,麻醉小鼠,取50 μL 15 mg/mL D-Luciferase灌入小鼠陰道內促使小鼠陰道上皮細胞內的luc發光,3 min后利用Xenogen小動物體內可見光成像系統(IVIS,Caliper Life Science)檢測小鼠體內熒光素酶的表達情況。在HPV16 VLP疫苗保護評價實驗中,疫苗免疫8周后,用β-雌二醇和醋酸甲羥孕酮處理小鼠,然后按照上述流程進行小鼠陰道感染和熒光檢測。
② 為研究HPV假病毒使用劑量對感染結果的影響,及在已知假病毒滴度下最的低感染劑量,設計5個不同的感染劑量,分別是5、10、15、20、25 μL,每個劑量3只小鼠,對照組3只小鼠感染PBS。假病毒感染48 h后,活體成像儀檢測感染結果。
1.2.4 HPV6 VLP疫苗免疫阻礙HPV16假病毒感染小鼠陰道
① HPV16 VLP疫苗免疫小鼠:將16只4~6周齡的雌性BALB/c小鼠隨機分成4組,分別免疫100、33.3、11.1 ng的HPV16 VLP疫苗[10]和鋁佐劑(作為陰性對照),每組4只。免疫程序是分別在0、2、4周進行免疫,共3次。首次接種第8周后眼眶采血檢測各組小鼠血清中HPV16的中和抗體滴度。
② 免疫血清中和滴度檢測:血清中和檢測方法參考已有報道[13],簡述如下,將293FT細胞以1.5×104個/孔的密度鋪于96孔細胞培養板中,37 ℃培養4~6 h。血清用含10%FBS的DMEM稀釋1000倍后加入96孔U型板首孔,再用10%FBS DMEM進行2倍梯度稀釋。取60 μL稀釋后的血清分別與60 μL用10%DMEM稀釋后的HPV16假病毒(攜帶GFP報告基因)混合,室溫孵育1 h后取100 μL加入預鋪有293FT細胞的96孔板中,37 ℃培養72 h后先在熒光顯微鏡下觀察,再用熒光Elisopt檢測各孔細胞的感染率,計算血清的中和滴度。感染率=細胞樣品在陽性區中的細胞數量百分率-未感染的對照細胞樣品在陽性區的數量百分率。感染抑制率=(1-阻斷孔的感染率/未阻斷孔的感染率)×100%。血清中和滴度的定義為:達到高于50%感染抑制率的最大稀釋倍數。經過稀釋后能達到50%以上感染抑制率的單抗或多抗被視為具有中和能力。

2 結果
2.1 攜帶Luc報告基因的HPV16假病毒制備及性質鑒定
2.1.1 攜帶Luc報告基因的HPV16假病毒制備:透射電鏡觀察結果顯示:假病毒被細胞內的雜蛋白包圍,假病毒純度較低,不利于后續實驗,見圖1A。經Core 700層析純化后,HPV16假病毒純度顯著提高,雜蛋白明顯減少,HPV16假病毒的顆粒形態更加清晰,假病毒顆粒規則飽滿,大小均一,直徑約60 nm,見圖1B。
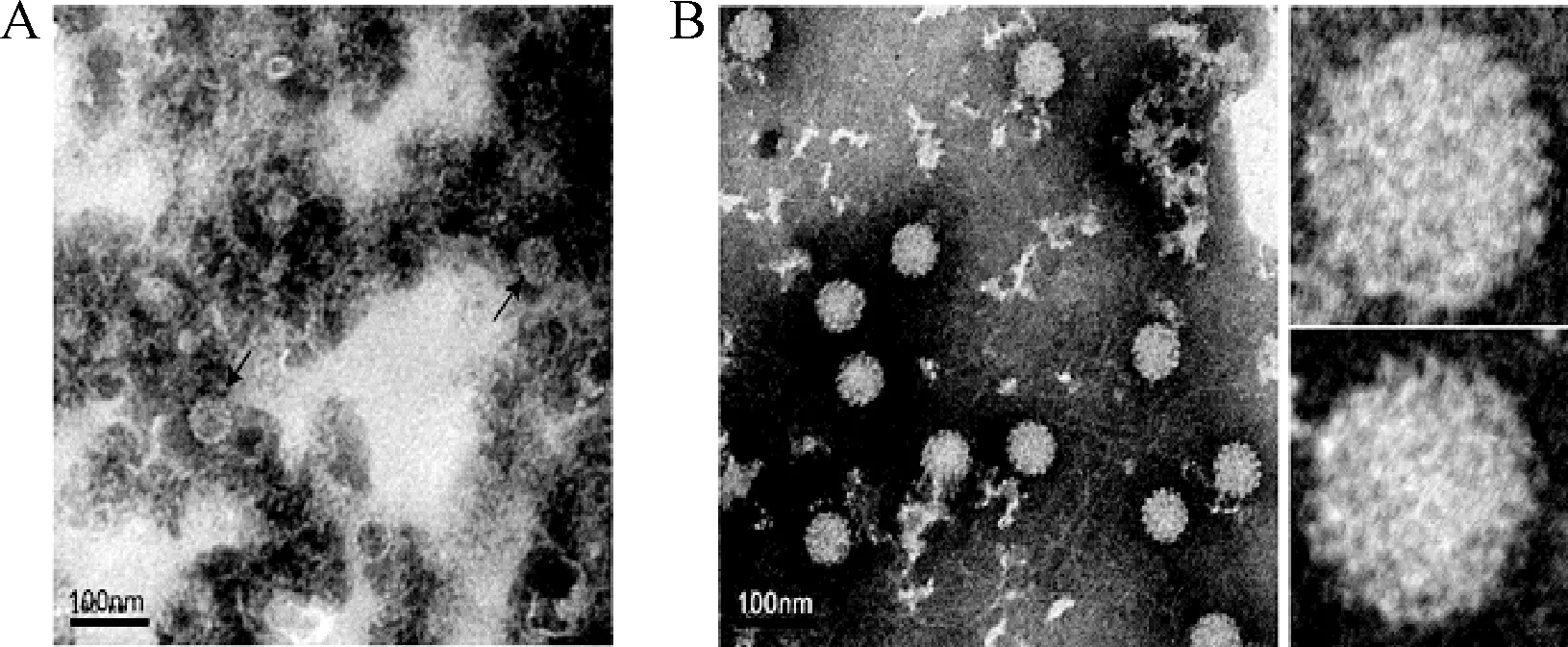
圖1 透射電鏡觀察HPV16假病毒(×25,000) A:純化前;B:Core 700 層析純化后Fig.1 TEM visualization of HPV16 pseudovirus(×25,000)A:Before purified;B:After purified by Core 700 chromatography
2.1.2 HPV16假病毒定量和定性檢測:雙抗夾心系統得到的標準曲線為“Y=0.0093X+0.1869”,見圖2A。計算出假病毒中L1的濃度是20.5 μg/mL。Western blot結果顯示純化后的假病毒中也含有L2蛋白,但L1的含量明顯高于L2的含量,見圖2B。L2蛋白理論分子量約為50 kDa,而電泳結果顯示L2蛋白條帶位于70 kDa左右,這與目前報道的結果一致[14]。
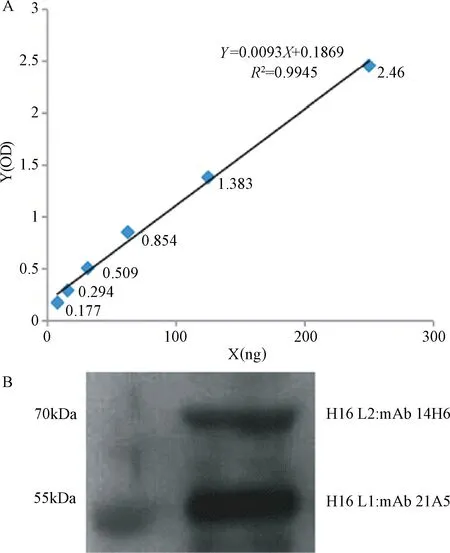
圖2 HPV16假病毒定量和定性檢測 A:雙抗夾心測量L1含量;B:Western blot檢測HPV16假病毒Fig.2 Quantity and quality assay for HPV16 pseudovirusA:double-antibody sandwich ELISA for detecting HPV16 pseudovirus;B:L1 and L2 of HPV16 pseudovirus detected by Western blot
2.2 攜帶Luc報告基因的HPV16假病毒感染滴度測定 根據活體成像儀檢測的熒光信號強度讀值和假病毒稀釋倍數,計算出假病毒稀釋前滴度為8.84×105TRLU/mL。
2.3 假病毒感染小鼠陰道模型的建立及不同假病毒用量對感染的影響
2.3.1 假病毒感染小鼠陰道模型的建立:活體成像儀結果顯示:HPV16假病毒成功感染小鼠陰道組織,見圖3B。對照組沒有熒光信號,見圖3A。為檢測該熒光信號的持久性,每隔3 min檢測一次,連續檢測12次,發現加入熒光素酶底物15~20 min后信號達到較高值,熒光信號可持續近40 min,見圖3C。

圖3 活體成像儀檢測HPV16假病毒感染小鼠陰道(n=3)A:對照組;B:感染HPV16假病毒組;C:連續測量小鼠陰道內熒光信號強度Fig.3 In vivo luminescence imaging in mouse after treatment with HPV16 PsV(n=3)A:Control; B:Treated with HPV16 PsV-Luc; C:Measured in photons/s/cm2/sr
2.3.2 不同假病毒用量對感染的影響:活體成像檢測結果顯示:對照組(假病毒感染劑量為0)和HPV16假病毒感染劑量為5、10、15 μL時均未檢測出病毒感染信號,見圖4A、4B、4C、4D。當HPV16假病毒感染劑量為20、25 μL時,能夠檢測到熒光信號,見圖4E、4G。且25 μL感染劑量組產生的熒光強度要明顯高于20 μL感染劑量組,見圖4H。假病毒滴度為8.84×105TRLU/mL,本實驗表明,1.7×104TRLU的HPV16假病毒即可成功感染小鼠陰道上皮組織,并能被激發出足夠的熒光被活體成像儀檢測到。為充分保證實驗良好的再現性,給與2.2×104TRLU的HPV16假病毒用量。
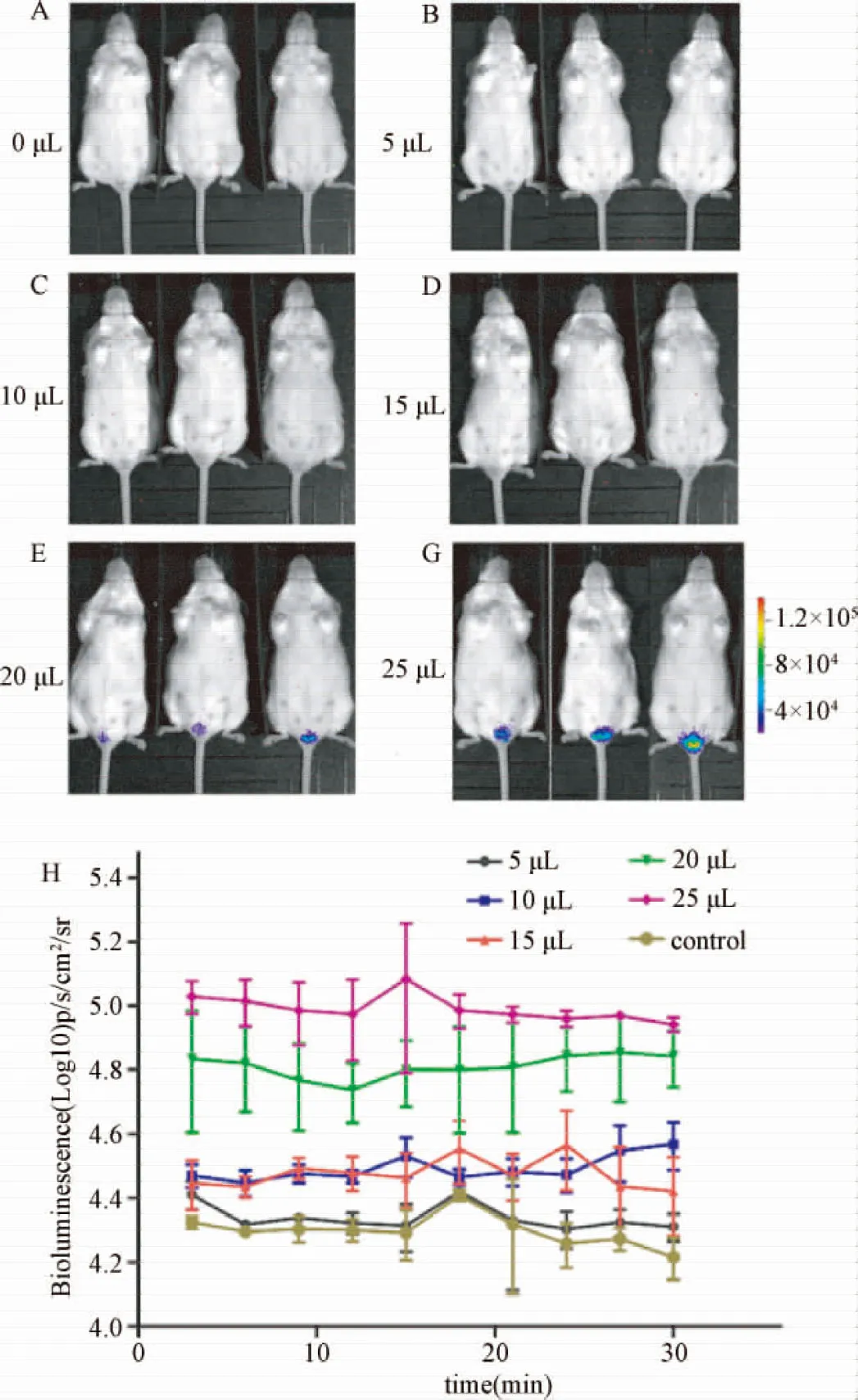
圖4 不同劑量的HPV16假病毒感染小鼠陰道(n=3)A:對照組;B-G:感染不同劑量假病毒組;H:連續測量各組小鼠陰道內熒光Fig.4 In vivo luminescence imaging after treatment with serial dosage of HPV16 PsV(n=3) A:Control; B-G:Treated with different dosages of HPV16 PsV-Luc;H:Measured in photons/s/cm2/sr
2.4 HPV6 VLP 疫苗免疫阻礙HPV16假病毒感染小鼠陰道 HPV16假病毒抗體中和滴度檢測結果顯示:11.1 ng疫苗接種產生的中和抗體滴度約為360,對照組不產生中和抗體,見圖5A。為進一步評價疫苗誘導產生的中和抗體抵御HPV感染的能力,將含有Luc報告基因的HPV16假病毒(劑量為3.0×104TRLU)感染小鼠,48 h后進行檢測,結果顯示:只有對照組的小鼠陰道部位出現明顯的感染信號,3組接種不同劑量的小鼠均沒有感染HPV16假病毒,見圖5B。表明HPV16 VLP疫苗具有較好的預防HPV感染的能力,HPV16疫苗免疫小鼠產生的中和抗體滴度為256時即可完全抵御HPV16假病毒的感染。

圖5 HPV16 VLP疫苗免疫小鼠保護HPV16假病毒感染(n=4)A:不同劑量HPV16 VLP疫苗免疫后誘導中和抗體滴度;B:活體成像儀檢測接種不同濃度疫苗后的小鼠陰道抵御HPV16假病毒感染情況Fig.5 HPV16 VLP vaccine protection against in vivo genital HPV16 PsV infection(n=4) A:HPV16 neutralizing titers measured by HPV16 PsV in vitro neutralization assay;B:Immune sera were titrated using HPV16 PsV neutralization assay
3 討論
本文利用PEI轉染法獲得包裹Luc報告基因的HPV16假病毒,利用透射電鏡和Western Blot等檢測方法表明純化后假病毒的顆粒形態飽滿,含有L2蛋白,與已報道的HPV16假病毒性質一致。雙抗夾心系統檢測HPV16假病毒中L1蛋白含量為20.5 μg/mL,利用活體成像儀檢測HPV16假病毒感染細胞的能力是8.84×105TRLU/mL,達到進行小鼠感染的實驗要求。
HPV可感染受損的粘膜上皮細胞,Elenius等[[15]利用免疫組化和原位雜交技術發現受損的上皮細胞在進行傷口愈合過程中,硫酸乙酰肝素(HSPG)的表達量顯著增加。研究發現受損的小鼠陰道上皮組織可促進HPV16假病毒的感染[16]。通過注射醋酸甲羥孕酮使小鼠進入動情間期,壬苯醇醚-9(N-9)化學損傷其陰道,再利用HPV16假病毒感染小鼠陰道,成功的建立了假病毒感染小鼠陰道模型,且研究表明HPV16假病毒最低感染劑量為1.7×104TRLU。
利用該假病毒感染小鼠陰道模型,證明了HPV16 VLP疫苗具有很好的保護性,疫苗免疫的小鼠產生的中和抗體為256即可完全可以抵御HPV16 假病毒的感染,同時也表明了該假病毒感染模型具有較好的應用價值。
截止2015年已有3種HPV預防性疫苗上市,疫苗上市前要經歷長時間的臨床試驗,目前普遍采用的臨床試驗選擇的臨床終點是癌前子宮頸、陰道、外陰等高度病變[17],而HPV感染引起這些疾病的過程十分緩慢,這導致HPV疫苗臨床周期很長,臨床試驗成本急劇增加,同時給臨床試驗受試者帶來較大傷害。而HPV假病毒感染小鼠陰道模型給評價HPV疫苗的保護性帶來了希望,該模型成本低,周期較短,操作簡單,可以模擬HPV感染陰道上皮組織過程,因此該模型在研究HPV感染和評價疫苗保護性方面具有較大的潛力。
本研究基于HPV16假病毒建立的感染小鼠陰道模型,而能引起宮頸癌、陰道癌和肛門癌等相關疾病的HPV 型別達17種以上[18],因此還需進一步研究其他型別是否適用于這一感染模型。本研究對小鼠陰道的感染情況只是通過活體成像儀檢測感染產生的熒光信號的強度判斷,無法觀察假病毒感染引起的炎癥。在2013年Kines等[19]利用微型陰道鏡檢測小鼠陰道病變情況,該研究在很大程度上彌補了該模型的缺點,可以更加直觀地研究HPV感染及治療。
綜上所述,本研究基于Core 700層析純化的包裹Luc報告基因的HPV16假病毒,成功地建立了HPV假病毒小鼠感染陰道模型,為HPV預防性疫苗免疫保護評價、HPV中和抗體研究、HPV治療性疫苗開發和HPV感染研究提供了有利條件。
[1] Tyler M,Tumban E,Chackerian B.Second-generation prophylactic HPV vaccines:successes and challenges[J].Expert Rev Vaccines,2014,13(2):247-255.
[2] Zhou J,Sun XY,Stenzel DJ,et al.Expression of vaccinia recombinant HPV 16 L1 and L2 ORF proteins in epithelial cells is sufficient for assembly of HPV virion-like particles[J].Virology,1991,185(1):251-257.
[3] Kosalaraksa P,Mehlsen J,Vesikari T,et al.An open-label,randomized study of a 9-valent human papillomavirus vaccine given concomitantly with diphtheria,tetanus,pertussis and poliomyelitis vaccines to healthy adolescents 11-15 years of age[J].Pediatr Infect Dis J,2015,34(6):627-634.
[4] Herrero R,Gonzalez P,Markowitz LE.Present status of human papillomavirus vaccine development and implementation[J].Lancet Oncol,2015,16(5):e206-216.
[5] Schiller JT,Muller M.Next generation prophylactic human papillomavirus vaccines[J].Lancet Oncol,2015,16(5):e217-225.
[6] Hu YM,Huang SJ,Chu K,et al.Safety of an Escherichia coli-expressed bivalent human papillomavirus (types 16 and 18) L1 virus-like particle vaccine:an open-label phase I clinical trial[J].Hum Vaccin Immunother,2014,10(2):469-475.
[7] Sehr P,Rubio I,Seitz H,et al.High-throughput pseudovirion-based neutralization assay for analysis of natural and vaccine-induced antibodies against human papillomaviruses[J].PloS One,2013,8(10):e75677.
[8] Pastrana DV,Buck CB,Pang YY,et al.Reactivity of human sera in a sensitive,high-throughput pseudovirus-based papillomavirus neutralization assay for HPV16 and HPV18[J].Virology,2004,321(2):205-216.
[9] Buck CB,Pastrana DV,Lowy DR,et al.Generation of HPV pseudovirions using transfection and their use in neutralization assays[J].Methods Mol Med,2005,119:445-462.
[10] Wei MX,Li SW,Huang B,et al.Production of human papillomavirus type 16 virus-like particles and its immunogenicity[J].Chinese J Virol,2009,25(4):245-250.
[11] Buck CB,Pastrana DV,Lowy DR,et al.Efficient intracellular assembly of papillomaviral vectors[J].J Virol,2004,78(2):751-757.
[12] Wang DN,Li ZH,Xiao JQ,et al.Identification of Broad-Genotype HPV L2 Neutralization Site for Pan-HPV Vaccine Development by a Cross-Neutralizing Antibody[J].PloS One,2015,10(4):e0123944.
[13] 鄭舟,周國棟,張雅麗,等.人乳頭瘤病毒假病毒制備方法的優化[J].廈門大學學報,2009, 48(2): 269-273.
[14] Wang JW,Roden RB.L2,the minor capsid protein of papillomavirus[J].Virology,2013,445(2):175-186.
[15] Elenius K,Vainio S,Laato M,et al.Induced expression of syndecan in healing wounds[J].J Cell Biol,1991,114(3):585-595.
[16] Roberts JN,Buck CB,Thompson CD,et al.Genital transmission of HPV in a mouse model is potentiated by nonoxynol-9 and inhibited by carrageenan[J].Nature medicine,2007,13(7):857-861.
[17] HPV vaccine works against nine viral types[J].Cancer Discov,2014,4(1):OF2.
[18] Ljubojevic S,Skerlev M,HPV-associated diseases[J].Clin Dermatol,2014,32(2):227-234.
[19] Kines RC,Kobayashi H,Choyke PL,et al.Optical imaging of HPV infection in a murine model[J].Methods Mol Biol,2013(961):141-150.
(編校:吳茜)
Establishment of human papillomavirus pseudovirion infection model in mouse for potency evaluation of HPV16 VLP Vaccine
WANG Da-ning1, ZHANG Li2, LIU Ya-jing1, WEI Min-xi3, XIA Ning-shao1,4, LI Shao-wei1,4Δ
(1.State Key Laboratory of Molecular Vaccinology and Molecular Diagnostics, School of Public Health, Xiamen University, Xiamen 361102, China; 2. School of Medicine, Xiamen University, Xiamen 3611024, China; 3. Xiamen Innovax Biotechnology Co.,Ltd., Xiamen 361000, China; 4.National Institute of Diagnostics and Vaccine Development of Infectious Diseases, School of Life Sciences, Xiamen University, Xiamen 361102, China)
ObjectiveTo establish a mouse model of genital human papillomavirus (HPV) pseudovirion (PsV) transmission and evaluate the protective potency of HPV16 VLP vaccine.MethodsHPV16 PsV with the encapsidated luciferase expressing plasmid Luc were generated from 293FT cells and purified by size-exclusion chromatography. The endpoint titers of HPV16 PsV-Luc were determined on 293FT cells, denoted as TRLU/mL. For in vivo genital challenge, mice were synchronized in a diestrus-like status by a subcutaneous injection with 0.1 μg β-estradiol and then with 3mg DepoProvera after 24 hours. Six hours prior to HPV16 PsV-Luc challenge, deeply anesthetized mice were intravaginally pretreated with 50 μL of 4%nonoxynol-9 (N-9). HPV16 PsV-Luc was thoroughly mixed with 20 μL solution containing 4%carboxymethylcellulose (CMC) and intravaginally instilled using a positive-displacement pipette. Forty-eight hours after PsV-Luc challenge, mice were anesthetized and D luciferin was intravaginally instilled. After 3 minites, bioluminescence was measured with a cryogenically cooled Xenogen IVIS camera system. Then,the murine genital challenge model was used to determine the potency that HPV16 VLP vaccine is efficient at preventing HPV infection.ResultsHPV16 PsV-Luc was generated and purified from 293FT cells. HPV16 PsV-Luc was verified to containe L1 and L2 protein by Western blot. HPV 16 PsV-Luc successfully infected vaginal epithelial cells of mouse and the murine genital challenge model was established. To achieve consistent bioluminescence, the minimal dose of HPV16 PsV-Luc was 1.7×104TRLU. The protective potency of HPV16 VLP vaccine was shown using this murine model. Our data showed that immune serum with over neutralizing antibody titer of 256-fold was sufficient to confer protection against HPV PsV genital infection.ConclusionThe murine genital challenge model of HPV16 was successfully established, and the model is used to evaluate the potency of HPV16 VLP vaccine against in vivo genital HPV16 PsV challenge. Our model will benefit for the investigation of HPV neutralization and the potency evaluation of the HPV vaccine.
human papillomavirus; HPV pseudovirus; pseudovirion infection model; protective potency
國家自然科學基金(81172885)
王大宇,男,博士在讀,研究方向:生物化學與分子生物學,E-mail:haining411@163.com;李少偉,通信作者,男,博士,教授,博士生導師,研究方向:分子病毒學,E-mail:shaowei@xmil.edu.cn。
R373
A
1005-1678(2015)11-0005-06

