IL- 25在小鼠哮喘中通過Nuocyte細胞誘導Th2炎性細胞因子的表達
劉清發,陳方方,劉 粉,李鴻佳,許文娟,孫啟晶,宮 冰,張才擎*
(1.山東大學 醫學院 附屬千佛山醫院 呼吸內科, 山東 濟南 250014; 2.泰山醫學院, 山東 泰安 271000;3.濰坊醫學院, 山東 濰坊 261053)
?
研究論文
IL- 25在小鼠哮喘中通過Nuocyte細胞誘導Th2炎性細胞因子的表達
劉清發1,陳方方1,劉 粉1,李鴻佳1,許文娟2,孫啟晶1,宮 冰3,張才擎1*
(1.山東大學 醫學院 附屬千佛山醫院 呼吸內科, 山東 濟南 250014; 2.泰山醫學院, 山東 泰安 271000;3.濰坊醫學院, 山東 濰坊 261053)
目的研究哮喘氣道炎性因子IL- 25通過nuocyte細胞對Th2炎性細胞因子的影響。方法建立小鼠哮喘模型,分離并培養nuocyte細胞,將nuocyte細胞分為PBS對照組、IL- 25處理組、抗IL- 25組,體外給予IL- 25和抗IL- 25處理。ELISA方法檢測細胞上清液IL- 5和IL- 13的含量;Western blot檢測細胞IL- 5和IL- 13蛋白表達;RT-PCR檢測IL- 5和IL- 13 mRNA表達;流式細胞計數測定nuocyte細胞數量。結果IL- 25處理組nuocyte細胞IL- 5及IL- 13在蛋白和基因水平的表達均比對照組和抗IL- 25組IL- 5及IL- 13表達水平高(P<0.05);IL- 25處理組nuocyte細胞數量高于對照組及抗IL- 25組(P<0.05)。結論IL- 25在小鼠哮喘中可通過nuocyte細胞誘導IL- 5和IL- 13的表達,促進哮喘的發生和發展。
IL- 25;哮喘;nuocyte細胞;IL- 5;IL- 13
哮喘(asthma)使小氣道痙攣和黏液大量分泌,引起氣道狹窄和氣道高反應。發病機制以Th1/Th2細胞比例失衡,激活CD4+TH2細胞釋放IL- 5和IL- 13為主的Th2型免疫應答, 促使B細胞轉換為IgE分泌型細胞[1]。固有免疫細胞也可生成IL- 5和IL- 13等TH2型細胞因子,在Th2型免疫應答的啟動可能發揮著重要作用[2]。IL- 25刺激小鼠引起IL- 5和IL- 13等細胞因子升高,引發強烈的Th2型免疫應答[3]。
Nuocyte細胞是主要的固有免疫細胞之一,在細胞免疫應答中起重要作用,近年來發現 nuocyte細胞在細胞免疫應答中能促使TH2型細胞因子的表達。在哮喘動物實驗中也發現大量的nuocyte細胞的存在,該細胞表面IL- 25受體高表達。IL- 25與nuocyte在哮喘中作用機制如何?本研究旨在探討IL- 25和nuocyte對TH2型炎癥因子表達的影響,為哮喘治療提供新方向。
1 材料與方法
1.1材料
雞清卵蛋白(OVA)(Sigma公司);IL- 5抗體和IL- 13抗體(Abcam HongKong 公司);辣根過氧化物酶標記山羊抗兔IgG(H+L)二抗(北京中杉金橋生物科技公司);蛋白內參GAPDH(Ptglab公司);GAPDH mRNA內參(康偉世紀公司);ICOS-FITC和ST1/ST2-PE流式細胞術用兔抗小鼠抗體(BD公司);SDS-PAGE凝膠配制試劑盒和超敏ECL化學發光試劑盒(中國碧云天生物技術研究所);Trizol總RNA提取試劑、SuperQuickRT cDNA第一鏈合成試劑盒(For Real-time PCR)和UltraSYBR Mixture(with ROX)(康為世紀公司);RPMI-1640培養基和FCS(Gibco公司)。
1.2 方法
1.2.1 動物:SPF級BALB/c雌性小鼠20只,6~8周,體質量15~25 g[山東大學醫學院動物實驗中心,動物合格證號:SCXR(魯)20090001號],隨機雙盲將動物分為對照組及哮喘組,每組為10只。哮喘模型制備參照HONDA[4]方法制作。1.2.2 肺功能檢測:用5%的水合氯醛麻醉小鼠,氣管切開,套管針置入、固定,將小鼠放入密閉的箱子中,連接管道,機械通氣參數:呼吸頻率為90次/min,潮氣量5.6 mL/kg。呼吸壓力為-8 cmH2O(1 cmH2O=0.098 kPa),記錄跨肺壓、流速,潮氣量容積的變化,用計算機計算用力最大流速(PEF)、FEV0.45/FVC時用5倍潮氣量進行機械通氣,-8 cmH2O負壓輔助呼氣,氣道反應性以肺阻力(RL)表示。
1.2.3 標本處理:末次激發后24 h,解剖小鼠胸腔及腹腔,氣管中注入0.3 mL的0.9%氯化鈉溶液行肺泡灌洗3次,收集肺泡灌洗液離心,棄上清液,加入PBS、ICOS-FITC及ST1/ST2-PE抗體,流式細胞術測定nuocyte細胞數;取小鼠脾臟,分離nuocyte細胞,原代細胞培養;肺組織HE染色,顯微鏡下觀察。
1.2.4 流式細胞測定nuocyte的數量:末次激發小鼠24 h之內,收集小鼠肺泡灌洗液,1 500 r/min,離心6 min,棄上清,沉淀中加入PBS重懸細胞,將流式抗體ICOS-FITC和ST1/ST2-PE加入重懸液中,4 ℃靜置30 min,測定小鼠肺泡灌洗液中nuocyte細胞數,ICOS和ST1/ST2雙陽性細胞為nuocyte細胞。
1.2.5 Nuocyte細胞分離、分組及處理:用水合氯醛麻醉后,無菌條件下取出小鼠脾臟,用RPMI-1640反復沖洗脾組織,用研缽將脾臟研磨碎,收集液體,后加入含淋巴分離液的無菌離心管中,2 000 r/min,離心15 min,吸取單個核細胞層接種于培養瓶中,加入RPMI-1640培養基,37 ℃,5% CO2恒溫箱中培養細胞。24 h更換培養液。細胞貼壁增殖到90%以上時,用0.25%胰蛋白酶消化細胞,均勻將細胞接種于培養瓶中,按時換液體。待細胞傳代及增殖狀態較好時,用0.25%胰蛋白酶消化細胞,制成單細胞懸液并計數,取1×106個細胞,用抗ICOS-FITC和ST1/ST2-PE抗體,避光孵育30 min,流式細胞實驗分析nuocyte細胞表面標志,ICOS和ST1/ST2雙陽性細胞為nuocyte細胞。將nuocyte細胞分組并進行培養,以1×105/mL個細胞密度分別種植于6孔板中,每孔2.5 mL,加入含20%FCS的RPMI-1640培養基于37 ℃,5%的CO2培養箱中孵育24 h。實驗分為PBS對照組、IL- 25處理組(50 μg/L)、抗IL- 25組(50 μg/L)。保留細胞培養上清液,用ELISA、Western blot及RT-PCR方法,檢測IL- 5和IL- 13蛋白及基因的表達,每個組設置3個復孔,獨立實驗重復3次。
1.2.6 ELISA方法檢測:Nuocyte細胞在溫箱中孵育24 h,收集培養液于1.5 mL離心管中,2 500 r/min,離心3 min,收集上清液,按ELISA試劑盒說明書操作,依次加入收集的上清液、辣根過氧化物酶標記山羊抗兔二抗、底物及終止液等,測定細胞培養液中IL- 5及IL- 13含量。
1.2.7 Western blot檢測nuocyte 中IL- 5及IL- 13的表達:將細胞37 ℃溫箱孵育24 h,胰蛋白酶消化細胞后,1 500 r/min,離心5 min,棄上清液,細胞沉淀中加50 μL細胞裂解液(RIPA∶PMSF=100∶1),冰上裂解10 min,4 ℃,12 000 r/min,離心15 min。收集上清液,BCA試劑盒測定蛋白濃度。配制12%分離膠和5%濃縮膠進行蛋白電泳、凝膠上蛋白轉到0.22 μm 的PVDF膜上,5%脫脂牛奶封閉,IL- 5及IL- 13抗體、內參(山羊抗兔GAPDH抗體)(1∶3 500)4 ℃孵育過夜,TBST清洗,辣根過氧化物酶標記山羊抗兔二抗(1∶6000)37 ℃孵育1 h,TBST清洗,ECL發光試劑盒顯影。
1.2.8 RT-PCR檢測IL- 5及IL- 13 mRNA在不同nuocyte細胞組中的表達:RPMI-1640培養基培養nuocyte細胞,按照Trizol試劑盒的步驟提取細胞總RNA。紫外分光光度計檢測mRNA純度及濃度。cDNA合成按照反轉錄試劑盒說明書操作;再按照DNA擴增試劑盒的說明分別加入IL- 5及IL- 13引物(表1)和反轉錄的cDNA,反應體系20 μL,ABI7900RT-PCR擴增儀95 ℃ 15 min,95 ℃ 10 s,65 ℃ 32 s進行40個循環擴增,以GAPDH mRNA(小鼠的GAPDH引物)為內參,根據2-△△CT公式計算IL- 5 mRNA及IL- 13 mRNA的表達量。

表1 擴增基因引物序列Table 1 Primer sequences used for amplification gene
1.9 統計學分析
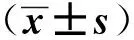
3 結果
2.1 小鼠造模成功的評估
2.1.1 小鼠哮喘癥狀:OVA誘導組小鼠出現全身毛發豎立,易激惹,性情暴躁不安,呼吸頻率急促,腹肌抽動甚至出現點頭呼吸等癥狀。
2.1.2 小鼠肺組織病理學改變:對照組小鼠氣道黏膜正常,肺泡壁結構完整,無黏液分泌,無炎性細胞浸潤;哮喘組小鼠氣道黏膜充血水腫,肺泡壁結構殘缺,有大量黏液分泌,支氣管壁及血管周圍有大量炎性細胞浸潤(圖1)。
2.1.3 肺功能變化及RL的變化:OVA小鼠組反應氣道高反應性的肺阻力RL明顯升高(P<0.05);OVA組肺功能指標PEF、FEV0.4/FVC均高于對照組(P<0.05) (圖2)。
2.2 流式細胞測定nuocyte的數量
與對照組(圖3A)相比較,哮喘組(圖3B)小鼠肺泡灌洗液中nuocyte細胞數量為(2 890±432)明顯增高于對照組(832±65)(P<0.05)。
2.3 ELISA檢測nuocyte細胞中IL- 5及IL- 13的濃度
與對照組比較,IL- 25處理組nuocyte細胞中分泌的IL- 5及IL- 13均明顯升高(P<0.05)(圖4)。
2.4 Western blot檢測nuocyte中IL- 5和IL- 13的表達
與對照組比較,IL- 25處理組nuocyte細胞中分泌的IL- 5和IL- 13均明顯升高(P<0.05)(圖5和表2)。
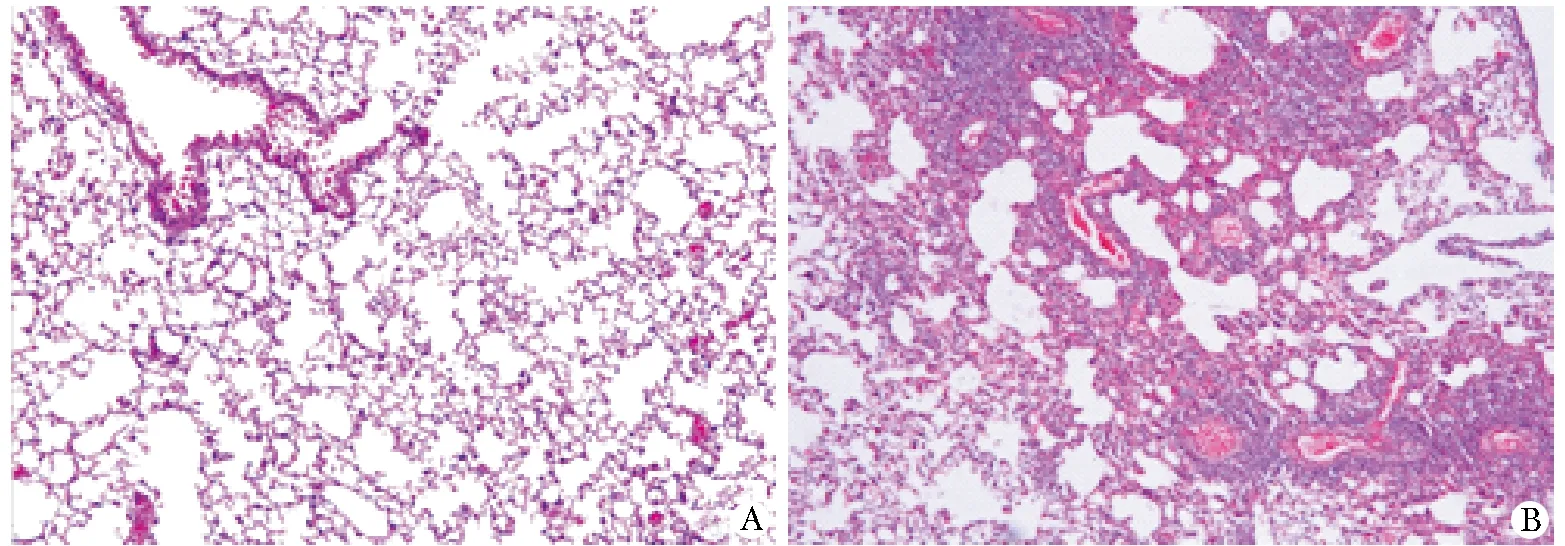
A.control; B.asthma圖1 小鼠肺組織HE染色Fig 1 Hematoxylin-eosin staining of mouse lung tissues (HE×200)
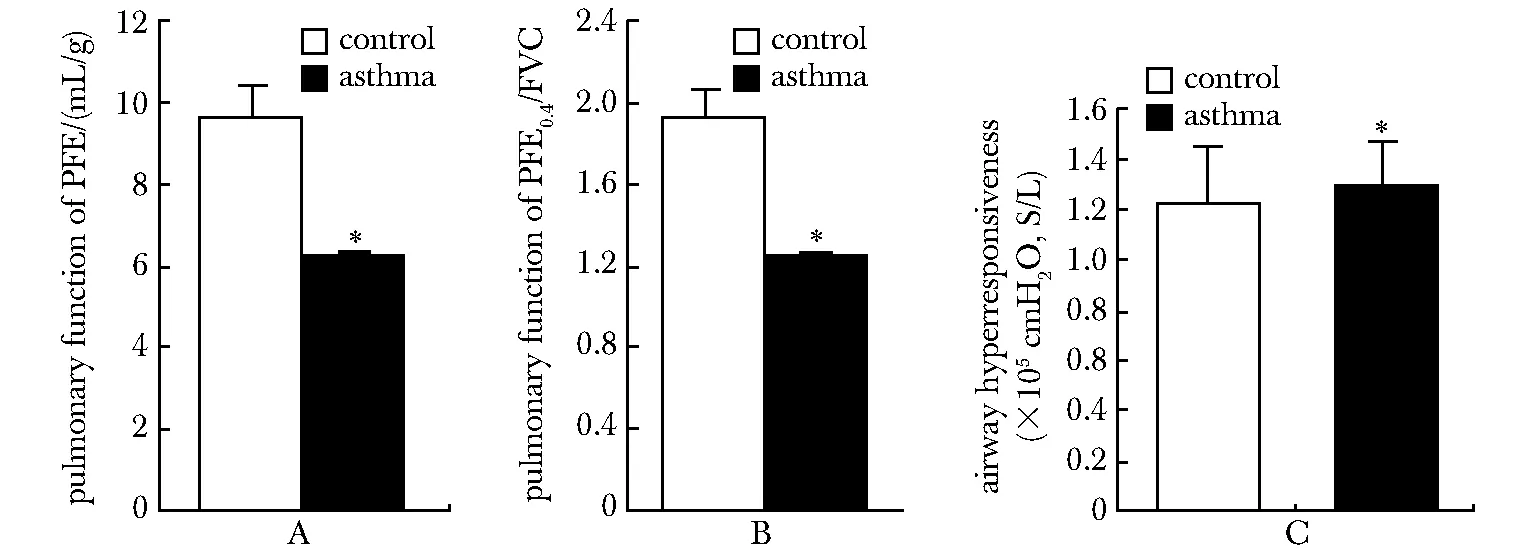
A.pulmonary function of PEF; B.pulmonary function of FEV0.4/FVC; C.airway hyperresponsiveness;#P<0.05 compared with control

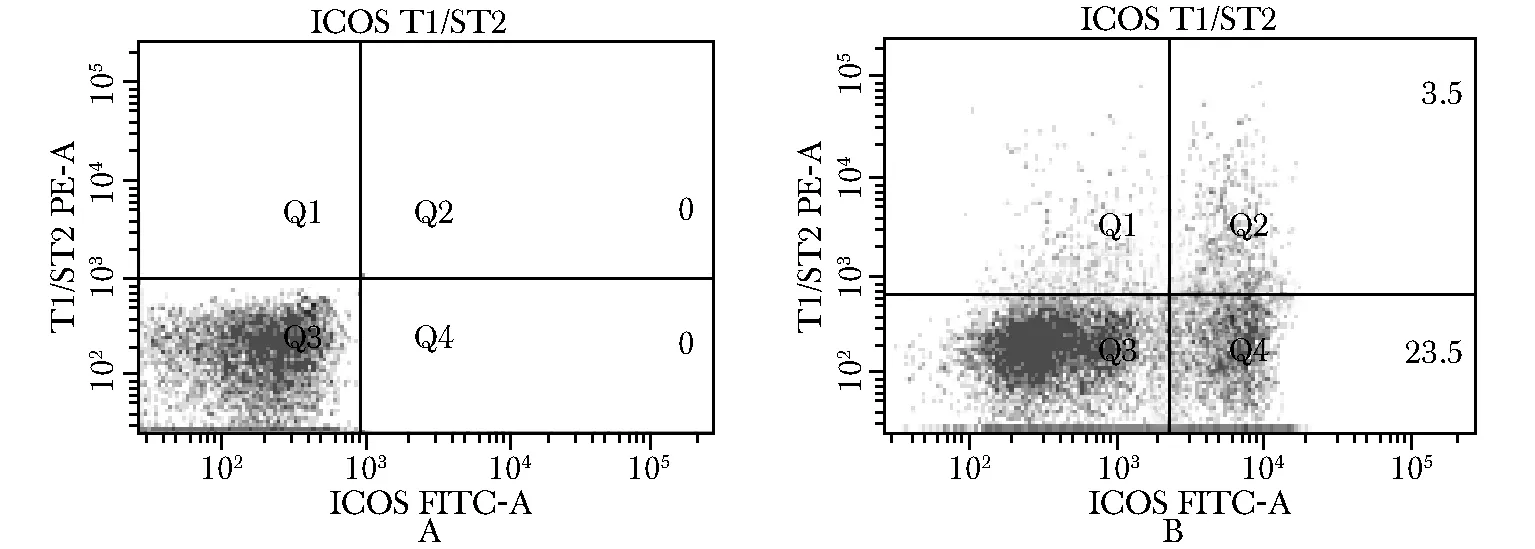
A.the number of nuocyte in control; B.the number of nuocyte in asthma; Q1.ST1/ST2 Single positive; Q2.ST1/ST2 and ICOS double positive; Q3.ST1/ST2 and ICOS double negative; Q4.ICOS single positive
圖3 流式細胞術檢測小鼠肺泡灌洗液中nuocyte的數量
Fig 3 The number of nuocyte detection in mouse alveolar lavage fluid by flow cytometry
2.5 RT-PCR測定結果
與對照組相比,IL- 25處理組nuocyte細胞中IL- 5 mRNA及IL- 13 mRNA表達均明顯升高(P<0.05)(圖6)。
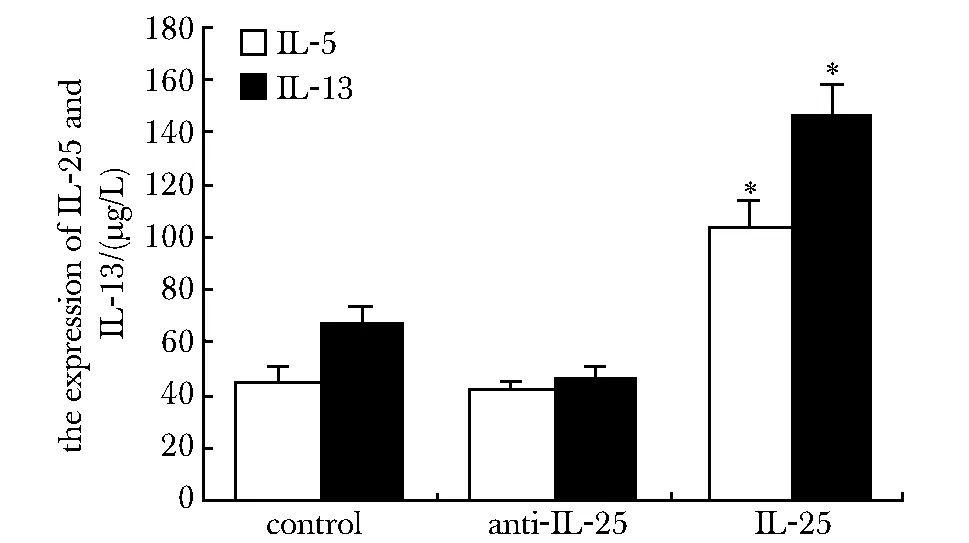
*P<0.05 compared with control group圖4 ELISA檢測nuocyte細胞中IL- 5及IL- 13的濃度Fig 4 The expresstion of IL- 5 and IL- 13 in nuocyte detected by ELISA(±s, n=10)

圖5 Western blot 檢測nuocyte細胞中IL- 5和IL- 13蛋白表達Fig 5 The expresstion of IL- 5 and IL- 13 in nuocytedetected by Western blot (±s, n=3)

groupIL-5IL-13control1.001.00 anti-IL-250.92±0.230.89±0.25IL-251.98±0.47*1.64±0.52*
*P<0.05 compared with control group.

*P<0.05 compared with control group圖6 RT-PCR檢測nuocyte細胞中IL- 5mRNA及IL- 13 mRNA的表達Fig 6 The expresstion of IL- 5mRNA and IL- 13 mRNAin nuocyte detected by RT-PCR(±s, n=3)
3 討論
哮喘反應核心是TH2型炎癥因子介導的免疫應答。研究表明,固有免疫細胞nuocyte及IL- 25均參與TH2型免疫應答[5- 6]。IL- 25可在肺、上皮細胞[5- 7],Th2細胞[5]等表達,與受體IL- 17BR結合介導生物學效應。IL- 25引起哮喘的作用已有報道[8- 10]。nuocyte細胞在免疫反應中的作用雖還不明確,但在啟動某些疾病Th2型免疫應答中發揮重要作用[2]。本實驗通過觀察nuocyte細胞及IL- 25對TH2型細胞因子的影響,結果顯示IL- 25通過nuocyte細胞促進TH2型細胞因子表達。
本文對造模小鼠肺功能及肺組織進行病理學檢測,證實了哮喘造模的成功。流式細胞術檢測肺泡灌洗液中nuocyte細胞數,發現哮喘組中明顯增多。有文獻研究報道,在寄生蟲感染和過敏性肺部炎癥引起的Th2型免疫應答中,也發現了大量nuocyte細胞產生[11],提示其可能參與哮喘的發生過程。然而具體機制還有待闡明。
本研究將IL- 25和抗IL- 25抗體分別加入nuocyte細胞中進行干預,發現IL- 25組大量分泌IL- 5和IL- 13細胞因子,比其他組明顯增高;并且IL- 25組IL- 5和IL- 13mRNA的表達也較另兩組明顯上調,與Min B等研究相符[12],IL- 25是Th2型免疫應答的強效激活劑[13],其作用于nuocyte細胞后產生大量IL- 5和IL- 13細胞因子[6],表明IL- 25能促進TH2炎癥細胞因子表達,可能機制與以下因素有關:1)IL- 25和nuocyte細胞參與了哮喘的發生發展,nuocyte細胞表面有ICOS、T1/ST2及IL- 17BR受體表達[11],而IL- 25可能與其表面IL- 17BR受體結合,促使nuocyte分泌IL- 5及IL- 13等細胞因子,加重哮喘疾病進展。2)IL- 25與nuocyte細胞表面的IL- 17BR結合,使nuocyte細胞增生[13],可能促使本身分泌大量IL- 5及IL- 13等細胞因子,但具體機制尚不明確,有待進一步探討。
總之,IL- 25可能通過nuocyte細胞促進IL- 5和IL- 13等TH2型細胞因子的表達,誘發哮喘的發生發展,在哮喘研究和治療方面提供新的方向和治療靶點,然而IL- 25與nuocyte之間的確切作用機制及在哮喘中發揮的具體作用還有待進一步研究。
[1] Paul WE,Zhu J. How are T(H)2-type immune responses initiated and amplified? [J]. Nat Rev Immuno, 2010,10:225- 235.
[2] Voehringer D, Shinkai K, Locksley RM. Type 2 immunity reflects orchestrated recruitment of cells committed to IL- 4 production.[J] Immunity, 2004,20:267- 277.
[3] Schmitz J, Owyang A, Oldham E, et al.IL- 33,aninterleukin- 1-likecytokinethatsignalsviatheIL- 1receptor-relatedproteinST2andinducesThelpertype2-associatedcytokines[J].Immunity, 2005,23:479- 490.
[4]HondaK,MarquilliesP,CapronM, et al.PeroxisomeProliferatoractivatedreceptorgammaisexpressedinairwaysandinhibitsfeaturesofairwayremodel-inginamouseasthmamodel[J].AllergyClinImmunol, 2004,113:882- 888.
[5]FortMM,CheungJ,YenD, et al.IL- 25inducesIL- 4,IL- 5,andIL- 13andTh2-associatedpathologiesin vivo[J].Immunity, 2001,15:985- 995.
[6]AngkasekwinaiP,ParkH,WangYH, et al.Interleukin25promotestheinitiationofproallergictype2responses[J].JExpMed, 2007, 204:1509- 1517.
[7]CarusoR,SarraM,StolfiC, et al.Interleukin- 25inhibitsinterleukin- 12productionandTh1celldriveninflammationinthegut[J].Gastroenterology, 2009, 136:2270- 2279.
[8]BallantyneSJ,BarlowJL,JolinHE, et al.BlockingIL- 25preventsairwayhyper-responsivenessinallergicasthma[J].AllergyClinImmunol,2007,120:1324- 1331.
[9]CorriganCJ,WangW,MengQ, et al.Allergen-inducedexpressionofIL- 25andIL- 25receptorinatopicasthmaticairwaysandlate-phasecutaneousresponses[J]AllergyClinImmunol, 2011,128:116- 124.
[10]BarlowJL,FlynnRJ,BallantyneSJ,et al.ReciprocalexpressionofIL- 25andIL- 17Aisimportantforallergicairwayshyperreactivity[J].ClinExpAllergy,2011, 41:1447- 1455.
[11]BarlowJL,BellosiA,HardmanCS, et al.InnateIL- 13-producingnuocyteariseduringallergiclunginflammationandcontributetoairwayshyperreactivity[J].AllergyClinImmuno, 2012,129: 191- 198.
[12]MinB,ProutM,Hu-LiJ, et al.BasophilsproduceIL- 4andaccumulateintissuesafterinfectionwithaTh2-inducingparasite[J].ExpMed, 2004,200:507- 517.
[13]JillianL,LesleyF,DanielR,et al.BlockingIL- 25signallingprotectsagainstgutinflammationinatype- 2modelofcolitisbysuppressingnuocyteandNKTderivedIL- 13[J].Gastroenterol, 2012,47:1198- 1211.
IL- 25 induces expression of Th2inflammatory factor by nuocyte in asthma of mouse
LIU Qing-fa1, CHEN Fang-fang1, LIU Fen1, LI Hong-jia1, XU Wen-juan2, SUN Qi-jing1,GONG Bing3, ZHANG Cai-qing1*
(1.Dept. of Respiratory,Qianfoshan Hospital,Shandong University,Jinan 250014; 2.Taishan Medical College,Taian 271000; 3.Weifang Medical College,Weifang 261053,China)
Objective To study the effect of Interleukin- 25 on expressing Th2 inflammatory factor in mouse asthma by nuocyte cells. Methods Nuocytes were collected from mouse spleen of OVA-induced asthma model by density gradient centrifugation. Samples were divided into 3 groups according to different intervention conditions: Interleukin-25 group; control group; anti-Interleukin- 25 group. The expression of Interleukin- 5 and Interleukin- 13 proteins in nuocyte cells supernatant was detected by ELISA. The expression of Interleukin- 5 and Interleukin- 13 in nuocyte cells was detected by Western blot. The expression of Interleukin- 5 and Interleukin- 13 mRNA was detected by RT-PCR. The number of nuocyte cells was detected by flow cytometry. Results The expression of Interleukin- 5 and Interleukin- 13 protein and related gene in Interleukin- 25 group was higer than that in the control group or anti-Interleukin- 25 group (P<0.05). The number of nuocyte cells in Interleukin- 25 group was more than that in control group or anti-interleukin- 25(P<0.05). Conclusions Interleukin- 25 can promote the expressing Interleukin- 5 and Interleukin- 13 in asthma by nuocyte cells and promote the occurrence and development of asthma.
interleukin- 25;asthma;nuocyte;interleukin- 5;interleukin- 13
2015- 02- 01
2015- 07- 01
山東省科技攻關基金(2012ZSF11830)
1001-6325(2015)11-1508-06
R562.25
A
*通信作者(corresponding author):freezcq66@163.com

