Fcγ和Fcε受體在小鼠三叉神經節的表達
劉 帆,李春艷,徐魯斌,陳納澤,周 末,姜浩武,馬 超
(中國醫學科學院 基礎醫學研究所 北京協和醫學院 基礎學院 人體解剖與組織胚胎學系, 北京 100005)
?
研究論文
Fcγ和Fcε受體在小鼠三叉神經節的表達
劉 帆,李春艷,徐魯斌,陳納澤,周 末,姜浩武,馬 超*
(中國醫學科學院 基礎醫學研究所 北京協和醫學院 基礎學院 人體解剖與組織胚胎學系, 北京 100005)
目的檢測正常小鼠三叉神經節(TG)是否表達免疫球蛋白G(IgG)和免疫球蛋白E(IgE)Fc段Fcγ受體和 Fcε受體,及其在過敏小鼠TG中的變化。方法通過腹腔注射OVA和鋁劑,建立小鼠過敏性結膜炎(ACJ)模型。ELISA檢測血清總IgE。用Western blot 和免疫熒光檢測Fcγ受體和Fcε受體的表達。結果小鼠TG表達Fcγ受體和 Fcε受體。其中IgG激活型高親和力受體FcγRI和抑制型低親和力受體FcγRⅡ只表達在小鼠TG神經元上,而IgG激活型低親和力受體FcγRⅢ表達在小鼠TG中的衛星膠質細胞上。IgE激活型高親和力受體FcεRⅠ表達在小鼠TG神經元上,而IgE低親和力受體FcεRⅡ同時表達在小鼠TG神經元和衛星膠質細胞上。與正常小鼠比較,ACJ小鼠的血清總IgE水平升高,TG的FcεRⅠ和FcγRⅡ表達增加(P<0.05)。而ACJ小鼠的FcεRⅡ和FcγRI表達下降(P<0.05)。FcγRⅢ在正常和ACJ小鼠TG中的表達無顯著差別。結論小鼠TG表達的Fcγ和Fcε受體可能參與ACJ及其他過敏性疾病的發生和發展。
Fcγ受體;Fcε受體;免疫球蛋白G;免疫球蛋白E;過敏
Fc受體家族在適應性免疫中扮演了關鍵的角色。這些受體的失調可能導致包括自身免疫性疾病和過敏性疾病在內的多種疾病。Fcγ受體是IgG Fc段的受體,Fcε受體是IgE Fc段的受體,二者主要表達于免疫相關細胞的膜受體。
目前研究發現神經系統參與很多免疫相關疾病的病理生理過程[1- 2]。既往研究在大鼠背根神經節(dorsal root ganglion, DRG)傷害性感覺神經元上發現神經元表達的FcγR[3- 5]和FcεR[6]可以被IgG和IgE免疫復合物激活。本課題組曾發現在正常的大鼠足底注射IgG免疫復合物(IgG-IC)可以誘發疼痛,而足底給予大劑量正常大鼠IgG可以減輕足底注射IgG-IC誘發的疼痛[6]。過敏性結膜炎(allergic conjunctivitis, ACJ)是臨床最常見的過敏性疾病之一,目前治療上主要采用抗組胺藥物,但部分患者療效欠佳。根據本課題組和其他研究者的發現[6],推測支配眼結膜的三叉神經節(trigeminal ganglion, TG)感覺神經元表達Fcγ和ε受體,從而可能參與過敏性結膜炎導致的眼部瘙癢和疼痛癥狀的發生。本研究將檢測在小鼠TG是否表達各型Fcγ和ε受體,及在過敏疾病狀態下小鼠各型TG Fcγ和ε受體的表達變化。
1 材料與方法
1.1 材料
OVA(Sigma-Aldrich公司)。鋁劑(imject alum)(Thermo公司)。RIPA裂解液、蛋白酶抑制劑、BCA蛋白定量試劑盒、ECL發光試劑盒(康為世紀公司)。倉鼠抗FcεRⅠ抗體(LifeSpan Bio公司)。兔抗FcγRⅠ抗體(Sino Bio公司)。大鼠抗FcεRⅡ抗體(Abd公司)。兔抗FcγRⅡ抗體、兔抗FcγRⅢ抗體和HRP標記的羊抗倉鼠二抗(Abcam公司)。小鼠抗β-actin抗體、HRP標記的羊抗兔IgG、羊抗大鼠IgG和羊抗小鼠IgG二抗(中杉金橋公司)。各型熒光二抗(Jackson Immuno Research公司)。
1.2 動物及ACJ動物模型制備
SPF級雄性C57小鼠,體質量20~25 g[中國食品藥品檢定研究院提供,許可證SCXK(京):2009- 0017]。
動物隨機分為對照組和過敏模型組。其中過敏模型組按不同時間點0、7和14 d 3次腹腔注射OVA和鋁劑的混合液,第21天給予1% OVA滴眼進行激發。激發24 h后,采取TG。致敏模型組小鼠眼睛被1% OVA激發,小鼠眼部處于過敏狀態。
1.3 ELISA檢測
按照小鼠IgE ELISA Kit(eBioscience公司)說明書操作檢測對照組和過敏模型組小鼠血清中總IgE濃度。
1.4 Western blot測定
每10 mg TG組織塊中加入99 μL預冷的RIPA裂解液和2 μL蛋白酶抑制劑。超聲破碎,提取上清后,使用BCA法測定蛋白濃度。SDS聚乙烯酰胺凝膠電泳,濕法轉膜、5%脫脂牛奶封閉。抗FcεRⅠ抗體(1∶1000)、抗FcεRⅡ抗體(1∶1 000)、抗FcγRⅠ抗體(1∶1 000)、抗FcγRⅡ抗體(1∶5 000)、抗FcγRⅢ抗體(1∶5 000)和抗β-actin(1∶800)4 ℃孵育過夜;TBST清洗3遍,加二抗,室溫孵育1 h。ECL發光,應用ImageQuant LAS4000 mini成像系統顯影成像。
1.5 免疫熒光
正常對照組和過敏模型組小鼠的TG在10%緩沖甲醛固定液中4 ℃固定過夜。然后浸泡在30%蔗糖溶液中并置于4 ℃脫水。待組織沉底后進行冷凍切片,片厚12 μm。正常羊血清室溫封閉1 h后分別加入抗FcεR Ⅰ抗體(1∶100)、抗FcεRⅡ抗體(1∶100)、抗FcγR Ⅰ抗體(1∶150)、抗FcγRⅡ抗體(1∶200)和抗FcγRⅢ抗體(1∶150)4 ℃孵育過夜;分別加入Alexa Fluor488標記的羊抗倉鼠IgG(1∶400)、Alexa Fluor488標記的羊抗兔IgG(1∶600)和Alexa Fluor488標記的羊抗大鼠IgG(1∶500),室溫孵育1 h;封片后用熒光顯微鏡觀察。
1.6 統計學處理
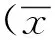
2 結果
2.1 IgG Fc受體在TG表達
小鼠TG表達IgG Fc受體的FcγRⅠ、FcγRⅡ和FcγRⅢ(圖1A)。IgG Fc受體的FcγR Ⅰ表達于小鼠TG的大、中和小神經元上,在衛星膠質細胞(satellite glial cells)上不表達(圖1B)。FcγRⅡ與FcγR Ⅰ相同也只表達在小鼠TG神經元上(圖1C)。而FcγRⅢ只表達在小鼠TG的衛星膠質細胞上,在神經元上不表達(圖1D)。
2.2 IgE Fc受體在TG表達
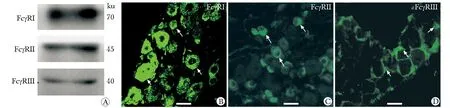
在小鼠TG存在IgE Fc高親和力受體FcεRⅠ和IgE Fc低親和力受體FcεRⅡ的表達(圖2A)。IgE Fc高親和力受體FcεRⅠ只在小鼠TG神經元上表達(圖2B)。而IgE Fc低親和力受體FcεRⅡ在小鼠TG的神經元和衛星膠質細胞皆有表達(圖2C)。
2.3 致敏模型小鼠外周血總IgE的表達
造模第21天,致敏模型組小鼠血清總IgE濃度為(1 980±271)ng/mL,顯著高于正常組小鼠血清總IgE濃度為(243±90)ng/mL(P<0.05)。
2.4 過敏小鼠TG IgG Fc受體和IgE Fc受體的表達變化
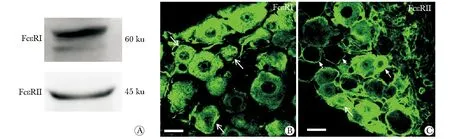
OVA激發24 h后,在過敏小鼠的三叉神經中,IgG Fc受體的FcγR Ⅰ表達降低 (P<0.05),而FcγRⅡ表達升高 (P<0.05),FcγRⅢ表達沒有變化(圖3)。同正常小鼠相比,過敏小鼠三叉神經中IgE Fc受體的FcεRⅠ表達增加(P<0.05),而FcεRⅡ表達降低(P<0.05)(圖4)。
A.Western blot assay of FcγRⅠ, FcγRⅡ and FcγRⅢ in TG; B.expression of FcγRI on TG neurons (arrows); C.immunofluorenscent staining of FcγRⅡ on TG neurons (arrows); D.FcγRⅢ was found on the satellite glial cells (arrows)(scale bar=25 μm)
圖1 IgG Fc受體在三叉神經節表達
Fig 1 Expression of IgG Fc receptor in the TG
A.Western blot assay of FcεRⅠ and FcεRⅡ in TG; B.expression of FcεRⅠ on TG neurons; C.immunoreactivity for FcεRⅡ was found on both neurons (arrows) and satellite glial cells (arrow-heads)(scale bar=25 μm)
圖2 IgE Fc受體在三叉神經節表達
Fig 2 Expression of IgE Fc receptor in the TG
A.Western blot assay for the level of FcγRⅠ, FcγRⅡ and FcγRⅢ in both allergic mice and na?ve mice TG; B.data summary of the FcγRⅠ, FcγRⅡ and FcγRⅢ expression level in both allergic mice and na?ve mice TG;*P<0.05 compared with na?ve FcγRⅠ;#P<0.05 compared with na?ve FcγRⅡ
圖3 過敏小鼠IgG Fc受體在三叉神經節表達
Fig 3 Expression of IgG Fc receptor in the TG
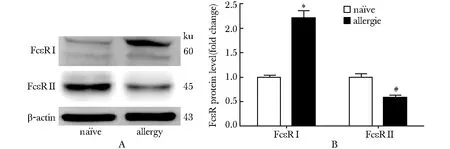
A.Western blot assay for the level of FcεRⅠ and FcεRⅡ in both allergic mice and na?ve mice TG; B.data summary of the FcεRⅠ and FcεRⅡ expression level in both allergic mice and na?ve mice TG;*P<0.05 compared with na?ve FcεRⅠ,#P<0.05 compared with na?ve FcεRⅡ
圖4 過敏小鼠IgE Fc受體在三叉神經節表達
Fig 4 Expression of IgE Fc receptor in the TG
3 討論
本研究觀察到正常小鼠TG中表達各型IgG Fc受體和IgE Fc受體。發現TG中IgG Fc受體FcγRⅠ和FcγRⅡ只表達在神經元上。而IgG Fc受體FcγRⅢ不表達在神經元上,只表達在衛星膠質細胞上。同時發現IgE Fc受體FcεRⅠ只表達在神經元上,而IgE Fc受體FcεRⅡ在神經元和衛星膠質細胞上同時都表達。在過敏小鼠TG中FcγRⅠ表達降低,而FcγRⅡ表達增加,FcγRⅢ表達無變化。FcεRⅠ在過敏小鼠TG上表達增加,而FcεRⅡ在過敏小鼠TG上表達下降。
IgG Fc受體中FcγRⅠ、FcγRⅢ和IgE Fc受體FcεRⅠ為激活型受體,主要表達在單核巨噬細胞、粒細胞和肥大細胞等免疫細胞上,都含有與Fc段結合的α亞基和包含ITAM (immunoreceptor tyrosine-based activation motif) 基序的γ亞基[7]。當免疫復合物與FcγRⅠ、FcγRⅢ或FcεRⅠ結合,給細胞以活化信號[8- 11]。FcγRⅡ為IgG的抑制型受體,其胞內為ITIM基序(immunoreceptor tyrosine-based inhibitor motif),免疫復合物與FcγRⅡ結合,激活ITIM基序,給細胞以抑制信號[8- 10]。FcεRⅡ 為IgE的低親和力受體,主要表達在B細胞、T細胞和粒細胞上。與其他Fc受體都屬于免疫球蛋白超家族不同,FcεRⅡ屬于凝集素家族,主要調節IgE抗體的表達[11]。
最近研究表明,在DRG神經元中表達的FcγRⅠ和頸上神經節中的神經元表達的FcεRⅠ能夠分別直接被IgG或IgE免疫復合物激活[3,12]。本實驗中系統性的檢測了Fcγ受體和 Fcε受體各亞型在TG中各類型細胞上的表達情況,發現在小鼠過敏后一些Fcγ受體和 Fcε受體的亞型在TG中表達發生改變。
綜上所述,本實驗觀察到小鼠FcεRⅠ在ACJ模型TG神經元中表達增高,提示其可能參與過敏性疾病的發生,發揮類似DRG神經元上的FcγRⅠ和IgG免疫復合物結合的作用[3- 5],直接與免疫復合物結合引起神經元興奮性增高,參與過敏性疾病的發生,導致瘙癢或疼痛。關于這些受體在TG神經元上的功能特性及其分子信號傳導機制還有待進一步實驗研究。
[1] Bautista DM, Wilson SR, Hoon MA. Why we scratch an itch: the molecules, cells and circuits of itch [J]. Nat Neurosci, 2014,17:175- 182.
[2] Calvo M, Dawes JM, Bennett DLH. The role of the immune system in the generation of neuropathic pain [J]. Lancet Neuro, 2012, 11:629- 642.
[3] Qu L, Zhang P, Ma C,etal. Neuronal Fc-gamma receptor Ⅰ mediated excitatory effects of IgG immune complex on rat dorsal root ganglion neurons [J]. Brain Behav and Immun, 2011, 25:1399- 1407.
[4] Qu L, Li Y, Ma C,etal. Transient Receptor Potential Canonical 3 (TRPC3) Is Required for IgG Immune Complex-Induced Excitation of the Rat Dorsal Root Ganglion Neurons [J]. J Neurosci, 2012, 32:9554- 9562.
[5] Andoh T, Kuraishi Y. Direct action of immunoglobulin G on primary sensory neurons through Fc gamma receptor I [J]. Faseb J, 2004, 18:182- 184.
[6] Andoh T, Kuraishi Y. Expression of Fc epsilon receptor I on primary sensory neurons in mice [J]. Neuroreport, 2004, 15:2029- 2031.
[7] Nimmerjahn F, Ravetch JV. Fc gamma receptors as regulators of immune responses [J]. Nat Rev Immunol, 2008, 8:34- 47.
[8] Nimmerjahn F, Ravetch JV. Fc gamma receptors: Old friends and new family members [J]. Immunity, 2006, 24:19- 28.
[9] Bezbradica JS, Rosenstein RK, Medzhitov R,etal. A role for the ITAM signaling module in specifying cytokine-receptor functions [J]. Nat Immunol, 2014, 15:333- 342.
[10] Schwab I, Nimmerjahn F. Intravenous immunoglobulin therapy: how does IgG modulate the immune system? [J]. Nat Rev Immunol, 2013, 13:176- 189.
[11] Conner ER, Saini SS. The immunoglobulin E receptor: Expression and regulation [J]. Curr Allergy Asthma Rep, 2005, 5:191- 196.
[12] van der Kleij H, Janssen L,etal. Evidence for neuronal expression of functional Fc (epsilon and gamma) receptors [J]. J Allergy Clin Immunol, 2010, 125:757- 760.
Expression of Fcγ and Fcε receptor on mouse trigeminal ganglions
LIU Fan, LI Chun-yan, XU Lu-bin, CHEN Na-ze, ZHOU Mo, JIANG Hao-wu, MA Chao*
(Dept. of Anatomy, Histology and Embryology, Institute of Basic Medical Sciences, Chinese Academy of Medical Sciences, School of Basic Medicine, Peking Union Medical College, Beijing 100005, China)
Objective To investigate the expression of Fcγ and ε receptor on mouse trigeminal ganglions and the expression change f neuronal Fcγ and ε receptor in allergy. Methods Allergy model of mouse was developed by intraperitoneal injection of OVA and Alum. ELISA was applied to identify the level of the serum total IgE in the na?ve and allergic mouse. Western blotting and immunofluorescence were employed to detect the expression and the change of Fcγ and ε receptor on na?ve and allergic mouse trigeminal ganglions. Results Fcγ and ε receptor were expressed on mouse trigeminal ganglions. The FcγRⅠ, the IgG high-affinity activating receptor, and FcγRⅡ that is the low-affinity inhibitory receptor FcγRⅡ only expressed on trigeminal ganglions neurons, but the IgG low-affinity activating receptor FcγRⅢ were only expressed on the satellite glial cells, not neurons of mouse trigeminal ganglions. The only IgE high-affinity activating receptor FcεRⅠ was just expressed on trigeminal ganglions neurons, but the IgE low-affinity receptor FcεRⅡ expressed on neurons and satellite glial cells of trigeminal ganglions. Compared with na?ve mouse, the level of serum total IgE and the FcεRⅠ and FcγRⅡ protein of trigeminal ganglions were increased in allergic mouse. But the protein levels of trigeminal ganglions FcεRⅡ and FcγRI were decreased in allergic mouse. The expression of FcγRⅢ was not significantly differente between na?ve mouse and allergic mouse trigeminal ganglions. Conclusions Fcγ and ε receptor on mouse trigeminal ganglions may be involved in the allergic desease.
Fcγ receptor; Fcε receptor; IgG; IgE; allergy
2015- 03- 13
2015- 04- 14
國家自然科學基金(81271239);中國醫學科學院基礎醫學研究所院所長基金(2011RC01);北京協和醫學院青年科研基金(201211)
1001-6325(2015)06-0729-05
R322.8
A
*通信作者(corresponding author):machao@ibms.cams.cn

