HPLC測定果汁飲料中兩種鄰苯二甲酸酯
李巧玲,魏冠棉,2,李劭彤,劉峰
(1.河北科技大學生物科學與工程學院,河北石家莊050018;2.江南大學食品學院,江蘇無錫214122)
HPLC測定果汁飲料中兩種鄰苯二甲酸酯
李巧玲1,魏冠棉1,2,李劭彤1,劉峰1
(1.河北科技大學生物科學與工程學院,河北石家莊050018;2.江南大學食品學院,江蘇無錫214122)
建立了高效液相色譜(HPLC)對果汁飲料中鄰苯二甲酸二乙酯(DEP)和鄰苯二甲酸二丁酯(DBP)進行定性和定量分析的方法。果汁飲料樣品經正己烷溶解、超聲波輔助提取、高速離心、過SPE小柱等預處理后,用HPLC進行定性和定量分析。結果表明:DEP和DBP在1.0 mg/L~40 mg/L濃度范圍內線性關系良好,線性相關系數(R2)均大于0.999,3個水平的樣品添加回收率為88.3%~99.9%,相對標準偏差在0.94%~1.95%之間,2種目標化合物的檢出限分別為0.1 mg/L和0.05 mg/L。
高效液相色譜;鄰苯二甲酸二乙酯;鄰苯二甲酸二丁酯;果汁飲料
近兩年,隨著塑化劑在一些飲料、酒中的不斷檢出,塑化劑對食品的污染引起了人們強烈關注。塑化劑是一種能夠提高材料柔軟性的添加劑,它通過削弱聚合物分子之間的范德華力,增加了聚合物分子鏈的移動性,降低了聚合物分子鏈的結晶性,從而增加了聚合物的塑性[1]。塑化劑對食物的污染主要來自2個方面:一方面是由于食品包裝材料(例如聚氯乙烯)中添加了塑化劑,在同食物進行接觸的過程中,包裝材料中的塑化劑遷移進入食物中[2];另一方面是非法添加入食品中,例如,代替起云劑。
塑化劑種類繁多,使用最普遍的是鄰苯二甲酸酯類(phthalie acid esters,PAEs)化合物。鄰苯二甲酸酯類化合物是可用于食品包裝材料的增塑劑。《食品容器、包裝材料用添加劑使用衛生標準》(GB9685-2008)中嚴格規定了該類塑化劑在食品及食品添加劑中的最大殘留量,其中鄰苯二甲酸二(2-乙基己)酯(DEHP)、鄰苯二甲酸異壬酯(DINP)和鄰苯二甲酸二丁酯(DBP)最大殘留量分別為1.5、9.0 mg/kg和0.3 mg/kg[3]。鄰苯二甲酸酯類塑化劑都具有類雌激素作用[4]。研究表明,鄰苯二甲酸酯類進入人體后與相應激素受體結合,影響生物體內激素的正常分泌,使得人體生殖功能產生障礙、發育遲緩,甚至引發惡性腫瘤,產生致畸、致癌和致突變性以及免疫抑制性[5-10]。
《食品中鄰苯二甲酸酯的測定》(GB/T 21911-2008)中規定了氣相色譜-質譜聯用法為食品中鄰苯二甲酸酯類化合物的檢測方法。盡管用高效液相色譜法測定塑化劑成分已有研究[11-17],但是對于飲料中塑化劑含量的測定報導較少。本文擬采用超聲波輔助正己烷提取、SPE小柱凈化、富集,高效液相色譜檢測的方法測定果汁飲料中DEP和DBP的含量,以期了解飲料中受PAEs污染的程度,找到一種檢測成本低,適用于各基層單位的PAEs塑化劑的檢測方法,從而完善飲料中塑化劑的檢測手段。
1 材料與方法
1.1 材料、試劑與儀器
塑料瓶裝安梨汁飲料600 mL,購買于超市。
實驗用水為超純水;甲醇(色譜純),正己烷、丙酮、無水硫酸鈉:均為分析純,天津康科德科技有限公司;鄰苯二甲酸二乙酯和鄰苯二甲酸二丁酯標品:河北省食品質量監督檢驗研究院提供;0.45 μm有機相微孔濾膜:天津市沃爾孚科技發展有限公司;高純氮氣:純度大于99.999%。
無水硫酸鈉需在450℃下灼燒4 h~6 h除去含有的結晶水;正己烷需要重蒸處理。
1.2 儀器與設備
LC-20A型高效液相色譜儀(配有SPD-20A紫外檢測器、7725i手動進樣器、C70-1AS柱溫箱、LC-solution色譜工作站):日本Shimadzu公司;KUDOSSK5200LHC超聲處理器:上海科導超聲儀器有限公司;XW-80A渦旋混合器:蘇州江東精密儀器有限公司;超純水制備裝置:上海康雷分析儀器有限公司;高速離心機(LG16-A):北京雷勃爾有限公司;Welch C18SPE固相萃取小柱(20 mg/6 mL,5PK):Welch Material,Inc.公司;氮氣吹干儀:上海濟成分析儀器有限公司。
1.3 方法
1.3.1 溶液的配制
混合標準溶液:稱取DEP和DBP各1.000 0 g,放入同一100 mL容量瓶中,用甲醇溶解并稀釋至刻度,搖勻,配成濃度為10 g/L的混合標準溶液。用移液管移取5 mL的10 g/L混合標準溶液于100 mL容量瓶中,用甲醇定容至刻度,混勻,配成濃度為0.5 g/L的混合標準溶液,于4℃冰箱中冷藏備用。
1.3.2 標準曲線的繪制
用移液管分別移取0.1、0.5、1.0、2.0、4.0 mL的0.5 g/L混合標準溶液放于不同的50 mL容量瓶中,用甲醇定容至刻度,混勻,配成濃度為1、5、10、20、40 mg/L的混合標準溶液。
將配好的5種濃度的混合標準儲備液各取20 μL按下述色譜條件進樣分析。以標準樣品的質量濃度為橫坐標、相應的峰面積為縱坐標,得到DEP和DBP的標準曲線及相關系數。
1.3.3 樣品的前處理
取5.0 g樣品于干燥的玻璃離心管(避免用塑料的實驗儀器)中,加入正己烷5.0 mL,旋渦振蕩混合2 min,超聲處理10 min后,以7 000 r/min的轉速離心5 min,取上清液移取至玻璃試管中。離心管中的殘存物再經上述過程提取1次,然后合并上清液,用氮氣將其吹至5 mL,等待凈化。
向Welch C18 SPE柱中依次加入5 mL丙酮、5 mL正己烷淋洗SPE柱后,再向柱子中加入1.0 g無水硫酸鈉,用洗耳球輕輕敲SPE柱,使無水硫酸鈉鋪平,加入待凈化液,流速控制在1 mL/min,依次加入5 mL丙酮、5 mL丙酮-正己烷(1∶25,體積比)洗脫液進行洗脫,收集洗脫液,然后用氮氣吹干,再用1.5 mL正己烷溶解,過0.45 μm有機濾膜過濾后,供HPLC分析。
1.3.4 色譜條件
色譜柱為Eclipse XDB-C18柱(150 mm×4.6 mm,5 μm);柱溫25℃;流速1.0 mL/min;檢測波長227 nm;進樣量20 μL;流動相為甲醇-水體系(85∶15,體積比)。
1.3.5 樣品的測定
將前處理好的樣品在1.3.4的色譜條件下平行測定5次,根據標準品的色譜圖,對試樣中的DEP和DBP的含量進行定性和定量分析。
2 結果與分析
2.1 提取劑選擇
實驗分別考察了用甲醇、石油醚、正己烷等溶劑作為提取劑,提取樣品中的塑化劑成分。從HPLC檢測的結果來看,甲醇作為提取劑時,飲料樣品中沒有檢測出DEP和DBP,見圖1。
而對于相同樣品用正己烷或石油醚作為提取劑后,高效液相色譜的測定結果表明,飲料中不但存在DEP和DBP,而且正己烷提取的樣品在高效液相色譜圖上雜質峰少,效果較為理想,見圖2。因此,選用正己烷作為提取劑。
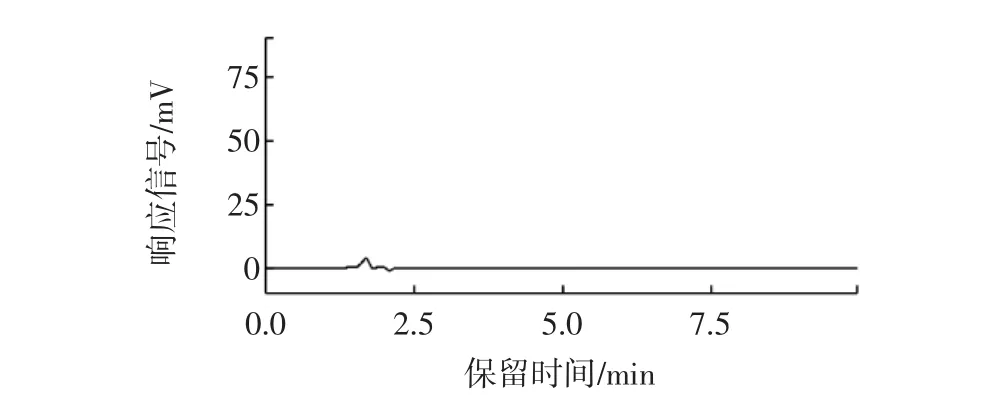
圖1 甲醇做提取劑的高效液相色譜圖Fig.1 HPLC chromatogram of methanol extract
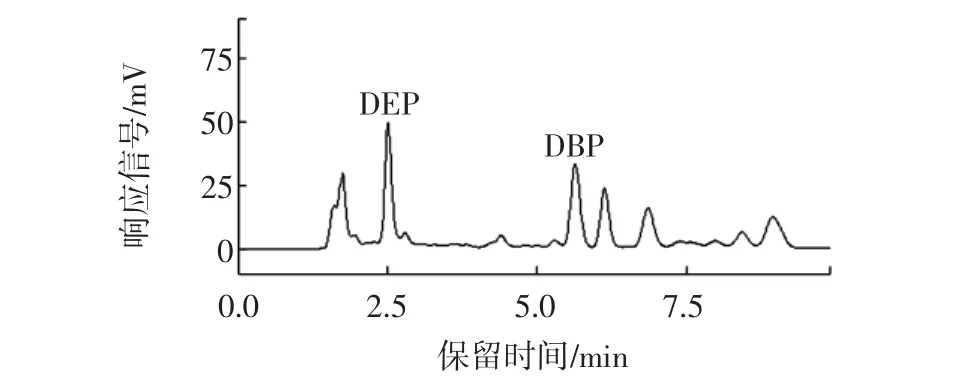
圖2 正己烷做提取劑的高效液相色譜圖Fig.2 HPLC chromatogram of n-hexane extract
2.2 色譜條件的優化
由于PAEs是一類極性較弱的化合物,其結構中含有苯環,所以在選擇色譜柱時應當選擇非極性或弱極性的固定相,結合本實驗室現有的條件,故以Eclipse XDB-C18為本研究分析所用色譜柱。
鄰苯二甲酸酯類物質在227、245 nm和280 nm處有均有特征吸收峰,由于DEP和DBP在227 nm處的吸收強度優于245 nm和280 nm處,因此選擇227 nm作為本研究的檢測波長,這樣得到的檢出限較低。
以甲醇—水體系作為流動相,流動相的配比能顯著地影響分離效果。當甲醇—水流動相體積比為90∶10時,盡管可以在4分鐘內完成DEP和DBP的分離,但DEP有拖尾現象。之后對V甲醇∶V水分別為75∶15、80∶20、85∶15的流動相亦進行了詳細的探討,發現V甲醇∶V水=85∶15時,DEP和DBP兩個峰的分離效果最好,如圖3所示,故選擇流動相甲醇—水體系配比為85∶15。
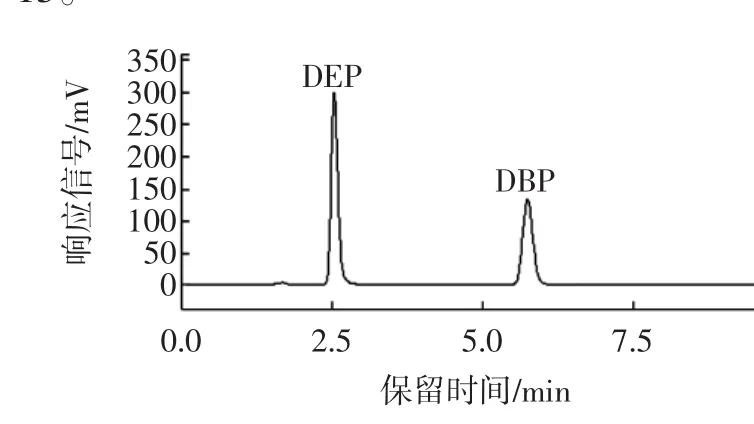
圖340 mg/mL DBP和DEP混合標準溶液的高效液相色譜圖Fig.3 HPLC chromatogram of 40 mg/mL DBP and DEP standard solution
2.3 混合標準品的標準曲線和檢出限
按1.3.4的色譜條件,分別取20 μL的1、5、10、 20、40 mg/L的混合標準溶液進行測定。分別以DEP和DBP的質量濃度為橫坐標,峰面積為縱坐標進行線性回歸,得到的回歸方程及相關系數見表1。

表1 DBP和DEP的回歸方程、相關系數和檢出限Table 1Regression equations,correlation coefficients and detection limits of DEP and DBP
DEP和DBP在1 mg/L~40 mg/L范圍內峰面積與濃度呈現良好的線性關系,相關系數R2均大于0.999。根據3倍噪音的峰面積響應值和方法回收率,得到DEP和DBP的最低檢出限[19]。測定表明,DEP的檢出限為0.1 mg/L,DBP的檢出限為0.05 mg/L,此數值低于國標《食品中鄰苯二甲酸酯的測定》中各鄰苯二甲酸酯化合物的檢出限(1.5 mg/kg),可以滿足對飲料中DBP和DEP的檢測分析。
2.4 方法回收率及精密度的測定
本試驗分別取5.0 g的飲料樣品3份,DEP和DBP的添加水平分別是5、10、20 mg/L,按照前述樣品前處理方法及檢測條件分別測定,同時做空白樣品2份,每份樣品檢測6次,確定加標回收率。測得的回收率及相對標準偏差如表2所示。
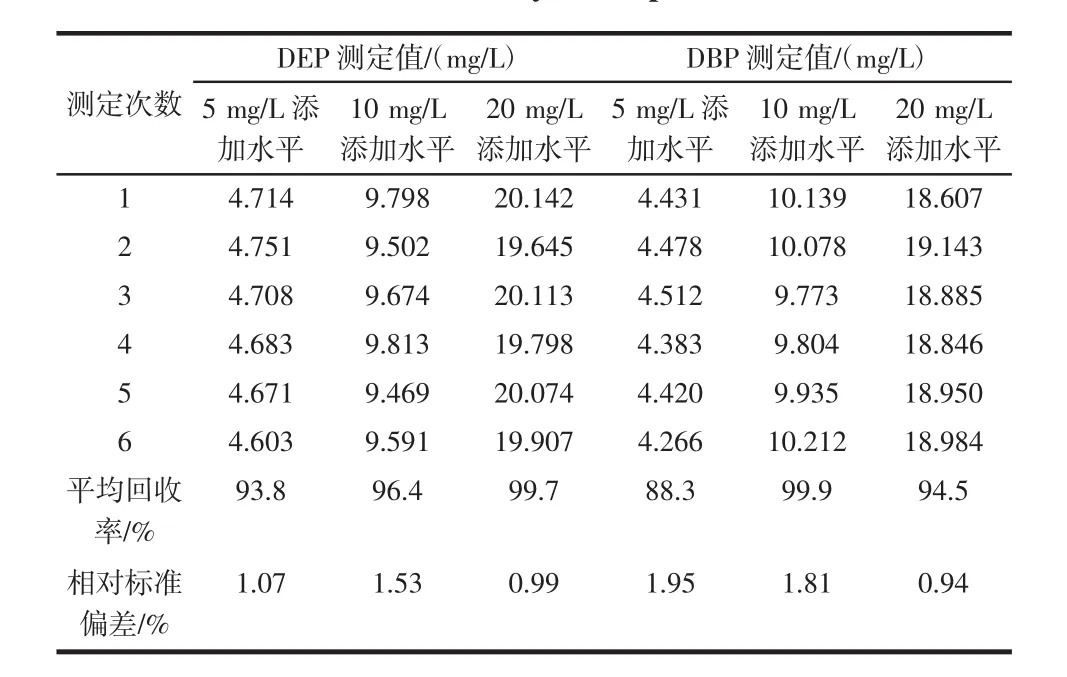
表2 樣品的加標回收率(n=6)Table 2Recovery of sample(n=6)
結果表明,飲料樣品在3個添加水平下,DEP和DBP的回收率在88.3%~99.9%之間,相對標準偏差在0.94%~1.95%之間,說明該方法準確度和精密度良好,能夠滿足樣品測試的要求。
2.5 飲料中DEP和DBP的含量測定
飲料中DEP和DBP的含量測定的高效液相色譜圖見圖4。
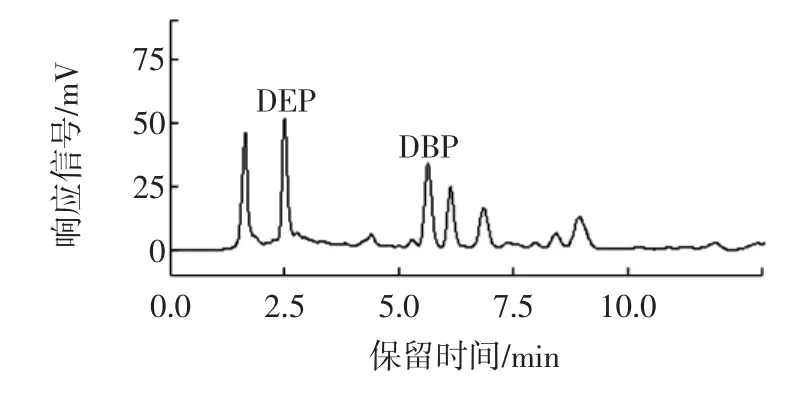
圖4 飲料樣品的高效液相色譜圖Fig.4 HPLC chromatogram of beverage sample
由圖4可知,DEP的保留時間在2.6 min左右,DBP的保留時間在5.7 min左右。圖4同圖3相對照可知,飲料樣品中含有DEP和DBP。根據表1的相關方程,通過外標法計算得出飲料樣品中DEP和DBP的含量分別為2.713 mg/kg和4.628 mg/kg。這表明飲料在生產加工或儲運過程中可能被PAEs類增塑劑污染。
2011年6月國家衛生部辦公廳發布了《衛生部辦公廳關于通報食品及食品添加劑中鄰苯二甲酸酯類物質最大殘留量的函》(衛辦監督函[2011]551號),規定食品、食品添加劑中DBP最大殘留量為0.3 mg/kg,DEP的限量在我國并沒有明確規定。由此可以看出本實驗所用樣品中DBP的含量已經超出了國家規定限量值。分析原因可能為:一方面是飲料在生產加工過程中被PAEs類增塑劑污染;另一方面是包裝容器中的PAE s向飲料中的遷移引起的。
3 結論
該研究表明,飲料樣品經超聲波輔助正己烷提取、SPE小柱凈化、富集等預處理后,可以用高效液相色譜法測定樣品中的鄰苯二甲酸酯類塑化劑。該方法的回收率高、重現性好、檢出限較低,操作簡單,可推廣應用于一般單位檢測飲料中鄰苯二甲酸酯類物質。
從對飲料樣品的檢測結果來看,飲料中塑化劑的含量超過了國家標準要求的限量。造成塑化劑超標的原因有待于進一步探索。由于塑化劑從包裝材料遷移進入食品中與食品的儲存時間、儲存溫度、包裝材料的成分等因素關系密切,建議可從上述幾個方面對包裝材料中塑化劑的遷移情況進行深入探討,為制定塑料包裝飲料的儲存條件提供基礎數據。
[1]劉超,李來生,許麗麗,等.HPLC測定一次性塑料用品中鄰苯二甲酸酯類增塑劑[J].化學研究與應用,2007,19(7):834-837
[2]王東輝,李懿睿,田玉平,等.食品包裝用塑料中八種鄰苯二甲酸酯的檢測方法[J].氨基酸與生物資源,2010,34(3):83-86
[3]中華人民共和國衛生部,中國國家標準化管理委員會.GB9685-2008.食品容器、包裝材料用添加劑使用衛生標準.北京:中國標準出版社,2008
[4]劉風云.塑化劑的應用及危害[J].廣東化學,2011,38(11):77-78
[5]陳洪濤,王力清,黃翠莉,等.鄰苯二甲酸酯毒理學研究進展[J].食品與機械,2012,28(5):251-254
[6]Swan S H,Main K M,Liu F,et al.Decrease in anogenital distance among male infants with prenatal phthalate exposure[J].Environ Health Persp,2005,113:1056-1061
[7]劉曉毅,蔣可心,石維妮.國內外食品接觸材料中鄰苯二甲酸酯類塑化劑遷移量對比分析[J].食品工業科技,2011,32(10):397-399,446
[8]Larsen S T,Hansen J S,Hansen E K,et al.Airway inflammation and adjuvant effect after repeated airborne exposures to di-(2-ethylhexyl)phthalate and ovalbumin in BALB/c mice[J].Toxicology, 2007,235:119-129
[9]陳文婕,戴紅,陳敏,等.鄰苯二甲酸二乙基己酯(DEHP)對小白鼠肝臟毒性及脂質過氧化損傷[J].生態毒理學報,2012,7(1):93-98
[10]Matthias Wittassek,Angerer,Marike Kolossa-Gehring,et al.Fetal exposure to phthalates[J].Int J Hyg Environ Health,2009,212:492-498
[11]王麗霞,王明林.高效液相色譜法測定塑料袋裝食品中的鄰苯二甲酸酯[J].分析實驗室,2007,26(9):13-16
[12]王美麗,陳海婷,張會娜,等.高效液相色譜法測定肉制食品中五種鄰苯二甲酸酯[J].分析實驗室,2009,28(6):49-52
[13]王少杰,孟雨吟,李秋順,等.高效液相色譜法測定蔬菜中的鄰苯二甲酸二丁酯殘留[J].山東農業科學,2012,44(1):112-114
[14]佟曉波,李瑩,矯筱曼,等.HPLC法測定化妝品中十六種鄰苯二甲酸酯類化合物[J].香精香料化妝品,2012,3(6):33-38
[15]王美麗,陳海婷,張會娜,等.高效液相色譜測定肉制食品中的五種鄰苯二甲酸酯[J].分析實驗室,2009,28(6):49-50
[16]蔡全英,莫測輝,李云輝,等.廣州、深圳地區蔬菜生產基地土壤中鄰苯二甲酸酯(PAEs)研究[J].生態學報,2005,25(2):283
[17]張磊,吳青,梁建華,等.高效液相色譜法同時測定食品塑料包裝材料中8種鄰苯二甲酸酯的含量[J].食品科學,2012,33(20): 184-188
[18]陳再潔,楊曉燕,李小俠,等.HPLC同時測定歐盟限用6種塑化劑的含量[J].廣州化工,2010,38(1):151-153
[19]朱明華.儀器分析[M].第三版.北京:高等教育出版社,2007:44
Determination of Two Phthalic Acid Esters in Fruit Beverage by High Performance Liquid Chromatography
LI Qiao-ling1,WEI Guan-mian1,2,LI Shao-tong1,LIU Feng1
(1.College of Bioscience and Bioengineering,Hebei University of Science and Technology,Shijiazhuang 050018,Hebei,China;2.School of Food Science and Technology,Jiangnan University,Wuxi 214122,Jiangsu,China)
A method based on high performance liquid chromatography(HPLC)was developed for the determination of diethyl phthalate(DEP)and dibutyl phthalate(DBP)in fruit beverage.The sample was dissolved by n-hexane,extracted by ultrasonic wave,centrifuged by the high-speed centrifuge,next was purified with Welch C18 SPE column,then identified and quantified by HPLC.The results showed that linearity of response over 2 phthalic acid esters was good from 1.0 to 40.0 mg/L with correlation coefficients higher than 0.999.The average recoveries ranged from 88.3%to 99.9%for two compounds at three different spiked levels. The relative standard deviations were in the range of 0.94%-1.95%.The detection limits of DEP and DBP were 0.1 mg/L and 0.05 mg/L,respectively.
high performance liquid chromatography;diethyl phthalate;dibutyl phthalate;fruit beverage
2013-12-23
10.3969/j.issn.1005-6521.2015.02.027
國家科技支撐計劃(2012BAD29B04-1-1);河北省科技支撐項目(12220402D)
李巧玲(1973—),女(漢),教授,博士后,研究方向:食品安全與檢測。

