肝細胞生長因子促進HeLa細胞上皮間質轉化
王志敏,包 珊
(1.南華大學, 湖南 衡陽 421001; 2.海南省人民醫院 婦產科, 海南 海口 570100)
?
研究論文
肝細胞生長因子促進HeLa細胞上皮間質轉化
王志敏1,2,包 珊2*
(1.南華大學, 湖南 衡陽 421001; 2.海南省人民醫院 婦產科, 海南 海口 570100)
目的探討肝細胞生長因子對宮頸癌HeLa細胞上皮間質轉化的影響。方法以不同濃度的HGF(0、5、10、20和40 ng/mL)處理細胞24 h或20 ng/mL 肝細胞生長因子(HGF)處理細胞不同時間(0、6、12、24和48 h),MTT檢測細胞活力;用HGF(20 ng/mL)處理細胞24 h,倒置顯微鏡觀察HeLa細胞形態,劃痕實驗檢測細胞的遷移及Transwell實驗檢測細胞的侵襲能力。Western blot檢測上皮細胞的標志蛋白E-Cadherin及轉錄因子snail和間質細胞的表面標志蛋白vimentin的表達, HGF/c-Met信號通路分子的表達情況。結果HGF促進HeLa細胞增殖,其中以20 ng/mL或20 ng/mL處理24 h生存率達到最高峰;此外,HGF可以促進HeLa細胞遷移、侵襲及上皮間質轉化,并促進c-Met磷酸化,并且激活p-ERK、p-AKT以及促進snail 的蛋白表達(P<0.05或P<0.01)。結論HGF可以促進HeLa細胞上皮間質轉化,其機制可能是通過HGF/c-Met/MAPK或HGF/c-Met/AKT通路上調snail表達,進而調控E-cadherin或vimentin表達有關。
上皮間質轉化;肝細胞生長因子;宮頸癌
上皮-間質轉化(epithelial-mesenchymal transition, EMT)是上皮細胞在特殊的生物信號的調節下轉換為間質細胞表型的生物過程,其是惡性腫瘤發生侵襲及轉移的重要機制[1- 2]。肝細胞生長因子(hepatocyte growth factor, HGF)是由間質細胞所產生的,具有多種生物學功能的生物信號分子,其可以通過調控其特異性受體c-Met的活性,從而影響惡性腫瘤(如前列腺癌、肺癌和胃癌等)的侵襲及轉移[3- 5],然而其在宮頸癌中是否具有同樣的作用目前尚不清楚。最近研究顯示,在宮頸癌中c-Met存在高表達[6],這提示HGF有可能通過激活c-Met,進而影響其下游信號分子,從而調控宮頸癌的侵襲及轉移。本研究以宮頸癌HeLa細胞作為研究對象,觀察HGF對上皮-間質轉化及侵襲、遷移的影響,并初步探討HGF誘導HeLa細胞上皮間質轉化的機制,從而為宮頸癌的治療提供新的方向及實驗依據。
1 材料與方法
1.1 材料與試劑
宮頸癌HeLa細胞(中南大學湘雅醫學院細胞中心);肝細胞生長因子(Invitrogen公司);二甲基亞砜(DMSO) (Sigma公司); DMEM 培養基(Hyclone公司);無支原體胎牛血清(杭州四季青生物工程材料有限公司); E-cadherin,vimentin兔抗人一抗(Santa Cruz公司),p-Met、AKT、p-AKT、ERK、p-ERK兔抗人一抗(CST公司);snail,c-Met,β-actin 抗體(Abnova公司);HRP 標記山羊抗兔 IgG、HRP標記的羊抗兔二抗、ECL化學發光劑試劑盒(杭州碧云天公司); BCA蛋白定量試劑盒(北京康為生物技術有限公司); SDS-PAGE凝膠試劑盒(北京鼎國生物有限公司);反轉錄試劑盒(Fermantas公司);實時熒光定量PCR試劑盒(UltraSYBR Mixture)(北京康為生物技術有限公司); PCR引物設計合成(上海生物工程股份有限公司),其余的生物試劑均是國產或國外分析純以上。
1.2 細胞培養
用Hyclone的DMEM 培養基培養HeLa細胞,培養基內加入10%胎牛血清,將培養瓶置于培養箱中培養,培養條件為37 ℃、5% CO2。此后,根據細胞的狀態每隔1~2 d換1次新鮮培養液,并根據實際情況每隔2~3 d進行傳代,實驗時選擇處于對數增殖期細胞進行。
1.3 細胞活力檢測
將處于對數期的HeLa細胞用胰蛋白酶消化制成細胞懸液,隨后接種于96 孔培養板,每孔培液為100 μL(約為8×103細胞/孔)。根據分組的情況每個組設置4個復孔,隨后將培養板置于細胞培養箱(條件:37 ℃、5% CO2)中培養。在培養至12 h,用不同濃度的HGF(0、5、10、20和40 ng/mL)處理細胞或20 ng/mL HGF處理不同時間(0、6、12、24和48 h)。隨后在無光的條件下加入 20 μL濃度為5 g/L的MTT溶液,于室溫孵育4 h,接著將上清液倒棄,隨后每孔加入150 μL的DMSO (避光進行)。最后將培養板置于酶標儀上,混勻。用空白孔進行調零,并于 490 nm的波長下測定每孔的吸光度值(A)。實驗重復進行3次。細胞的活力(%)=(處理組的A值-空白組的A值)/(對照組的A值-空白組的A值)×100%。
1.4 細胞遷移能力檢測
實驗時用胰蛋白酶使貼壁的細胞脫落,并用培養基吹打制成細胞懸液,隨后接種于6孔板(每孔2 mL,細胞大約為3×105個細胞/mL)。然后將培養瓶放置于培養箱中培養(條件: 37 ℃、5% CO2)12 h。細胞長滿后取無菌的10 μL的槍頭在6孔板的每個孔上進行劃痕,劃完后用無菌的的PBS清洗3遍,除去槍頭劃下的細胞,加入新鮮的DMEM培養基。將6孔板放置在倒置顯微鏡下,并取各培養孔中細胞劃痕的寬度相等的位置進行拍照。隨后將細胞重新放入培養箱中繼續培養(條件:37 ℃、5% CO2),培養24 h后,再用倒置顯微鏡觀察培養板的相同一位置上細胞遷移的情況并拍照。
1.5 細胞侵襲能力檢測
在培養板中放入 Transwell小室,接著將無血清培養基(300 μL)的在Transwell小室的上室,并于室溫下放置15~20 min,待基質膠重新水化后。隨后取200 μL的細胞懸液(約為3×105個/mL)加入Transwell 小室中的上室。與此同時在下室加入500 μL的新鮮培養基(含胎牛血清)。然后根據具體的分組用HGF處理 Transwell 上室的細胞。待孵育24 h后,對下室的基質膠膜的細胞進行染色,隨機篩取5個視野進行計數分析。
1.6 蛋白提取和Western blot分析
收集各組細胞,加入細胞裂解液,提取細胞的總蛋白,按照BAC試劑盒操作說明書測定蛋白質濃度。按照SDS-PAGE操作說明書配置5%濃縮膠和8%分離膠進行電泳,每孔的上樣量30 μg,條件恒壓80 V 30 min,120 V 70 min,電泳完畢后根據Mark顯示,切取相應膠帶進行轉膜,轉膜前PVDF膜甲醇浸泡15 min,轉膜條件為恒流200 mA 2 h,隨后用5%牛奶(TBST配置)封閉6 h,隨后E-cadherin、vimentin、c-Met一抗以1∶500比例稀釋;AKT、p-AKT、ERK、p-ERK一抗以1∶1 000比例稀釋;snail、β-actin一抗均以1∶2 000 比例稀釋,4 ℃ 孵育過夜。經 TBST 洗滌3次后,每次10 min(注意磷酸化抗體洗滌時應輕柔),加入HRP標記的特異性二抗以1∶2 000比例稀釋,室溫下孵育2 h,加入ECL發光劑,于成像系統中觀察蛋白條帶。并用Labwork凝膠成像系統對條帶進行分析。
1.7 統計學分析
2 結果
2.1 HGF對HeLa細胞的增殖以及形態的影響
HGF可以呈濃度及時間依賴性的上調細胞增殖,其中以20 ng/mL處理濃度及20 ng/mL處理24 h細胞的增殖能力最強,之后均無明顯變化(圖1A,B),故以20 ng/mL HGF處理24 h作為處理條件。與對照組相比HGF處理細胞后,HeLa細胞形態由多角形變為長梭型,由“鋪路石”樣緊密相連變為細長“間質細胞樣”散在生長(圖1C)。
2.2 HGF對HeLa細胞遷移的影響
分組處理24 h,對照組遷移(39.54±1.34)μm,顯著低于HGF處理組的(79.56±1.67)μm(圖2)(P<0.05)。此外, HGF處理后細胞穿過小室的細胞數目為130±7個,顯著高于對照組的(52±6)個,增高2.5倍(圖3)(P<0.05)。
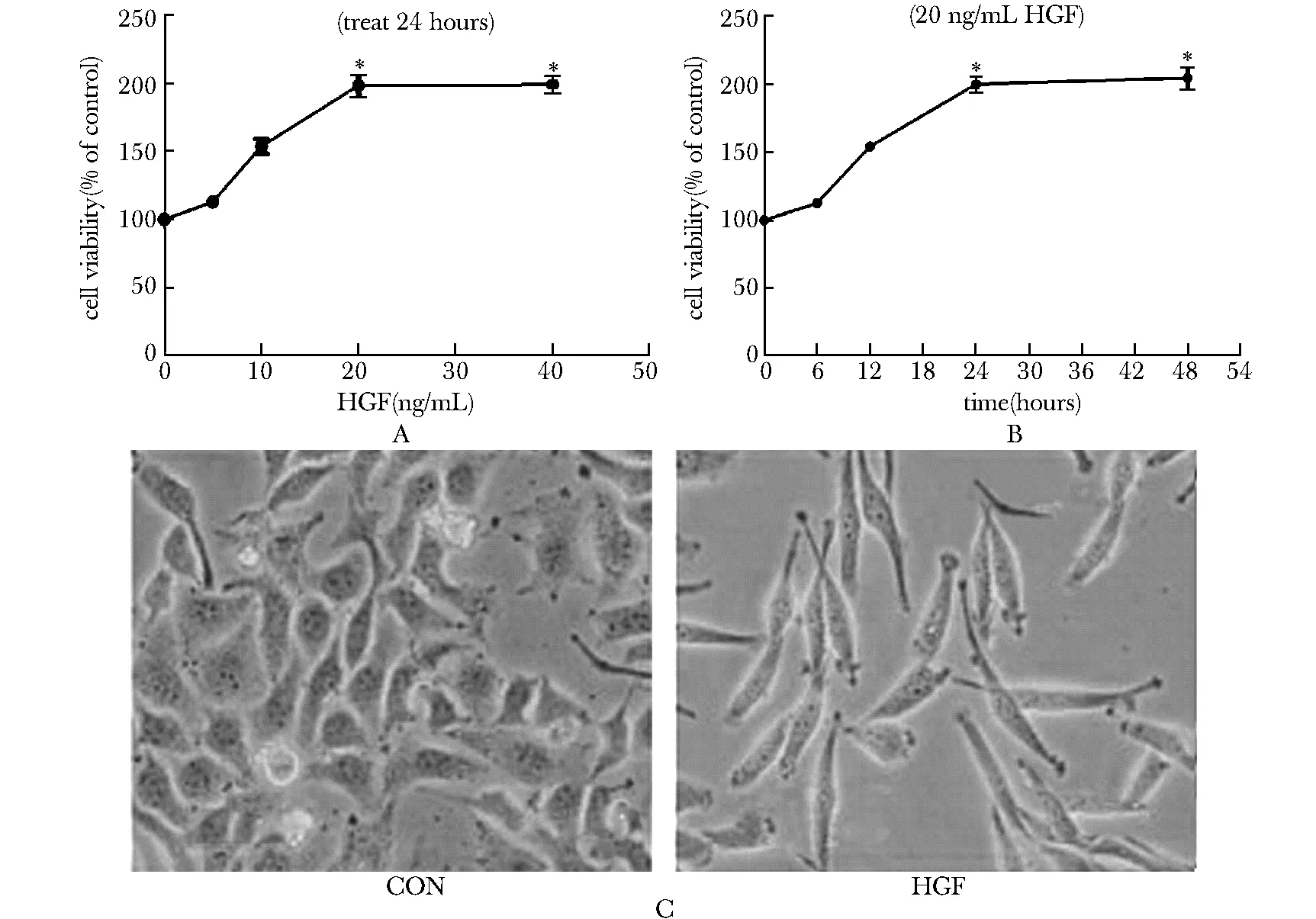
A.the effect of different concentration HGF on HeLa proliferation; B.the effect of HGF on HeLa proliferation in different times; C.the effect of HGF on morphological of HeLa cells
圖1 HGF對HeLa細胞增殖及形態的影響
Fig 1 The effect of HGF on proliferation and morphological(×400)
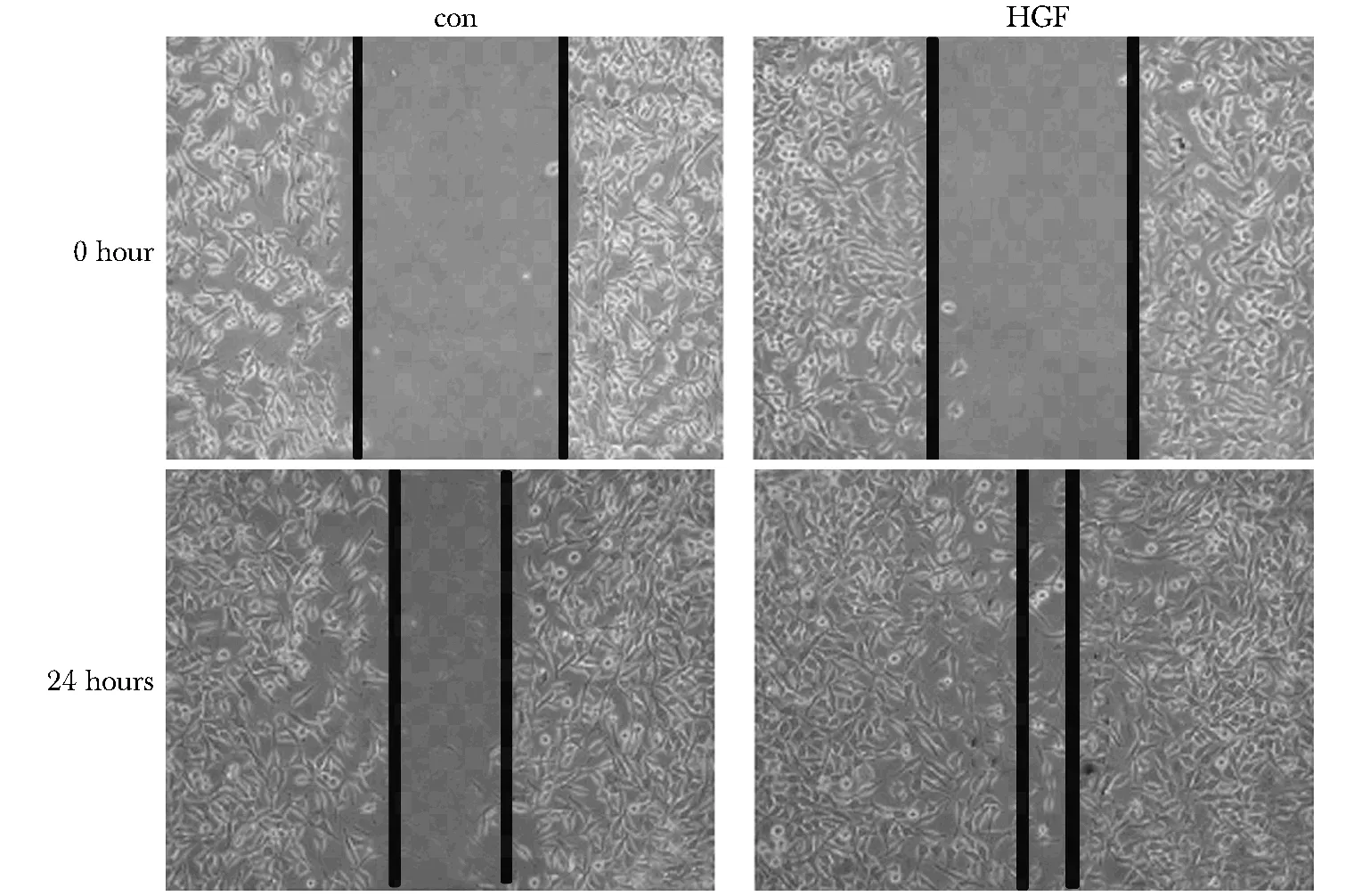
圖2 HGF對HeLa細胞遷移的影響
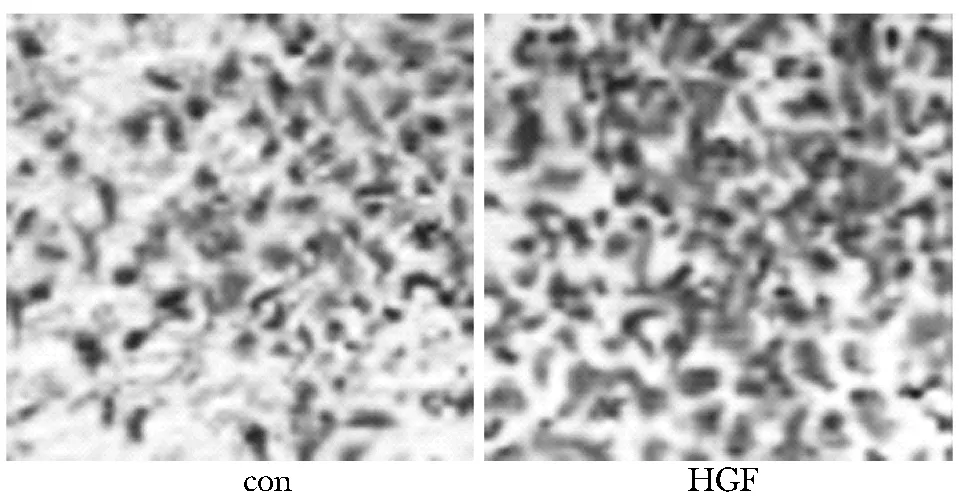
圖3 HGF對HeLa細胞侵襲能力的影響Fig 3 The effect of HGF on cell migration(×200)
2.3 HGF對HeLa細胞EMT標記蛋白表達的影響
HGF處理HeLa 24 h后,HGF可以明顯地下調E-cadherin蛋白表達,上調vimentin蛋白表達,并促進snail蛋白表達(圖4,表1)。
2.4 HGF對c-Met表達及下游AKT、MAPK通路的影響
與對照組相比, HGF可以促進HeLa細胞p-c-Met、p-AKT和p-ERK的表達(P<0.05),但c-Met、AKT和ERK表達并無明顯改變(表2,圖5)。
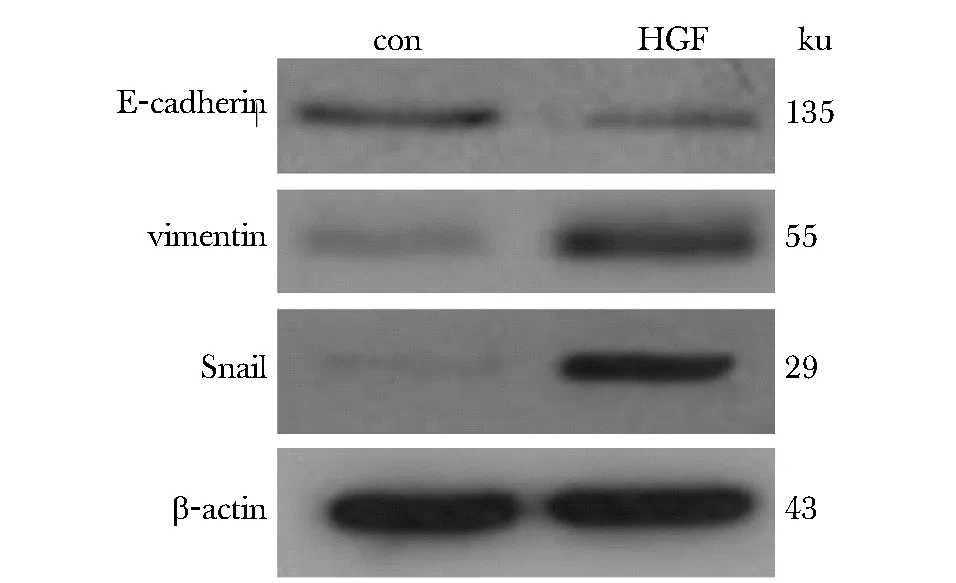
圖4 HGF對HeLa細胞E-cadherin、vimentin及snail蛋白表達的影響Fig 4 The effect of HGF on the protein expression of E-cadherin, vimentin and snail
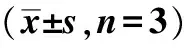

groupE?cadherinvimentinsnailcontrol 089±007 015±010 012±008HGF 040±011? 094±012?? 095±013??
*P<0.05,**P<0.01 compared with control.
表2 Western blot檢測 p-Met、Met、p-AKT、AKT、p-ERK、ERK蛋白的表達
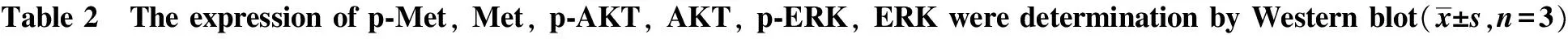
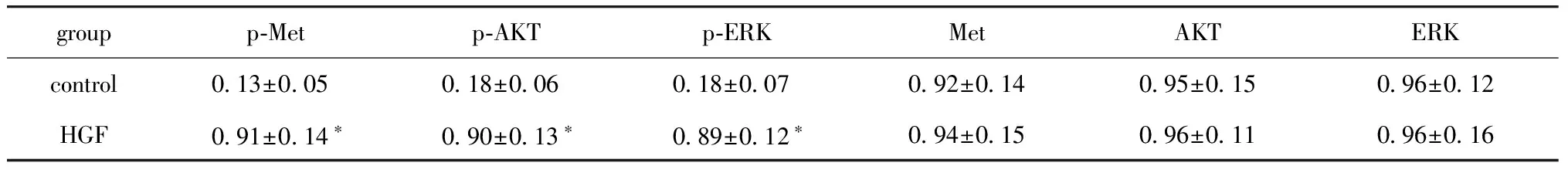
groupp?Metp?AKTp?ERKMetAKTERKcontrol 013±005 018±006 018±007092±014095±015096±012HGF 091±014? 090±013? 089±012?094±015096±011096±016
*P<0.05 compared with control.
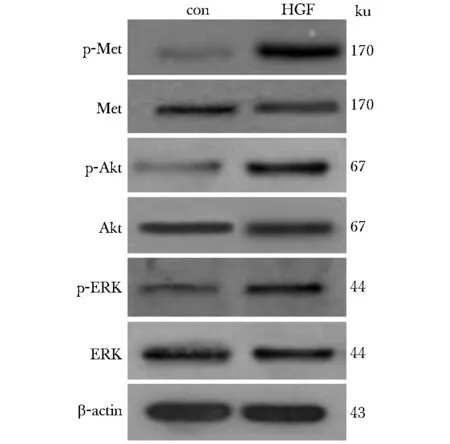
圖5 HGF對c-Met表達及下游AKT、MAPK通路的影響Fig 5 The effect of HGF on the c-Met expression and AKT, MAPK signaling
3 討論
宮頸癌的患者的死亡主要由于癌細胞的侵襲及轉移。而癌細胞的EMT是癌細胞發生侵襲轉移的重要機制之一[7]。癌細胞在發生 EMT 改變的時,除了細胞形態的轉換外,其表達的標志物也會隨之發生相應的改變,比如上皮細胞來源的標記蛋白如: E-cadherin、緊密連接蛋白 ZO-1 等表達降低,而代表間質細胞來源的標記蛋白如: vimentin、N-cadherin 等表達升高,從而引起了癌細胞之間黏附能力的下降,加快細胞的侵襲和轉移[8- 9]。
HGF是一種具有多重效應的生長因子,它能促進上皮細胞包括癌細胞的運動和生長[10]。現已證明,HGF可以促進多種腫瘤細胞(如肺癌、肝癌和前列腺癌細胞等)發生EMT,從而促進腫瘤細胞發生發展[4,11- 12]。在當前的研究中,HGF 明顯促進HeLa細胞EMT變化:細胞形態原來緊密連接飽滿的多角形 “上皮樣”細胞變為散在分布的短梭形“間質樣”細胞;細胞具有更強的侵襲和遷移能力;細胞的E-cadherin的表達下調,與vimentin的表達升高有關。
酪氨酸激酶受體 c-Met,是介導HGF發揮生物學效應的核心受體,目前大量的研究顯示,HGF可以通過激活c-Met受體,進而調節其下游信號通路如MAPK、AKT通路,從而調控腫瘤細胞發生EMT,促進腫瘤細胞的侵襲及遷移[10,13]。Snail作為調控EMT相關標記蛋白的重要轉錄因子,研究顯示其可以通過與 E-cadherin 啟動子部位的 E-box結合,從而抑制E-cadherin基因的表達[14]。而MAPK信號通路作為HGF/c-Met下游信號,ERK的活化可以激活轉錄因子snail[15]。在當前的實驗中, HGF確實激活宮頸癌細胞的c-Met受體,并隨之激活其下游的信號分子ERK、AKT,促進snail表達。因此,HGF很可能是通過激活c-Met-ERK信號通路,上調snail表達,從而下調E-cadherin蛋白,上調vimentin蛋白,引發如侵襲和轉移等一系列生物學活性。但是在當前的實驗中,并沒有采取干擾或者用抑制劑預處理細胞以進一步驗證HGF是否通過c-Met-ERK通路調控HeLa細胞EMT進程,而這也是該篇文章的不足,因此課題組將會在未來的研究中進一步明確該機制。
總之,本結果表明HGF可以促進HeLa細胞 EMT 的發生,其機制可能是通過激活c-Met/MAPK/snail通路,下調E-cadherin蛋白或上調vimentin蛋白實現的。這提示HGF可能作為 c-Met 激活劑,而抑制c-Met的激活或表達有可能是成為抑制宮頸癌侵襲及轉移的重要舉措,而這為臨床治療宮頸癌藥物的開發提供新的理論依據和實驗基礎。
[1] Kothari AN, Mi Z, Zapf M,etal. Novel clinical therapeutics targeting the epithelial to mesenchymal transition. [J]. Clin Transl Med, 2014,3:35- 47. doi: 10.1186/s40169- 014- 0035- 0.
[2] Davis FM, Stewart TA, Thompson EW,etal. Targeting EMT in cancer: opportunities for pharmacological intervention[J]. Trends Pharmacol Sci,2014,35:479- 488.
[3] Davies G, Watkins G, Mason MD,etal. Targeting the HGF/SF receptor c-Met using a hammerhead ribozyme transgene reducesinvitroinvasion and migration in prostate cancer cells[J].Prostate,2004,60: 317- 324.
[4] Ksiazkiewicz M,Markiewicz A,Zaczek AJ. Epithelial -mesenchy-mal transition: a hallmark in metastasis formation linking circulating tumor cells and cancer stem cells[J].Pathobiology,2012,79: 195- 208.
[5] Hung CM, Kuo DH, Chou CH,etal. Osthole suppresses hepatocyte growth factor (HGF)-induced epithelial-mesenchymal transition via repression of the c-Met/Akt/mTOR pathway in human breast cancer cells[J]. J Agric Food Chem, 2011,59:9683- 9690.
[6] Chen XP, Ren XP, Lan JY,etal. Analysis of HGF, MACC1, c-Met and apoptosis-related genes in cervical carcinoma mice[J]. Mol Biol Rep,2014,41:1247- 1256.
[7] Schaeffer D, Somarelli JA, Hanna G,etal. Cellular migration and invasion uncoupled: increased migration is not an inexorable consequence of epithelial-to-mesenchymal transition[J]. Mol Cell Biol,2014,34:3486- 3499.
[8] Ksiazkiewicz M,Markiewicz A, Zaczek AJ. Epithelial-mesenchy-mal transition: a hallmark in metastasis formation linking circulating tumor cells and cancer stem cells [J].Pathobiology,2012,79:195- 208.
[9] Guo F, Parker, Kerrigan BC,etal. Post-transcriptional regulatory network of epithelial-to-mesenchymal and mesenchymal-to-epithelial transitions[J]. J Hematol Oncol, 2014,5:7- 19.
[10] Nagai T, Arao T, Furuta K,etal.Sorafenib inhibits the hepatocyte growth factor-mediated epithelial mesenchymal transition in hepatocellular carcinoma[J].Mol Cancer Ther,2011,10: 169- 177.
[12] Yu G, Jing Y, Kou X,etal. Hepatic stellate cells secreted hepatocyte growth factor contributes to the chemoresistance of hepatocellular carcinoma[J]. PLoS One, 2013, 8:e73312. doi: 10.1371/journal.pone.0073312.
[13] Yu MA, Shin KS, Kim JH,etal. HGF and BMP-7 ameliorate high glucose-induced epithelial-to-mesenchymal transition of peritoneal mesothelium[J]. J Am Soc Nephrol,2009,20:567- 581.
[14] Kaufhold S, Bonavida B. Central role of Snail1 in the regulation of EMT and resistance in cancer: a target for therapeutic intervention[J]. J Exp Clin Cancer Res,2014,33:62- 69.
[15] Smith BN, Burton LJ, Henderson V,etal. Snail promotes epithelial mesenchymal transition in breast cancer cells in part via activation of nuclear ERK2[J]. PLoS One, 2014,9:e104987.doi:10.1371/journal. pone.0104987.
Hepatocyte growth factor promotes epithelial-mesenchymal transition of HeLa cells
WANG Zhi-min1,2, BAO Shan2*
(1.University of South China, Hengyang 421001; 2.Dept. of Gynaecology, People’s Hospital of Hainan Province, Haikou 570100, China)
Objective To investigate the effect of HGF on epithelial-mesenchymal transition of HeLa cells. MethodsHeLa cells were treated with different concentrations of HGF(0,5,10,20 and 40 ng/mL) or incubated with HGF of same dosage(20 ng/mL) for different times(0,6,12,24 and 48 h), MTT method was used to detect cell proliferation. Migration of HeLa cells was detected by wound healing and Transwell assay; The protein expression of p-Met, E-cadherin,vimentin,snail,c-Met,p-AKT,and p-ERK were determined by Western blot.Results HGF significantly increased HeLa cells proliferation in both concentration-and time-dependent manner. Moreover, HGF promoted the migration of HeLa cells, and Western blot showed that E-cadherin was decreased,whereas vimentin was increased in HGF treated cells.Meanwhile,HGF significantly activated c-Met, and then promoted AKT, ERK activation.Conclusions HGF induces epithelial-mesenchymal transition of HeLa cell, it may up-regulate the expression of snail, and then regulate E-cadherin or vimentin expression via stimulating HGF/c-Met/MAPK or HGF/c-Met/AKT signaling.
epithelial-mesenchymal transition; hepatocyte growth factor; cervical cancer
2014- 10- 08
2014- 12- 01
海南省社會發展科技專項(SF201302);海南省自然科學基金(30633)
1001-6325(2015)04-0485-06
R737.33
A
*通信作者(corresponding author):baoshan3@126.com

