馬鈴薯六種主要病毒通用RT-PCR檢測體系的建立
張威,白艷菊*,文景芝,范國權,高艷玲,申宇,張抒,孟憲欣,王軍
病蟲防治
馬鈴薯六種主要病毒通用RT-PCR檢測體系的建立
張威1,白艷菊1*,文景芝2,范國權1,高艷玲1,申宇1,張抒1,孟憲欣3,王軍4
(1.黑龍江省農業科學院植物脫毒苗木研究所,黑龍江哈爾濱150086;2.東北農業大學農學院,黑龍江哈爾濱150030;3.黑龍江省農業科學院作物育種研究所,黑龍江哈爾濱150086;4.北大荒墾豐種業股份有限公司,黑龍江哈爾濱150090)
馬鈴薯X病毒(PVX)、馬鈴薯Y病毒(PVY)、馬鈴薯S病毒(PVS)、馬鈴薯卷葉病毒(PLRV)、馬鈴薯M病毒(PVM)和馬鈴薯A病毒(PVA)是馬鈴薯生產田中發生率較高、危害較嚴重的病毒,因此,建立特異性強、靈敏度高、檢測速度快的RT-PCR分子檢測體系對保障馬鈴薯種薯質量具有非常重要的意義。試驗篩選了6種病毒的特異引物、優化了PCR部分的試劑以及確定了退火溫度。結果表明,當Mg2+濃度為2.6 mmol/L、dNTPs濃度為0.1 mmol/L、Taq DNA聚合酶濃度為0.03 U/μL,以及退火溫度為55.5℃時反應體系最穩定。最終,建立了一套通用RT-PCR檢測體系,只需要變換每種病毒的引物,就可以實現對PVX、PVY、PVS、PLRV、PVM和PVA病毒的RT-PCR檢測。每種病毒檢測靈敏度均能達到pg以上。
馬鈴薯;PVX;PVY;PVS;PLRV;PVM;PVA
馬鈴薯是世界上最重要的糧食作物之一,具有分布范圍廣、適應性強、產量高、用途廣等特點。中國馬鈴薯的種植面積和總產量均居世界首位[1],然而整體生產水平卻只有馬鈴薯生產發達國家荷蘭平均單產的32%[2]。其中病毒病是降低馬鈴薯種薯產量,引起種性退化的主要原因。
目前,生產上發生普遍、危害較嚴重的6種主要病毒有:馬鈴薯X病毒(PVX)、馬鈴薯Y病毒(PVY)、馬鈴薯S病毒(PVS)、馬鈴薯卷葉病毒(PLRV)、馬鈴薯M病毒(PVM)和馬鈴薯A病毒(PVA)[3-7],是馬鈴薯產業發展的制約瓶頸[8,9]。現階段對病毒病尚沒有有效的治療辦法,只能預防[10]。病毒檢測是防治措施中最為重要的環節,也是種薯質量認證的關鍵指標。
反轉錄聚合酶鏈式反應(Reverse transcriptionpolymerase chain reaction,RT-PCR)是從分子水平上對病毒的RNA進行檢測,以其靈敏度高、特異性強、檢測速度快等優點在病毒檢測中日益顯示出了強大的優勢。6種病毒RT-PCR的檢測體系都具有獨特性,其中PCR部分各試劑用量、退火溫度等都具有不同要求,為了提高6種病毒的檢測效率,簡化操作步驟,通過對每種病毒PCR部分Mg2+、dNTPs、Taq DNA聚合酶濃度工作范圍,以及退火溫度梯度等試驗研究,最終,建立了一套通用RT-PCR檢測體系,只需要變換每種病毒的引物,其他試劑用量和程序不變,就可以實現對這6種病毒的檢測。
1 材料與方法
1.1試驗材料
1.1.1樣品來源
從馬鈴薯現蕾期到收獲期,對內蒙古、黑龍江、吉林、云南等主要馬鈴薯產區進行樣品采集,主要采集花葉、卷葉、壞死、皺縮、矮化等典型病毒病癥狀或疑似病毒病癥狀的樣品,應用英國ADGEN公司的馬鈴薯病毒DAS-ELISA檢測試劑盒對樣品進行PVX,PVY,PVS,PLRV,PVM和PVA檢測,陽性樣品于-70℃冰箱保存備用,6種病毒的陰、陽性對照由黑龍江省農業科學院植物脫毒苗木研究所提供。
1.1.2主要試劑
Trizol購自Invitrogen公司;M-MLV反轉錄酶購自Promeger公司;dNTPs、RNA酶抑制劑、Taq DNA聚合酶、Eco R I、Sal I和pMD18-T均購自TaKaRa(大連)公司;大腸桿菌Escherichia coli GM109由實驗室保存;質粒提取試劑盒和DNA片段回收試劑盒均購自北京全式金生物技術有限公司;其他試劑均為分析純;引物合成及序列測定委托上海生工生物工程有限公司完成。
1.2試驗方法
1.2.1引物的篩選
每種病毒從中、英文文獻中查找多對引物,篩選出CP(Coat protein,CP)保守區的引物;用Primer Premier 5.0軟件進行評價,篩選分值高的引物;然后進行RT-PCR擴增,篩選出只能擴增得到特異性條帶的引物,經綜合考慮,最終每種病毒篩選1對特異性引物(表1)。
1.2.2總RNA提取
參照TrizolReagent(InvitrogenTM)說明書,并在此基礎上進行改進:將樣品置于研缽中,加液氮研磨成粉末,轉至1.5 mL離心管,加入1 mL Trizol混勻,使其充分裂解;4℃、14 000 r/min離心5 min;取上清,加入200μL三氯甲烷,振蕩混勻,室溫放置15 min;4℃,12 000 r/min離心15 min;吸取上層水相至新1.5 mL離心管中,加入0.5 mL異丙醇,混勻,室溫放置10 min;4℃、12 000 r/min離心10 min;棄上清,留沉淀,加入1 mL 75%乙醇,溫和振蕩離心管,懸浮沉淀;4℃、7 500 r/min離心5 min,棄上清,將離心管倒置于濾紙上,自然干燥;加入25~100μL DEPC水溶解沉淀,即得到RNA。
1.2.3提取RNA質量的檢測
用紫外分光光度計測定其吸光度值,鑒定總RNA的純度。
1.2.4RT-PCR
反轉錄體系:取2.5μL RNA,65℃加熱8 min,冰上放置2 min;再加入下游引物(100 ng/μL)0.5μL,5 3 5 CVGGFS 1μL,dNTPs(2.5 mmol/L)1μL,RNase Inhibitor5 U,M-MLV反轉錄酶100 U,用ddH2O補足至10μL,短暫離心。反應程序:42℃反應1 h,92℃滅活2 min,-20℃保存待用。
PCR反應體系:取2μL cDNA,10 1 3 buffer 2.5μL,上、下游引物(100 ng/μL)各0.5μL。分別對6種病毒反應體系中的Mg2+、dNTPs、Taq DNA聚合酶濃度進行優化:dNTPs濃度選擇在0.1~0.5 mmol/L,Taq DNA聚合酶濃度選擇在0.01~0.05 U/μL,Mg2+濃度選擇在1.0~3.7 mmol/L。
PCR反應程序:92℃預變性5 min;92℃變性30 s,退火溫度設定49.0~60.3℃、30 s,72℃延伸45 s,循環30次;72℃延伸8 min。
1.2.5PCR產物的檢測、克隆與測序
反應結束后,取5μL擴增產物進行1.5%瓊脂糖凝膠(含0.5 mg/L的溴化乙錠)電泳檢測。用Bio-Rad凝膠成像系統觀察結果。
RT-PCR產物純化后分別連接到pMD18-T載體上,轉化到GM109感受態細胞中。挑取的抗性單菌落擴繁后,試劑盒提取質粒,再應用Eco R I和Sal I對重組質粒進行酶切鑒定。目的片段進行測定,采用DNAstar軟件進行序列分析。

表1 病毒特異性引物Table 1 Specific primers of viruses

表2 RNA的紫外吸收值Table 2 Ultraviolet absorption value of RNA
2 結果與分析
2.1總RNA提取質量
試驗采用Trizol法提取總RNA,為保障RT-PCR檢測結果準確,必須使用純度較高、完整性較好的RNA。從表2可以看出,試驗提取的總RNA OD260/OD280比值均為1.80~1.90,表明植物組織中的酚類化合物、多糖和蛋白質等已基本去除,總RNA純度較理想。
2.2PCR部分試劑濃度確定
通過分別對PVX,PVY,PVS,PLRV,PVM和PVA6種病毒PCR部分的Mg2+(1.0~3.7 mmol/L)、dNTPs(0.1~0.5 mmol/L)、Taq DNA聚合酶(0.01~0.05 U/μL)進行單因子工作濃度確定。經反復試驗,最終確定當dNTPs濃度在0.1 mmol/L、Mg2+濃度在2.6 mmol/L、Taq DNA聚合酶濃度在0.03 U/μL時,6種病毒的RT-PCR均能達到檢測穩定的狀態,而且應用一套通用RT-PCR檢測體系,只需要變換每種病毒的引物,就可以實現對這6種病毒進行檢測,提高了檢測效率,簡化了操作步驟且達到節約成本的目的。
2.3RT-PCR反應程序退火溫度確定
通過分別對PVX,PVY,PVS,PLRV,PVM和PVA6種病毒RT-PCR退火溫度梯度的試驗,確定了每種病毒的退火溫度范圍,從表3可以看出,退火溫度在51.9~58.6℃時,6種病毒都能擴增得到目的片段,最終選擇中間值55.5℃為體系的退火溫度。
2.46種病毒通用RT-PCR檢測體系的建立
通過對6種病毒PCR部分Mg2+、dNTPs、Taq DNA聚合酶濃度工作范圍,以及退火溫度梯度等試驗,最終建立了一套通用RT-PCR檢測體系(表4)。

表3 6種病毒的退火溫度范圍Table 3 Annealing temperature range of six viruses
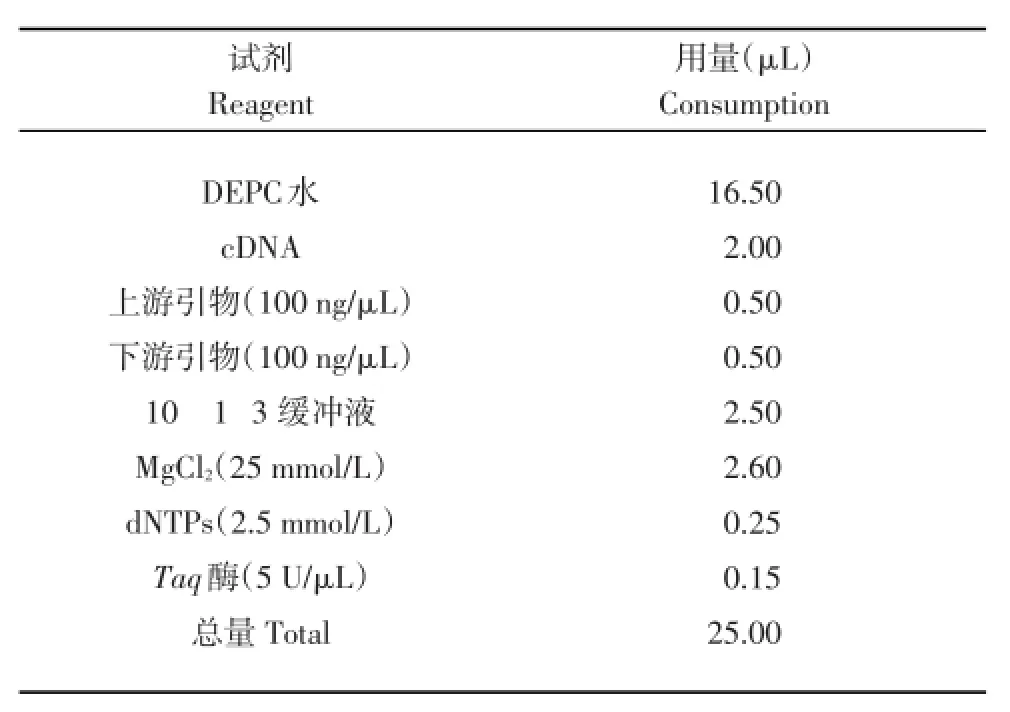
表4 PCR反應體系Table 4 PCR reaction system
分別以感染病毒的馬鈴薯葉片總RNA為模板,對6種病毒分別進行RT-PCR擴增。從圖1看出,泳道2,3,4,5,6和7分別擴增得到長度為273 bp,336 bp,447 bp,520 bp,711 bp和729 bp的6條特異性條帶,而陰性對照無此條帶,成功擴增得到PVA、PLRV、PVY、PVM、PVX和PVS病毒。
2.5RT-PCR產物的克隆與序列測定
將6種病毒的RT-PCR擴增產物純化后,克隆到pMD18-T載體上,試劑盒提取質粒,對重組質粒的插入片段進行序列測定,測序結果用DNAstar軟件分析,分析結果顯示:PVX,PVY,PVS,PLRV,PVM和PVA的擴增產物分別由711,447,729,336,520和273個核苷酸組成,與預期片段大小相同,序列與相應病毒序列同源性均在98.5%以上,證明RT-PCR檢測結果準確。
2.6通用RT-PCR檢測體系的靈敏度
提取PVX,PVY,PVS,PLRV,PVM和PVA病毒的RNA,紫外分光光度計測定RNA的濃度依次為921.30 ng/μL,1 120.50 ng/μL,605.75 ng/μL,160.35 ng/ μL,66.78 ng/μL和561.00 ng/μL,每一種病毒的RNA經過濃度梯度稀釋后再進行RT-PCR擴增,結果見表5,經計算6種病毒的RT-PCR檢測體系最低能檢測出RNA濃度分別為368 pg/μL,448 pg/μL,303 pg/ μL,107 pg/μL,66 pg/μL和374 pg/μL。
2.7應用RT-PCR檢測體系對馬鈴薯田間樣品進行檢測
分別應用PVX,PVY,PVS,PLRV,PVM和PVA 6種病毒RT-PCR檢測體系對已知帶毒情況的田間采集的馬鈴薯病葉和脫毒試管苗進行檢測,RT-PCR檢測結果非常準確。圖2為代表性樣品的電泳圖。
3 討論
PVX,PVY,PVS,PLRV,PVM和PVA是馬鈴薯生產田中發生率較高、危害較嚴重的病毒,也是國家標準《馬鈴薯種薯》(GB18133-2008)中規定的馬鈴薯種薯必須檢測的病毒。目前馬鈴薯質檢單位和科研機構主要采用血清學DAS-ELISA方法進行病毒檢測,此方法雖適合樣品量較大的田間樣品的檢測,但不適用于病毒濃度較低的馬鈴薯脫毒試管苗和休眠薯塊的檢測,馬鈴薯試管苗作為源頭,其脫毒是否徹底關系到各級種薯的質量,因此,需要配套更靈敏的檢測技術。近年來,RT-PCR檢測技術以其靈敏度高、特異性強、檢測速度快等特點在病毒檢測上得到應用,可以彌補DAS-ELISA檢測方法的不足,對試管苗、休眠薯塊等樣品都可以進行準確檢測。
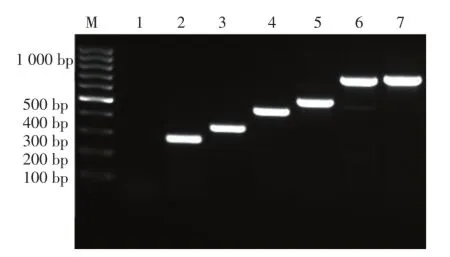
圖1 馬鈴薯六種病毒通用RT-PCR檢測體系的建立Figure 1 Establishment of RT-PCR detection system for six potato viruses

表5 通用RT-PCR檢測體系的靈敏度Table 5 Universal RT-PCR detection system sensitivity

圖2 應用RT-PCR對馬鈴薯田間樣品的檢測Figure 2 Detection of potato field samples using RT-PCR
通過分別對6種病毒引物篩選、PCR部分各試劑工作濃度以及每種病毒退火溫度確定,最終建立一套通用RT-PCR分子檢測體系,只需要變換每種病毒的引物,就可以實現分別對PVX,PVY,PVS,PLRV,PVM和PVA病毒的RT-PCR檢測。在RT-PCR反應體系中,引物的選擇對試驗的成敗起關鍵性作用[18],既要使引物能對病毒進行特異性擴增,又要使引物能對同一病毒的不同株系進行特異性擴增,以保障不漏檢病毒。本研究從中、英文文獻中每種病毒查找多對引物,首先在GenBank上將每種病毒不同分離物的CP基因進行多序列比對,篩選出在保守區的引物,然后用Primer Premier 5.0軟件進行綜合評價,篩選效果好的引物,然后再用RT-PCR體系擴增,篩選出能擴增得到特異性條帶而無雜帶的引物,最終每種病毒篩選到一對特異性引物。其次,PCR部分Mg2+、dNTPs、Taq DNA聚合酶濃度對試驗成敗起關鍵作用,經反復試驗,最終確定當dNTPs濃度在0.1 mmol/ L、Mg2+濃度在2.6 mmol/L、Taq DNA聚合酶濃度在0.03 U/μL時,6種病毒的RT-PCR均能達到檢測穩定的狀態。再次,PCR反應程序中退火溫度對反應的影響很大,通過對每種病毒RT-PCR退火溫度梯度進行試驗,確定了退火溫度在51.9~58.6℃6種病毒都能擴增得到目的片段,最終選擇中間值55.5℃為體系的退火溫度。
本研究還對6種病毒RT-PCR檢測體系的靈敏度進行了測定,對每一種病毒的RNA經過濃度梯度稀釋后再進行RT-PCR擴增,經計算6種病毒的RT-PCR檢測體系最低能檢測出RNA濃度分別為368 pg/μL,448 pg/μL,303 pg/μL,107 pg/μL,66 pg/μL和374 pg/μL,均達到pg以上。
最后,分別應用PVX,PVY,PVS,PLRV,PVM和PVA 6種病毒通用RT-PCR檢測體系對已知帶毒情況的田間采集的馬鈴薯病葉和脫毒試管苗進行檢測,RT-PCR檢測結果非常準確,但對病毒含量較低的脫毒試管苗來說,RT-PCR檢測的靈敏度更高,因此該體系完全可以應用于馬鈴薯上述6種病毒的田間檢測。
[1]張威,白艷菊,高艷玲,等.馬鈴薯主產區病毒病發生情況調查[J].黑龍江農業科學,2010(4):71-74.
[2]王迎男,賈立國,樊明壽.2010~2012年世界各洲及各洲主要生產國馬鈴薯生產狀況分析[M]//屈冬玉,陳伊里.馬鈴薯產業與現代可持續農業.哈爾濱:哈爾濱地圖出版社,2015.
[3]Solomon-Blackburn R M,Barker H.Breeding virus resistant potatoes(Solanum tuberosum):a review of traditional and molecular approaches[J].Heredity,2001,86:17-35.
[4]鐘婷婷,蒲志剛,何俊蓉,等.四川省馬鈴薯主產區最新病毒病普查及血清學鑒定[J].西南農業學報,2008,21(1):96-99.
[5]劉洪義,張洪祥,李明福,等.黑龍江省馬鈴薯病毒病的普查及鑒定[J].東北農業大學學報,2006,37(3):307-310.
[6]白艷菊,文景芝,楊明秀,等.西南地區與東北地區馬鈴薯主要病毒發生比較[J].東北農業大學學報,2007,38(6):733-736.
[7]張仲凱,丁銘,方琦,等.云南馬鈴薯病毒種類及脫病毒種苗篩選技術體系[J].云南農業科技,2003(增刊):121-130.
[8]Jansky S,Jin L,Xie K,et al.Potato production and breeding in China[J].Potato Research,2009,52(1):57-65.
[9]Wang Q,Zhang W.An economic analysis of potato demand in China[J].American Journal of Potato Research,2010,87(3):245-252.
[10]吳興泉,陳士華,謝聯輝.馬鈴薯X病毒的分子鑒定與檢測技術[J].河南農業科學,2006(2):72-75.
[11]張威,白艷菊,申宇,等.馬鈴薯X病毒黑龍江分離物外殼蛋白基因克隆與序列分析[J].黑龍江農業科學,2010(8):1-5.
[12]孫琦,張春慶,孟昭東,等.馬鈴薯X、Y病毒的復合RT-PCR檢測體系的建立[J].農業生物技術學報,2009,17(4):737-738.
[13]Crosslin J M,Hamlin L L.Standardized RT-PCR conditions for detection and identification of eleven viruses of potato and potato spindle tuber viroid[J].American Journal of Potato Research,2011,88:333-338.
[14]Nie X,Singh R P.A novel usage of random primers for multiplex RT-PCR detection of virus and viroid in aphids,leaves,and tuber[J]. JournalofVirologicalMethods,2001,91:37-49.
[15]Singh R P,Nie X Z,Singh M.Duplex RT-PCR:Reagent concentrations at reverse transcription stage affect the PCR performance[J].Journal of Virological Methods,2000,86:121-129.
[16]Nie X Z,Singh R P.Detection of multiple potato viruses using an oligo(dT)as a common cDNA primer in multiplex RT-PCR[J]. JournalofVirologicalMethods,2000,86:179-185.
[17]Xu H,D'Aubin J,Nie J.Genomic variability in potato virus M and the developmentof RT-PCR and RFLP procedures for the detection ofthis virus in seed potatoes[J].Virology Journal,2010:25(7):1-7.
[18]鄭軒,成巨龍,趙震,等.五種煙草病毒TMV、CMV、TEV、PVY及TVBMV的多重RT-PCR同步檢測[J].植物病理學報,2011,41(2):146-153.
Establishment of UniversalRT-PCR System for Detection of Six Major Potato Viruses
ZHANG Wei1,BAIYanju1*,WEN Jingzhi2,FAN Guoquan1,GAO Yanling1,SHENYu1, ZHANG Shu1,MENG Xianxin3,WANG Jun4
(1.Institute of Virus-free Seedling Research,Heilongjiang Academy of AgriculturalSciences,Harbin,Heilongjiang 150086,China; 2.College ofAgronomy,NortheastAgriculturalUniversity,Harbin,Heilongjiang 150030,China;3.Institute of Crop Breeding, Heilongjiang Academy ofAgriculturalSciences,Harbin,Heilongjiang 150086,China;4.Beidahuang Kenfeng Seed Limited Company,Harbin,Heilongjiang 150090,China)
The higher incidence and more serious viruses in potato fields are potato virus X(PVX),potato virus Y (PVY),potato virus S(PVS),potato leafrollvirus(PLRV),potato virus M(PVM),and potato virus A(PVA),so it is very importantto guarantee the quality ofseed potato by establishmentof RT-PCRmolecular detection system with specificity, high sensitivity and fastdetection speed for these viruses.In this research,the primer for each virus was screened,PCR reagents were optimized,and annealing temperature was determined.The results indicated thatwhen the concentration of Mg2+was 2.6 mmol/L,d NTPs was 0.1 mmol/L,Taq DNA polymerase was 0.03 U/μL,and annealing temperature was 55.5℃,the reaction system was the most stable.Finally,a universalRT-PCR detection system was established,which only need to change primer for each virus when the RT-PCR detection for PVX,PVY,PVS,PLRV,PVM and PVA was needed.The detection sensitivity ofeach virus could reach the levelofpg.
potato;PVX;PVY;PVS;PLRV;PVM;PVA
S532
A
1672—3635(2015)04-0222-06
2014-12-20
黑龍江省自然科學基金項目(C201234);黑龍江省農業科技創新工程重點資助項目(2012ZD015);現代農業產業技術體系專項資金資助(CARS-10-P14);國家科技支撐項目(2012BAD06B02-02C2)。
張威(1981-),女,助理研究員,碩士,研究方向為分子植物病理學。
(Corresponding author):白艷菊,研究員,研究方向為分子植物病理學,E-mail:yanjubai@163.com。

