超極化磁共振波譜的原理和應用
齊海云,張曉璐,徐雅芳,文建國,許予明,程敬亮,Albert P. Chen, Lotte Bonde Bertelsen,Steffen Ringgaard, Christoffer Laustsen, Hans St?dkilde -J?rgensen*
超極化磁共振波譜的原理和應用
齊海云1,張曉璐1,徐雅芳1,文建國2,許予明2,程敬亮2,Albert P. Chen3, Lotte Bonde Bertelsen1,Steffen Ringgaard1, Christoffer Laustsen1, Hans St?dkilde -J?rgensen1*
作者單位:
1.MR 研究中心,臨床醫學系,奧胡斯大學,奧胡斯,丹麥
2.鄭州大學第一附屬醫院,鄭州450052
3.GE Healthcare,多倫多,加拿大
共同第一作者:
齊海云,張曉璐,徐雅芳
通過動態核極化(dynamic nuclear polarization,DNP)的方法使原子核自旋極化達到熱平衡之上來增強分子磁共振10,000倍以上的信號,這一過程稱為超極化(hyperpolarization,HP)。溶解性DNP允許超極化分子以液體形式轉移至生物體內,可實時觀測體內的生物灌注、代謝產物的運輸和代謝反應。該技術的發明克服了傳統磁共振信號低,不能實時監測體內代謝過程的缺點。本文旨在介紹動態核極化的定義和技術、常用的超極化生物探針、超極化磁共振波譜圖像的結果分析以及初步的動物實驗和臨床試驗結果。
超極化;動態核極化;生物探針;生物反應器;磁共振波譜;磁共振成像
1 超極化磁共振的定義與動態核極化
磁共振(magnetic resonance,MR)的兩大主要應用是磁共振波譜(magnetic resonance spectroscopy,MRS)與磁共振成像(magnetic resonance imaging,MRI),MRS可獲得分子動態結構以及分子間、分子內部的相互作用,是一種重要的分析技術;而MRI是臨床上重要的非創傷性診斷技術,具有良好的軟組織對比度和廣泛的診斷應用價值[1-2]。但是MR固有的低靈敏度限制著磁共振的應用。從根本上講,MR低敏感性源于室溫下原子核自旋極化的低磁能量,這一量級約為0.0001%~0.0005%。MRI能得以臨床應用是因為人體脂肪和自由水中氫質子(1H)含量高,從而能產生較高的時間、空間分辨率。然而其他可用于磁共振觀察的同位素原子核由于自然豐度低,即天然存在比低,故其敏感性很低,比如13C與15N,并且這類原子核旋磁比低,如13C是1H質子旋磁比的1/4,這意味著13C MR敏感性比1H低4倍,而15N MR敏感性則更低,故采集其原子核的磁共振波譜很困難。因此,生物組織體內大量其他分子的生物信號與生物化學信息由于濃度低、信號低而很難探知。
要解決15N、13C這些原子信號低問題,需要提高所觀察分子的自旋極化能級。Overhauser 在1953年首次提出動態核極化(dynamic nuclear polarization,DNP)的概念[3],即通過轉移高度極化的電子自旋到原子核自旋,從而提高熱平衡狀態下原子核的極化來增加磁共振信號,目前被廣泛稱為“超極化”(hyperpolarization,HP)。在低溫磁場下,將較高極化的電子自旋通過接近其共振頻率的微波輻照,部分極化轉移至可提供生物信息的自旋原子核上,例如13C。Jan Henrik Ardenkjaer-Larsen于2003年發明了溶解性動態核極化(dissolution-DNP,d-DNP)[4],使固態超極化探針溶解并可轉移至生物體內,得到提高10,000倍以上的磁共振信號(圖1),因此可得到探針相關的生物灌注、代謝產物的運輸和代謝反應等生物信息,在生物醫學中引起了廣泛關注[4-7]。借助于傳統磁共振設備掃描注射入靶生物體內的超極化生物探針并得到至少提高10,000倍的MR信號,稱之為超極化磁共振。MRS、MRI和DNP的聯合應用極大提高了MR檢測的時間分辨率和空間分辨率,并且與PET、CT等檢測方法相比,此聯合應用無電離輻射,無毒性代謝物,化學特異性高,能夠幫助區分母體復合物和代謝產物。

圖1 HP磁共振生物探針的生產與應用,13C標記的丙酮酸在SPINLAB中完成DNP超極化并被充分溶解,然后注射入靶生物體內通過MR掃描儀觀察其代謝信息Fig. 1 The polarization process and applications of HP-MR bio-probes.13C-labelled pyruvate is hyperpolarized in a SPINLAB polarization system and subsequently injected intravenously with the target located in the MR-scanner. The outcome is highly detailed metabolic flux information.
2 超極化生物探針
HP探針需要選擇極化損失慢(長T1)的MR活躍原子核,可迅速完成檢測(表1)。與質子相比,13C 和15N旋磁比低但T1時間較長,在體內研究中13C 和15N的一些分子位點T1可達數分鐘[8]。這類同位素生物體內自然豐度低,所以背景信號低,而且動態核極化使探針SNR增加超過10,000倍,因而易于定量監測[4]。能用于超極化的候選探針很多,要求具備溶解度高、T1時間長、快速質膜轉運、無毒性代謝產物等條件,且與代謝物之間具有明顯的化學位移差異。多種HP探針已用于細胞內反應、信號通路動力學、探針攝取和輸出、pH、氧化還原狀態、活性氧、離子濃度、藥物效力和癌基因信號等生物醫學研究[8-9]。
臨床磁共振掃描主要檢測體內H2O中的1H質子。1H的很多特點使它成為熱動力平衡狀態下MRI和MRS最理想的原子核:高天然豐度、體內高濃度、大旋磁比γ、短T1。利用1H-MRS測量細胞代謝,在疾病早期診斷和檢測腫瘤對治療反應方面具有較好的敏感性,但只能提供細胞代謝的靜態圖[10-12]。HP生物探針能無創實時動態監測生物體內的代謝信息。
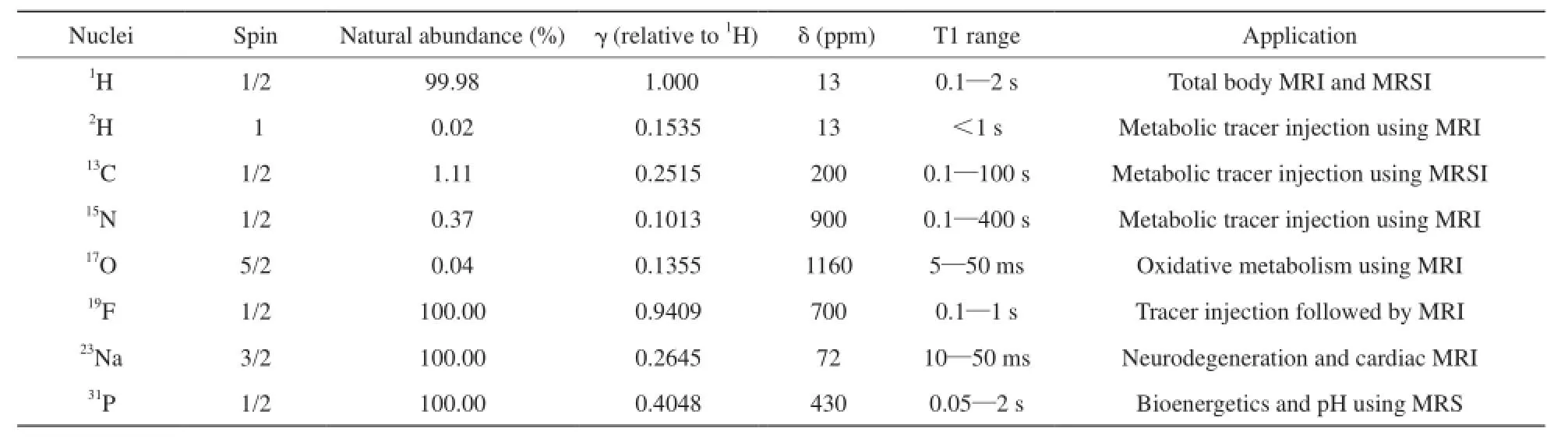
表1 生物醫學中應用的MR活躍核Tab. 1 MR active nuclei in biomedical applications
目前,一線的HP生物探針主要是以13C為主,包括[1-13C]丙酮酸、[2-13C]丙酮酸、13C-醋酸鹽、13C-碳酸氫鈉和13C-延胡索酸鹽等(表2)。本文也將主要介紹超極化13C在生物醫學的應用。丙酮酸在細胞代謝的中心作用使得[1-13C]丙酮酸成為最主要的HP生物探針,其T1時間長(>60 s),有希望廣泛用于臨床[13],它產生3種可用13CMR觀察的代謝中間產物:乳酸、丙氨酸和CO2,分別由乳酸脫氫酶(LDH)、丙氨酸氨基轉移酶(ALT)和丙酮酸脫氫酶復合物(PDH)介導,CO2可通過碳酸酐酶(CA)轉化為HCO3-(圖2)。[2-13C]丙酮酸可以觀察線粒體的代謝。因此,13C丙酮酸是HP磁共振技術中重要的生物探針,在腦、心臟、癌癥模型、內分泌疾病模型以及細胞培養等領域已取得了廣泛的應用,在臨床病人的試驗中也取得了重要結果。

表2 13C標記的超極化生物探針Tab. 2 Hyperpolarized13C-labelled bio-probes
3 超極化磁共振波譜
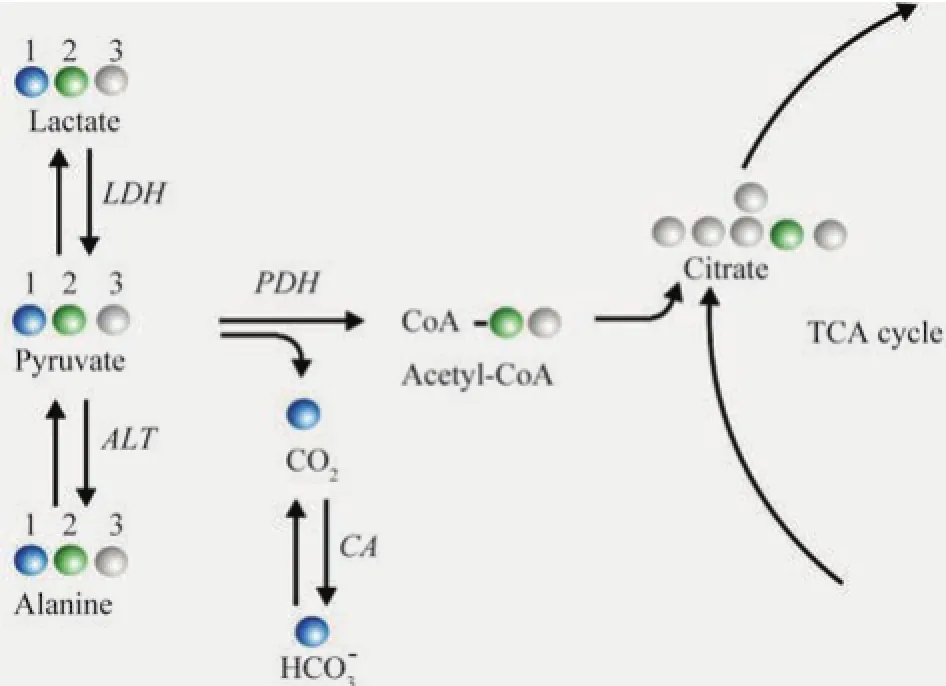
圖2 丙酮酸代謝途徑。丙酮酸分別通過乳酸脫氫酶(LDH)、丙氨酸氨基轉移酶(ALT)以及丙酮酸脫氫酶(PDH)催化為乳酸、丙氨酸以及乙酰CoA和CO2,乙酰CoA進入線粒體三羧酸(TCA)循環,CO2在碳酸酐酶(CA)作用下轉換為碳酸氫鹽。丙酮酸分子的碳原子色碼可以追蹤相應的代謝產物。例如當丙酮酸的第一個碳原子(藍色)被13C替換并被超極化后,磁共振波譜可以定量測得[1-13C]丙酮酸代謝為乳酸、丙氨酸或碳酸氫鹽的代謝通量Fig. 2 Pyruvate is transformed into lactate, alanine or acetyl-CoA and CO2. These processes are catalyzed by lactate dehydrogenase(LDH), alanine transaminase(ALT) and pyruvate dehydrogenase(PDH), respectively. Acetyl-CoA is transported into mitochondria to join in tricarboxylic acid(TCA) cycle. CO2is interconverted with bicarbonate catalyzed by carbonic anhydrase(CA). The atom color codes circles in the pyruvate molecule allow tracing the flux into the corresponding metabolites. For example if carbon atom number one (blue) in pyruvate is exchanged with13C and hyperpolarized then magnetic resonance spectroscopy allows quantification of the flux of [1-13C] pyruvate into the lactate, alanine or bicarbonate metabolites.
以HP[1-13C]丙酮酸為例分析HP生物探針在體內的代謝信息(圖3),在采集到的13C磁共振波譜不同化學位移代表不同的代謝產物,波峰下覆蓋面積的增減可用來檢測代謝的變化[14]。[1-13C]乳酸為糖酵解的終產物,糖無氧酵解過程加強時,乳酸含量增高,代表乳酸的MRS峰值會升高。[1-13C]碳酸氫鹽是有氧代謝的產物,有氧代謝減弱時其含量降低,代表碳酸氫鹽的MRS峰值會降低。

圖3 超極化13C丙酮酸和其代謝產物的MR波譜。波峰從左至右依次為乳酸(化學位移為183.2 ppm)、丙酮酸水合物(179.0 ppm)、丙氨酸(178.5 ppm)、丙酮酸(170.6 ppm)以及碳酸氫鹽(160.9 ppm)。圖片引用于文獻Magn Reson Med. 2015 Aug;74(2):558-563,并獲得許可Fig. 3 The MR spectra of HP-13C pyruvate and its metabolites. The spectra peaks are lactate(183.2 ppm), hydrate-pyruvate(179.0 ppm), alanine(178.5 ppm), pyruvate(170.6 ppm) and bicarbonate(160.9 ppm), respectively. Adapted from Magn Reson Med. 2015 Aug; 74(2): 558-563,with permission from John Wiley and Sons.
4 超極化磁共振設備
隨著超極化磁共振的廣泛應用,商業化的d-DNP極化器也應運而生。目前使用最廣泛的兩種極化器是針對體外實驗以及小動物實驗的HyperSense DNP極化器(Oxford instruments,UK)和由GE公司生產的安裝無菌設備擬為臨床使用的DNP偏振器,并將其命名為SPINLAB動態核極化器[4,15]。SPINLAB可以同時產生4個大劑量樣品,并安裝質量控制裝備以確保臨床的使用流程與生物兼容性,最近SPINLAB在加利福尼亞大學初次用于人體實驗并取得了成功[13]。目前,包括加利福尼亞大學在內,劍橋大學、多倫多Sunnybrook健康科學中心、紀念斯隆-凱特琳癌癥中心、美國國立衛生研究院、瑞士聯邦理工學院、牛津大學、奧胡斯大學等幾個國際站點已經安裝了SPINLAB設備。在丹麥奧胡斯大學MR中心,主要應用超極化磁共振技術在腫瘤細胞、糖尿病腎病、腦卒中和動脈粥樣硬化性心肌病等疾病模型中,并使用不同生物探針研究其代謝機制。
5 超極化磁共振波譜在生物醫學中的初步應用
5.1HP13C在腫瘤細胞培養、腫瘤動物模型以及與生物反應器的聯合應用
乳酸含量增加可被用來幫助區分腫瘤組織和正常組織[16-17]。在小鼠前列腺癌HP研究中發現,乳酸信號高低與腫瘤組織學分級具有強相關性,丙酮酸-乳酸交換通量可被用于腫瘤分級[18]。對于評估腫瘤的治療反應,HP[1-13C]丙酮酸MRS在前列腺癌和顱腦腫瘤治療后早期即可檢測到丙酮酸-乳酸轉化降低[19-20],但采用FDG-PET-18F攝取率成像方法檢測時,原發前列腺癌組織的攝取率低和背景攝取率高[21],癌細胞代謝反應觀察較困難,因此,HP丙酮酸有可能提供早期評估腫瘤治療效果的方法。HP丙酮酸也被證明是監測惡性膠質瘤和乳腺癌小鼠模型中PI3K 抑制劑LY294002的一種有價值的工具,PI3K通路抑制導致LDH活性降低從而減少HP丙酮酸轉換乳酸的信號[22]。
體外HP[1-13C]丙酮酸的代謝研究需要有能與磁共振相連接的組織培養系統,來確保實驗的再現性和穩定性,此系統稱之為“生物反應器”,它需要一個快速注射系統,具有調節流速重要參數的能力,并能維持磁場均勻性。Keshari KR 等使用HP13C丙酮酸聯合生物反應器研究腎癌細胞,發現可實時觀察代謝通路,并能控制氧化作用、流量、pH和底物等引起的微環境變化,這項研究揭示了MCT4轉運在疾病發生和疾病進展的重要性,而且MCT4介導調節乳酸轉運可用HP13C MRS來檢測[23]。在使用生物反應器培養人體組織切片代謝研究中,也證明了生物反應器平臺能在磁共振測量儀中保持組織活性,并觀察HP探針的代謝[24]。
HP13C延胡索酸鹽已在體外癌細胞和體內的腫瘤移植物經化療后被證明能水合成蘋果酸,且蘋果酸的產生水平和壞死水平相關,延胡索酸鹽活細胞攝取率低,但在細胞膜通透性屏障破壞的地方,可快速被細胞攝取并水合形成蘋果酸,是觀察壞死的理想標志物,腫瘤間隙中同時存在被釋放的延胡索酸酶,因此,HP13C延胡索酸被認為是腫瘤細胞壞死的早期標志物[25-27]。酸性環境介導腫瘤細胞遷移和侵入并影響抗腫瘤藥物的攝取,但尚無實用的方法對體內pH進行分布成像。HP H13CO3
-和13CO2可用來計算腫瘤動物模型細胞外pH的空間分布[28],因此,H13CO3-可提供一種非侵入性探測人體細胞外pH成像的方法,成為一種用來檢測疾病存在和對治療反應的通用方法。很多腫瘤存在支鏈氨基酸上調,在小鼠淋巴瘤細胞模型中注射HP[1-13C] 酮異己酸鹽在支鏈氨基酸轉移酶催化下產生[1-13C] 亮氨酸[29],因此,使用HP13C酮異己酸鹽可以探測支鏈氨基酸轉移酶的活性以及細胞內谷氨酸的濃度。另外,谷氨酰胺代謝的升高被假定為腫瘤生長和細胞增殖的標志,谷氨酰胺代謝的改變可能被用于識別肝硬化內肝細胞癌或者在不能重復活檢時幫助區分惡性和良性腫瘤。在體外肝癌細胞中已經證實[5-13C]谷氨酰胺在谷氨酰胺酶催化下實時轉換為[5-13C]谷氨酸[30]。
5.2HP13C在糖尿病的評估
糖尿病腎病是糖尿病晚期并發癥之一,也是引起晚期腎臟衰竭的主要原因之一。但其發病機制尚未完全探知,氧代謝紊亂引起的腎內組織低氧被認為是重要原因[31]。Laustsen C等使用HP[1-13C]丙酮酸 MRI觀察1型糖尿病早期的腎臟代謝改變[32],發現[1-13C]乳酸/[1-13C]丙酮酸比值在糖尿病腎臟中明顯升高,而[1-13C]碳酸氫鹽/[1-13C]丙酮酸比值未改變,腎臟耗氧增高,有效耗氧率降低。在不同氧濃度條件下,急性低氧時糖尿病腎臟[1-13C]丙酮酸向乳酸、丙氨酸轉化代謝增加,但未改變碳酸氫鹽通量;而在高氧濃度時乳酸水平正常[33]。這也許可以解釋為何居住在高海拔地區的糖尿病患者中腎病患者更多[34]。不規范的胰島素治療會增加腎臟負擔,腎臟會增加 [1-13C]丙酮酸的攝取,并同時增加無氧與有氧代謝的代謝通量(乳酸、丙氨酸、碳酸氫鹽信號上升),導致能量物質的消耗增加[35]。這提示對于胰島素依賴的糖尿病嚴格的血糖控制非常重要,血糖控制不佳時腎臟代謝紊亂依賴于能量基質的消耗,這或許預示針對糖尿病腎病的新治療靶點。
對于胰島素抵抗的2型糖尿病,過度的肝臟糖異生與糖原分解會引起血糖上升,HP[1-13C]丙酮酸波譜可以無創動態實時地測量體內肝臟的代謝改變[36]。糖尿病小鼠肝臟表現出更高信號的13C草酰乙酸、天冬氨酸與蘋果酸,與正常小鼠注射胰高血糖素糖異生代謝增加類似。二甲雙胍治療兩周后肝糖異生降低,13C標記的天冬氨酸與蘋果酸量下降,丙酮酸與天冬氨酸、蘋果酸的轉換率也下降,血糖水平下降,這與糖異生下調是一致的。[1-13C]丙酮酸可作為診斷糖尿病肝功能紊亂的生物標記物,幫助評定治療糖尿病藥物對肝臟代謝的影響,也可以更好理解糖尿病藥物的作用機制。HP13C代謝成像技術在糖尿病疾病模型中成功的運用,對臨床糖尿病本身以及并發癥的機制、治療以及管理有著積極的作用。
5.3HP13C評估心臟和腦部疾病
心肌氧化能量高達40%來源于血液中的葡萄糖和乳酸,通過其產生的丙酮酸進入三羧酸循環。已有研究顯示HP[1-13C]丙酮酸可以評估體內外心臟丙酮酸脫氫酶(PDH)含量和通量[37-38],以提供心肌活性的重要信息。目前超極化MRS多應用于評估心肌梗塞、心臟衰竭、心肌肥大及心臟腫瘤等疾病的代謝變化[39]。
Dodd等應用HP[1-13C]和[2-13C]丙酮酸評估大鼠心肌梗塞后的線粒體代謝變化[38]。心梗后第6周通過PDH產生的乙酰輔酶A含量正常,但其氧化減少(三羧酸循環減慢);心梗后第22周發現PDH含量與心臟射血分數顯著相關,乙酰輔酶A的產生及其氧化均減少。這預示著超極化MRS在評估心臟代謝方面具有重要的研究價值。
HP13C在腦卒中、腦腫瘤、神經退行性疾病及創傷性腦損傷等疾病中的應用前景廣闊[5]。Park 等用 HP13C丙酮酸評估大鼠腦膠質瘤模型的預后[17]。其13C-丙酮酸及其代謝產物13C-乳酸的信噪比均明顯高于正常腦組織,正常腦組織的血腦屏障(blood brain barrier,BBB)能夠限制丙酮酸進入腦細胞,而膠質瘤的BBB被破壞導致13C丙酮酸順利進入腦組織。BBB阻礙丙酮酸轉運限制了超極化MRS在腦部的研究,使其落后于在腫瘤學和心臟病學方面的研究。但Hurd等發現注射[1-13C]丙酮酸乙酯(親脂性丙酮酸衍生物)能夠比丙酮酸更快地跨越BBB且具有更高的極化比,腦組織內碳總量也顯著增高[40],這為超極化MRS在腦部研究開辟了新的方向。
5.4HP13C的首例人體應用
使用SPINLAB制備應用于人體的無菌HP探針需要過濾出二十碳五烯酸(eicosapentaenoic acid,EPA),完成溫度、pH值、探針濃度等質量監控。首例 [1-13C]丙酮酸MRI和MRS的臨床試驗在前列腺癌病人中得到成功應用[13]。臨床前期的研究表明,在前列腺癌動物模型中觀察到癌灶 [1-13C]乳酸升高,且隨著癌癥分期的增高,癌癥部位的[1-13C]乳酸/[1-13C]丙酮酸的比值隨之增高;而在得到有效治療后這一比值會降低[18,41-42]。這項臨床試驗研究首先證明:HP[1-13C]丙酮酸可以安全有效的運用于人體中,其次觀測到病灶出現明顯的[1-13C]乳酸峰,[1-13C]乳酸/[1-13C]丙酮酸的比值上升;而健康的前列腺組織和周圍的血管組織未出現或出現很低的[1-13C]乳酸峰。這一結果與臨床前期的實驗研究結果相吻合[18]。另一值得注意的是,對于一位活檢證實為前列腺雙側癌灶病人,分期檢查中常規T2WI、表觀擴散系數成像以及1H-MRS成像均只顯示了腺體右側的病變,而[1-13C]丙酮酸成像監測到腺體左右兩側均出現較高[1-13C]乳酸/[1-13C]丙酮酸信號比值的區域,后在MR引導下再活檢證實為雙側癌灶。這預示著[1-13C]丙酮酸代謝成像技術對無創性腫瘤診斷具有重要價值。另外,HP[1-13C]丙酮酸成像技術可以探測到雙邊癌癥這一驚奇發現,可能會成為癌癥緩慢生長類病人的一種特別重要的監控手段。
6 小結
超極化磁共振波譜能很好地探測13C且具有極高的靈敏性,HP13C生物探針能實時動態無創性地快速追蹤生物體內的代謝過程,得到關鍵酶的代謝信息,且無電離輻射的危險,可用于檢測臨床疾病模型的代謝改變與治療效果分析。前列腺癌病人的臨床試驗更是預示著[1-13C]丙酮酸應用于臨床疾病診斷以及更進一步監測治療效果的可能性。
[References]
[1] Cheng JL, Yang T. Application and development of magnetic resonance imaging in glioma. Chin J Magn Reson Imaging, 2014, 5(S1): 62-67.
程敬亮, 楊濤. 磁共振成像在腦膠質瘤中的應用及進展. 磁共振成像, 2014, 5(S1): 62-67.
[2] Jiang L, Liu W, Xiao CY, et al. The diagnosis value of1H-MRS quantitative analysis in brain parenchyma glioma grading. Chin J Magn Reson Imaging, 2015, 6(1): 15-20.
姜亮, 劉文, 肖朝勇, 等. 探討1H-MRS定量分析在腦實質區膠質瘤分級中的診斷價值. 磁共振成像, 2015, 6(1): 15-20.
[3] Overhauser AW. Polarization of nuclei in metals. Phys Rev, 1953, 92(2): 411-415.
[4] Ardenkjaer-Larsen JH, Fridlund B, Gram A, et al. Increase in signalto-noise ratio of>10000 times in liquid-state NMR. Proc Natl Acad Sci USA, 2003, 100(18): 10158-10163.
[5] Hurd RE, Yen YF, Chen A, et al. Hyperpolarized13C metabolic imaging using dissolution dynamic nuclear polarization. J Magn Reson Imag, 2012, 36(6): 1314-1328.
[6] Gallagher FA, Kettunen MI, Brindle KM. Biomedical applications of hyperpolarized13C magnetic resonance imaging. Prog Nucl Magn Reson Spectrosc 2009, 55(4): 285-295.
[7] Comment A, Merritt ME. Hyperpolarized magnetic resonance as a sensitive detector of metabolic function. Biochemistry, 2014, 53(47): 7333-7357.
[8] Meier S, Jensen PR, Karlsson M, et al. Hyperpolarized NMR probes for biological assays. Sensors (Basel), 2014, 14(1): 1576-1597.
[9] Keshari KR, Wilson DM. Chemistry and biochemistry of13C hyperpolarized magnetic resonance using dynamic nuclear polarization. Chem Soc Rev, 2014, 43(5): 1627-1659.
[10] Kurhanewicz J, Vigneron DB. Advances in MR spectroscopy of the prostate. Magn Reson Imaging Clin N Am, 2008, 16(4): 697-710.
[11] Nelson SJ, Graves E, Pirzkall A, et al. In vivo molecular imaging for planning radiation therapy of gliomas: an application of1H MRSI. J MagnReson Imaging, 2002, 16(4): 464-476.
[12] Sardanelli F, Fausto A, Podo F. MR spectroscopy of the breast. Magnetic Resonance Imaging Clinics of North America, 1994, 2(4): 691-703.
[13] Nelson SJ, Kurhanewicz J, Vigneron DB, et al. Metabolic imaging of patients with prostate cancer using hyperpolarized [1-13C]pyruvate. SciTransl Med. 2013, 5(198): 108.
[14] Laustsen C, Hansen ES, Kjaergaard U, et al. Acute porcine renal metabolic effect of endogastric soft drink administration assessed with hyperpolarized [1-(13)C]pyruvate. Magn Reson Med, 2015, 74(2): 558-563.
[15] Ardenkjaer-Larsen JH, Leach AM, Clarke N, et al. Dynamic nuclear polarization polarizer for sterile use intent. NMR Biomed, 2011, 24(8): 927-932.
[16] Golman K, Zandt RI, Lerche M, et al. Metabolic imaging by hyperpolarized13C magnetic resonance imaging for in vivo tumor diagnosis. Cancer Res, 2006, 66(22): 10855-10860.
[17] Park I, Larson PE, Zierhut ML, et al. Hyperpolarized13C magnetic resonance metabolic imaging: application to brain tumors. Neurooncology, 2010, 12(2): 133-144.
[18] Albers MJ, Robert B, Chen AP. Hyperpolarized13C lactate, pyruvate, and alanine: noninvasive biomarkers for prostate cancer detection and grading. Cancer Res, 2008, 68(20): 8607-8615.
[19] Zierhut ML, Yen YF, Chen AP, et al. Kinetic modeling of hyperpolarized13C1-pyruvate metabolism in normal rats and TRAMPmice. J MagnReson, 2010, 202(1): 85-92.
[20] Day SE, Kettunen MI, Krishna MC, et al. Detecting response of rat C6 glioma tumors to radiotherapy using hyperpolarized [1-13C]pyruvate and13C magnetic resonance spectroscopic imaging. MagnReson Med, 2011, 65(2): 557-563.
[21] Kanamaru H, Oyama N, Akino H, et al. Evaluation of prostate cancer using FDG-PET. Hinyokika Kiyo, 2000, 46(11): 851-853.
[22] Ward CS, Venkatesh HS, Chaumeil MM, et al. Noninvasive detection of target modulation following phosphatidylinositol 3-kinase inhibition using hyperpolarized13C magnetic resonance spectroscopy. Cancer Res, 2010, 70(4): 1296-1305.
[23] Keshari KR, Sriram R, Koelsch BL, et al. Hyperpolarized13C-pyruvate magnetic resonance reveals rapid lactate export in metastatic renal cell carcinomas. Cancer Res, 2013, 73(2): 529-538.
[24] Keshari KR, Sriram R, Van Criekinge M, et al. Metabolic reprogramming and validation of hyperpolarized13C lactate as a prostate cancer biomarker using ahuman prostate tissue slice culture bioreactor. Prostate, 2013, 73(11): 1171-1181.
[25] Gallagher FA, Kettunen MI, Hu DE, et al. Production of hyperpolarized [1,4-13C2]malate from [1,4-13C2]fumarate is a marker of cell necrosis and treatment response in tumors. Proc Natl AcadSci U S A, 2009, 106(47): 19801-19806.
[26] Witney TH, Kettunen MI, Hu DE, et al. Detecting treatment response in a model of human breast adenocarcinoma using hyperpolarised [1-13C]pyruvate and [1,4-13C2]fumarate. Br J Cancer, 2010, 103(9): 1400-1406.
[27] Bohndiek SE, Kettunen MI, Hu DE, et al. Detecting tumor response to a vascular disrupting agent using hyperpolarized13C magnetic resonance spectroscopy. Mol Cancer Ther, 2010, 9(12): 3278-3288.
[28] Gallagher FA, Kettunen MI, Day SE, et al. Magnetic resonance imaging of pH in vivo using hyperpolarized13C-labelled biocarbonate. Nature, 2008, 453(7197): 940-943.
[29] Karlsson M, Jensen PR, in 't Zandt R, et al. Imaging of branched chain amino acid metabolism in tumors with hyperpolarized13C ketoisocaproate. Int J Cancer, 2010, 127(3): 729-736.
[30] Gallagher FA, Kettunen MI, Day SE, et al.13C MR spectroscopy measurements of glutaminase activity in human hepatocellular carcinoma cells using hyperpolarized13C-labeled glutamine. Magn Reson Med, 2008, 60(2): 253-257.
[31] Hansell P, Welch WJ, Blantz RC, et al. Determinants of kidney oxygen consumption and their relationship to tissue oxygen tension in diabetes and hypertension. ClinExpPharmacol Physiol, 2013, 40(2): 123-137.
[32] Laustsen C, ?stergaard JA, Lauritzen MH, et al. Assessment of early diabetic renal changes with hyperpolarized [1-13C]pyruvate. Diabetes Metab Res Rev, 2013, 29(2): 125-129.
[33] Christoffer L, Lycke S, Palm F, et al. High altitude may alter oxygen availability and renal metabolism in diabetics as measured by hyperpolarized [1-13C]pyruvate magnetic resonance imaging. Kidney Int, 2014, 86(1): 67-74.
[34] Hochman ME, Watt JP, Reid R, et al. The prevalence and incidence of end-stage renal disease in Native American adults on the Navajo reservation. Kidney Int, 2007, 71(9): 931-937.
[35] Laustsen C, Lips? K, Ostergaard JA, et al. Insufficient insulin administration to diabetic rats increases substrate utilization and maintains lactate production in the kidney. Physiol Rep, 2014, 2(12): 12233.
[36] Lee P, Leong W, Tan T, et al. In vivo hyperpolarized carbon-13 magnetic resonance spectroscopy reveals increased pyruvate carboxylase flux in an insulin-resistant mouse model. Hepatology, 2013, 57(2): 515-524.
[37] Malloy CR, Merritt ME, Sherry AD. Could13C MRI assist clinical decision-making for patients with heart disease?. NMR Biomed, 2011, 24(8): 973-979.
[38] Dodd MS, Atherton HJ, Carr CA, et al. Impaired in vivo mitochondrial Krebs cycle activity after myocardial infarction assessed using hyperpolarized magnetic resonance spectroscopy. CircCardiovasc Imaging, 2014, 7(6): 895-904.
[39] Rider OJ, Tyler DJ. Clinical implications of cardiac hyperpolarized magnetic resonance imaging. J Cardiovasc Magn Reson, 2013, 15(20): 93.
[40] Hurd RE, Yen YF, Mayer D, et al. Metabolic imaging in the anesthetized rat brain using hyperpolarized (1-13C) pyruvate and (1-13C) ethyl pyruvate.Magn Reson Med, 2010, 63(5): 1137-1143.
[41] Day SE, Kettunen MI, Gallagher FA, et al. Detecting tumor response to treatment using hyperpolarized13C magnetic resonance imaging and spectroscopy. Nat Med, 2007, 13(11): 1382-1387.
[42] Dafni H, Larson PE, Hu S, et al. Hyperpolarized13C spectroscopic imaging informs on hypoxiainducible factor-1 and myc activity downstream of platelet-derived growth factor receptor. Cancer Res, 2010, 70(19): 7400-7410.

【通訊作者簡介】
Hans St?dkilde-J?rgensen,丹麥奧胡斯大學醫院(丹麥規模最大的醫院,歐洲規模最大的醫院之一)磁共振研究中心主任,奧胡斯大學教授、醫學博士,歐盟COST項目生物醫學和生物科學委員會前主席,丹麥生物醫學工程學會前主席,營養研究方面享受國家重要津貼。Hans St?dkilde-J?rgensen教授團隊在全球率先開展了超極化磁共振技術的臨床試驗研究,在腫瘤細胞、糖尿病腎病、腦卒中和動脈粥樣硬化性心肌病等疾病研究中做了大量工作,并使用不同生物探針研究其代謝機制。
Principle and application of hyperpolarized magnetic resonance spectroscopy
QI Hai-yun1, ZHANG Xiao-lu1, XU Ya-fang1, WEN Jian-guo2, XU Yu-ming2, CHENG Jing-liang2, Albert P. Chen3, Lotte Bonde Bertelsen1, Steffen Ringgaard1, Christoffer Lausten1, Hans St?dkilde-J?rgensen1*1MR Research Centre, Department of Clinical Medicine, Aarhus University, Aarhus, Denmark
2The First Affiliated Hospital of Zhengzhou University, Zhengzhou 450052 China
3GE Healthcare, Toronto Canada QI Hai-yun , ZHANG Xiao-lu and XU Ya-fang contributed equally to this article
*
Hans St?dkilde –J?rgensen, E-mail: hsj@mr.au.dk Received 7 Sep 2015, Accepted 2 Nov 2015
The polarization of nuclear spins can be enhanced above the thermal equilibrium polarization with dynamic nuclear polarization (DNP) to achieve signalnoise ratio improvement of greater than 10,000-fold in magnetic resonance, this technique is denoted "hyperpolarization"(HP). Dissolution DNP is allowed the enhanced sample to be transferred from the polarizer and injected in vivo, providing realtime measurement of perfusion, metabolite transport, and metabolism, which break the constraint of traditional magnetic resonance in detecting cellular metabolism in real time in vivo. The definition and introduction to the DNP technique, hyperpolarized bio-probes and applications, and analysis and interpretation of results from magnetic resonance images/spectroscope in pre-clinical and clinical areas were reviewed.
Hyperpolarization; Dynamic nuclear polarization; Bio-probes; Bioreactor; Magnetic resonance spectroscopy; Magnetic resonance imaging
Hans St?dkilde–J?rgensen,E-mail:hsj@mr.au.dk
2015-09-07
R445.2;O441.2
A
10.3969/j.issn.1674-8034.2015.12.001
接受日期:2015-11-02
齊海云, 張曉璐, 徐雅芳, 等. 超極化磁共振波譜的原理和應用. 磁共振成像, 2015, 6(12): 881-887.

