氨法脫硫中亞硫酸銨的氧化工藝參數(shù)
顧曉婧,何仁初,萬 皓,范向東
(1.上海大學(xué)機(jī)電工程與自動化學(xué)院,上海 200072;2上海大學(xué)環(huán)境與化學(xué)工程學(xué)院,上海 200444)
氨法脫硫中亞硫酸銨的氧化工藝參數(shù)
顧曉婧1,何仁初1,萬皓2,范向東2
(1.上海大學(xué)機(jī)電工程與自動化學(xué)院,上海 200072;2上海大學(xué)環(huán)境與化學(xué)工程學(xué)院,上海 200444)
通過改變亞硫酸銨初始濃度、硫酸銨初始濃度、反應(yīng)溫度、混合液pH值、空氣流量、催化劑濃度,研究氨法脫硫中亞硫酸銨氧化率的變化.結(jié)果表明:(NH4)2SO3的濃度與(NH4)2SO3的氧化率成反比關(guān)系;初始(NH4)2SO4濃度越大,(NH4)2SO3氧化率越低;當(dāng)反應(yīng)溫度為40~60?C時(shí),隨著溫度的升高,(NH4)2SO3的氧化率不斷增大;(NH4)2SO3氧化率受混合液pH值的影響,較合適的pH值為5.5;當(dāng)空氣流量為100~400 L/h時(shí),隨著空氣流量的增大,(NH4)2SO3的氧化率增大;隨著催化劑CoSO4濃度升高,(NH4)2SO3氧化率增大.結(jié)合氨法脫硫工程實(shí)例考慮,當(dāng)反應(yīng)溫度控制在50?C左右,(NH4)2SO3采用低濃度氧化,混合液pH值為5.5,空氣流量為300 L/h,催化劑濃度較高時(shí),(NH4)2SO3的氧化率較高.
亞硫酸銨;氨法;氧化率
我國已是SO2排放量的世界第一大國,面臨著來自國內(nèi)外巨大的減排壓力[1-2].如何有效控制工業(yè)燃煤煙氣中的SO2排放量是當(dāng)前刻不容緩的環(huán)保任務(wù)[3-4].煙氣脫硫技術(shù)是控制燃煤SO2排放的必然選擇,也是目前國內(nèi)外普遍采用的控制SO2排放的主要手段[5-6],并得到了有效的大規(guī)模商業(yè)化應(yīng)用[7-9].我國無論是投運(yùn)建成還是正在設(shè)計(jì)中的大型火電機(jī)組,其中的高硫煙氣脫硫設(shè)備幾乎全部采用石灰石-石膏法脫硫工藝.相比石灰石-石膏法脫硫工藝,氨法脫硫具有裝置阻力小、脫硫效率高、脫硫產(chǎn)物可資源化、無二次污染等優(yōu)點(diǎn).但目前國內(nèi)的氨法脫硫技術(shù)尚不成熟,氨成本較高、脫硫過程中氨逃逸、吸收液利用率不高等缺點(diǎn)阻礙了氨法脫硫工藝的發(fā)展與應(yīng)用.
亞硫酸銨((NH4)2SO3)的氧化是制約氨法脫硫技術(shù)發(fā)展的一個(gè)重要因素,也是一個(gè)值得深入探討的課題[10-12].如何經(jīng)濟(jì)高效地將亞硫酸銨轉(zhuǎn)為硫酸銨((NH4)2SO4),是氨法脫硫工藝實(shí)現(xiàn)工業(yè)化的關(guān)鍵[13].(NH4)2SO3溶液的氧化可以減少脫硫塔的注氨量,有效控制吸收塔出口煙氣中的逸氨及(NH4)2SO4氣溶膠,避免二次污染.
本實(shí)驗(yàn)通過改變工藝條件,尋求適合(NH4)2SO3氧化的工藝參數(shù),其中主要通過改變(NH4)2SO3初始濃度、(NH4)2SO4初始濃度、反應(yīng)溫度、混合液pH值、空氣流量和催化劑硫酸鈷(CoSO4)濃度來研究(NH4)2SO3的氧化問題.在實(shí)驗(yàn)過程中,(NH4)2SO3被氧化成(NH4)2SO4,因此通過測定氧化反應(yīng)前后亞硫酸根離子的含量來表示其氧化率,其中亞硫酸根離子的含量用碘量法滴定來測量.碘量法中碘液的濃度用標(biāo)準(zhǔn)溶液Na2S2O3標(biāo)定,標(biāo)定以重鉻酸鉀(K2Cr2O7)為基準(zhǔn)物并采用間接法[14].
1 氨法脫硫基本原理
氨法脫硫是氣液兩相過程,當(dāng)煙氣中的吸收質(zhì)和吸收劑兩相接觸時(shí),氣體向吸收劑轉(zhuǎn)移,其實(shí)質(zhì)是(NH4)2SO3-NH4HSO3混合液吸收煙氣中的SO2.
氨法脫硫工藝中主要發(fā)生的化學(xué)反應(yīng)為

由反應(yīng)式(1)~(4)可以看出,對SO2的吸收起主要作用的是(NH4)2SO3.因此,隨著反應(yīng)的進(jìn)行,NH4SO3的濃度會逐漸下降,而為了保持溶液的吸收能力,可向系統(tǒng)中注入氨水使NH4HSO3轉(zhuǎn)化為(NH4)2SO3.另外,(NH4)2SO3可被氧化風(fēng)機(jī)鼓入的空氣強(qiáng)制氧化,最終生成(NH4)2SO4.
2 實(shí)驗(yàn)
2.1實(shí)驗(yàn)藥品
亞硫酸銨(分析純,國藥集團(tuán)化學(xué)試劑有限公司);碘(分析純,國藥集團(tuán)化學(xué)試劑有限公司);碘化鉀(分析純,國藥集團(tuán)化學(xué)試劑有限公司);硫酸銨(上海埃彼化學(xué)試劑有限公司);硫酸(分析純,國藥集團(tuán)化學(xué)試劑有限公司);重鉻酸鉀(分析純,國藥集團(tuán)化學(xué)試劑有限公司);甲基橙(分析純,上海豪申化學(xué)試劑有限公司);甲基紅-靛藍(lán)混合指示劑(分析純,上海豪申化學(xué)試劑有限公司);過氧化氫(分析純,上海漢光化學(xué)試劑有限公司).
2.2實(shí)驗(yàn)裝置及流程
實(shí)驗(yàn)裝置如下:恒溫磁力攪拌器(鞏義市予華儀器有限責(zé)任公司);微孔曝氣管(上海川源機(jī)械工程有限公司);無油空氣壓縮機(jī)(上海捷豹壓縮機(jī)制造有限公司);溫度計(jì)(華東壓力表有限公司);流量計(jì)(浙江余姚市聞泰儀表有限公司).
實(shí)驗(yàn)流程如圖1所示.

圖1 (NH4)2SO3氧化實(shí)驗(yàn)流程Fig.1 Experimental procedure for the oxidation of(NH4)2SO3
2.3實(shí)驗(yàn)方法
按實(shí)驗(yàn)要求連接好實(shí)驗(yàn)裝置,并將微孔曝氣管和恒溫磁力攪拌器的轉(zhuǎn)子置于反應(yīng)器中.將配制好的不同濃度的(NH4)2SO3溶液置于反應(yīng)器中,開啟恒溫磁力攪拌器,待(NH4)2SO3溶液穩(wěn)定到所需溫度時(shí),開啟空氣壓縮機(jī),調(diào)節(jié)流量計(jì)和轉(zhuǎn)子轉(zhuǎn)速,通過微孔曝氣管向(NH4)2SO3溶液中曝氣,進(jìn)行氧化反應(yīng),實(shí)驗(yàn)過程中,每隔1 h,對反應(yīng)溶液取樣進(jìn)行測定,計(jì)算(NH4)2SO3的氧化率.
3 實(shí)驗(yàn)結(jié)果與討論
3.1(NH4)2SO3初始濃度對(NH4)2SO3氧化率的影響
在混合溶液的pH值5.5、空氣流量300 L/h、氧化反應(yīng)溫度50?C的條件下,通過改變(NH4)2SO3的初始濃度,考察(NH4)2SO3濃度對(NH4)2SO3氧化率的影響.實(shí)驗(yàn)結(jié)果如圖2所示.
由圖2可以看出,隨著(NH4)2SO3濃度的增大,(NH4)2SO3的氧化率不斷降低,二者呈反比關(guān)系.這是因?yàn)殡S著(NH4)2SO3濃度的增大,溶液的黏度和密度也隨之增大,液膜阻力變大,傳質(zhì)速率減小,導(dǎo)致(NH4)2SO3的氧化率降低.當(dāng)(NH4)2SO3濃度0.5 mol/L、氧化時(shí)間8 h時(shí),(NH4)2SO3的氧化率高達(dá)95%;而當(dāng)(NH4)2SO3濃度1.5 mol/L、氧化時(shí)間8 h時(shí),(NH4)2SO3的氧化率僅為30%.因此,工業(yè)生產(chǎn)中應(yīng)選用較低濃度的(NH4)2SO3進(jìn)行氧化.呂早生等[15]的研究結(jié)果也表明:低濃度(NH4)2SO3較易氧化;(NH4)2SO3濃度越高,氧化越困難.
3.2(NH4)2SO4初始濃度對(NH4)2SO3氧化率的影響
在(NH4)2SO3初始濃度0.5 mol/L、混合溶液pH值5.5、空氣流量300 L/h、氧化反應(yīng)溫度50?C的條件下,通過改變(NH4)2SO4的初始濃度,考察(NH4)2SO3的氧化率隨時(shí)間的變化.實(shí)驗(yàn)結(jié)果如圖3所示.

圖2 不同(NH4)2SO3濃度下(NH4)2SO3氧化率隨時(shí)間的變化Fig.2 Variations of the oxidation rate of(NH4)2SO3with time at different concentrations of(NH4)2SO3
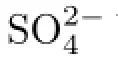

圖3 不同(NH4)2SO4濃度下(NH4)2SO3氧化率隨時(shí)間的變化Fig.3 Variations of the oxidation rate of(NH4)2SO3with time at different concentrations of(NH4)2SO4
3.3溫度對(NH4)2SO3氧化率的影響
在混合溶液的pH值5.5、空氣流量300 L/h、(NH4)2SO3初始濃度0.5 mol/L的條件下,通過調(diào)節(jié)反應(yīng)溫度,考察溫度對(NH4)2SO3氧化率的影響.實(shí)驗(yàn)結(jié)果如圖4所示.
由圖4可知,在其他條件不變的情況下,隨著反應(yīng)溫度的升高,(NH4)2SO3的氧化率逐漸增大.當(dāng)反應(yīng)溫度40?C、反應(yīng)時(shí)間8 h時(shí),(NH4)2SO3的氧化率僅為60%;當(dāng)反應(yīng)溫度50?C、反應(yīng)時(shí)間6 h時(shí),(NH4)2SO3的氧化率即達(dá)60%,并且8 h后(NH4)2SO3的氧化率高達(dá)87%;而當(dāng)反應(yīng)溫度60?C、反應(yīng)時(shí)間8 h時(shí),(NH4)2SO3的氧化率高達(dá)97%.這是因?yàn)椋瑴囟鹊纳咭环矫媸沟梅肿舆h(yuǎn)動加快,提高了O2的溶解能力,從而提高了氧化反應(yīng)的速率;另一方面,根據(jù)Arrehenius公式,溫度的升高使得反應(yīng)速率加快,促進(jìn)了化學(xué)反應(yīng)的正向進(jìn)行.
另外,考慮到氨法脫硫工程實(shí)例中,當(dāng)鍋爐煙氣的溫度為140?C以上時(shí)需采用換熱器等進(jìn)行降溫,使(NH4)2SO3的氧化溫度一般控制在50?C左右.因此,本實(shí)驗(yàn)選擇反應(yīng)溫度為50?C.

圖4 不同溫度下(NH4)2SO3氧化率隨時(shí)間的變化Fig.4 Variations of the oxidation rate of(NH4)2SO3with time at different temperatures
3.4混合溶液pH值對(NH4)2SO3氧化率的影響
在(NH4)2SO3初始濃度0.5 mol/L、空氣流量300 L/h、氧化反應(yīng)溫度50?C的條件下,通過改變混合溶液的pH值,對(NH4)2SO3進(jìn)行氧化實(shí)驗(yàn).(NH4)2SO3的氧化率隨時(shí)間的變化如圖5所示.

圖5 不同pH值下(NH4)2SO3氧化率隨時(shí)間的變化Fig.5 Variations of the oxidation rate of(NH4)2SO3with time at different pH values
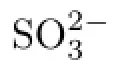
3.5空氣流量對(NH4)2SO3氧化率的影響
在(NH4)2SO3的初始濃度0.5 mol/L、混合溶液pH值5.5、氧化反應(yīng)溫度50?C的條件下,通過改變空氣流量,考察空氣流量對(NH4)2SO3氧化率的影響.實(shí)驗(yàn)結(jié)果如圖6所示.
從圖6可以看出,在其他條件不變的情況下,隨著空氣流量的增大,(NH4)2SO3的氧化率不斷增大.當(dāng)空氣流量為100,200 L/h時(shí),(NH4)2SO3的氧化率達(dá)到80%左右所需時(shí)間為5 h;而當(dāng)空氣流量為300,400 L/h時(shí),反應(yīng)時(shí)間僅4 h,(NH4)2SO3的氧化率即可達(dá)到90%以上.這是因?yàn)檠鯕庠诨旌先芤褐械娜芙舛群艿停?dāng)空氣流量增大時(shí),氣液流動趨于紊亂,液相中的氧含量就越多,進(jìn)而促進(jìn)了反應(yīng)的進(jìn)行,使得(NH4)2SO3氧化率增大;但當(dāng)空氣流量增大到一定值后,液相氧含量趨向飽和,空氣流量的增大對(NH4)2SO3的氧化率影響不大.綜合考慮,本實(shí)驗(yàn)中空氣流量采用300 L/h.
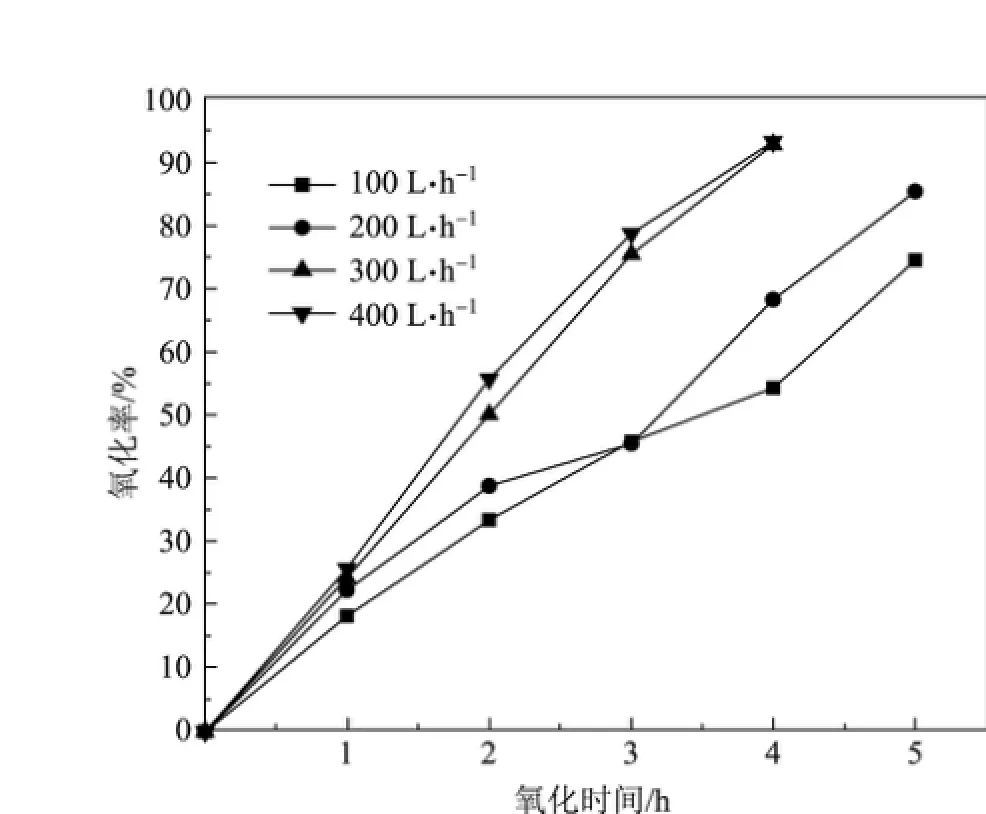
圖6 不同空氣流量下(NH4)2SO3的氧化率隨時(shí)間的變化Fig.6 Variations of the oxidation rate of(NH4)2SO3with time at different air flows
3.6催化劑硫酸鈷(CoSO4)對(NH4)2SO3氧化率的影響
過渡金屬對(NH4)2SO3的氧化反應(yīng)有催化作用[16].因此,本實(shí)驗(yàn)以硫酸鈷(CoSO4)為催化劑,在(NH4)2SO3初始濃度0.5 mol/L、反應(yīng)溫度50?C、空氣流量300 L/h、pH值5.5的條件下,考察催化劑硫酸鈷的濃度對(NH4)2SO3氧化率的影響.實(shí)驗(yàn)結(jié)果如圖7所示.
由圖7可以看出,當(dāng)CoSO4的濃度為0.001~0.003 mol/L時(shí),(NH4)2SO3的氧化反應(yīng)速率較慢,達(dá)到90%的轉(zhuǎn)化率約需8 h.當(dāng)CoSO4的濃度大于0.005 mol/L時(shí),(NH4)2SO3的氧化速率較大,反應(yīng)4 h時(shí)轉(zhuǎn)化率就已經(jīng)達(dá)到60%以上,而反應(yīng)6 h時(shí),轉(zhuǎn)化率達(dá)到90%以上.因此,(NH4)2SO3的氧化反應(yīng)速率隨著催化劑濃度的升高而逐漸增大.

圖7 不同硫酸鈷濃度下(NH4)2SO3氧化率隨時(shí)間的變化Fig.7 Variations of the oxidation rate of(NH4)2SO3with reaction time at different concentrations of CoSO4
4 結(jié)束語
本工作研究了(NH4)2SO3的初始濃度、(NH4)2SO4的初始濃度、反應(yīng)溫度、混合溶液的pH值、空氣流量和催化劑濃度對(NH4)2SO3的氧化率的影響,研究結(jié)果表明:(NH4)2SO3的濃度與(NH4)2SO3的氧化率成反比關(guān)系,低濃度的(NH4)2SO3易氧化;(NH4)2SO4的初始濃度越大,(NH4)2SO3的氧化率越低;隨著溫度的升高,(NH4)2SO3的氧化率不斷增大;空氣流量增大,(NH4)2SO3的氧化率增大;催化劑的濃度越高,(NH4)2SO3的氧化率越大.綜合考慮,本工作建議的工藝參數(shù)如下:較低濃度的(NH4)2SO3和(NH4)2SO4,反應(yīng)溫度為50?C,混合溶液pH值為5.5,空氣流量為30 L/h,較高濃度的催化劑CoSO4.
[1]王浩,陳書健,王永生,等.淺談FCL氨法脫硫技術(shù)在小型燃煤鍋爐煙氣脫硫中的應(yīng)用[J].電力環(huán)境保護(hù),2009,25(1):24-26.
[2]趙希正.電力行業(yè)節(jié)能減排的現(xiàn)狀及對策[J].中國核工業(yè),2007(4):11-12.
[3]Liu Y,Bisson T M,Yang H Q,et al.Recent developments in novel sorbents for flue gas clean up[J].Fuel Processing Technology,2010,91(10):1175-1197.
[4]Ogenga D O,Mbarawa M M,Lee K T,et al.Sulphur dioxide removal using South African limestone/siliceous materials[J].Fuel,2010,89(9):2549-2555.
[5]隋建才,杜云貴,劉藝,等.我國煙氣脫硫技術(shù)現(xiàn)狀與建議[J].能源技術(shù),2008,29(5):277-280.
[6]Hansen B B,F(xiàn)ogh F,Knudsen N O,et al.Performance of a wet flue gas desulfurization pilot plant under oxy-fuel conditions[J].Industral&Engineering Chemistry Research,2011,50(8):4238-4244.
[7]Gao X,Ding H L,Du Z,et al.Gas-liquid absorption reaction between(NH4)2SO3solution and SO2for ammonia-based wet flue gas desulfurization[J].Applied Energy,2010,87(8):2647-2651.
[8]梁高.氨法脫硫在熱電廠中應(yīng)用[J].能源環(huán)境保護(hù),2004,18(4):34-35.
[9]Xu G W,Guo Q M,Kaneko T,et al.A new semi-dry desulfurization process using a powderparticle spouted bed[J].Advances in Environmental Research,2000,4(1):9-18.
[10]魏月琴,肖文德.低濃度亞硫酸銨氧化動力學(xué)的研究[J].化學(xué)世界,2007,9:534-537.
[11]Hu X T,Zhu T L,Jiang X D,et al.A pilot investigation on oxidation of ammonium sulfite by streamer corona plasma[J].Chemical Engineering Journal,2008,139(3):469-474.
[12]葉奕森.硫氮污染物的控制對策及治理技術(shù)[M].北京:中國環(huán)境科學(xué)出版社,1994.
[13]王春玉,李紅英,薛士科.煙氣脫硫技術(shù)綜合性能評價(jià)及方案選擇[J].廣東化工,2009,36(8):139-140.
[14]武漢大學(xué).分析化學(xué)實(shí)驗(yàn)[M].4版.北京:高等教育出版社,2001:202-206.
[15]呂早生,秦峰.空氣催化氧化亞硫酸銨制備硫酸銨[J].化學(xué)與生物工程,2007,24(8):18-20.
[16]柳海剛,彭健,葉世超.亞硫酸銨催化氧化實(shí)驗(yàn)研究[J].廣東化工,2011,38(3):67-68.
本文彩色版可登陸本刊網(wǎng)站查詢:http://www.journal.shu.edu.cn
Process parameters of ammonium sulfite oxidation in ammonia desulfurization technology
GU Xiao-jing1,HE Ren-chu1,WAN Hao2,F(xiàn)AN Xiang-dong2
(1.School of Mechatronic Engineering and Automation,Shanghai University,Shanghai 200072,China;2.School of Environmental and Chemical Engineering,Shanghai University,Shanghai 200444,China)
The influence of affecting factors on the oxidation rate of(NH4)2SO3including concentration of(NH4)2SO3,concentration of(NH4)2SO4,temperature,pH value,air flow rate and concentration of CoSO4were studied.The results showed that the oxidation rate of(NH4)2SO3is lowered with the increase of initial concentration of(NH4)2SO3.It is the same as concentration of(NH4)2SO4.From 40?C to 60?C,(NH4)2SO3oxidation rate increases with the increase of reaction temperature.The(NH4)2SO3oxidation rate is also influenced by the pH value of the mixed solution,with the most preferred value being 5.5.When the air flow rate is within 100~400 L/h and with increase of air flow,(NH4)2SO3oxidation rate increases.Taking into account the ammonia desulfurization project,the most appropriate process parameters are:reaction temperature at about 50?C,(NH4)2SO3at low concentration,the pH value of mixed solution at 5.5,air flow rate at 300 L/h and CoSO4at high concentration.
ammonium sulfite;ammonia method;oxidation rate
X 511;X 701.3
A
1007-2861(2015)06-0701-08
10.3969/j.issn.1007-2861.2014.03.009
2014-05-09
國家高技術(shù)研究發(fā)展計(jì)劃(863計(jì)劃)資助項(xiàng)目(2009AA064102)
顧曉婧(1986—),女,助理實(shí)驗(yàn)師,研究方向?yàn)闊煔饷摿蛎撓醯?E-mail:guxiaojing@shu.edu.cn

