毒死蜱的環境生物學效應分析
余凱敏 馮為民 李國超 張家禹 劉麗麗 閆艷春
(中國農業科學院研究生院,北京 100081)
毒死蜱的環境生物學效應分析
余凱敏 馮為民 李國超 張家禹 劉麗麗 閆艷春
(中國農業科學院研究生院,北京100081)
高毒有機磷農藥禁用以后,毒死蜱作為其替代品逐漸開始大規模應用。毒死蜱在水中降解緩慢,因此在水中的殘留會對水生生物及其他生物造成潛在危害。為探究低濃度毒死蜱的內分泌干擾效應,使用流式細胞儀分析了其對人子宮內膜癌細胞HEC-1B生長周期的影響。為探究高濃度毒死蜱的生物毒性,將斑馬魚胚胎暴露在不同濃度的毒死蜱(0、1.0、2.0、3.0和4.0 ppm)中60 h,發現毒死蜱能導致斑馬魚胚胎的死亡和嚴重畸形,并且胚胎存活率與處理濃度呈負相關,畸形率與處理濃度呈正相關。最后,檢測了毒死蜱處理后斑馬魚胚胎中5種神經系統發育相關基因的表達情況。結果表明,低濃度毒死蜱具有內分泌干擾效應,高濃度毒死蜱會影響斑馬魚神經系統的正常發育。
毒死蜱;環境生物學效應;斑馬魚胚胎;神經發育毒性;內分泌干擾效應
毒死蜱是一種世界范圍內廣泛使用的有機磷殺蟲劑,早在1965年毒死蜱就被引入美國市場并且廣泛應用于農業生產和家庭害蟲的防治[1]。2008年1月,我國政府徹底禁止了對硫磷等5種高毒有機磷農藥的生產和使用,毒死蜱作為高毒有機磷農藥的替代品應用日益廣泛[2]。毒死蜱的大規模應用,也使其逐漸成為人體健康和環境污染研究領域的重點關注對象。盡管毒死蜱屬于中等毒性農藥,但是其對多數水生生物仍具有較高毒性,一些發達國家已經開始禁用或者限制使用毒死蜱[3]。
農作物病蟲害防治過程中,使用的農藥大部分會進入農田土壤,并且通過滲透、排水等方式轉移至地下水或河流,造成水體污染[4]。有研究指出,在相對集中的玉米種植區,徑流水帶入河水中的毒死蜱濃度可達0.1 μg/L[5],大豆種植區地表水毒死蜱濃度最高達10.8 μg/L[6],而在肯尼亞的Naivasha湖中毒死蜱的濃度高達26.6 μg/L[7]。由于毒死蜱在水中降解的速度緩慢,且會隨著水體的轉移而造成二次污染,因此其在水中的殘留會對水生生物及其他生物造成潛在的危害。
斑馬魚具有體型小、易于培養、產卵量大、胚胎易于觀察和顯微操作等特點,并且斑馬魚胚胎和幼魚對有害物質非常敏感,因此常用于研究環境物質對發育的影響及作用機制[8-10]。基于這些優勢,斑馬魚已經成為一種公認的發育生物學和毒理學研究模式生物。由于毒死蜱在水環境中具有難以降解的特性,因此水生模式生物斑馬魚也成為本研究的理想模型。本研究首先脅迫處理人子宮內膜癌細胞(HEC-1B)進行流式細胞分析,確定低濃度毒死蜱的內分泌干擾物效應,然后分析毒死蜱對斑馬魚的急性毒性和可能的神經發育毒性,旨在探究水環境殘留的毒死蜱所具有環境生物學效應。
1 材料與方法
1.1 材料
1.1.1 化學試劑 毒死蜱(O,O-二乙基-O-3,5,6-三氯-2-吡啶基硫代磷酸酯,chlorpyrifos,CPF)購自于中國山東省天成生物科技有限公司,純度≥98%;17β-雌二醇(E2)購自于Sigma公司,純度≥98%。熒光染料碘化丙啶(Propidium Iodide,PI)購自于Sigma公司。MEM細胞培養液、牛血清、胰酶、PBS購自BD公司。本研究中其他化學試劑均屬于分析純級別,各種試劑先配制母液保存,使用前配制相應濃度的工作液。
1.1.2 實驗材料 本研究使用的AB型野生斑馬魚購自于國家斑馬魚資源中心(China Zebrafish Resource Center,CZRC),人子宮內膜癌細胞株HEC-1B購自于中國醫學科學院腫瘤細胞庫。
1.2 方法
1.2.1 癌細胞的培養和處理 HEC-1B在MEM培養液中采用開放式單層貼壁培養,培養條件為37℃,5% CO2,飽和濕度。加受試物前4 d將細胞用PBS洗滌后改為在無酚紅MEM培養液中培養,目的是耗盡細胞內儲存的雌激素。設置空白對照組,雌激素對照組(E2):終濃度為0.05 ppm;毒死蜱梯度處理組(CPF):終濃度分別為0.05、0.01和0.005 ppm。將HEC-1B 細胞接種于5 mL培養瓶,培養24 h待細胞貼壁后,加入受試物處理72 h,用胰酶消化收集細胞,充分吹打,制成單細胞懸液。
1.2.2 細胞周期分析 使用PI(碘化丙啶)染色法檢驗細胞周期。收集胰酶消化的HEC-1B細胞,使用預冷70%乙醇于4℃固定一晚。離心收集細胞,使用50 μg/L的PI溶液4℃避光染色30 min,PBS洗滌兩遍后40 μm篩網過濾,制成單細胞懸液。使用流式細胞儀(BD FACSJazz,USA)在488 nm波長下觀察細胞周期分布及亞二倍體細胞所占比例,每個樣本檢測3次。數據使用流式細胞分析軟件FlowJow 7.6.1分析。
1.2.3 斑馬魚養殖 本研究使用的AB型野生斑馬魚,其養殖方法和胚胎收集按照本實驗室的傳統方法進行。即野生型(AB品系)斑馬魚養殖在封閉的貫流系統(北京愛生公司)中,自來水經過活性炭過濾,控制水溫(28±0.5)℃,光照黑暗比例14∶10。斑馬魚每天喂食3次,食物為豐年蟲幼蟲。將產卵用的成魚按照2∶1的比例裝入盒中準備收集受精卵。挑選發育正常(無畸形)的0.5-1.0 hpf的胚胎,隨機分裝于一次性培養皿中(50/個)。
1.2.4 毒死蜱對斑馬魚的毒性測試 以定時更換處理液的方式,使用毒死蜱對斑馬魚胚胎進行毒性處理,設計4個毒死蜱實驗濃度,分別為0、1.00、2.00、3.00和4.00 ppm,每個濃度3個平行處理,每個處理的培養皿中分別加入50個發育正常的胚胎和40 mL處理液。由于毒死蜱難溶于水,易溶于有機溶劑這一特征,故選用丙酮作為助溶劑。在處理液中,丙酮的最高濃度為0.1%。我們以前的研究表明,低濃度(<0.1%)的丙酮不會影響實驗結果。
1.2.5 斑馬魚胚胎形態學觀察 毒死蜱暴露處理后,每12 h對斑馬魚胚胎進行一次鏡檢(奧林巴斯公司,日本)觀察。將斑馬魚胚胎放入加有3%亞甲基纖維素的雙凹載玻片中,明場觀察并且拍照記錄。統計分析胚胎的孵化率、畸形率和死亡率。
1.2.6 神經系統相關基因的表達 毒死蜱暴露處理后,收集胚胎并且加入TRIzol試劑-80℃保存。每種濃度的胚胎分別取30枚保存,一式3份。使用TRIzol試劑提取總RNA,總RNA濃度在260 nm下估算,質量則通過OD260/OD280比率驗證。使用0.8%瓊脂糖凝膠電泳、溴化乙錠染色進行總RNA的進一步驗證。單鏈cDNA的合成按照試劑盒(PrimeScriptTMRT reagent Kit with gDNA Eraser,TaKaRa, Japan)說明書進行。以β-actin作為內參調整數據,使用Primer Premier 5軟件設計引物(表1),PCR擴增程序為:95℃ 10 min;95℃ 30 s,57℃ 30 s,72℃1 min。基因表達的差異倍數通過2-△△Ct方法計算。3組平行均進行表達量檢測。
1.2.7 統計分析 使用Levene檢驗方法檢測數據的方差齊性,并且使用SPSS19.0(美國SPSS公司)進行單因素方差分析(one-way ANOVA)和Duncan法多重比較分析。認定P<0.05作為統計顯著性的標準,所有值表示方法均為平均值±標準誤(x-±s)。
2 結果
2.1 低濃度毒死蜱的毒性
2.1.1 毒死蜱對HEC-1B細胞周期的影響 為了進一步研究毒死蜱的內分泌干擾效應,選用人子宮內膜癌細胞(HEC-1B)進行脅迫處理。考慮到癌細胞的耐受性,因此選用相對較低的濃度進行暴露處理。通過碘化丙啶染色和流式細胞儀檢測,并且通過FlowJow分析。對照組的細胞增殖系數PI(proliferous index,PI)為22.17,雌二醇E2對照組PI為41.19,毒死蜱0.05、0.01和0.005 ppm處理組的增殖系數PI分別為36.55、34.74和30.96(表2)。對比各組增值系數,E2>CPF0.05>CPF0.01>CPF0.005>CK。
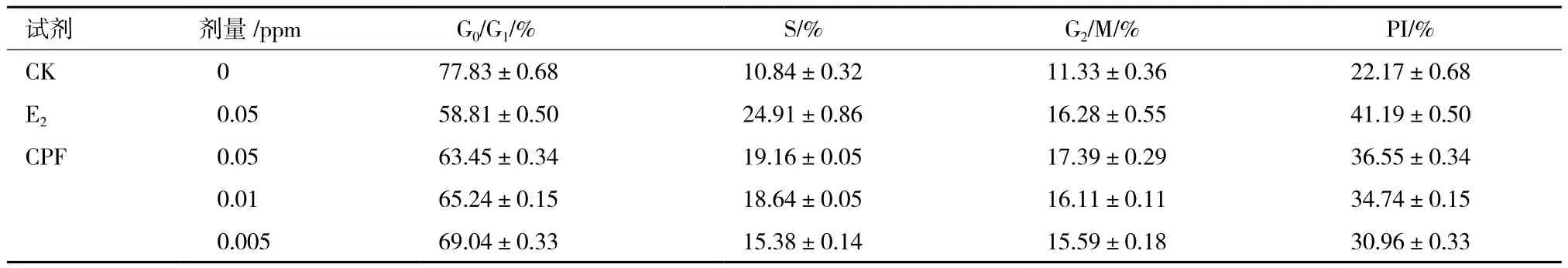
表2 低濃度毒死蜱對HEC-1B細胞周期的影響
2.1.2 毒死蜱對斑馬魚胚胎孵化的影響 考慮到毒死蜱在水環境中的溶解度僅為1.2 ppm,因此使用較低的實驗濃度。使用梯度濃度CPF(0、0.10、0.25、0.50、0.75和1.00 ppm)暴露處理斑馬魚胚胎48 h后,出現了一個有趣的現象,即處理組胚胎比對照組快,并且胚胎的孵化率與暴露濃度成正比(未發表),同時低濃度處理組很少出現胚胎發育畸形。
2.2 高濃度毒死蜱的毒性
2.2.1 毒死蜱對斑馬魚的致死作用 采用梯度濃度的毒死蜱(0、1.00、2.00、3.00和4.00 ppm)對斑馬魚胚胎進行處理,每12 h進行一次處理液更換和胚胎觀察,記錄各時段胚胎及幼魚的存活情況,對正常幼魚和死亡幼魚進行拍照記錄(圖1-A和圖1-B)。處理60 h后,毒死蜱0、1.00、2.00、3.00和4.00 ppm處理組存活率分別為98.9%、91.1%、48.4%、37.8%和23.3%(圖1-C)。

圖1 毒死蜱的致死作用
2.2.2 毒死蜱對斑馬魚的致畸作用 梯度濃度的毒死蜱處理胚胎時,處理48 h后孵化的幼魚就會出現體軸彎曲、心包囊腫等畸形現象(圖2-A和圖2-B),統計該時段的幼魚出現各畸形的數目并計算平均畸形率。處理48 h后,毒死蜱0、1.00、2.00、3.00和4.00 ppm處理組體軸彎曲的比例分別為3.3%、14.6%、23.9%、37.1%和36.8%(圖2-C),即隨著濃度的提高,斑馬魚幼魚出現畸形的比例也隨之提高。而心包囊腫的畸形現象出現的比例相對較低,并且該現象出現的時間相對較晚。
2.2.3 毒死蜱對斑馬魚的神經毒性 考慮到毒死蜱具有神經毒性,因此選取斑馬魚的5種神經發育標志基因作為參考,從基因的轉錄水平探究其神經發育毒性。使用60 h半致死濃度的毒死蜱(2.00 ppm)處理斑馬魚胚胎48 h后,收集胚胎,提取總RNA進行熒光定量PCR分析,得到各組基因表達量變化。本研究選取的神經標志基因包括neurog1、elavl3、nkx2.2a、nestin和gfap,相對于空白對照組分別上調1.30、0.58、1.46、1.58和0.42倍(圖3)。
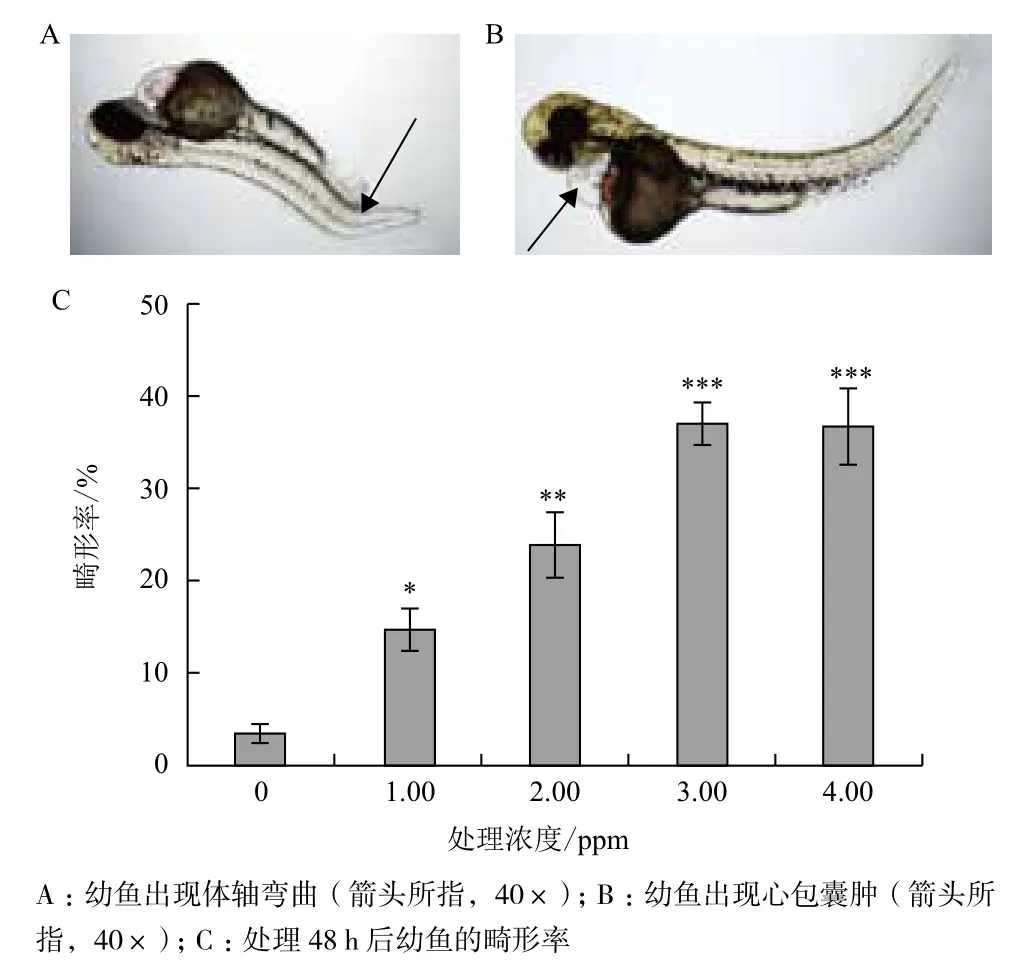
圖2 毒死蜱的致畸作用

圖3 神經標志基因m RNA表達量的變化
3 討論
隨著毒死蜱的廣泛應用,對其毒理的研究也越來越多樣化。2007年美國環保署(US EPA)公布首批73種化學物質進行內分泌干擾物檢測(Endocrine Disruptor Screening Program,EDSP),其中就包括毒死蜱[11]。內分泌干擾物(endocrine disrupting chemicals,EDCs)是指干擾生物體內維持內穩態及調節生殖、發育過程的天然激素的正常體內代謝過程的外源性物質[12],包括農藥、洗滌劑、殺菌劑、化妝品、合成雌激素等一系列化合物[13]。一些研究表明,毒死蜱對雄性小鼠具有內分泌干擾效應,導致精子異常或死亡[14]。同時,毒死蜱也會對雌性小鼠生殖器官造成永久傷害[15]。而在我們之前的研究中,低濃度的毒死蜱能加快斑馬魚胚胎的孵化,可能是毒死蜱的一種內分泌干擾效應。為了驗證毒死蜱的這種作用,本研究選用人子宮內膜癌細胞HEC-1B進行低濃度毒死蜱脅迫處理,結果發現毒死蜱處理組的細胞增殖系數高于空白對照組,并且同等濃度下其增殖效應不及雌二醇,即毒死蜱具有類雌激素的作用,因此證明毒死蜱具有內分泌干擾物效應。
動物實驗是有毒物質毒性測試、新藥開發等過程中的一個重要環節[16]。本研究選用的模式生物斑馬魚,其胚胎發育早期對環境毒性物質具有相當強的敏感性,并且產生不同的形態學病變[17-19]。在本研究中,梯度濃度的毒死蜱處理斑馬魚胚胎后,其存活率隨著處理濃度的上升而降低,并且60 h的半致死濃度約為2 ppm。毒死蜱不僅會導致斑馬魚胚胎的死亡,還會造成存活胚胎發育的畸形,并且這種畸形的比例與處理濃度正相關。斑馬魚毒性測試結果表明,高濃度的毒死蜱對斑馬魚具有較強的毒性,并且會導致斑馬魚胚胎的死亡和發育畸形。
研究表明,毒死蜱及其代謝產物能夠抑制乙酰膽堿酶,從而阻止乙酰膽堿的降解,造成神經遞質在突觸的累積,導致持久的受體刺激和神經相關信號通路的異常[20,21],這也是毒死蜱毒殺害蟲的主要方式。研究發現,毒死蜱能夠影響小鼠腦部的發育、造成小鼠中樞神經系統損傷[22,23]。同時,應用基因芯片技術對處理前后的大鼠腦干和前腦進行轉錄譜分析,發現差異基因主要參與神經細胞的生長、分化,神經遞質合成等過程[24]。因此,為了判斷毒死蜱對斑馬魚的神經系統的發育毒性,本研究選取了5種斑馬魚神經系統發育相關的標志基因,試圖從轉錄水平進行探究。neurog1(ngn1)是神經前體細胞的標志基因,在斑馬魚胚胎受精24 h后主要分布于前腦、中腦、后腦、脊髓、耳部和鰓背基板處[25]。elavl3是最早期的神經元標志物之一,在神經系統廣泛表達,是神經元決定的標志[26]。nkx2.2a在哺乳動物和斑馬魚的背腹側神經系統的形成與功能中起重要作用[27]。nestin是一種中等纖維蛋白,它在哺乳動物神經前體細胞中高表達,已被廣泛用作神經前體細胞的標志分子[28]。gfap 為神經膠質細胞的標志基因,于胚胎受精12 h后在腦中表達,15 h至成魚在神經膠質細胞中持續表達[29]。而本研究中,2 ppm毒死蜱處理斑馬魚胚胎48 h后,5種標志基因的mRNA表達量基本都出現明顯上調,造成神經系統發育相關基因的表達紊亂,從而影響神經系統正常發育,也可能是造成斑馬魚胚胎出現畸形的原因。
4 結論
低濃度的毒死蜱具有內分泌干擾效應,能夠加速胚胎的孵化脫膜,同時也能提高癌細胞的增殖系數,促進細胞的生長和分裂。通過斑馬魚的急性毒理研究,證明水環境中高濃度的毒死蜱主要表現為神經毒性,能夠造成胚胎的畸形和死亡,并且顯著影響神經系統相關基因的表達量。
[1]Juberg DR, Gehen SC, Coady KK, et al. Chlorpyrifos:weight of evidence evaluation of potential interaction with the estrogen,androgen, or thyroid pathways[J]. Regul Toxicol Pharmacol,2013, 66(3):249-263.
[2]王川, 周巧紅, 吳振斌. 有機磷農藥毒死蜱研究進展[J]. 環境科學與技術, 2011, 34(7):123-127.
[3]Smith JN, Hinderliter PM, Timchalk C, et al. A human life-stage physiologically based pharmacokinetic and pharmacodynamic model for chlorpyrifos:development and validation[J]. Regul Toxicol Pharmacol, 2014, 69(3):580-597.
[4]吳長興, 趙學平, 吳聲敢, 等. 丘陵地區水稻田使用毒死蜱對水體的污染及其生態風險[J]. 生態與農村環境學報, 2011, 27(3):108-112.
[5]Ferenczi J, Ambrus A, Wauchope RD, et al. Persistence and runoff losses of 3 herbicides and chlorpyrifos from a corn field in the Lake Balaton watershed of Hungary[J]. J Environ Sci Health B, 2002,37(3):211-224.
[6]Marino D, Ronco A. Cypermethrin and chlorpyrifos concentrationlevels in su rface water bodies of the Pampa Ondu lada,Argentina[J]. Bull Environ Contam Toxicol, 2005, 75:820-826.
[7]Otieno PO, Schramm KW, Pfister G, et al. Spatial distribution and temporal trend in concentration of carbofuran, diazinon and chlorpyrifos ethyl residues in sediment and water in Lake Naivasha,Kenya[J]. Bull Environ Contam Toxicol, 2012, 88:526-532.
[8]Engeszer RE, Patterson LB, Rao AA, et al. Zebrafish in the wild:a review of natural history and new notes from the field[J]. Zebrafish, 2007, 4(1):21-40.
[9]Segner H. Zebrafish(Danio rerio)as a model organism for investigating endocrine disruption[J]. Comp Biochem Physiol C Toxicol Pharmacol, 2009, 149(2):187-195.
[10]Parng C. In vivo zebrafish assays for toxicity testing[J]. Curr Opin Drug Discov Devel, 2005, 8(1):100-106.
[11]US EPA 2007a. United States Environmental Protection Agency. Draft list of initial pesticide active ingredients and pesticide inerts to be considered for screening under the Federal Food, Drug, and Cosmetic Act Federal Register, 2007, 72(116):33486-33503.
[12]Diamanti-Kandarakis E, Bourguignon JP, Giudice LC, et al. Endocrine-disrupting chemicals:an Endocrine Society scientific statement[J]. Endocr Rev, 2009, 30(4):293-342.
[13]Mills LJ, Chichester C. Review of evidence:are endocrinedisrupting chemicals in the aquatic environment impacting fish populations?[J]. Sci Total Environ, 2005, 343(1-3):1-34.
[14]Farag AT, Radwan AH, Sorour F, et al. Chlorpyrifos induced reproductive toxicity in male mice[J]. Reprod Toxicol, 2010, 29(1):80-85.
[15]Nishi K, Hundal SS. Chlorpyrifos induced toxicity in reproductive organs of female Wistar rats[J]. Food Chem Toxicol, 2013, 62:732-738.
[16]Mangipudy R, Burkhardt J, Kadambi VJ. Use of animals for toxicology testing is necessary to ensure patient safety in pharmaceutical development[J]. Regul Toxicol Pharmacol,2014, 70(2):439-441.
[17]Parker T, Libourel PA, Hetheridge MJ, et al. A multi-endpoint in vivo larval zebrafish(Danio rerio)model for the assessment of integrated cardiovascular function[J]. J Pharmacol Toxicol Methods, 2014, 69(1):30-38.
[18] Beasley A, Elrod-Erickson M, Otter RR. Consistency of morphological endpoints used to assess developmental timing in zebrafish(Danio rerio)across a temperature gradient[J]. Reprod Toxicol,2012, 34(4):561-567.
[19]Scholz S. Zebrafish embryos as an alternative model for screening of drug-induced organ toxicity[J]. Arch Toxicol, 2013, 87(5):767-769.
[20]Pope C, Karanth S, Liu J. Pharmacology and toxicology of cholinesterase inhibitors:uses and misuses of a common mechanism of action[J]. Environ Toxicol Pharmacol, 2005, 19(3):433-446.
[21]Eaton DL, Daroff RB, Autrup H, et al. Review of the toxicology of chlorpyrifos with an emphasis on human exposure and neurodevelopment[J]. Crit Rev Toxicol, 2008, 38(Suppl 2):1-125.
[22]Venerosi A, Calamandrei G, Ricceri L. A social recognition test for female mice reveals behavioral effects of developmental chlorpyrifos exposure[J]. Neurotoxicol Teratol, 2006, 28(4):466-471.
[23]Canadas F, Cardona D, Davila E, et al. Long-term neurotoxicity of chlorpyrifos:spatial learning impairment on repeated acquisition in a water maze[J]. Toxicol Sci, 2005, 85(2):944-951.
[24]Slotkin TA, Seidler FJ. Comparative developmental neurotoxicity of organophosphates in vivo:transcriptional responses of pathways for brain cell development, cell siavgnaling, cytotoxicity and neurotransmitter systems[J]. Brain Res Bull, 2007, 72(4-6):232-274.
[25]Quinones HI, Savage TK, Battiste J, et al. Neurogenin 1(Neurog1)expression in the ventral neural tube is mediated by a distinct enhancer and preferentially marks ventral interneuron lineages[J]. Dev Biol, 2010, 340(2):283-292.
[26]Fan CY, Cowden J, Simmons SO, et al. Gene expression changes in developing zebrafish as potential markers for rapid developmental neurotoxicity screening[J]. Neurotoxicol Teratol, 2010, 32(1):91-98.
[27]Pauls S, Zecchin E, Tiso N, et al. Function and regulation of zebrafish nkx2. 2a during development of pancreatic islet and ducts[J]. Dev Biol, 2007, 304(2):875-890.
[28]Xue XJ, Yuan XB. Nestin is essential for mitogen-stimulated proliferation of neural progenitor cells[J]. Mol Cell Neurosci,2010, 45(1):26-36.
[29]Bernardos RL, Raymond PA. GFAP transgenic zebrafish[J]. Gene Expr Patterns, 2006, 6(8):1007-1013.
(責任編輯 馬鑫)
An Analysis of Environmental and Biological Effects of Chlorpyrifos
Yu Kaimin Feng Weimin Li Guochao Zhang Jiayu Liu Lili Yan Yanchun
(Graduate School,Chinese Academy of Agricultural Sciences,Beijing100081)
With the prohibition of high-toxicity organophosphorous pesticides, the chlorpyrifos as their substitute has been used in a large-scale. The residue of chlorpyrifos, degrading slowly in the water, may cause the potential damages to aquatic organisms and others. To investigate the endocrine disrupting effects of low-concentration chlorpyrifos, flow cytometry was used to analyze the growth cycle of endometrial cancer cell HEC-1B of human. Moreover, zebrafish embryos were selected for chlorpyrifos exposing treatment 60 h at various concentrations of 0, 1.0, 2.0, 3.0 and 4.0 ppm. It was found that the chlorpyrifos caused the zebrafish embryos to death and significant embryonic malformation, the survival rate of the embryos was inversely proportional to chlorpyrifos’ concentration, and the malformation rate was proportional to chlorpyrifos’concentration. Further, the mRNA expression levels of 5 neurodevelopment maker genes in the chlorpyrifos-treated zebrafish embryos were detected. These results showed that chlorpyrifos of low-concentration acted as endocrine disruptor, and chlorpyrifos of high-concentration affected the normal development of nerve system.
chlorpyrifos;environmental and biological effects;zebrafish embryo;developmental neurotoxicity;endocrine disrupting effect
10.13560/j.cnki.biotech.bull.1985.2015.08.033
2014-12-09
國家自然科學基金項目(31170119),中國農業科學院基礎研究基金項目(0042014006,0042012003,0042011006)
余凱敏,男,碩士研究生,研究方向:微生物分子生物學與基因工程;E-mail:kmyu1989@gmail.com
閆艷春,女,博士,教授,研究方向:微生物分子生物學與基因工程;E-mail:yanyanchun@caas.cn

