黃體生成素受體基因在牦牛發情周期不同階段生殖系統中的表達模式
胡威 崔燕 潘陽陽 李谷月 何翃閎 熊力 余四九
(甘肅農業大學動物醫學院,蘭州 730070)
黃體生成素受體基因在牦牛發情周期不同階段生殖系統中的表達模式
胡威 崔燕 潘陽陽 李谷月 何翃閎 熊力 余四九
(甘肅農業大學動物醫學院,蘭州730070)
旨在檢測黃體生成素受體(Luteinizing hormone receptor,LHR)基因在牦牛發情周期不同階段生殖系統中的表達。實驗選取青海健康的處于卵泡期和黃體期的2歲齡雌性牦牛各3頭,根據黃牛LHR基因序列5'端和3'端的保守序列設計特異性引物,利用實時熒光定量PCR(RT-qPCR)法分析牦牛發情周期不同階段,生殖系統中LHR基因的相對表達量。結果顯示,LHR基因在牦牛發情周期不同階段生殖系統中的表達量存在差異,卵巢和輸卵管中卵泡期LHR基因的表達量高于黃體期,黃體期子宮中LHR基因的表達量高于卵泡期。研究表明牦牛在發情周期不同階段生殖系統中LHR基因的表達量存在差異,提示LHR在牦牛的繁殖過程中對生殖系統具有重要的調節作用。
牦牛;黃體生成素受體;生殖系統;實時熒光定量PCR;基因表達
牦牛是一種生活在高海拔地區的重要動物資源,品種原始,生產能力低下,這主要與其繁殖力較低有關,牦牛的實際繁殖水平一般僅為兩年一胎或三年兩胎[1]。由于其繁殖能力不強,因此有關如何提高牦牛繁殖率的研究將會成為當今和以后發展的趨勢。目前,日趨成熟的體外受精和胚胎移植技術在該方面已經展開了應用。
黃體生成素(Luteinizing hormone,LH)是動物體內重要的垂體促性腺激素,其對黃體的發育和維持起著重要作用,但其作用必須在黃體生成素受體(Luteinizing hormone receptor,LHR)的介導下發揮,因此對LHR的研究是十分必要的。LHR屬于G蛋白偶聯受體超家族中的糖蛋白亞家族成員,其氨基酸序列和結構有高度同源性,具有7個跨膜區、4個胞質區以及由3個環狀區和N端組成的細胞外區[2]。余四九等[3]對牦牛的發情特性及生殖激素含量的變化進行了系統的研究發現,LH峰出現在發情開始后14 h左右,提示LHR基因在此時表達應該也會較高。阿依木古麗等[4]對發情周期不同階段牦牛子宮中黃體生成素受體的表達變化進行了相關研究,結果表明發情周期不同階段子宮中促黃體素受體的表達量是不同的,說明LHR參與了發情周期不同階段牦牛子宮功能變化的調控。李廣君等[5]對濟寧青山羊發情周期不同階段LHR在輸卵管的分布及其mRNA的表達進行過相關研究,發現LHR陽性物質存在于發情周期各階段的輸卵管各段,且發情周期不同階段mRNA在輸卵管各階段的表達量也不相同,說明LH對輸卵管的功能具有一定的調節作用。但有關LHR基因在牦牛發情周期不同階段輸卵管、卵巢、子宮中的表達差異比較尚無報道。鑒于此,本研究對LHR基因在牦牛發情周期不同階段輸卵管、卵巢、子宮中的含量進行檢測,分析其表達模式,為進一步揭示LHR在牦牛生殖過程中發揮的作用奠定理論基礎。
1 材料與方法
1.1 材料
1.1.1 組織 青海省西寧市定點屠宰場。分離屠宰后的卵巢,根據卵巢判斷發情周期所處階段,分別取卵泡期、黃體期雌性牦牛卵巢、輸卵管、子宮組織樣,用錫箔紙包好后放入事先標記好的布袋中,立即投入液氮中帶回實驗室,-80℃ 保存備用。
1.1.2 主要試劑及儀器 TransZol Up、TransStartTMTop Green qPCR SuperMix均購自 TransGen Biotech公司,RNA反轉錄試劑盒購自Promega公司;引物由北京華大基因研究中心合成;普通PCR儀、凝膠成像系統均由Bio-Rad公司提供,實時熒光定量PCR儀由 Roche 公司提供,超微量分光光度計由Implen公司提供。
1.2 方法
1.2.1 引物設計 參照GenBank發表的黃牛LHR基因序列(GenBank登錄號為AF491303;引物1和引物2)和GAPDH基因序列(GenBank登錄號為NM_001034034.2,引物3,作為普通PCR內參引物),牦牛β-actin基因序列(GenBank登錄號為DQ838049.1,作為RT-qPCR內參基因),應用Primer5.0軟件設計3對特異性引物(表1)。
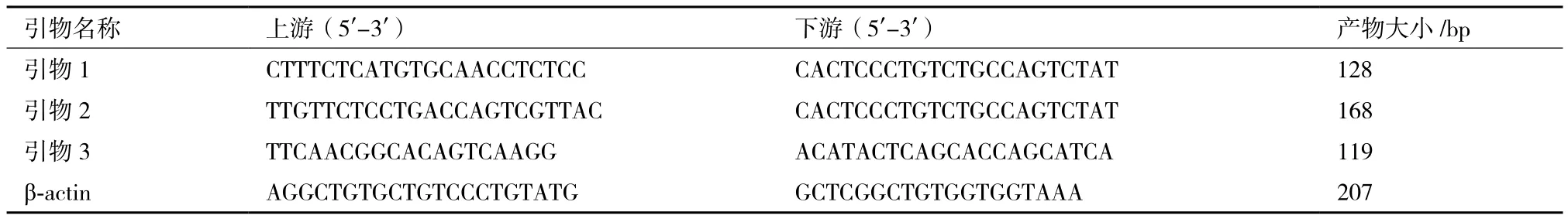
表1 目的基因與內參基因引物
1.2.2 總RNA的提取及反轉錄 用TransZol Up試劑提取不同時期牦牛卵巢、輸卵管、子宮總RNA,然后取不同組織的總RNA 5 μL,用1%瓊脂糖凝膠電泳鑒定其完整性。利用超微量分光光度計測定所提取RNA的OD260nm與OD280nm的比值,判斷其比值是否落在1.8-2.0之間,同時可得到RNA的濃度值。根據測定結果篩選出合格的RNA樣品,然后調節這些RNA的濃度至400 ng/μL以進行下一步實驗。最后按照RNA反轉錄試劑盒說明書進行cDNA第一鏈的合成,產物于-20℃保存。
1.2.3 RT-PCR擴增反應體系、擴增程序及PCR產物的檢測 以上述實驗獲得的cDNA為模板,進行LHR和β-actin基因的PCR擴增。優化后的PCR反應條件為(20 μL反應體系):Go Taq Green Master Mix 10 μL,上下游引物各0.5 μL,cDNA 1 μL,Nuclease-Free Water 8 μL。擴增程序:95℃ 2 min;95℃ 30 s,60℃ 30 s,72℃ 30 s,3個循環;72℃ 10min。用1%瓊脂糖凝膠電泳檢測PCR產物,凝膠成像系統采集圖像。隨后將目的條帶用膠回收試劑盒回收純化,將純化好的cDNA與pMDR18-T vector連接,并轉化到JM109感受態細胞中,將菌液送華大基因公司測序,使用DNAMAN和MEGA5軟件進行序列組裝,利用NCBI的BLAST軟件對測序后的目的基因進行比對分析。
1.2.4 發情周期不同階段牦牛卵巢、輸卵管、子宮中LHR基因的檢測 以上述實驗獲得的cDNA為模板,進行LHR和β-actin基因的實時熒光定量PCR(RT-qPCR)擴增。優化后的反應條件為(20 μL體系):2×TransStart Top Green qPCR SuperMix 10 μL,上下游引物各0.5 μL,cDNA 1 μL,ddH2O 8 μL。擴增程序:95℃ 5 min,95℃ 10 s,60℃ 15 s,72℃ 15 s,45個循環;95℃ 5 s,65℃ 1 min;40℃ 30 s。每個樣品重復3次。待上述反應結束后,通過得到的溶解曲線來判定RT-qPCR反應的特異性;獲得每個樣品的CT值,運用2-ΔΔCT法計算LHR基因在各個組織的相對表達量,實驗數據用x-±s表示。
2 結果
2.1 牦牛發情周期不同階段卵巢、輸卵管、子宮總RNA的提取及檢測
牦牛發情周期不同階段卵巢見圖1。1%瓊脂糖凝膠電泳檢測所提取總RNA的完整性。通過凝膠成像系統采集的圖像(圖2)可以清楚地看到28S rRNA、18S rRNA,5S rRNA幾乎看不到,說明所提取的總RNA信息含量完整,無降解。通過超微量分光光度計所測得的樣品OD260nm/OD280nm比值均在1.8-2.0之間,說明所提取的總RNA純度高,無蛋白質、基因組或者其他雜質的污染,可用于后續實驗。
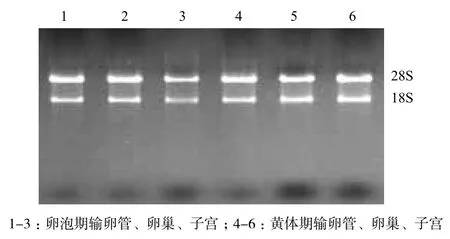
圖2 總RNA瓊脂糖凝膠電泳結果
2.2 RT-qPCR測定LHR基因在發情周期不同階段牦牛卵巢、輸卵管、子宮中的表達
LHR和GAPDH基因PCR擴增產物通過1%瓊脂糖凝膠電泳檢測后,可見在128 bp和119 bp處有明顯的條帶(圖3),與預期片段長度相符。經測序后得到128 bp和119 bp兩段序列,Blast比對分析表明,這兩段序列可在GenBank中公布的黃牛LHR和GAPDH序列中找到,其位置也與預期相符,并且與黃牛LHR的同源性高達99%。用BLAST和MEGA5軟件對比并剪切編輯得到一條長128 bp目的基因部分序列,牦牛LHR基因的部分序列見圖4。結果說明可以運用RT-qPCR法測定牦牛發情周期不同階段內生殖器中LHR的表達差異。
對RT-qPCR結果分析(圖5,圖6,表2)得出,LHR和β-actin PCR產物的Tm值都很均一,熔解曲線上只有單一銳利的峰,表明在實時熒光定量PCR過程中,熒光強度均來自特異性擴增產物,由此排除了引物二聚體和非特異性擴增產物的形成對試驗結果的影響。由實驗結果可知,LHR基因在黃體期輸卵管中的表達量最低,將黃體期輸卵管LHR基因的表達量選為對照組,因此,ΔΔCT= ΔCT樣品-ΔCT黃體期輸卵管。隨著發情周期的不同,LHR基因在生殖器官中的表達量也存在差異。卵泡期,LHR基因在卵巢中的表達量最高,與輸卵管和子宮中的表達量差異顯著(P<0.05),在輸卵管和子宮中的表達量差異不顯著(P>0.05);黃體期,LHR基因在子宮中的表達量最高,其次分別為卵巢、輸卵管,三者相互之間LHR基因的表達量存在差異顯著性(P<0.05)。卵巢中卵泡期LHR基因的表達量高于黃體期,輸卵管中LHR基因的表達量在卵泡期略高于黃體期,子宮中黃體期LHR基因的表達量略高于卵泡期。結果表明,LHR基因在牦牛發情周期不同階段對生殖系統具有重要的調節作用。

圖3 引物1(A)和引物3(B)RT-PCR產物瓊脂糖凝膠電泳結果
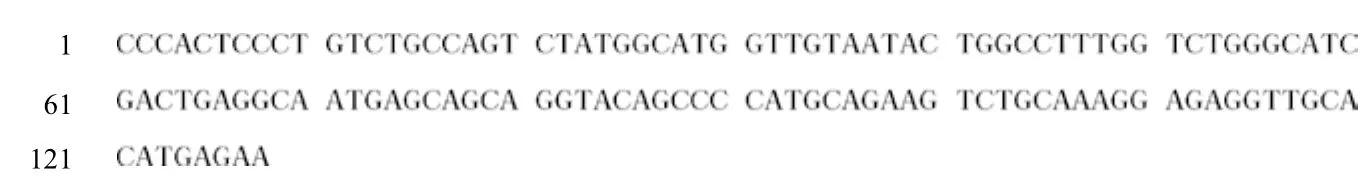
圖4 牦牛LHR基因的部分序列
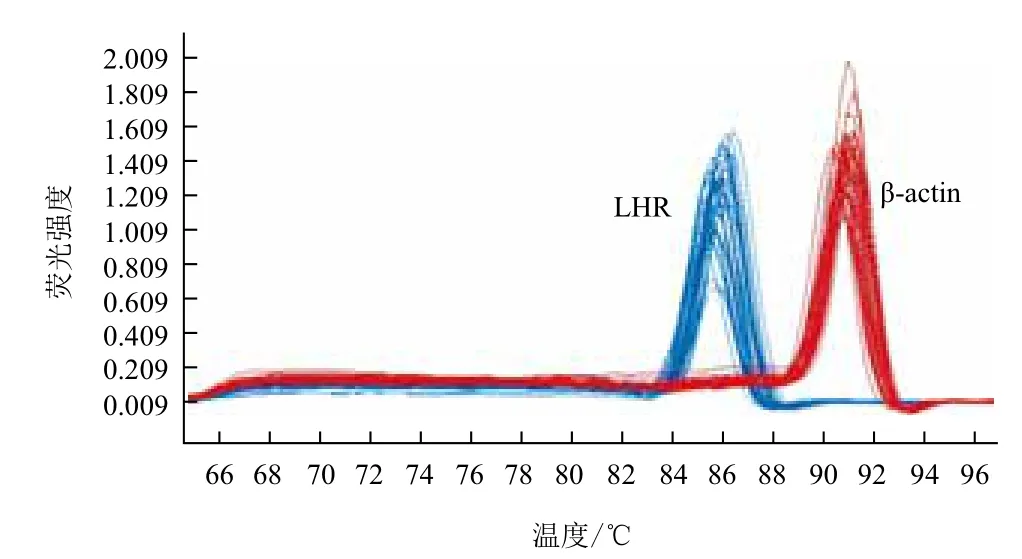
圖5 LHR和β-actin基因的熔解曲線
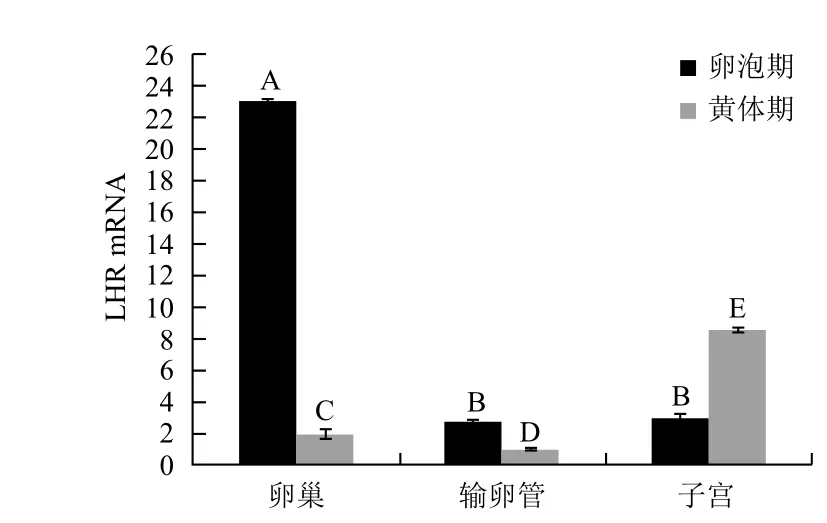
圖6 RT-qPCR檢測牦牛輸卵管、卵巢、子宮中LHR基因的表達結果
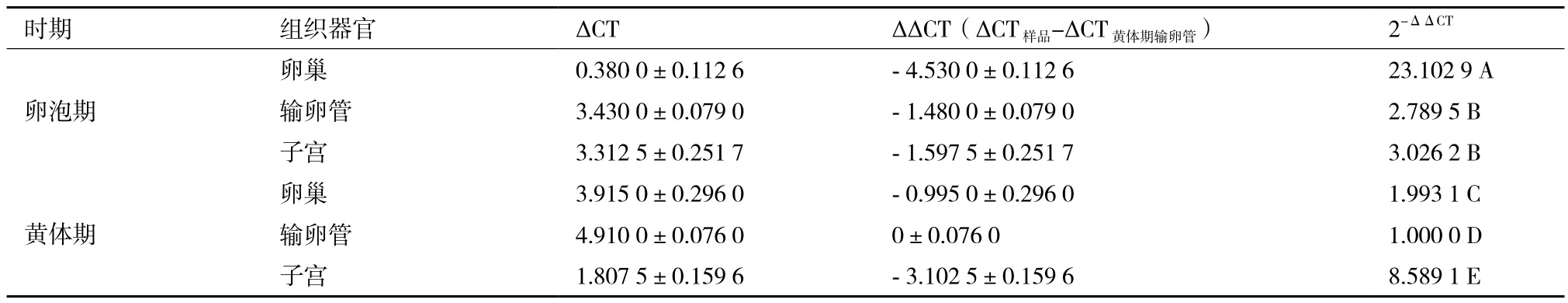
表2 LHR基因在牦牛妊娠前后卵巢、輸卵管、子宮中的表達
3 討論
黃體生成素(LH)是哺乳動物生殖調控的重要激素,生理作用通過其受體(LHR)介導,因此有關LHR基因的研究具有十分重要的意義。近年來,人們發現LH除了影響傳統的性腺靶器官外,LHR還存在于整個生殖道中,其對生殖道功能的發揮也起著重要的調控作用。李成嬌等[6]通過免疫組化實驗研究發現,在水牛的卵泡期和黃體期內生殖器官中,LHR的表達量存在差異,卵巢中卵泡期LHR的表達量均高于黃體期;子宮中LHR的表達量黃體期高于卵泡期;而輸卵管并沒有顯著差異。本實驗通過實時熒光定量PCR法檢測了LHR基因在牦牛發情周期不同階段輸卵管、卵巢、子宮中的表達量,結果顯示,卵巢中卵泡期LHR基因的表達量高于黃體期,子宮中LHR基因的表達量黃體期高于卵泡期,而輸卵管中LHR基因的表達量卵泡期略高于黃體期,與上述免疫組化實驗結果基本相符。
卵巢是促性腺激素發揮作用的重要場所,是雌性動物的性腺。宋翔等[7]研究發現高繁山羊卵巢LHR基因的表達量在發情前期和發情期高于發情后期和間情期,本研究結果與此相符。有研究表明卵泡發育后期由FSH依賴型轉向LH依賴型,排卵前,顆粒細胞中LHR數量達到最高水平,LH峰后,卵泡黃體化依賴于顆粒細胞膜上的LHR[8]。本研究發現LHR基因在牦牛卵巢中卵泡期的表達量最高,說明LHR對卵泡的發育具有重要的調節作用。Abdennebi等[9]研究發現多胎的羅曼諾夫綿羊LHR mRNA在小卵泡的顆粒細胞和內膜細胞的表達量均高于法蘭西島綿羊,盧晟盛等[10]實驗證實,當FSH和LH的添加濃度處于 0.25-2 μg/mL時,FSH和LH無論以何種濃度組合,均極顯著促進豬卵母細胞的核成熟,可見卵巢中LHR mRNA的表達量與繁殖率可能存在一定的關系。Saeki等[11]對牛和唐杰等[12]對翼中山羊的研究也證實了這一點。
Derecka等[13]研究發現在豬輸卵管的早期黃體期和卵泡期存在LHR轉錄物。Zheng等[14]在鼠的發情周期抽取的樣本中發現LHR的存在。Gawronska等[15]研究發現在婦女月經周期期間,輸卵管的LHR濃度發生變化,分泌期要比增殖期含更高LHR。李廣君等[5]的研究中表明濟寧青山羊輸卵管LHR基因的表達量在發情前期和發情期高于發情后期和間情期,王麗等[16]在對沂蒙黑山羊發情周期中輸卵管LHR基因的表達差異研究中得到了同樣的結果,本實驗結果與上述研究結果是相符的,所以可以肯定的是LHR對輸卵管的功能活動具有重要的調節作用。
Friedman等[17]研究發現LHR及其mRNA在牛子宮中發情周期不同階段表達量存在差異,表明LH與LHR處于動態的平衡過程,LHR基因在不同時期的表達量及功能是不同的。阿依木古麗等[4]研究發現牦牛子宮中LHR蛋白的表達量在發情前期和發情期低于發情后期和發情間期,石中強等[18]對沂蒙黑山羊子宮中LHR基因在發情周期內表達規律的研究中發現了同樣的結果,本實驗結果與此是相符的。蔣進等[19]研究發現豚鼠子宮LHR mRNA在發情周期第0、4天表達水平較低,第12天升至最高,說明發情周期不同時期的LHR mRNA 表達呈現明顯的規律性,這與本研究結果是相符的。另外,Shemesh等[20]研究發現牛子宮靜脈在整個發情周期都存在LHR mRNA的表達及LHR蛋白的合成,而在黃體期和排卵后期的LHR含量較少。申穎等[21]的研究中發現LHR基因在濟寧青山羊整個發情周期的子宮中都有表達,其中,發情期的表達水平最低,隨之在間情期升至最高值,而后在發情前期降低。Rzucidlo等[22]對豬以及Sawitzke等[23]對兔和鼠的研究結果也證實了相同的變化規律。
總之,LHR是LH發揮正常生理功能的重要結合位點。牦牛在發情周期不同階段生殖系統中LHR基因的表達存在差異,說明LHR在牦牛發情周期不同階段對生殖系統發揮著重要的調節作用。有關牦牛LHR基因表達的研究可以為提高牦牛繁殖率奠定重要的基礎,為進一步探討LHR對牦牛生殖機能的調控規律提供了重要的理論依據。
4 結論
牦牛輸卵管、卵巢、子宮均具有表達LHR基因的特性,且發情周期不同階段表達量具有差異,卵泡期卵巢中表達量最高,黃體期子宮中表達量最高,說明LHR在牦牛的繁殖過程中對生殖系統具有重要的調節作用。
[1]Li C, Wiener G. The yak[M]. RAP publication, 1995.
[2]Fanelli F, Puett D. Structural aspects of luteinizing hormone receptor[J]. Endocrine, 2002, 18(3):285-293.
[3]余四九, 陳北亨. 牦牛發情特性及生殖激素含量的變化[J].動物學報, 1997, 43(2):178-183.
[4]阿依木古麗, 蔡勇, 崔燕, 等. 發情周期不同階段牦牛子宮中黃體生成素受體的表達變化[J]. 畜牧獸醫學報, 2011, 42(5):729-733.
[5]李廣君, 王慧, 王樹迎, 等. 濟寧青山羊發情周期不同階段LHR在輸卵管的分布及其mRNA表達[J]. 中國農業科學,2011, 44(15):3235-3245.
[6]李成嬌, 朱曉玲, 李萬宏, 等. 促性腺激素受體在雌性水牛生殖器官的表達定位研究[J]. 中國畜牧獸醫, 2011, 38(4):66-69.
[7]宋翔. 高繁山羊發情周期中卵巢內 LHR 的定位及其 mRNA 表達規律研究[D]. 泰安:山東農業大學, 2009.
[8]McRae R, Johnston H, Mihm M, et al. Changes in mouse granulosa cell gene expression during early luteinization[J]. Endocrinology,2005, 146(1):309-317.
[9]Abdennebi L, Monget P, Pisselet C, et al. Comparative expression of luteinizing hormone and follicle-stimulating hormone receptors in ovarian follicles from high and low prolific sheep breeds[J]. Biology of Reproduction, 1999, 60(4):845-854.
[10] 盧晟盛, 盧克煥. 促性腺激素對豬卵母細胞體外成熟的影響[J]. 西南農業大學學報, 2004, 26(6):769-772.
[11] Saeki K, Hoshi M, Leibfried-Rutledge ML, et al. In vitro fertilization and development of bovine oocytes matured in serum-free medium[J]. Biology of Reproduction, 1991, 44(2):256-260.
[12] 唐杰. 山羊促性腺激素及其受體 mRNA 豐度的研究[D]. 保定:河北農業大學, 2007.
[13] Derecka K, Pietil? E, Rajaniemi H, et al. Cycle dependent LH/hCG receptor gene expression in porcine nongonadal reproductive tissues[J]. Journal of Physiology and Pharmacology:an Official Journal of the Polish Physiological Society, 1995, 46(1):77-85.
[14] Zheng M, Shi H, Segaloff DL, et al. Expression and localization of luteinizing hormone receptor in the female mouse reproductive tract[J]. Biology of Reproduction, 2001, 64(1):179-187.
[15]Gawronska B, Stepien A, Ziecik A. Role of luteinizing hormone in control of oviduct function[J]. Reproduction in Domestic Animals, 2000, 35(3-4):129-133.
[16]王麗, 李泰云, 王樹迎, 等. 沂蒙黑山羊發情周期中輸卵管促性腺激素受體基因的表達差異研究[J]. 中國獸醫科學,2011, 41(8):832-838.
[17]Freidman S, Gurevich M, Shemesh M. Bovine cyclic endometrium contains high-affinity luteinizing hormone/human chorionic gonadotropin binding sites[J]. Biol Reprod, 1995, 52(5):1020-1026.
[18]石中強, 徐艷, 王樹迎, 等. 沂蒙黑山羊子宮中 FSHR 和 LHR基因在發情周期內的表達規律[J]. 山東農業大學學報:自然科學版, 2011(1):48-54.
[19]蔣進, 曹少先, 茆達干, 等. 豚鼠發情周期不同時期的子宮LHR mRNA 差異表達研究[J]. 中國農業科學, 2011, 44(16):3420-3426.
[20]Shemesh M, Mizrachi D, Gurevich M, et al. Functional importance of bovine myometrial and vascular LH receptors and cervical FSH receptors[C]. Seminars in Reproductive Medicine, 2001, 19(1):87-96.
[21]申穎, 王慧, 王樹迎, 等. LHR 基因在濟寧青山羊發情周期不同階段子宮中表達差異的研究[J]. 畜牧獸醫學報, 2009, 40(3):338-342.
[22]Rzucidlo SJ, Weigl RM, Tilton JE. Myometrial LH/hCG receptors during the estrous cycle and pregnancy in pigs[J]. Animal Reproduction Science, 1998, 51(3):249-257.
[23]Sawitzke AL, Odell WD. Uterine binding sites for LH/hCG can be modulated by hormonal status in rabbits and rats[J]. Acta Endocrinologica, 1991, 124(3):322-330.
(責任編輯 李楠)
Analysis of Expression Pattern of LHR Gene in the Reproductive System of Yak During the Estrous Cycle
Hu Wei Cui Yan Pan Yangyang Li Guyue He Honghong Xiong Li Yu Sijiu
(College of Veterinary Medicine,Gansu Agricultural University,Lanzhou730070)
This experiment was conducted to study the differences in expression of luteinizing hormone receptor(LHR)gene in the reproduction of yak during the estrous cycle. Three 2-year female yaks in each phase(follicular and luteal phase)from Qinghai Province were selected for the experiment. Specific primers were designed on the basis of 5' and 3' end conservative LHR gene sequence of cattle. The comparative expression quantity of LHR gene in different phases of the reproductive system of yak was analyzed by real time quantitative PCR(RT-qPCR). The results showed that the comparative expression quantity of LHR gene in the reproductive system of yak during the estrous cycle were different, the expressions of LHR gene in ovary and oviduct were higher during the follicular phase than the luteal phase,and the expression of LHR gene in uterus was higher during the luteal phase than the follicular phase. Our findings showed that the expression of LHR gene in the reproductive system of yak during the estrous cycle was different. It implies that the LHR plays vital regulating role in the reproductive system during the reproduction of yak.
yak;LHR;reproductive system;RT-qPCR;gene expression
10.13560/j.cnki.biotech.bull.1985.2015.09.033
2014-12-15
國家自然科學基金項目(31272616),甘肅省科技支撐計劃項目(1204NKCA075),甘肅省生物技術專項項目(GNSW-2013-23)
胡威,男,碩士研究生,研究方向:動物生殖生理;E-mail:fyyzhuwei@sina.com
余四九,男,教授,博士生導師,研究方向:動物生殖生理;E-mail:sjyu@163.com

