細菌群體感應及其在病原菌防治中的應用
梁心琰 阮海華
(天津商業大學生物技術與食品科學學院,天津 300134)
細菌群體感應及其在病原菌防治中的應用
梁心琰 阮海華
(天津商業大學生物技術與食品科學學院,天津 300134)
細菌分泌一種或多種化學信號分子,這些化學信號分子作為誘導因子感知和判斷菌群密度和周圍環境的變化。當菌群達到一定閾值時會啟動一系列相關基因的表達以調控菌體的群體行為,細菌的這種生理行為稱為群體感應。大量的研究表明,不同類型的細菌具有不同的群體感應系統。群體感應機制廣泛存在于病原菌中,并與其侵染過程、毒力基因表達及致病性密切相關。利用這種群體感應機制作為靶點進行病原菌的防治是醫學領域廣泛關注的問題。在此就細菌群體感應及其在病原菌防治中的應用進行闡述。
細菌;群體感應;自身誘導因子;調控;病原菌防治
DIO: 10.13560/j.cnki.biotech.bull.1985.2015.01.005
20世紀70年代,Nealson和Hastings[1]通過研究海洋細菌費氏弧菌(Vibrio fischeri)和哈氏弧菌(Vibrio harveyi)生物發光現象發現了菌群間的交流及相互作用。90年代 Greenberg 等將這種細菌分泌小信號分子即誘導因子(Autoinducer),以及該因子在微生物小群體間共同行為轉導中所起的調控作用定義為群體感應(Quorum sensing,QS)[1]。群體感應參與調控細菌的多種生理過程,如生物發光、生物膜及孢子形成、細胞分化、質粒的接合轉移、運動性及胞外多糖形成等,并與致病菌毒力因子的誘導、細菌與真核生物的共生、細菌素的合成及抗菌藥物的研發等與人類關系密切的細菌的生理特性相關[2]。
迄今為止,大量研究發現,介導微生物群體感應的化學信號分子主要分為3類:(1)以N-酰基高絲氨酸內酯類(Acyl-homoserine lactones,AHLs)及其衍生物作為信號分子,主要作用于革蘭氏陰性菌;(2)氨基酸和短肽類(Autoinducing peptide,AIPs),主要作用于革蘭氏陽性菌;(3)呋喃硼酸酯類(Furanostl borate diester),即AI-2。AI-2是由LuxS蛋白介導產生的一類信號分子,是一類種間信號分子,在革蘭氏陽性菌和革蘭氏陰性菌中均存在,可感知不同種屬微生物間的數量進而調控其行為[3]。此外,最新研究表明,在某些細菌中還發現了一類新的信號系統AI-3,這類信號分子能產生類似腎上腺素的級聯放大反應[4]。
1 群體感應系統的分類
細菌群體感應系統首先由酶催化合成信號分子,信號分子經擴散或轉運系統到達胞外,當累積到一定濃度后,被位于膜上的感應系統識別,引起受體蛋白的構象的變化,最終激活靶基因的表達,該表達產物能使細菌適應外界環境的變化。細菌群體感應包括種間和種內兩種群體感應系統。
1.1 細菌種內的群體感應系統
1.1.1 革蘭氏陰性菌的群體感應系統 革蘭氏陰性菌的群體感應系統主要以N-酰基高絲氨酸內酯類及其衍生物作為信號分子[5]。AHLs由LuxI(以海洋費氏弧菌的Luciferase編碼基因LUX1命名)類蛋白酶催化脂肪酸代謝途徑中的酰基-酰基載體蛋白的酰基側鏈與S-腺苷甲硫氨酸中高絲氨酸結合后內酯化而成,其含有高絲氨酸內酯環和一個酰胺鏈,酰胺鏈中的碳原子數(從4-18個,多為偶數,奇數中只有7)和第3位上取代基(氫、羥基和羧基)決定了該類信號分子對細菌的不同調控功能[6]。如圖1所示,AHLs信號分子由一個疏水性的高保守絲氨酸內酯環的頭部和一個親水性的可變的酰胺側鏈的尾部組成,可變的酰基鏈的尾部決定了它的多樣性。AHLs帶有短的酰胺側鏈使其被動地進出細菌細胞壁,而帶有長的酰胺側鏈的AHLs靠主動轉運機制跨過細菌細胞膜[7]。因此,AHLs為膜透過性分子,可跨過細菌細胞膜。當AHLs分子在環境中積累到一定濃度時,AHLs分子跨過細胞膜與胞內LuxR受體蛋白的氨基端結合,形成特定構象,使羧基端與靶DNA序列相結合,從而調控某些功能基因的表達。同時AHLs信號分子與其受體蛋白形成的復合物也對AHLs信號分子及其受體蛋白本身的產生具有反饋調節效應。
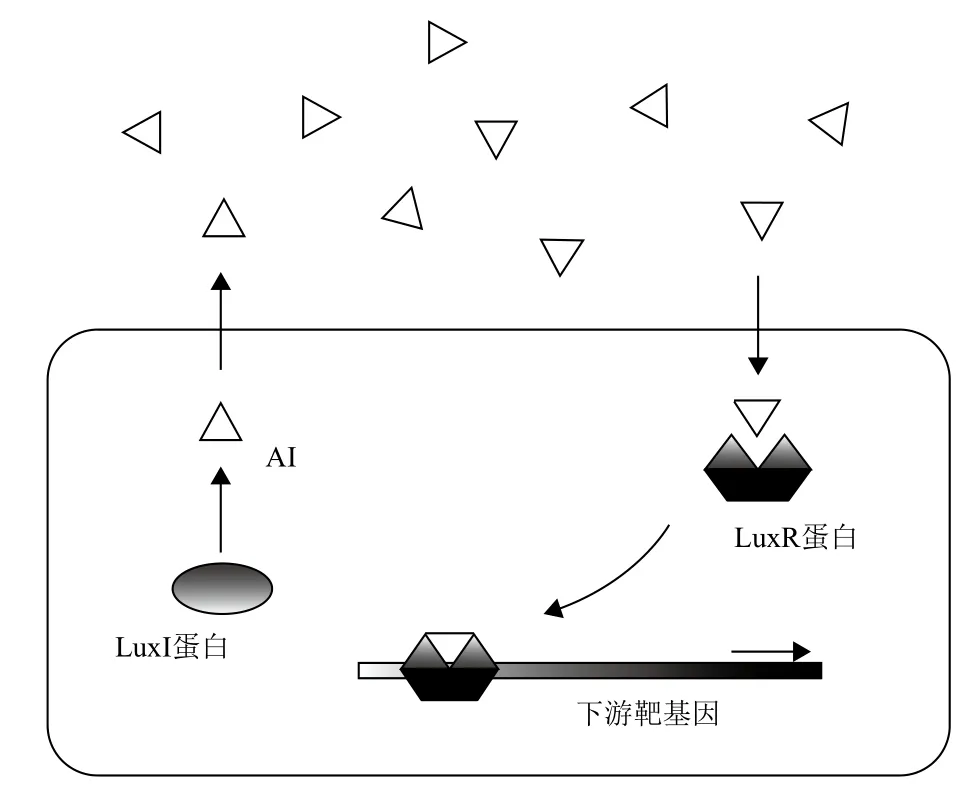
圖1 LuxI-LuxR型調節系統[8]
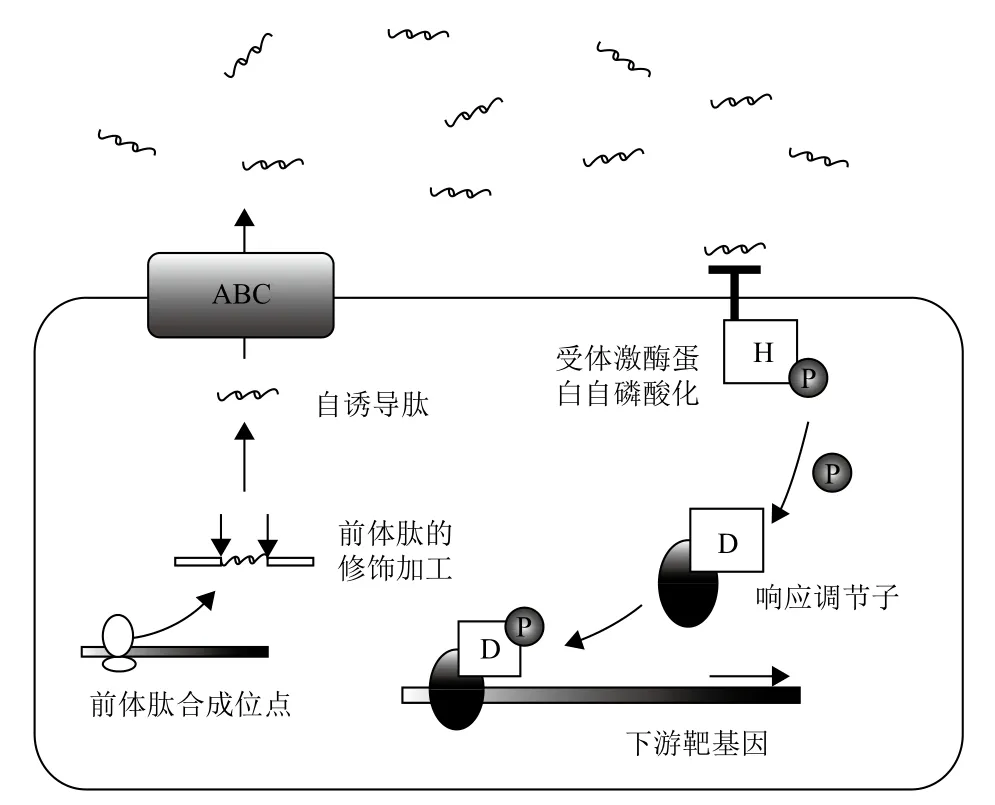
圖2 革蘭氏陽性菌群體感應系統[8]
1.1.2 革蘭氏陽性菌的群體感應系統 革蘭氏陽性菌的群體感應系統主要利用氨基酸和短肽類作為信號分子,AIPs是由體內前體肽經加工修飾后生成的成熟的寡肽信號分子,如圖2所示,它不能自由穿透細胞膜,需要ABC轉運系統(ATP-Binding-cassette)或其他膜通道蛋白的幫助運送到達胞外進而行使功能。這種寡肽信號AIPs隨菌體濃度增加而增加,當達到一定濃度時,被位于膜上的受體激酶蛋白與AIPs信號分子識別后,促進此雙組分磷酸激酶系統中的組氨酸殘基磷酸化,后經天冬氨酸殘基傳遞給受體蛋白,磷酸化的受體蛋白與DNA特定靶位結合,從而起到基因調控表達作用。
1.2 細菌種間群體感應系統
細菌除了種內的群體感應,也存在種間的群體感應。 Mok和Bassler等[9]研究發現,哈氏弧菌QS系統既能識別AHLs分子,也能識別AI-2類分子,并通過識別AI-2類分子感知自身或其他菌數量,進而調節自身行為[10]。AI-2信號分子在任何檢測的菌種中均為呋喃酰硼酸二酯,這一點與AHLs和AIPs信號分子具有細菌特異性不同。細菌識別AI-2信號分子的方式與革蘭氏陽性菌中雙組份激酶的識別系統類似。雙組份激酶識別AI-2信號分子后把磷酸化基團傳遞給受體蛋白并啟動相關基因的表達[11]。AI-2信號分子是上下對稱的雙五環結構的S-腺苷甲硫氨酸。由LuxS基因編碼的蛋白酶催化形成AI-2分子前體物經一系列中間反應后,最終在硼酸離子參與下形成呋喃酰硼酸二酯。因此,LuxS基因被認為是合成AI-2的標志基因,且在革蘭氏陽性菌及革蘭氏陰性菌中均較保守。
1.3 其他QS系統
另外,其他一些細菌基因組中含有LuxS的類似物,能產生AI-3小分子。研究表明,腸出血性大腸埃希氏菌(Enterohemorrhagic escherichia coli)的動力、黏附性及毒力基因的表達受其自身誘導物AI-3參與的QS系統調節[12]。腎上腺素/去甲腎上腺素可誘導腸出血性大腸埃希氏菌毒力基因的表達,而AI-3的作用可被腎上腺素受體拮抗劑抑制,由此可推測AI-3與腎上腺素/去甲腎上腺素結構相似。在真菌中,也有類似細菌的群體感應效應。白色念珠菌(Candida albicans)群體效應分子法尼醇(Farnesol)是真核生物中第一個被發現的群體感應分子[13]。它能通過改變宿主細胞膜通透性而增強白色念珠菌的致病性[14],還能削弱宿主細胞免疫功能[15]、調控生物膜的形成[16]、介導真菌間的相互拮抗作用[17]。另一種在白色念珠菌中發現的群體感應分子是對羥苯基乙醇(Tyrosol)。該分子與farnesol的作用相反,可促進白色念珠菌由酵母相向菌絲相的轉變[18],與farnesol共同調控此轉換。此外,新生隱球菌(Cryptococcus neoformans)中也有群體感應樣分子QSP1(Quorum sensing like peptide,QSP1)的存在,并且發現QSP1與新生隱球菌菌落的形成有關[19]。將從正常菌株培養液上清中分離出的QSP1加入不能正常生長的Δqsp1突變菌平板中可促進該突變菌株形成正常菌落。另有研究[20]發現莢膜組織胞漿菌(Histoplasmosis capsulati)細胞壁中α-1,3葡聚糖糖苷與其致病性密切相關。體外條件下該菌接種密度對糖苷的產生具有顯著影響,接種密度高合成糖苷,接種密度低則不合成糖苷。如果向低密度培養體系中加入高密度培養的上清液則低密度體系可以合成糖苷。這是由于該菌在高密度培養時釋放一種相對分子量大于6 000(kD)的物質,其效應類似于細菌中的自身誘導物,可促進糖苷的合成,構成細胞的胞壁組分。目前真菌的群體感應現象研究開展尚淺,不斷有新群體效應分子被發現,如在酵母(Saccharomycetes)中發現的phenylethanol和tryptophol[21]被證實也屬于群體感應分子,但其理化性質及作用機制尚未明確。一旦建立真菌群體感應同致病性的聯系,并明確其機制就可開發以真菌群體感應為靶點的新型抗菌藥物及治療手段。
2 細菌群體感應在病原菌防治中的應用
2.1 抑制QS系統的應用
抑制QS系統的應用主要包括3個方面:第一,控制病原菌的群體感應從而抑制致病毒素的分泌;第二,抑制QS系統的效應使病原菌難以形成對抗生素有抗性作用的生物被膜,解除病原菌的抗藥性;第三,抑制病原菌的群體感應效應可調節和加強受感染者自身免疫系統的抗病能力[22]。該應用的優勢包括:不會產生抗藥性;具較強的專一性,即在抑制有害菌作用的過程中不會傷害有益菌,尤其是競爭性抑制劑抑制有害菌,有時甚至可以促進有益菌的生長。
2.2 抑制QS系統的途徑
2.2.1 產生降解病原菌信號分子的酶,使病原菌QS系統不能啟動它所控制的基因 Dong等[23]從芽孢桿菌(Bacillus)240B1中分離出能夠降解AHLs的酶——AiiA。AiiA編碼一個AHLs內酯水解酶來水解AHLs的內酯鍵,使其難以達到引發致病因子表達的臨界濃度,從而使病原菌失去致病力[24]。VonBodman和Bauer等在根癌土壤桿菌(Agrobacterium tumefaciens)中發現了與AiiA類似的內酯酶——AttM[25],也能夠有效減弱該菌的致病性。
2.2.2 QS系統抑制劑干擾病原菌生物被膜的形成 近年來,人們發現細菌能產生一種具有協調性、功能性和高度結構性的膜狀復合物——生物被膜(Bacterialbiofilm,BF),其表面包被多聚糖基質,內部包含眾多輸送養料的管道。目前的研究發現近80%以上的人類細菌感染與BF的形成有關[26]。多數細菌BF的形成、發展及功能調節需QS信號分子參與[27-29]。其中,QS信號調控BF的功能主要表現在兩個方面:第一,調控BF的形成,提高菌群耐藥性;第二,直接參與多重耐藥泵的調控,提高菌群耐藥性[30]。例如,霍亂弧菌(Vibrio cholerae)和液化沙雷氏菌(Serratia liquefaciens)中QS信號分子調控被膜所需的外聚物合成和細胞聚集,并觸發其他被膜相關應答從而增強其抗藥性[31]。AHLs是細菌BF內的信息傳遞分子,對形成和維持細菌BF三維結構起著重要作用,所以不產生AHL的缺陷性菌株群體細胞極易被十二烷基磺酸鈉破壞[32]。例如,Bauer等[33]通過合成化合物干擾A1分子信號進而干擾細菌的QS系統,使細菌不發生聚集并形成BF。更多的研究也證實了這一點,Geske等[34]發現對銅綠假單胞菌(Pseudomonas aeruginosa)使用鐵螯合劑可對抗細菌BF的形成。Matsunaga等[35]發現多種兒茶素在亞抑菌濃度可抑制嚙蝕艾肯菌(Eikenella corrodens)BF的形成。Lee等[36]報道了3-吲哚乙腈可減少大腸埃希氏菌O157∶H7細菌BF的形成。因此,通過干擾細菌QS信號來破壞細菌BF形成為解決細菌由于BF引起的細菌耐藥提供了全新的思路。
2.2.3 產生病原菌信號分子的類似物與信號分子受體蛋白競爭結合 阻斷病原菌的QS系統 AHLs信號分子的類似物或拮抗劑可以與AHLs競爭其胞內特異受體蛋白,破壞AHLs的調控機制,使病原菌失去致病力。海洋紅藻產生的鹵化呋喃酮結構和AHLs結構相似,用該鹵化呋喃酮處理費氏弧菌后,其QS系統被競爭性抑制[37]。另外,吡咯酮類化合物、某些取代的HSL化合物、二酮哌嗪類化合物等也能夠起到相類似的競爭性抑制的作用[38]。事實上,通過人工合成的鹵代呋喃酮結構,如Manny等[39]合成的如呋喃酮56可以阻斷AHLs分子與受體蛋白結合且效果顯著。Hentzer等[40]用一種新的呋喃酮衍生物呋喃酮C-30作為銅綠假單胞菌的QS拮抗劑,抑制了編碼多藥外排泵和毒力因子基因的表達。Daniels等[41]的研究亦顯示,一些鹵代呋喃酮化合物還能抑制AI-2分子介導的QS信號系統。實際上除了鹵代呋喃酮,許多呋喃酮衍生物同樣具有群感效應的拮抗作用[42]。目前呋喃類化合物及其衍生物是研究較多的QS系統抑制劑,但其成分復雜且部分化合物具有細胞毒性[43],所以針對呋喃類化合物的作用還有待進一步研究。
2.2.4 利用QS系統中的信號分子來誘發宿主生物的抗性 豌豆、馬鈴薯、苜蓿屬等植物宿主不僅能產生抑制因子干擾細菌QS系統,還能產生AHLs類似物激活QS系統。Schuhegger等[44]研究發現番茄根際可產AHLs的細菌的存在可以誘導植物水楊酸和乙烯依賴的防衛反應,使植物產生對病原真菌交鏈孢屬病菌(Alternaria)的系統誘導抗性。這證明細菌QS系統的信號分子確實能夠誘發植物的一些反應,也為植物抗病性研究提供了新的思路。
另外,還可通過其他方式利用細菌群體感應防治病原菌。Lwewnza等[45]研究發現洋蔥伯克霍爾德菌能借助銅綠假單胞菌產生的AHL物質來控制自身的致病性。作為微生態治療制劑的益生菌乳酸桿菌(Lactobacillus)、糞鏈球菌(Streptococcus faecalis)、芽孢桿菌(Bacillus cohn,1872)、雙歧桿菌(Bifidobacterium)和酵母菌可產生過氧化氫、有機酸、殺菌素和抗生素等,對病原菌有明顯的生物拮抗作用。Brackman等[46]將具有QS抑制活性的物質與抗生素聯用,發現QS抑制劑可提高生物被膜細菌對藥物的敏感性,揭示了這種聯用方式可能是未來治療的一種趨勢。
3 結語
從發現至今,細菌間交流、聯系及在真核細胞侵染中發揮重要作用的QS系統愈來愈被世界各國的研究者所重視。掌握并有效地利用其機制來控制病原菌生物膜的形成、毒力因子的產生、細菌間基因交換等功能無疑為抵御細菌致病、感染、病原菌監測診斷和細菌耐藥性研究提供了一條新的途徑,同時也為QS機制全方位應用于生物技術領域提供了條件,因而具有極為廣闊的前景。
[1]Nealson KH, Hastings JW. Bacterial bioluminescence:its control and ecological significance[J]. Microbiol Rev, 1979, 43(4):496-518.
[2]梁燕, 王志鋼. 細菌的群體感應及與病原菌致病性的關系[J].生物技術通報, 2011(6):35-39.
[3]Atkinson S, Williams P. Quorum sensing and social networking in the microbial world[J]. J R Soc Interface, 2009, 6(40):959-978.
[4]Walter M, Sperandio V. Quorum sensing in Escherichia coli and Salmonella[J]. Int J Med Microbiol, 2006, 296(2-3):125-131.
[5]李曉玲, 王玥瑩, 羅聯響, 等. 天然產物抗細菌的群體感應系統的研究進展[J]. 廣東醫學院院報, 2013, 31(5):593-596.
[6]Miller MB, Bassler BL. Quorum sensing in bateria[J]. Annu Rev Microbiol, 2001, 55:165-199.
[7]張曉兵, 府偉靈. 細菌群體感應系統研究進展[J]. 中華醫院感染學雜志, 2010, 20(11):1639-1642.
[8] 陶金莉, 遲莉麗, 沈亞領, 等.細菌的群體行為調控機制-Quorum sensing[J]. 微生物通報, 2004, 31(4):106-110.
[9] Mok KC, Wingreen NS, Bassler BL. Vibrio harveyi quorum sensing:a coincidence detector for two controls gene expression[J]. EMBO J, 2003, 22(4):870-881.
[10] 郭靜, 李慕巖, 孫明, 等. 細菌的群體感應及其研究進展[J].國際檢驗醫學雜志, 2012, 33(1):1964-1977.
[11] Antunes LC, Ferreira RB. Intercellular communication in bacteria[J]. Crit Rev Microbiol, 2009, 35(2):69-80.
[12] Kendall MM, Sperandio V. Quorum sensing by enteric pathogens[J]. Curr Opin Gastroenterol, 2007, 23(1):10-15.
[13] Hornby JM, Jensen EC, Lisec AD, et al. Quorum sensing in the dimorphic fungus Candida albicans is mediated by farnesol[J]. Appl Environ Microbiol, 2001, 67(7):2982-2992.
[14] Nickerson KW, Atkin AL, Hornby JM. Quorum sensing in dimorphic fungi:farnesol and beyond[J]. Appl Environ Microbiol, 2006, 7(6):3805-3813.
[15] Navarathna DH, Nickers on KW, Duhamel GE, et al. Exogenous farnesol interferes with the normal progression of cytokine expression during candidiasis in a mouse model[J]. Infect Immun,2007, 75(8):4006-4011.
[16] Ramage G, Saville SP, Wickes BL, et al. Inhibition of Candida albicans biofilm formation by farnesol, a quorum-sensing molecule[J]. Appl Environ Microbiol, 2002, 68(11):5459-5463.
[17] Semighini CP, Hornby JM, Dumitru R, et al. Farneso-linduced apoptosis in Aspergillus nidulans reveals a possible mechanism for antagonistic interactions between fungi[J]. Mol Microbiol, 2006,59(3):753-764.
[18] Chen H, Fujita M, Feng Q, et al. Tyrosol is a quorum-sensing molecule in Candida albicans[J]. Proc Natl Acad Sci USA,2004, 101(14):5048-5052.
[19] Lee H, Chang YC, Nardone G, et al. TUP1 disruption in Cryptococcus neoformans uncovers a peptide-mediated density-dependent growth phenomenon that mimics quorum sensing[J].Mol Microbiol, 2007, 64(3):591-601.
[20] Kügler S, Schurtz ST, Groppe EL, et al. Phenotypic variation and intracellular parasitism by histoplasma Capsulatum[J]. Proc Natl Acad Sci USA, 2000, 97(16):8794-8798.
[21] Chen H, Fink GR. Feedback control of morphogenesis in fungi by aromatic alcohols[J]. Genes Dev, 2006, 20(9):150-161.
[22]Boyen F. Quorum sensing in veterinary pathogens:mechanisms,clinical importance and future perspectives[J]. Vet Microbiol,2009, 135(3-4):187-195.
[23] Dong YH, Xu JL, Li XZ, et al. AiiA, an enzyme that inactivates the acylhomoserine lactone quorum-sensing signal andattenuates the virulence of Erwinia carotovora[J]. Proc Natl Acad Sci USA,2000, 97(7):3526-3531.
[24] Gotz C, Fekete A, Gebefuegi I, et al. Uptake, degradation and chiral discrimination of N-acyl-D/L-homoserine lactones by barley(Hordeum vulgare)and yam bean(Pachyrhizus erosus)plants[J]. Anal Bioanal Chem, 2007, 389(5):1447-1457.
[25] Von Bodman SB, Bauer WD, Coplin DL.Quorum sensing in plantpathogenic bacteria[J].Annu Rev Phytopathol, 2003, 41:455-482.
[26] Palmer RJ Jr, Stoodley P. Biofilms 2007:Broadened horizons and new emphases[J]. J Bacteriol, 2007, 189(22):7948-7960.
[27] Sakuragi Y1, Kolter R. Quorum-sensing regulation of the biofilm matrix genes(pel)of Pseudomonas aeruginosa[J]. J Bacteriol,2007, 189(14):5383-5386.
[28] Ahmed NA, Petersen FC, Scheie AA. AI-2 quorum sensing affects antibiotic susceptibility in Streptococcus anginosus[J]. J Antimicrob Chemother, 2007, 60(1):49-53.
[29] Davies D. Understanding biofilm resistance to antibacterial agents[J]. Nat Rev Drug Discov, 2003, 2(2):114-122.
[30] 朱艮苗, 楊維青.群體感應系統對細菌耐藥的調控作用[J].中國抗生素雜志, 2011, 36(1):7-10.
[31] de Kievit TR, Iglewski BH. Bacterial quorum sensing in pathogenic relationships[J]. Infect and Immun, 2000, 68(9):4839-4849.
[32] Horton RE, Grant GD, Matthews B, et al. Quorum sensing negatively regulates multinucleate cell formation during intracellular growth of Burkholderia pseudomallei in macrophage-like cells[J]. PLoS One, 2013, 8(5):e63394.
[33] Bauer WD, Robinson JB.Disruption of bacterial quorum sensing by other organisms[J]. Curr Opin Biotechnol, 2002, 13(3):234-237.
[34] Geske GD, Wezeman RJ, Siegel AP, et al.Small molecule inhibitors of bacterial quorum sensing and biofilm formation[J]. J Am Chem Soc, 2005, 127(37):12762-12763.
[35] Matsunaga T, Nakahara A, Minnatul KM, et al. The inhibitory effects of catechins on biofilm formation by the periodontopathogenic bacterium, Eikenella corrodens[J]. Biosci Biotechnol Biochem,2010, 74(12):2445-2450.
[36] Lee JH, Cho MH, Lee J. 3-indolylacetonitrile decreases Escherichia coli O157:H7 biofilm formation and Pseudomonasaeruginosa Virulence[J]. Environ Microbiol, 2011, 13(1):62-73.
[37] Givskov M, Manefield M. Eukaryotic interference with homoserine lactone-mediated prokaryotic signalling[J]. J Bacteriol, 1996,178(22):6618-6622.
[38] 郭嘉亮, 陳衛民. 細菌群體感應信號分子與抑制劑研究進展[J]. 生命科學, 2007, 19(2):224-232.
[39] Manny AJ, Kjelleberg S, Kumar N, et al. Reinvestigation of the sulfuric acid-catalysed cyclisation of brominated 2-alkyllevulinic acids to 3-alkyl-5-methylene-2(5H)-furanones[J]. Tetrahedron, 1997, 53(46):15813-15826.
[40] Hentzer M, Wu H, Andersen JB, et al. Attenuation of Pseudomonas aeruginosa virulence by quorum sensing inhibitors[J]. EMBO J,2003, 22(15):3803-3815.
[41] Daniels R, Vanderleyden J, Michiels J. Quorum sensing and swarming migration in bacteria[J]. Microbiol Rev, 2004, 28(3):261-289.
[42] Shobharani P, Agrawal R. Interception of quorum sensing signal molecule by furanone to enhance shelf life of fermented milk[J]. Food Control, 2010, 21(1):61-69.
[43] Kuehl R, AI-Bataineh S, Gordon O, et al. Furanone at subinhibitory concentrations enhances Staphylococcal biofilm formation by LuxS repression[J]. Antimicrob Agents Chemother, 2009, 53(10):4159-4166.
[44] Schuhegger R, Ihring A, Gantner S, et al. Induction of systemic resistance in tomato by N-acyI-L-homoserine Laetone-producing rhizosphere bacteria[J]. Plant Cell Environ, 2006, 29(5):909-918.
[45] Lewenza S, Conway B, Greenberg EP, et al. Quorum sensing in Burkholderia cepacia: identification of the LuxRI homologs CepRI[J]. J Bacteriol, 1999, 181(3):748-756.
[46] Brackman G, Cos P, Maes L, et al. Quorum sensing inhibitors increase the susceptibility of bacterial biofilm to antibiotics in vitro and in vivo[J]. Antimicrob Agents Chemother, 2011, 55(6):2655-2661.
(責任編輯 狄艷紅)
Quorum Sensing and Its Application in Preventing and Therapeutic Effect for Pathogenic Bacteria
Liang Xinyan Ruan Haihua
(Department of Biotechnology and Food Science,Tianjin University of Commerce,Tianjin 300134)
Bacteria releases one or several chemical molecules served as signal to estimate the density of bacteria and sense the change of environment. This chemical communication, called as “quorum sensing”(QS)is defined as a density dependent mechanism by which bacteria coordinate expression of specific target genes in response to a critical concentration of signal molecules. A many of studies had showed that the construction of various QS system depends on the type of bacteria. QS system exists widely in pathogenic bacteria, which build up the capability of infection, expression of toxic genes and pathogenesis. Therefore, it is a concerned topic in medicine realm that prevents and cures the diseases caused by pathogenic bacteria by targeting the QS system. Here, this review discussed the QS and its application in preventing and therapeutic effect for pathogenic bacteria.
bacteria;quorum sensing;autoinducer;control;pathogen therapeutic
2014-07-14
國家自然科學基金項目(81101220),天津市應用基礎與前沿研究計劃項目(12JCQNJC08100),“十二五”綜投天津市高校中青年骨干創新人才支持計劃,天津市創新團隊建設項目(TD12-5049)
梁心琰,女,研究方向:微生物與發酵;E-mail:liangxinyanmm@163.com
阮海華,女,博士,副教授,研究方向:微生物與基因工程;E-mail:ruanhaihua@tjcu.edu.cn

