一種耐酸熱普魯蘭酶生產菌種的分子構建及發酵研究
陳 超,劉校函,俞 峰,紀明華,史吉平,4,孫俊松,4,*(1.天津科技大學生物工程學院,天津00457;.中國科學院上海高等研究院,生物煉制實驗室,上海0110;.白銀賽諾生物科技有限公司,甘肅白銀70914;4.上海科技大學生命科學學院,上海0110)
一種耐酸熱普魯蘭酶生產菌種的分子構建及發酵研究
陳超1,2,劉校函3,俞峰3,紀明華2,史吉平2,4,孫俊松2,4,*
(1.天津科技大學生物工程學院,天津300457;2.中國科學院上海高等研究院,生物煉制實驗室,上海201210;3.白銀賽諾生物科技有限公司,甘肅白銀730914;4.上海科技大學生命科學學院,上海201210)
將長野芽胞桿菌的普魯蘭酶基因經密碼子優化后,組建了人工合成的二聯啟動子Pga2,并將它克隆到枯草芽胞桿菌穿梭質粒pMK4-BPB以及自殺質粒pGE-BPB中;經轉化和篩選獲得了中性蛋白酶基因nprE被敲除的普魯蘭酶生產菌株CH-1;該重組菌在基礎培養基中所產普魯蘭酶的酶活達到30.3 U/mL;經過對培養基組分及發酵條件(培養溫度、起始pH,起始接種量等)進行優化,確定了發酵的最適碳源為45 g/L的蔗糖,氮源為60 g/L的麩皮+豆粕時,設定初始培養基的pH為6.2,在培養溫度為32℃時進行發酵,CH-1發酵產重組普魯蘭酶酶活高達268 U/mL。
普魯蘭酶,枯草芽胞桿菌,基因合成,串聯啟動子,發酵優化
普魯蘭酶(Pullulanase,EC 3.2.1.41)是一種能夠水解糖苷鍵的解支酶[1-3],在食品行業中主要用于提高淀粉的利用率。此外,普魯蘭酶還可以與其他糖苷水解酶類協同作用于多種多糖底物,獲得不同類型的降解產物。因此,普魯蘭酶在化工和制藥等行業中也是一種用途廣泛的酶類。根據作用位點的不同,普魯蘭酶可以分為Ⅰ型及Ⅱ型酶[4-6]。Ⅰ型普魯蘭酶只能水解多糖的α-1,6糖苷鍵,而Ⅱ型普魯蘭酶不僅可以水解α-1,6糖苷鍵,也可以內切α-1,4糖苷鍵,兼具α-淀粉酶和普魯蘭酶兩種酶的活性。與Ⅱ型普魯蘭酶相比,Ⅰ型普魯蘭酶的作用位點更加特異,添加效果顯著,目前已得到廣泛的工業應用[7-9]。但目前外資企業申請了大量的生產技術專利,基本壟斷了普魯蘭酶的生產。因此,開發具有自主知識產權的普魯蘭酶生產技術十分必要,并可帶來巨大的經濟效益。
來自長野芽胞桿菌(Bacillus naganoensis)的普魯蘭酶(Bn PulB)最適溫度62.5℃,最適pH在5.0以下,穩定催化溫度在60℃左右,非常適合糖化加工,目前江南大學的實驗組已利用大腸桿菌對該酶成功地進行了分泌生產[10-12],酶活表達量達到1156 U/mL。然而枯草芽胞桿菌因分泌能力強大,被列為安全微生物之一,顯然更適于食品級普魯蘭酶的工業生產。本研究利用化學合成技術獲得了含串聯啟動子的人工操作子盒Bn PulB Cassette(BPB),經質粒構建、同源重組、無痕基因敲除等分子生物學技術,獲得了分泌表達Bn PulB的枯草芽胞桿菌穩定生產菌株,并對培養基及其發酵條件進行了初步的探索,旨為進一步的工業菌株制備及放大生產研究奠定基礎。
1 材料與方法
1.1材料與儀器
枯草芽胞桿菌Bacillus subtilis 168(Bs 168)購自美國菌種保藏中心ATCC;穿梭質粒pMK4由美國芽胞桿菌保藏中心(BGSC)饋贈[13];大腸桿菌Escherichia coli DH5α本實驗室傳代保存;質粒pGENE-nprLR本實驗室構建并保藏;質粒及基因組DNA提取試劑盒、PCR清潔回收試劑盒以及DNA凝膠回收等試劑盒均由AxyGEN公司提供;T4連接酶、去磷酸化酶以及DNA限制性內切酶等由TakaRa公司生產;Taq DNA聚合酶購自Fermentas;高保真DNA聚合酶TOYOBO公司的KOD-Plus-;其他生化試劑均為國產或進口分析純;引物合成、PCR產物的TA克隆、DNA測序和拼接以及DNA合成等服務由蘇州金唯智生物科技有限公司完成;所用的引物對名稱及序列分別為BPB-F(GGACAAGGCTCAACCCG AACGG)/BPB-R1(GGAAACCGTCAACGTGGTACTC ATTG)、NPR-L(TCATTCGGTTAGACAGCGG)/NPRR(CGTAAGC-AAGACGATAGCTGCCGTC)以及NPRL/BPB-R2(GCGAAAACAGGCTGAAGCTGAACATG AG);LB培養基1.0%NaCL,1.0%胰蛋白胨,0.5%酵母浸取物;初始發酵培養基2.0%玉米淀粉,1.0%蛋白胨,0.5%(NH4)2SO4,0.1%KH2PO4,同時每升補加0.25 g MgSO4,0.001 g FeSO4。
ZHWY-2102控溫搖床上海志誠設備廠;TU-1810型紫外分光光度計北京普析通用儀器有限責任公司;SHA-B水浴恒溫振蕩器江蘇國華儀器廠;Mastercycler梯度PCR儀德國Eppendorf;NanoDrop 2000微量分光光度計美國Thermo Scientific。
1.2實驗方法
1.2.1普魯蘭酶表達操作子的設計如圖1(A)所示,用于普魯蘭酶表達的基因操縱子(BPB)包括一個由串聯啟動子Pga2以及進行了密碼子優化的編碼Bn PulB(GenBank:AEV53626.1)的基因序列和一個短的終止子序列,其中Pga2是由啟動子PyxiE[14]及RNA穩定因子CryIIIA[15-16]構成,編碼淀粉酶基因amyL的分泌肽[17]是SPamyL,以上序列文件可見于補充文件。
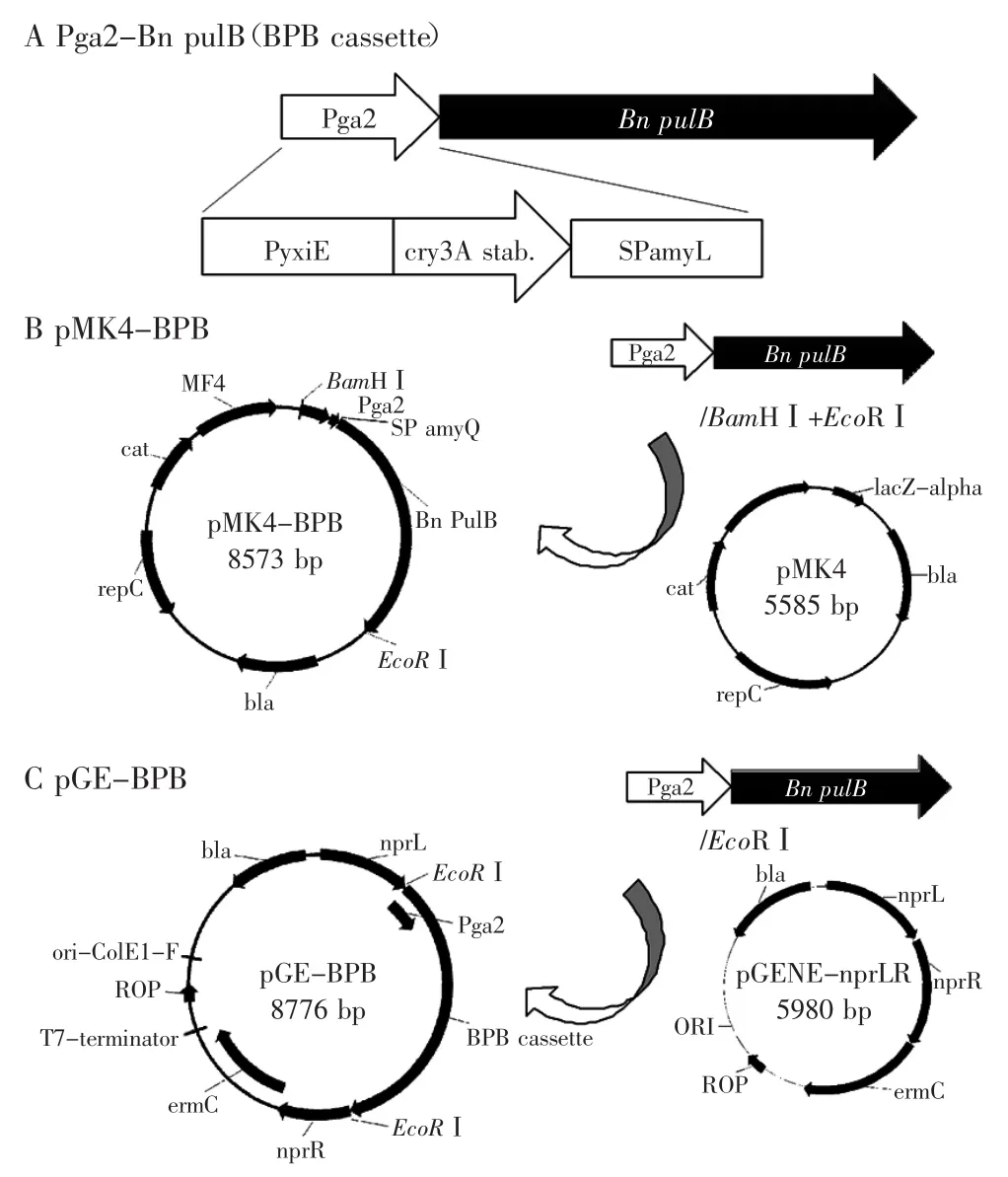
圖1 編碼普魯蘭酶的人工操作子及其表達質粒的構建Fig.1 Construction of plasmids for expression of recombinant pullulanase
1.2.2表達質粒、重組質粒的構建及枯草芽胞桿菌的轉化和二次重組篩選如圖1(B)所示,表達Bn PulB的完整操縱子BPB全長3011個堿基,經BamHⅠ和EcoRⅠ酶切后,構建到枯草芽胞桿菌質粒pMK4中,得到表達質粒pMK4-BPB;而兩端帶有EcoRⅠ位點的BPB由PCR獲得,產物經純化后,以EcoRⅠ酶切,與經EcoRⅠ和去磷酸化處理的線性質粒DNA pGENE-nprLR連接,得到重組質粒pGE-BPB(圖1C)。將pGEBPB轉入枯草芽胞桿菌168感受態細胞,其制備由兩次培養方式完成[18],先將枯草芽胞桿菌168在LB瓊脂板活化,取單克隆在LB中培養,以5%的體積比轉接到SPⅠ培養基中,200 r/min,37℃振動培養大約3 h到對數生長期,然后同樣稀釋轉接到SPⅡ培養基中同樣方式培養大約4 h到對數生長期,2500×g、離心10 min收集形成OD600大約為5.0的濃縮感受態細胞;轉化168感受態細胞時,取1.0 μg的質粒DNA,與50 μL細胞混勻后冰浴30 min,加入5 mL LB培養基于37℃振動培養2 h,最后將細胞濃縮至500 μL,取100 μL涂板到含有篩選標記的培養板上,37℃培養至菌體克隆生成。
如圖2所示,篩選標記的去除通過二次重組完成[19]:首先取2株經驗證已整合有重組質粒的單菌體細胞(168/pGE-BPB),接種到不含抗生素的培養基中,12 h后傳代一次,4~5次傳代后,稀釋并涂到無抗生素的培養板上,取100~200左右的單個菌體克隆,將它們分別在無抗及含有5 μg/mL紅霉素的LB平板上進行抗生素的耐受鑒定,在得到10個左右不耐受抗生素的克隆后,對其進行基因組型的PCR鑒定,最終獲得重組了單拷貝普魯蘭酶基因的菌株CH-1。
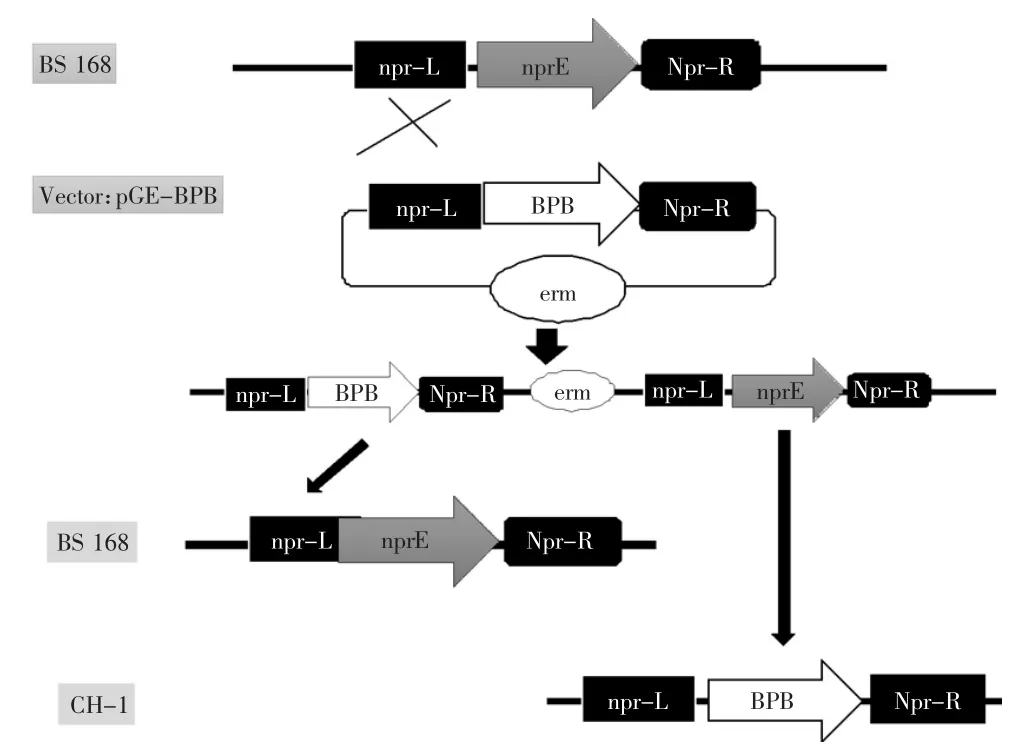
圖2 產普魯蘭酶重組菌株CH-1的構建過程Fig.2 Construction of pullulanase producing strain CH-1 through genomic integration
1.2.3產普魯蘭酶枯草芽胞桿菌的搖瓶培養挑取培養皿上單菌落接到裝有50 mL LB培養基的250 mL三角瓶中,37℃、200 r/min搖床培養16 h,然后以1%的接種量將種子轉接到裝有50 mL培養基的500 mL三角瓶中,37℃、200 r/min搖床培養72 h。發酵液采樣從接種12 h后開始進行,每隔6 h或12 h,取1 mL培養液,10000×g離心5 min收集培養上清及細胞沉淀。
1.2.4產普魯蘭酶枯草芽胞桿菌的發酵優化初始發酵培養基中含有20 g/L的玉米淀粉為碳源,為了確定最適的發酵碳源,分別以20 g/L的玉米粉、甘油、葡萄糖、蔗糖、普魯蘭糖、可溶淀粉等多種碳源替代,然后進行產酶發酵;在確定蔗糖最佳濃度的發酵實驗中,分別添加0.5%、1.0%、1.5%,遞增0.5%直至5.5%的蔗糖作為碳源,取代初始培養基中20 g/L的玉米粉;在分析產酶的最適氮源時,分別以50 g/L的麩皮、豆粕、牛肉膏、蛋白胨、酵母粉、1∶1混合的豆粕+麩皮或者麩皮+蛋白胨,替代初始培養基中的蛋白胨和硫酸銨,碳源為45 g/L的蔗糖;為了確定最適氮源濃度,15、30、45、60、75、90、105 g/L的豆粕+麩皮(1∶1)被用作氮源進行搖瓶發酵,碳源為45 g/L的蔗糖;在最適pH及最佳發酵溫度的確定實驗中,60 g/L豆粕+麩皮和45 g/L蔗糖分別被用作氮源和碳源,發酵溫度分別為30、32、37、40、42℃;在確定最適初始pH時,培養溫度為32℃,60 g/L豆粕+麩皮和45 g/L蔗糖分別被用作氮源和碳源,培養基的初始pH分別調整為4.0、5.0、6.0、6.2(自然pH)、7.0及8.0。
1.2.5普魯蘭酶酶活分析采用3,5-二硝基水楊酸法(DNS法)[20]。略有改動,具體如下:在1.0 mL 0.5%的普魯蘭糖溶液中加入1.0 mL pH4.6的醋酸-醋酸鈉緩沖液,然后加入1.0 mL的酶液(對照組先將1.0 mL酶液沸水浴10 min),于60℃水浴鍋中水浴30 min,加入3,5-二硝基水楊酸3.0 mL,沸水浴10 min,取出后流水冷卻,于550 nm測光吸收值。一個酶活力單位定義為:在上述反應條件下,每分鐘分解普魯蘭糖釋放出1 μmol葡萄糖所需的酶量。
2 結果與分析
2.1產普魯蘭酶重組枯草芽胞桿菌CH-1的PCR鑒定
野生型菌株及重組菌株的基因組型可以使用PCR完成鑒定,其中引物對BPB-F/BPB-R1特異地擴增普魯蘭酶基因pulB的DNA片斷(0.7 ku),主要用于驗證第一次同源重組后的陽性克隆;引物對NPR-L/ NPR-R用于擴增出野生型Bs 168中nprE操縱子的DNA片斷(0.8 ku);而引物對NPR-L/BPB-R2則用于鑒定二次重組后陽性克隆的基因型(2.0 ku)。表達菌株168/pMK4-BPB因含有質粒,進行分子生物學驗證比較容易,因為質粒pMK4-BPB可以從枯草芽胞桿菌中分離提取。而重組菌株CH-1整合了表達普魯蘭酶的操作子BPB,此外,該菌株的中性蛋白酶基因nprE被原位敲除。圖3列出了3組用于鑒定PCR的引物的位置以及PCR產物的理論長度,它們分別為0.7 ku及2.0 ku的普魯蘭酶基因特異DNA片斷和0.8 ku的nprE基因產物。如鑒定結果(圖3)所示,以Bs 168基因組DNA為模板時,只能得到0.8 ku的DNA產物,而以重組菌株CH-1基因組DNA為模板時,可以分別獲得0.7 ku及2.0 ku的兩個PCR產物,完全驗證了CH-1的基因組型。
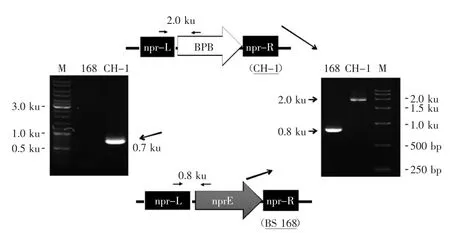
圖3 普魯蘭酶重組菌株CH-1的分子鑒定Fig.3 Molecular identification of markerless strain CH-1 by PCR
2.2重組普魯蘭酶的多拷貝質粒表達及單拷貝的基因組表達
重組菌株168/pMK4-BPB含有多拷貝的表達質粒,抗氯霉素;整合了單一拷貝普魯蘭酶基因的重組菌株CH-1無篩選標記,且敲除了中性蛋白酶基因,遺傳穩定性更好。為了對這兩種表達菌株的產普魯蘭酶能力進行驗證,分別將其接種到含有1.0%葡萄糖的無抗性基本營養培養基中,進行連續發酵培養,時間長達72 h,結果如圖4所示,這兩種重組菌呈現出不同的產酶特點,但均呈現出在特定時間段內出現產酶高峰的特點:168/pMK4-BPB的產酶峰值出現在36 h左右,達到38.3 U/mL,而CH-1的酶活峰值為30.3 U/mL,位于發酵48 h左右。
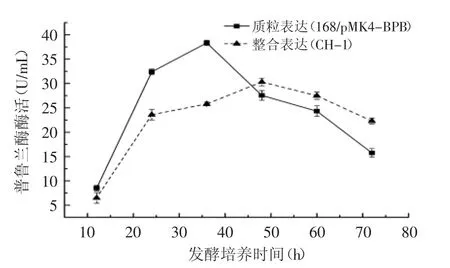
圖4 不同類型的重組菌株的產普魯蘭酶發酵產酶隨時間的變化Fig.4 Production of heterologous pullulanase from different recombinant Bacillus strains
這說明多拷貝的重組菌株在平行發酵中有更好的酶活表現,酶活出峰時間也較早,但隨著時間延長,峰值下降較快,而CH-1雖然酶活稍低,但發酵酶活曲線更為平穩,考慮到CH-1的培養不需要添加抗生素,可以滿足食品工業普魯蘭酶生產的要求。因此,后續的發酵優化,主要集中于對CH-1的研究。
2.3碳源種類及濃度對CH-1產酶的影響
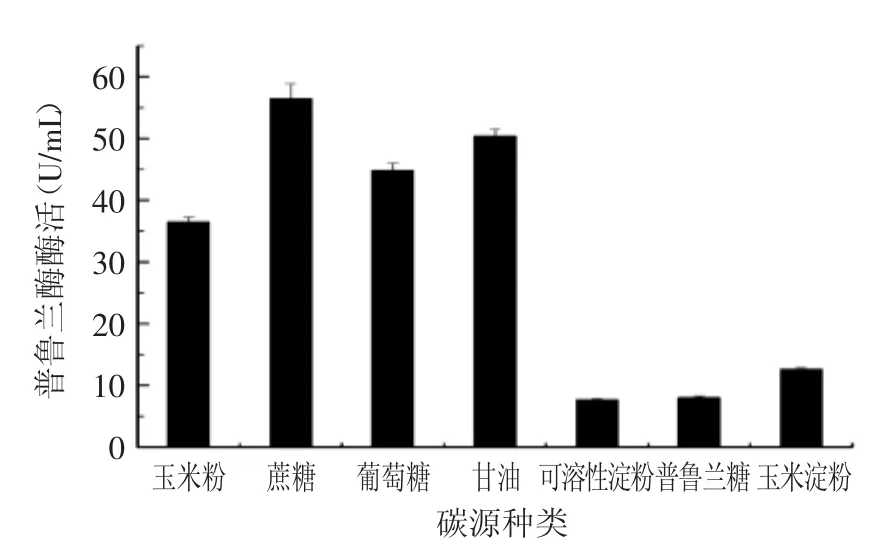
圖5 碳源種類對產酶的影響Fig.5 Effect of carbon sources on the production of Bn PulB
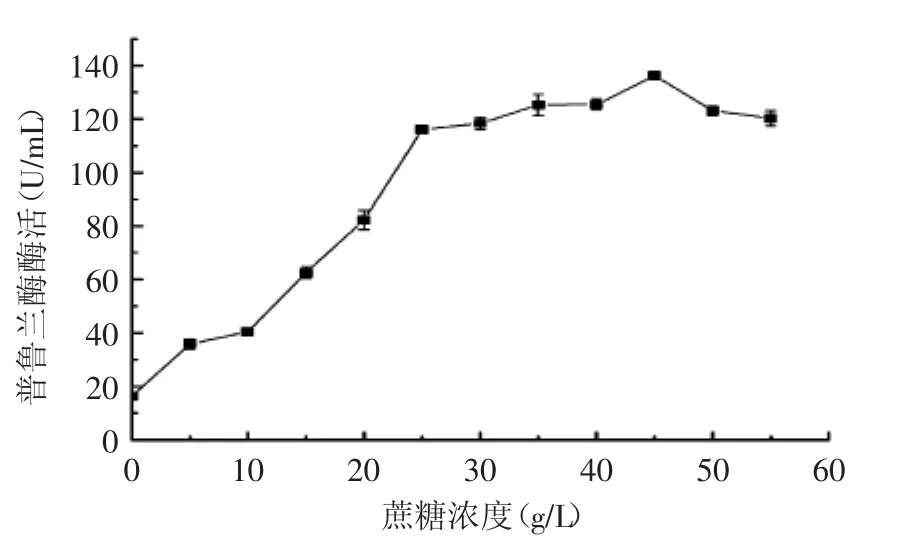
圖6 蔗糖濃度對產酶的影響Fig.6 Effect of sucrose concentration on the production of Bn PulB
培養基中不同碳源對枯草芽胞桿菌蛋白分泌的狀態影響很大,首先通過使用不同種類的碳源替代基礎發酵培養基中的玉米淀粉(20 g/L),在保持其他發酵條件不變的條件下,檢測發酵培養后發酵液的普魯蘭酶活,找出最佳的碳源基本成分。由圖5所示,在以蔗糖和甘油作為碳源時,重組菌的發酵酶活較高,葡萄糖和玉米粉次之,而可溶性淀粉,玉米淀粉的發酵效果不理想。接著測試了在培養基中添加不同濃度的蔗糖對CH-1產普魯蘭酶的影響,由圖6可見,蔗糖添加量為45 g/L時,發酵液中的普魯蘭酶酶活最高,達到137 U/mL。
2.4不同有機氮源及含量對產酶的影響
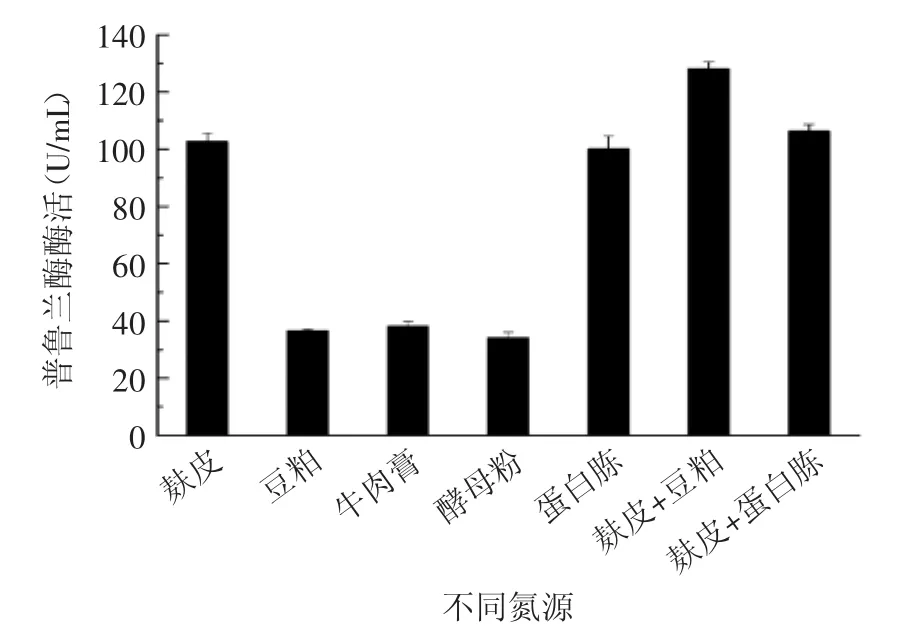
圖7 氮源種類對產酶的影響Fig.7 Effect of different nitrogen source on the production of pullulanase
氮源含量及組成是影響發酵的重要因素之一,根據枯草芽胞桿菌分泌和營養需求的特點,多種不同的有機氮源(圖7)以不同的配比加入培養基中,但總氮源含量確定為50 g/L,結果顯示,在相同的發酵條件下,麩皮+豆粕(麩皮∶豆粕=1∶1)產酶效果最佳,酶活達到128.5 U/mL,而且麩皮和豆粕的價格較為低廉,比較適合工業級放大生產。因此接下來開展了以不同濃度的麩皮和豆粕為氮源的發酵優化,結果如圖8所示,不同濃度的麩皮+豆粕氮源對CH-1發酵產酶產生很大的影響。由圖8可知,當有機氮原料的濃度為90 g/L時,菌株分泌的普魯蘭酶酶活最高,達到214 U/mL。但90 g/L的氮源添加量太大,不僅會造成培養液的粘度過大,不利于菌株的好氧生長,也不利用工業生產中的成本控制,因此,以50~60 g/L左右的麩皮+豆粕作為起始養份,后期發酵中再進行補料可能是更為理想的氮源補加方案。
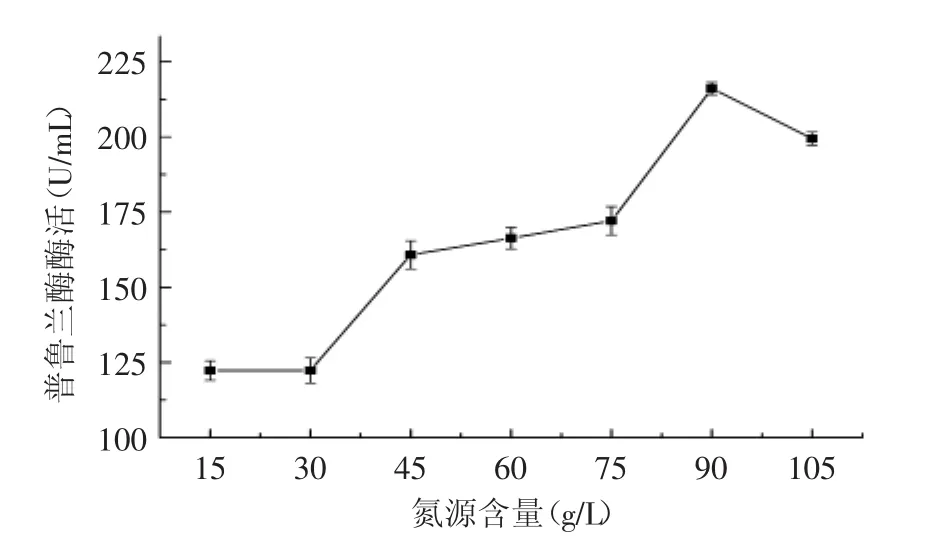
圖8 氮源種類對產酶的影響Fig.8 Effect of concentration of nitrogen source on productivity of recombinant pullulanase
2.5溫度、pH等發酵因素對菌株CH-1產酶的影響
由于Bs 168的發酵培養溫度范圍比較寬,28~42℃均可以正常生長,因此有必要對產酶的最佳溫度進行探索,結果如圖9所示,32℃進行發酵時,分泌產普魯蘭酶酶活最高,達到226 U/mL。而在更高溫度發酵時,雖然細胞生長較快,營養利用速度快,但是檢測到的酶活卻沒有相應提升,提示宿主細胞的最佳繁殖狀態和最佳的產酶狀態沒有保持一致,因此在32℃低溫培養可能更利于重組普魯蘭酶的蛋白折疊或胞外分泌。
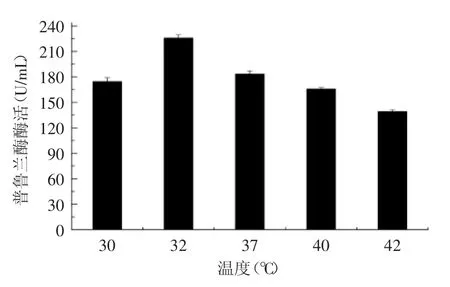
圖9 發酵溫度對產酶的影響Fig.9 Effect of temperature on the expression level of the enzyme
此外,實驗發現,培養基不同的初始pH對普魯蘭酶的重組表達及分泌也有影響,結果如圖10所示,起始pH過大過小都不利于發酵產酶。實驗結果顯示,利用初始pH為6.2的培養基進行發酵時可以獲得比較高的酶活,達到268 U/mL,比優化前的搖瓶發酵的產酶量提高了8倍多,使得CH-1初步具備了進行工業生產的能力,為利用該菌進一步的放大中試培養及發酵優化提供了實驗依據。
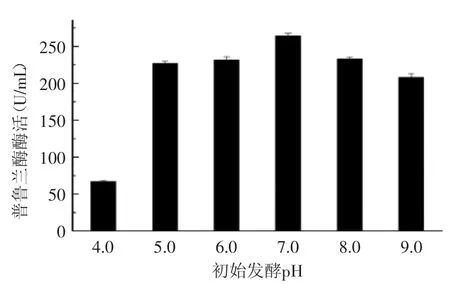
圖10 培養基起始pH對產酶的影響Fig.10 Effect of initial pH of the medium on the expression level of the enzyme
3 結論和討論
普魯蘭酶分泌表達菌株的構建是當前工業酶研究的熱點之一,盡管大腸桿菌也可以高效分泌普魯蘭酶[12,21],但枯草芽胞桿菌表達系統具有生產這類胞外酶的天然優勢。本實驗通過對芽胞桿菌高效啟動子的分子構建,利用基因合成技術,組建了長約3 ku的人工操縱子元件BPB并分別導入表達質粒pMK4及重組質粒pGENE-nprLR中,經轉化后獲得含有表達質粒的枯草芽胞桿菌168/pGE-BPB及整合表達菌株CH-1。初步發酵證實這兩種表達菌株均能分泌表達耐酸熱的普魯蘭酶Bn PulB,擁有多拷貝表達質粒的菌株發酵酶活稍高,但出于遺傳穩定性及食品工業酶生產要求的需要,重點針對CH-1展開了一系列地發酵優化研究,并初步確定了發酵的最適碳源為4.5%的蔗糖,60 g/L麩皮+豆粕為氮源的基本發酵成分,并發現在初始培養基的pH為6.2,培養溫度為32℃時進行發酵,重組普魯蘭酶的酶活達到268 U/mL,是單一因素優化前的8倍多,為今后的多元素組合優化奠定了分析基礎。
本研究中所用的重組枯草芽胞桿菌菌株CH-1只含有一個拷貝的外源操縱子,為進一步提高重組菌株的產酶能力,將來可以利用分子技術整合多份拷貝到宿主細胞的基因組中。而且,由于Bn pulB被整合到基因組中,傳統地物化誘變等依然可以應用于CH-1的誘變育種。由于CH-1不帶抗性基因,可以進一步對細胞展開一系列的基因操作,例如敲除原宿主細胞中與芽胞產生相關的基因sigF[22]、堿性蛋白酶相關基因aprE以及與外源普魯蘭酶競爭分泌通路的淀粉酶基因amyE等,而這些都是可能提升重組普魯蘭酶產量的有效途徑。此外,對發酵過程的各項參數進行精細控制和系統分析,進一步優化發酵過程,確定最佳工業發酵條件,也是有待進行的重要研究內容。
[1]Crabb WD,Shetty JK.Commodity scale production of sugars from starches[J].Current Opinion of Microbiology,1999,2(3):252-256.
[2]Bertoldo C,Antranikian G.Starch-hydrolyzing enzymes from thermophilic archaea and bacteria[J].Current Opinion of Chemical Biology,2002,6(2):151-160.
[3]NishaM, SatyanarayanaT.Recombinantbacterial amylopullulanases:developmentsandperspectives[J]. Bioengineered,2013,4(6):388-400.
[4]Hatada Y,Igarashi K,Ozaki K,et al.Amino acid sequence and molecular structure of an alkaline amylopullulanase from Bacillus that hydrolyzes α-1,4 and α-1,6 linkages in polysaccharides at different active sites[J].Journal of Biological Chemistry,1996,271(39):24075-24083.
[5]焦豫良,王淑軍,呂明生.GH57家族高溫淀粉普魯蘭酶的結構與功能分析[J].微生物學報,2011,51(1):21-28.
[6]Doman-Pytka M,Bardowski J.Pullulan degrading enzymes of bacterial origin[J].Critical Reviews in Microbiology,2004,30(2):107-121.
[7]Chulein MS,Hojer-Pedersen B.Characterization of a new class of thermophilic pullulanase from Bacillus acidopullulyticus[J].Annual New York Academic Sciences,1984,434(7):271-274.
[8]Kunamneni A,Singh S.Improved high thermal stability of pullulanase from a newly isolated thermophilic Bacillus sp.AN-7[J].Enzyme and Microbial Technology,2006,39(7):1399-1404.
[9]Ara K,Saeki K,Igarashi K,et al.Purification and characterization of an alkaline amylopullulanase with both α-1,4 and α-1,6-hydrolytic activity from alkalophilic Bacillus sp. KSM-1378[J].Biochimica et Biophysica Acta,1995,1243(3):315-324.
[10]Teague WT,Brumm PJ.Pullulanase expression construction containing α-amylase promoter and leader sequence.US,6300115[P/OL].2001-10-9.http://www.freepatentsonline.com/ 6300115.pdf.
[11]嚴偉,聶堯,徐巖.長野芽胞桿菌(Bacillus naganoensis)普魯蘭酶在大腸桿菌中的活性表達與分泌調控[J].微生物學報,2013,53(2):145-153.
[12]NIE Y,YAN W,XU Y,et al.High-Level expression of Bacillus naganoensis pullulanase from recombinant Escherichia coli with auto-induction:effect of lac operator[J].PLoS ONE 2013,8(10):e78416.
[13]Brueckner R.A series of shuttle vectors for Bacillus subtilis and Escherichia coli[J].Gene,1992,122(1):187-192.
[14]ZHANG AL,LIU H,YANG MM,et al.Assay and characterization of a strong promoter element from B.subtilis[J]. Biochemical and Biophysical Research Communications,2007,354(1):90-95.
[15]Agaisse H,Lereclus D.Structural and functional analysis of the promoter region involved in full expression of the cryIIIA toxin gene of Bacillus thuringiensis[J].Molecular Microbiology, 1994,13(1):97-107.
[16]Agaisse H,Lereclus D.STAB-SD:a Shine-Dalgarno sequence in the 5’-untranslated region is a determinant of mRNA stability[J].Molecular Microbiology,1996,20(3):634-644.
[17]Sibakov M.High expression of Bacillus licheniformisαamylase with a Bacillus secretion vector[J].European Journal of Biochemistry,1986,155(3):577-581.
[18]李瑞芳,薛雯雯,黃亮.枯草芽孢桿菌(Bacillus subtilis)感受態細胞的制備及質粒轉化方法研究[J].生物技術通報,2011,65(5):227-230.
[19]Arnaud M,Chastanet A,Debarbouille M.New vector for efficientallelicreplacementinnaturallynontransformable,Low-GC-Content,Gram-PositiveBacteria[J].Appliedand Environmental Microbiology,2004,70(11):6887-6891.
[20]Jinho Kang,Kyung-Min Park,Kyoung-Hwa Choi,et al. Molecular cloning and biochemical characterization of a heatstable type I pullulanase from Thermotoga neapolitana[J].Enzyme and Microbial Technology,2011,48(3):260-266.
[21]CHEN A,LI Y,LIU X,et al.Soluble expression of pullulanase from Bacillus acidopullulyticus in Escherichia coli by tightly controlling basal expression[J].Journal of Industrial Microbiology&Biotechnology,2014,41(12):1803-1810.
[22]Margolis P,Driks A,Losick R.Establishment of cell type by compartmentalized activation of a transcription factor[J].Science,1991,254(5031):562-565.
Construction of a thermostable pullulanase producing bacillus strain and its fermentation studies
CHEN Chao1,2,LIU Xiao-han3,YU Feng3,JI Ming-hua2,SHI Ji-ping2,4,SUN Jun-song2,4,*
(1.College of Biotechnology,Tianjin University of Science&Technology,Tianjin 300457,China;2.Shanghai Advanced Research Institute,Chinese Academy of Sciences,Shanghai 201210,China;3.Baiyin Sinozyme Corp,Baiyin 730914,China;4.School of Life Science and Technology,Shanghai Tech University,Shanghai 201210,China)
A codon optimized thermostable pullunase gene(Bn pulB)was synthesized and cloned behind an artificial tandom promter Pga2.The synthetic cassette was used to generate a suicide plasmid pGE-BPB;transformation of the plasmid into Bacillus subtilis 168 led to a pullulanase producing recombinant strain CH-1 with native nprE deleted.Initially,30.3 U/mL of extracellular pullulanase was detected by CH-1 on regular medium supplemented with glucose,up to 268 U/mL of enzyme was detected by fermentation at 32℃ in medium with initial pH at 6.2,using 45 g/L of sucrose as carbon source and 60 g/L of wheat bran plus bean pulp as nitrogen source.
pullulanase;Bacillus subtilis;synthetic operon;tandem promoter;fermentation optimization
TS201.3
A
1002-0306(2015)20-0214-06
10.13386/j.issn1002-0306.2015.20.037
2015-01-22
陳超(1989-),男,碩士研究生,研究方向:生物工程,E-mail:19890801chenwei@163.com。
孫俊松(1974-),男,博士,研究員,研究方向:酶工程與生物化工,E-mail:sunjs@sari.ac.cn。
上海市長三角科技聯合攻關領域項目(15295810600)。

