乳酸菌胞外多糖生理功能及合成途徑的研究進展
秦曉萌,張遠森,柳陳堅,張昆林,楊 恩
(昆明理工大學,生命科學與技術學院,云南昆明650500)
乳酸菌胞外多糖生理功能及合成途徑的研究進展
秦曉萌,張遠森,柳陳堅,張昆林,楊恩*
(昆明理工大學,生命科學與技術學院,云南昆明650500)
乳酸菌(Lactic acid bacteria,LAB)是一類重要的益生微生物,同時也是一類重要的工業發酵菌,在食品發酵生產上應用廣泛,它的代謝產物也受到極大關注。本文總結了乳酸菌代謝合成的胞外多糖(Exopolysaccharide,EPS)的主要生理生化功能以及胞外多糖合成的四個主要過程,以期為乳酸菌EPS的應用、產量提高及結構改造提供指導。
乳酸菌,胞外多糖,生理功能,代謝途徑
乳酸菌(Lactic acid bacteria,LAB)是一類能發酵糖類產生乳酸的細菌的總稱,目前發現的這類細菌在分類學上至少有23個屬,其中在工業生產上應用較多的有7個屬[1],包括鏈球菌屬(Streptococcus),乳桿菌屬(Lactobacillus),明串珠菌屬(Leuconostoc),雙歧桿菌屬(Bifidobacterium),片球菌屬(Pediococcus)等。乳酸菌在食品行業中應用廣泛,與人體健康關系密切,具有調節腸道菌群平衡、免疫調節、抗腫瘤等多種生理活性[1],有學者認為上述生理活性與細胞表面多糖分子相關[2]。乳酸菌胞外多糖(Exopolysaccharide,EPS)是一種次生代謝產物,與細胞連接松散或直接分泌到環境中[3]。胞外多糖可分為粘液多糖和莢膜多糖,莢膜多糖和粘液多糖之間沒有明確的界限,細菌莢膜多糖經常會失去與細胞膜的結合而溶解到溶液中[4]。乳酸菌EPS的分子量通常在4.0×104~6.0×106u之間[3],可分為同多糖和雜多糖。同多糖僅由一種單糖所構成,一般為葡萄糖或果糖。而雜多糖則是由多種單糖構成,單糖先聚合為3~8個單體構成的寡糖重復單元,再聚合成為多糖[5]。乳酸菌代謝產生的EPS是一種安全的天然產物,通常是作為食品添加劑和增稠劑使用[6-7]。
目前具有商業價值的乳酸菌多糖是由一種腸膜明串珠菌合成的同多糖——右旋糖苷,可以用于凝膠過濾的組分和血漿的替代品[8]。但是由于乳酸菌EPS的產量過低,提取成本高,無法滿足工業規模的需求[9]。如果將EPS用作食品添加劑,那么EPS發酵生產的濃度需要達到10~15g/L,而目前已報道的最高生產濃度是2.767g/L[5]。然而,現代分子生物學和基因工程技術的不斷發展以及比較基因組學等方法應用于乳酸菌的相關研究,為提高乳酸菌EPS產量提供了有效的理論基礎和技術手段。
1 乳酸菌胞外多糖的生理功能
1.1乳酸菌EPS的粘附作用。
EPS可以作為一種粘附因子,幫助乳酸菌在腸道黏膜上定植[10],具有改善人體腸道環境的功能[4]。EPS還能選擇性促進有益菌的增殖,進而抑制有害菌的增殖和有害物質的產生[11]。當前,比較基因組學和功能基因組研究發現人乳中的特定的糖對嬰幼兒腸道微生物的發展起到了重要的作用[12]。然而,細菌胞外多糖的粘附作用也會產生一定的負面影響,例如變異鏈球菌(S.mutans)能夠合成一種葡聚糖(Glucan),使菌體黏附在牙齒的表面腐蝕牙釉質而導致齟齒[13]。
1.2乳酸菌EPS的抗氧化作用
乳酸菌EPS具有抗氧化活性并且具有低細胞毒性已得到廣泛的報道[14],有研究認為多糖的抗氧化性質與分子量相關,分子量越小抗氧化活性越強[15]。Lai等[16]對分離自高粱酒糟泡菜的產EPS乳酸菌的抗氧化性質進行了研究,發現短乳桿菌A3(L.brevis A3)、植物乳桿菌B2(L.plantarum B2)、短乳桿菌C9(L.brevis C9)和短乳桿菌D7(L.brevis D7)四種乳酸菌的完整細胞和無細胞提取物均具有抗氧化活性。在對羥自由基、DPPH和脂質過氧化的分析中,L.brevis D7的完整細胞和無細胞提取物均具有最好的氧化清除活性,而同時L.brevis D7的胞外多糖產量也最高,說明EPS對乳酸菌的抗氧化性質具有重要作用。將動物雙歧桿菌RH(B.animalis RH)所產EPS分離純化,得到一種主要的胞外多糖EPSa,并發現濃度為0.2mg/mL時,EPSa片段對DPPH自由基的清除活性與0.25mg/mL的抗壞血酸相當;而EPSa對羥自由基和超氧陰離子自由基的清除活力、脂質超氧化的抑制能力都要明顯優于抗壞血酸[17]。
1.3乳酸菌EPS的免疫調節作用
乳酸菌EPS具有免疫調節作用,但并不是所有的多糖都具有免疫活化功能,這表明多糖的理化特征與其生物功能特性密切相關。EPS的結構特性與免疫調節性質的關系包括以下兩個方面[18]:含有負電荷側鏈結構的酸性雜多糖具有良好的誘導免疫反應的作用;雜多糖的體積或分子量大就會抑制免疫反應的發生。
乳酸乳球菌乳脂亞種KSV20(Lactococcus lactis subsp.cremoris KSV20)是一種廣泛用于斯堪的納維亞發酵酸奶viili生產的菌種,該菌合成一種雜多糖能夠誘導體外培養的鼠脾巨噬細胞產生IFNγ和IL-1α。這種多糖結構中的吡喃型半乳糖側鏈被磷酸基團所取代[19],多糖中的酸性片段能夠有效地誘導巨噬細胞的增殖和活化。將雜多糖中的磷酸基團脫去后發現多糖的免疫刺激減弱,從而證明了磷酸基是一種免疫反應的分子激活物[20]。除了磷酸基團外,多糖中含有硫酸基團也可以刺激免疫細胞分泌出細胞素類物質。嗜鹽四聯球菌KK221(Tetragenococcus halophilus KK221)合成的巖藻聚糖(fucoidan)[21](有26.7%硫酸基團),通過比較完整多糖和脫硫酸化多糖的免疫刺激效應發現,在含有硫酸基團的狀態下具有良好的免疫激活作用,而脫硫酸化多糖的免疫激活作用下降。多糖的免疫激活作用與硫酸基團有關,而與多糖鏈的長度無關,這說明硫酸基團對上調細胞素類物質是必需的。
乳酸菌多糖分子量與免疫調節作用的關系也有一系列的報道。鼠李糖乳桿菌ATCC9595(L.rhamnosus ATCC9595)及其變異菌株鼠李糖乳桿菌RW-9595M(L.rhamnosus RW-9595M)產生的低分子量EPS和高分子量EPS分別刺激老鼠腹腔粘膜的巨噬細胞,L.rhamnosus ATCC9595合成的低分子量的EPS可以誘導巨噬細胞產生高水平的TNF、IL-6和IL-12,而高分子量的EPS誘導產生的TNF和IL-6水平較低[22]。
此外,乳酸菌的免疫調節作用還具有菌株差異性,即不同的乳酸菌及計量可以引起不同的免疫反應。一些乳酸菌主要是誘導發生先天性免疫反應,包括抑制炎癥應答、調節Toll樣受體(Toll-like receptors,TLRs)的表達、活化自然殺傷細胞(Nature killer cells,NK cells)、活化樹狀細胞(Dendritic cells,DCs)和其他抗原呈遞細胞(Antigen presenting cells,APC cells);另一些乳酸菌則誘導后天免疫反應,包括促進淋巴細胞增殖、胃腸道特異性的IgA的產生以及Th1/Th2應答的平衡[23]。
目前乳酸菌細胞表面糖類物質的免疫調節作用已經得到普遍認同,未來研究的重點是了解乳酸菌與宿主在體內的互作以及這些表面免疫物質的分子基礎[24]。
1.4乳酸菌的抗腫瘤作用
乳酸菌具有抗腫瘤活性,特別是對結直腸癌具有很好的預防作用。一些研究對來自于乳酸菌的組分的抗腫瘤活性進行分析,發現來自于乳酸菌的肽聚糖、多糖片段和糖蛋白都具有抗腫瘤作用[25]。Chong[11]認為乳酸菌的抗癌效應機制包括以下幾個方面:乳酸菌能夠利用胞外多糖粘附在腸道黏膜表面,競爭性抑制有害菌的附著,改善腸道的菌落結構;改變腸道菌落的酶活性,抑制與致癌物產生相關的酶活性,包括β-葡糖苷酸酶(β-glucuronidase)、β-葡糖苷酶(β-glucosidase)、硝基還原酶(Nitroreductase)和偶氮還原酶(Azoreductase)。這些酶類催化產生致癌物,可以導致結直腸癌的發生;乳酸菌缺少7α-脫羥化酶(7α-dehydroxylase)活性,可以減少具有致癌作用的次級膽酸(脫氧膽酸Deoxycholic acid,DCA;石膽酸Lithocholic acid,LCA)的產生,EPS有利于機體中膽酸的排除。再者乳酸菌EPS及肽聚糖還可以結合體內的N-亞硝基組分和黃曲霉毒素等致癌物、致突變劑,預防由DNA損傷誘導的癌變發生。
乳酸菌作為一類廣泛利用的微生物,不僅具有抗氧化、抗腫瘤、抗炎和免疫調節[26]等重要的生理活性,并具有分泌產糖的特性。這使得乳酸菌一直是工業生產、醫藥保健等領域研究開發的熱點之一。而乳酸菌EPS由于其多方面的作用,且不同于其他的食品添加劑,是一種原位發酵的天然產物,因而被認為是一種安全的食品物質(General Recognised As Safe status,GRAS)[3],受到越來越多的關注。但乳酸菌合成EPS的產量普遍較低,不能滿足工業生產的需求,還不能成為動物性多糖和植物性多糖的替代品[27]。因此,需要對乳酸菌胞外多糖合成相關的基因和合成途徑進行全面研究,使基因工程操作成為可能。
2 乳酸菌EPS的合成
2.1乳酸菌雜多糖(Heteropolysaccharides,HePS)的合成
EPS的合成過程是復雜的,有大量的基因參與這個過程。目前了解還不全面,但可以確定EPS的合成途徑分為四個過程[6],包括:將參與反應的單糖轉運進入細胞質中;葡糖-1-磷酸的合成;糖的活化和鏈接聚合;EPS的輸出過程。
EPS合成中編碼相關的酶和調節蛋白基因的座位是不同的,有的乳酸菌的基因位于質粒上,而另一些乳酸菌的基因則位于染色體上[6]。乳酸菌產生胞外多糖的能力也是不穩定的,這與細胞中遺傳物質的不穩定性有關。
2.1.1參與反應的單糖轉運進入細胞質單糖的轉運系統分為三類:初級轉運系統:通過轉運特異性ATP酶將單糖的轉運與ATP的水解偶聯起來,利用ATP水解獲得的能量實現單糖的運輸;二級轉運系統:這一系統中單糖的轉運不與ATP的水解偶聯,而是與離子或其他溶質的同向或反向跨膜運輸相偶聯;烯醇式丙酮酸-糖特異性磷酸轉移酶系統(PEPPTS)。在這一系統中,磷酸烯醇式丙酮酸(PEP)提供能量,糖特異性的磷酸轉移酶系統(PTS)負責單糖的轉運[7]。
將單糖轉運進入細胞質的最常見機制是烯醇式丙酮酸-糖特異性磷酸轉移酶系統(PEP-PTS)[28]。PEP-PTS系統包括一系列蛋白,分別負責底物連接、跨膜轉運和底物的磷酸化。PEP-PTS系統中第一類蛋白包括酶I(即包含組氨酸殘基的磷酸載體蛋白HPr)和酶II(即糖特異性的透過酶復合物)[29]。如圖1所示[6],首先磷酸烯醇式丙酮酸(PEP)將磷酸基團傳遞給酶I,酶I的組氨酸殘基接受磷酸基團,HPr轉變為磷酸化的HPr(His-P)[28]。同時酶II復合物與糖單體結合,負責糖的跨膜運輸并將HPr(His-P)上的磷酸基團轉移到糖單體上[30]。在單糖的運輸及磷酸化的過程中,PEP是磷酸基團的供體,單糖是磷酸基的最終受體。微生物不同,PEP-PTS系統的組成也可能不同,L.lactis的乳糖轉運PEP-PTS系統的酶II由三種蛋白構成,分別是:酶IIA、酶IIB、酶IIC[31]。
第二類蛋白具有調節營養物質吸收的功能。目前最清楚的調節蛋白是由一種代謝調控蛋白CcpA和PTS載體蛋白HPr形成的一種二聚體蛋白[32]。HPr有His和Ser兩個磷酸化位點。CcpA蛋白與Ser磷酸化的HPr(Ser-P)結合,抑制活性單糖的轉運[33]。
2.1.2葡糖-1-磷酸的合成細胞質中磷酸化單糖的代謝取決于其磷酸化的狀態,葡糖-6-磷酸進入分解途徑,葡糖-1-磷酸參與多糖的合成。通過PEPPTS系統進入細胞的一般是葡糖-6-磷酸。而在葡糖-6-磷酸轉變為葡糖-1-磷酸的過程中,磷酸葡糖變位酶(PGMs)發揮了重要作用。PGMs對糖的代謝具有調控作用[34-35]。細胞中存在兩種磷酸葡糖變位酶(PGMs):α-PGM和β-PGM。如圖1所示,β-PGM的作用是將β-葡糖-1-磷酸轉變為葡糖-6-磷酸;而α-PGM則是將葡糖-6-磷酸轉變為α-葡糖-1-磷酸并用于合成EPS[34-35]。但是用葡萄糖培養L.lactis時,葡萄糖必須先轉換為葡糖-6-磷酸再用于EPS的合成[36]。除了上述產生α-葡糖-1-磷酸的途徑外,還有一些替代途徑,這些途徑的不同之處在于糖原和轉運系統的差異[37-38]。
2.1.3糖核苷酸的合成與EPS重復單元的聚合此過程所需的基因分為兩組:核苷糖生物合成基因和EPS合成特異性基因。
第一組基因與核苷糖的合成有關,核苷糖用于重復單元的合成,主要有UDP-glucose、UDP-galactose和dTDP-rhamnose[6]。核苷糖合成完成,進入EPS合成階段。這一階段的酶是EPS特異性酶,屬于第二組基因的編碼產物。這些基因的組成在不同細胞內相對保守,由四個互不重疊的結構域組成,如圖2所示[5]。在革蘭氏陽性細菌中,EPS特異性基因簇依次為調節序列、鏈長決定序列、重復單元合成序列、聚合及輸出序列[5]。
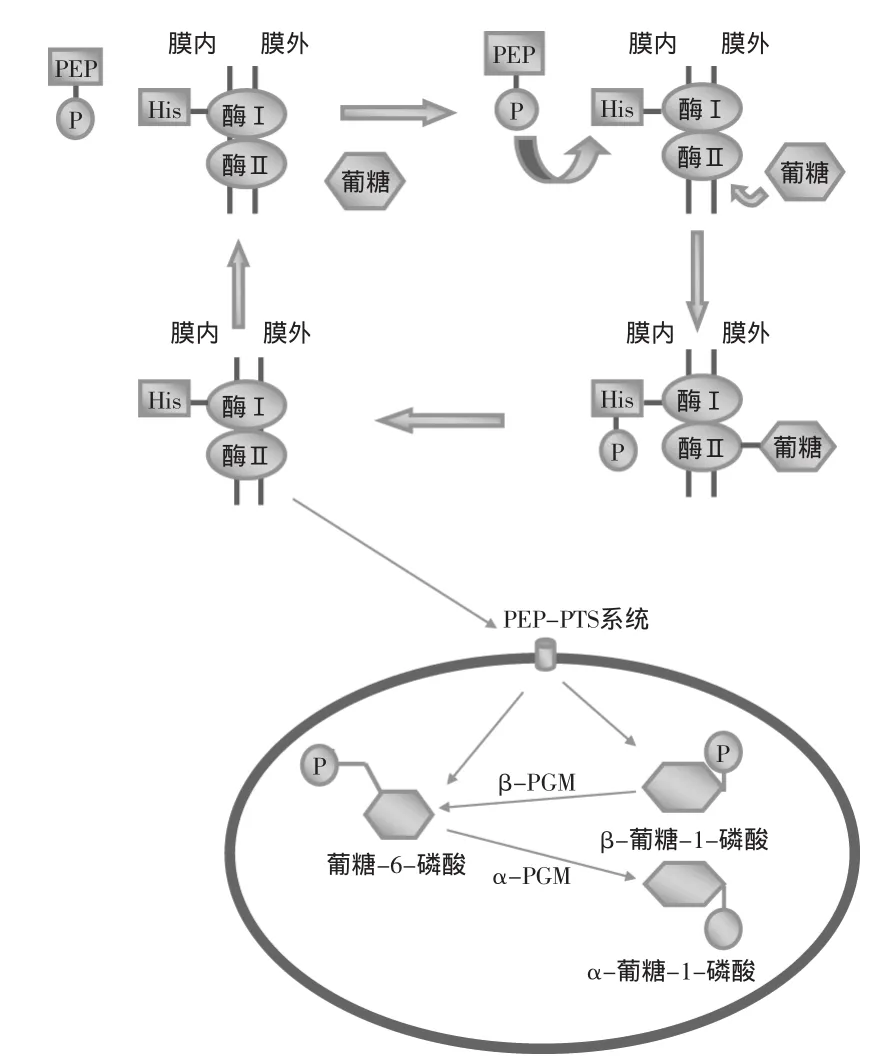
圖1 PEP-PTS系統對糖單體的轉運示意圖Fig.1 PEP-PTS system diagram of sugar monomer transfer
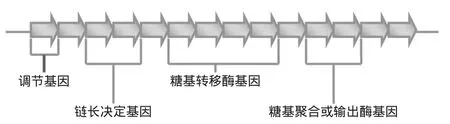
圖2 EPS特異性基因分布示意圖Fig.2 Distribution of EPS-specific genes
重復單元的合成是在細胞質膜的內表面完成的。首先在特異性糖基轉移酶作用下,UDP-糖作為糖基供體將糖轉移到脂質載體(十一異戊烯磷酸,Und-P)上形成脂載體焦磷酸化糖(Und-PP-糖)。然后通過各種不同的糖基轉移酶將不同的糖依次轉移到脂質載體上,形成脂載體焦磷酸化糖重復單元(Und-PP-糖重復單元)。最后在翻轉酶作用下將Und-PP-糖重復單元轉移到細胞外[39]。
2.1.4EPS的聚合及分泌自然界中多糖的種類及結構雖然千變萬化,但它們的合成途徑相對一致,即在特異性糖基轉移酶作用下將單糖依次轉移到脂質載體上形成寡糖重復單元,再轉移到胞外并聚合為多糖。重復單元的起始、聚合和輸出是多糖合成的主要步驟,根據這些步驟的差異可將這一過程分為三種類型,即Wzy依賴途徑、ABC轉運依賴途徑和合成酶依賴途徑[40]。
Wzy依賴途徑是O-抗原合成的主要途徑,并作為多糖合成的模型[41]。在糖基轉移酶作用下,脂載體焦磷酸化糖(Und-PP-糖)不斷延伸形成脂載體焦磷酸化重復單元(Und-PP-糖重復單元),Und-PP-糖重復單元在翻轉酶Wzx作用下輸出到細胞外;然后通過聚合酶Wzy形成一個長鏈的O-抗原;Wzz在O-抗原聚合過程中控制寡糖重復單元的數量,即決定了糖鏈的長度。
現在對重復單元的聚合方式以及參與整個過程的酶還不完全了解。但是可以概括出一個簡單的EPS聚合和轉運的模型。首先在翻轉酶作用下,脂載體焦磷酸-糖重復單元(Und-PP-糖重復單元)從膜的內表面轉移到外表面,然后聚合酶將重復單元連接為一個長鏈,最后酶催化脂載體和糖鏈的分離并起到控制鏈長的作用。
2.2乳酸菌同多糖(Homopolysaccharides,HoPS)的合成
在乳酸菌細胞中同多糖的合成要簡單許多。同多糖的合成發生在細胞外[3],由特異性糖基轉移酶即葡聚糖-蔗糖酶(Glycansucrases)或果聚糖-蔗糖酶(Fructansucrase)催化合成。在細胞外,乳酸菌通過Glycansucrases利用蔗糖作為底物來合成同多糖,多糖合成過程所需的能量也來自蔗糖的水解[13]。同多糖合成不需要其他能量,因為其過程中不需要將糖類轉運進入細胞內,也不需要將單糖轉化為活性核苷糖形式,因此乳酸菌能很容易將蔗糖轉變為同多糖。由蔗糖轉化為HoPS的反應如下[13]:

葡聚糖、果聚糖是最為常見的同多糖[13],其中果聚糖中主要包括β-2,6糖苷鍵和β-2,1糖苷鍵;葡聚糖中主要通過α-1,6糖苷鍵、α-1,3糖苷鍵、α-1,4糖苷鍵和α-1,2糖苷鍵與α-D-葡糖基團連接,而β-D-葡聚糖主要以β-1,3鍵和β-1,2鍵連接。由于HoPS的合成過程較為簡單,對能量要求不高,所以HoPS既可以在培養基中合成,也可以在無細胞的酶液中合成[42]。
3 結論及展望
乳酸菌胞外多糖是一種安全的微生物次生代謝產物,不僅能夠改善乳制品的口感和風味,還具有抗氧化、抗腫瘤、抗炎癥和免疫調節等顯著的益生作用,應用前景廣闊。
乳酸菌EPS作為一種粘附因子有助于乳酸菌在腸道中粘附定植,進而競爭性抑制有害菌的附著增殖,減少有害菌數量,同時也減少了有害物質的產生。EPS具有很好的抗氧化作用,這種抗氧化特性與分子量的大小關系密切,同時乳酸菌EPS具有很低的細胞毒性的優點,是一種潛在的優良抗氧化物質。乳酸菌EPS還具有免疫調節作用,這種作用與EPS的來源,種類和結構有關。通常情況下含有負電荷側鏈的酸性多糖以及分子量越小的EPS具有較好的免疫調節作用。不同的乳酸菌對免疫系統的激活也具有差異性,有些主要誘導先天性免疫,另一些則誘導后天免疫。這種免疫激活的菌種特異性的分子基礎還有待進一步研究。乳酸菌EPS具有抗腫瘤活性,這一特性與乳酸菌的粘附作用、抗氧化作用和免疫調節作用緊密相連。抗氧化活性可以抑制機體的氧化性損傷,防止DNA損傷誘發的癌變;免疫調節作用可以提高機體免疫系統活性,抑制癌細胞的增殖和轉移,促進癌細胞的凋亡;EPS的附著吸附作用一方面能夠幫助菌體定植,增加EPS體內留存時間以加強其作用效果,另一方面也可以吸附有害有毒成分,減小對細胞的破壞。
乳酸菌EPS的生物合成機制是胞外多糖研究的一個重要方面,可以為EPS的定向改造提供理論依據和指導方向。當前乳酸菌EPS的合成機制還并不十分清楚完善,但可以確定乳酸菌合成胞外多糖的四個主要步驟,包括:單糖分子進入細胞質;葡糖-1-磷酸的合成轉化;糖的活化與寡糖重復單元的合成;EPS的聚合與輸出。其中雜多糖的聚合過程較為復雜,組分與結構多樣,并且主要過程發生于細胞質中,需要ATP等提供能量;而同多糖的合成過程相對簡單,主要分為葡聚糖和果聚糖,底物通常是蔗糖,在細胞外合成,能量來源于蔗糖中糖苷鍵的水解。因此,乳酸菌同多糖的產量一般要高于雜多糖的產量。鑒于國內外現狀,多糖合成機理的研究有限,重點主要集中在合成條件的研究篩選。
現在人們對于乳酸菌和大型可食用真菌(如香菇、靈芝)的多糖類物質的研究不斷深入,對它們的特性也更加了解。這促使更多的人將目光集中在多糖的研究上,大量的新型菌株不斷被發現,更多的多糖被分離出來。陸地上的極端生境、海洋、極地以及太空都是具有巨大潛力的微生物種源地,其中大量有價值的微生物還有待開發。未來的研究重點在于多糖結構與功能的關系。多糖的結構復雜,包括單體的種類、單體數量、連鍵類型以及側鏈的差異。目前多糖的結構與功能關系并不清楚,什么樣的結構具有抗氧化作用,什么種類的側鏈能夠賦予多糖抗腫瘤特性等,弄清其結構功能的關系有助于多糖產品的開發、改性與定向改造。
[1]張筠,劉寧,孟祥晨.乳酸菌胞外多糖生物學活性[J].國外醫學衛生學冊,2004,31(4):227-230.
[2]Fanning S,Hall JL,Cronin M,et al.Bifidobacterial surfaceexopolysaccharide facilitates commensal-host interaction through immune modulation and pathogen protection[J].PNAS,2012,109(6):2108-2113.
[3]Ruas-Madiedo P,Hugenholtz J,Zoon P.An overview of the functionality of exopolysaccharides produced by lactic acid bacteria[J].Int Dairy J,2002,12:163-171.
[4]Costerton JW,Irvin RT,Cheng KJ,et al.The role of bacterial surface structures in pathogenesis[J].Crit Rev Microbiol,1981,8(4):303-338.
[5]Welman AD,Maddox IS.Exopolysaccharides from lactic acid bacteria:perspectives and challenges[J].Trends Biotechnol,2003,21(6):269-274.
[6]Laws A,Gu Y,Marshall V.Biosynthesis,characterization,and design of bacterial exopolysaccharides from lactic acid bacteria[J].Biotechnol Adv,2001,19(8):597-625.
[7]De Vuyst L,De Vin F,Vaningelgem F,et al.Recent developmentsinthebiosynthesisandapplicationsof heteropolysaccharides from lactic acid bacteria[J].Int Dairy J,2001(11):687-707.
[8]Badel S,Bernardi T,Michaud P.New perspectives for lactobacilli exopolysaccharides[J].Biotechnol Adv,2011,29(1):54-66.
[9]Nwodo UU,Green E,Okoh AI.Bacterial exopolysaccharides:functionality and prospects[J].Int J Mol Sci,2012,13(11):14002-14015.
[10]Vélez MP,De Keersmaecker SC,Vanderleyden J.Adherence factors of Lactobacillus in the human gastrointestinal tract[J]. FEMS Microbiol Lett,2007,276(2):140-148.
[11]Chong ES.A potential role of probiotics in colorectal cancer prevention:review of possible mechanisms of action[J].World J Microbiol Biotechnol,2014,30(2):351-374.
[12]Zivkovic AM,German JB,Lebrilla CB,et al.Human milk glycobiome and its impact on the infant gastrointestinal microbiota[J].PNAS,2011,108:4653-4658.
[13]Monsan P,Bozonnet S,Albenne C,et al.Homopolysaccharides from lactic acid bacteria[J].Int Dairy J,2001,11:675-685.
[14]Pan D,Mei X.Antioxidant activity of an exopolysaccharide purified from Lactococcus lactis subsp.lactis 12[J].Carbohyd Polym,2010,80:908-914.
[15]Chen H,Zhang M,Qu Z,et al.Antioxidant activities of different fractions of polysaccharide conjugates from green tea(Camellia Sinensis)[J].Food Chem,2008,106:559-563.
[16]Lai Y,Tsai S,Lee M.Isolation of Exopolysaccharide Producing Lactobacillus Strains from Sorghum Distillery Residues Pickled Cabbage and their Antioxidant Properties[J].Food Sci Biotechnol,2014,23(4):1231-1236.
[17]Xu R,Shen Q,Ding X,et al.Chemical characterization and antioxidant activity of an exopolysaccharide fraction isolated from Bifidobacterium animalis RH[J].Eur Food Res Technol,2011,232:231-240.
[18]Hidalgo-Cantabrana C,López P,Gueimonde M,et al. Immune modulation capability of exopolysaccharides synthesized by lactic acid bacteria and bifidobacteria[J].Probiotics Antimicro Prot,2012,4:227-237.
[19]Nakajima H,Hirota T,Toba T,et al.Structure of the extracellular polysaccharide from slime-forming Lactococcus lactis subsp.cremoris SBT 0495[J].Carbohyd Res,1992,224:245-253.
[20]Kitazawa H,Harata T,Uemura J,et al.Phosphate group requirement for mitogenic activation of lymphocytes by an extracellularphosphopolysaccharidefromLactobacillus delbrueckii ssp.bulgaricus[J].Int J Food Microbiol,1998,40(3):169-175.
[21]Kawashima T,Murakami K,Nishimura I,et al.A sulfated polysaccharide,fucoidan,enhances the immunomodulatory effects of lactic acid bacteria[J].Int J Mol Med,2012,29(3):447-453.
[22]Bleau C,Monges A,Rashidan K,et al.Intermediate chains of exopolysaccharides from Lactobacillus rhamnosus RW-9595M increase IL-10 production by macrophages[J].J Appl Microbiol,2010,108(2):666-675.
[23]Tsai YT,Cheng PC,Pan TM.The immunomodulatory effects of lactic acid bacteria for improving immune functions and benefits[J].Appl Microbiol Biotechnol,2012,96(4):853-862.
[24]Wells JM.Immunomodulatory mechanisms of lactobacilli[J]. Microb Cell Fact,2011,10:1-15.
[25]Lee do K,Jang S,Kim MJ,et al.Anti-proliferative effects of Bifidobacterium adolescentis SPM0212 extract on human colon cancer cell lines[J].BMC Cancer,2008,8:1-8.
[26]Saad N,Delattre C,Urdaci M,et al.An overview of the last advances in probiotic and prebiotic field[J].LWT-Food Sci Technol,2013,50:1-16.
[27]Canquil N,Villarroel M,Bravo S,et al.Behavior of the rheological parameters of exopolysaccharides synthesized by three lactic acid bacteria[J].Carbohyd Polym,2007,68:270-279.
[28]PostmaPW,LengelerJW,JacobsonGR.Phosphoenolpyruvate:carbohydrate phosphotransferase systems of bacteria[J].Microbiol Rev,1993,57(3):543-594.
[29]Viana R,Monedero V,Dossonnet V,et al.Enzyme I and HPr from Lactobacillus casei:their role in sugar transport,carbon catabolite repression and inducer exclusion[J].Mol Microbiol,2000,36(3):570-584.
[30]Sliz P,Engelmann R,Hengstenberg W,et al.The structure of enzyme IIAlactosefrom Lactococcus lactis reveals a new fold and points to possible interactions of a multicomponent system[J]. Structure,1997,5(6):775-788.
[31]Wang G,Louis JM,Sondej M,et al.Solution structure of the phosphoryl transfer complex between the signal transducing proteinsHPrandIIAGlucoseoftheEscherichiacoli phosphoenolpyruvate:sugar phosphotransferase system[J].EMBO J,2000,19(21):5635-5649.
[32]Van den Bogaard PT,Kleerebezem M,Kuipers OP,et al. Control of lactose transport,β-galactosidase activity,and glycolysis by CcpA in Streptococcus thermophiles:evidence for carbon catabolite repression by a non-phosphoenolpyruvate-dependent phosphotransferase system sugar[J].J Bacteriol,2000,182(21):5982-5989.[33]Suárez CA,Blancato VS,Poncet S,et al.CcpA represses the expression of the divergent cit operons of Enterococcus faecalis through multiple cre sites[J].BMC Microbiol,2011(11):1-13.
[34]Sj?berg A,Hahn-H?gerdal B.β-glucose-1-phosphate,a possible mediator for polysaccharide formation in maltoseassimilating Lactococcus lactis[J].Appl Environ Microbiol,1989,55(6):1549-1554.
[35]Degeest B,De Vuyst L.Correlation of activities of the enzymes α-phosphoglucomutase,UDP-galactose 4-epimerase,and UDP-glucose pyrophosphorylase with exopolysaccharide biosynthesis by Streptococcus thermophilus LY03[J].Appl Environ Microbiol,2000,66(8):3519-3527.
[36]Ramos A,Boels IC,De Vos WM,et al.Relationship between glycolysis and exopolysaccharide biosynthesis in Lactococcus lactis[J].Appl Environ Microbiol,2001,67(1):33-41.
[37]Grobben GJ,Smith MR,Sikkema J,et al.Influence of fructose and glucose on the production of exopolysaccharides and the activities of enzymes involved in the sugar metabolism and the synthesis of sugar nucleotides in Lactobacillus delbrueckii subsp. Bulgaricus NCFB 2772[J].Appl Microbiol Biot,1996,46:279-284.
[38]De Vos WM,Vaughan EE.Genetics of lactose utilization in lactic acid bacteria[J].FEMS Microbiol Rev,1994,15(2-3):217-237.
[39]丹彤,王俊國,張和平.乳酸菌胞外多糖的結構、生物合成及其應用[J].食品科學,2013,34(7):335-339.
[40]陳蕾蕾,王未名,祝清俊,等.細菌多糖的生物合成機制[J].微生物學報,2010,50(12):1583-1589.
[41]Whitfield C,Valvano MA.Biosynthesis and expression of cell-surface polysaccharides in gram-negative bacteria[J].Adv Microb Physiol,1993,35:135-246.
[42]姚晶,任婧,吳正鈞,等.乳酸菌胞外多糖的生物合成及其遺傳調控[J].食品與發酵工業,2011,37(2):11-16.
Progress on the physiological functions and synthesis pathways of lactic acid bacteria exopolysaccharide
QIN Xiao-meng,ZHANG Yuan-sen,LIU Chen-jian,ZHANG Kun-lin,YANG En*
(Kunming University of Science and Technology,Faculty of Life Science and Technology,Kunming 650500,China)
Lactic acid bacteria(LAB)were important probiotic microorganisms and critical industry bacteria,which were widely used in fermentation foods.The fermentation productions which produced by LAB were attracted great attention.This paper provided an overview of the main physiological and biochemical functions of exopolysaccharide(EPS)which produced by LAB.Besides,four metabolic pathways which related to exopolysaccharide biosynthesis also had been summarized,in order to provide evidence for the EPS applications,raising yields and structure modification.
lactic acid bacteria;exopolysaccharide;physiological functions;metabolic pathways
TS201.2
A
1002-0306(2015)14-0389-06
10.13386/j.issn1002-0306.2015.14.072
2014-10-28
秦曉萌(1990-),男,碩士研究生,研究方向:食品微生物。
楊恩(1982-),女,博士,講師,研究方向:食品微生物。
云南省昆明理工大學人才培養項目(14118480);昆明理工大學分析測試基金(20140707)。

