甲硫醚降解菌JLM-8的分離鑒定與降解條件優化
邱吉國,李愛文,葉杰旭,陳建孟
?
甲硫醚降解菌JLM-8的分離鑒定與降解條件優化
邱吉國,李愛文,葉杰旭,陳建孟
(浙江工業大學生物與環境工程學院,浙江杭州 310014)
從制藥廠的活性污泥中分離到一株能以唯一碳源和硫源降解甲硫醚的菌株JLM-8,經過生理生化測試與16S rDNA系統發育樹分析鑒定為嗜麥芽寡養單胞菌()。通過測定菌株的生長量、甲硫醚的降解率,利用響應面法優化最佳降解條件,并測定了該菌降解甲硫醚的動力學參數。結果表明:當接種量為25 mg·L-1時,通過響應面法優化的最佳降解條件為溫度31.3℃、pH 7.5,初始甲硫醚濃度50 mg·L-1時最大預測降解率為98.2%,實驗驗證降解率為97.9%。菌株降解動力學參數最大比降解速率、半飽和系數抑制系數分別為2.37 h-1、143.55 mg·L-1、51.35 mg·L-1,臨界抑制濃度為78.46 mg·L-1。
甲硫醚;嗜麥芽寡養單胞菌;降解;動力學;環境
引 言
隨著我國化工、石化、輕工等工業的迅速發展,大量揮發性有機硫化物(volatile organic sulfur compounds,VOSCs)被隨意排放進入大氣中,其中甲硫醚(dimethyl sulfide,DMS)是主要的有機硫化物。同大多數VOSCs一樣,DMS是惡臭氣體,嗅閾值較低[(0.07~5.9)×10-3μl·L-1][1-2],且其具有生物毒性和腐蝕性,當空氣中的濃度高于0.5 μl·L-1時就可對身體健康產生危害[3]。DMS這一惡臭氣體的存在嚴重影響了人們的生活質量,給人類的健康帶來極大的危害[4-5]。在工業生產中,DMS是低碳硫醚系列的主要品種之一,是重要的化工原料和中間體,可以合成多種農藥殺蟲劑、殺菌劑,在合成農藥領域占有重要地位。因此采用高效經濟的方法來處理DMS是一項意義重大的舉措[6]。國內外有不少的學者采用化學法、物理法來處理DMS[7],但是這些方法都存在一定的缺陷和不足,這些方法需要較高的成本和能量供應,并會產生二次污染,因此,化學、物理的方法不是經濟有效的處理方法。相比之下,生物法處理惡臭氣體既環保又經濟,尤其對那些低濃度高通量的惡臭氣體的去除更加有效[8-10]。
當前大部分報道的降解菌株都能利用DMS為唯一碳源和能源生長,如Suylen等[11]從造紙廠生物過濾器中篩選到的sp. EG。Sch?fer[12]從英吉利海峽的海水中篩選的sp. DMS026。少部分細菌則只能以共代謝的方式降解DMS,如ATCC 19178a[13]和NI[14]。另外,不動桿菌sp. 20B能利用DMS為硫源生長[15]。在厭氧條件下,一些產甲烷古菌如和等可以利用硝酸鹽作為電子受體厭氧轉化DMS[3]。這些不同的降解方式顯示了微生物代謝DMS的生物多樣性。研究結果顯示,DMS降解菌雖分布較廣,但DMS降解能力較弱[16-17]。因此,為提高環境中DMS的降解效率,進一步篩選高效降解DMS的菌種,并研究其生物降解特性就具有重要的意義[18]。
在本文的研究中,從活性污泥中分離得到了一株DMS的高效降解菌嗜芽單胞菌JLM-8,采用響應面分析的方法[19]優化菌株的降解條件,用動力學模型分析底物的降解情況以及菌體的生長情況,為生物法處理DMS污染物奠定了生物學基礎。
1 實驗材料和方法
1.1 試劑與培養基
甲硫醚購自上海百靈威科技公司。其他常規試劑購自杭州常青化工公司。
基礎無機鹽培養基(MSM,g·L-1):Na2HPO4·12H2O 4.5,KH2PO41.0,NH4Cl 1.5,MgCl20.2,CaCl20.023,微量元素母液1 ml。微量元素母液(g·L-1):FeCl21.0,H3BO30.014, MnCl20.10,ZnCl20.10,Na2MoO4·2H2O 0.02,CoCl2·6H2O 0.02。
LB培養基(g·L-1):蛋白胨 10,酵母膏 5,NaCl 10。
1.2 降解菌株的分離鑒定
活性污泥取自浙江臺州某醫藥廠污水池。將污泥放置廣口瓶中,以DMS為唯一碳源和能源進行馴化、富集。數月后取上層菌懸液,接種至含50 ml MSM培養基的250 ml密封藍蓋瓶中,以DMS作為唯一碳源和能源,30℃、180 r·min-1繼續培養。將在藍蓋瓶中經過多次傳代富集的混合菌液進行稀釋涂布,依據菌體群落的差異性挑取單菌落,進行多次劃線分離后,再接種至以DMS為唯一碳源和能源的MM培養基中,驗證其是否具有DMS降解能力。選擇具有DMS降解能力的純菌,低溫保藏。除觀察菌落特征外,還要結合顯微鏡等設備檢測并記錄菌體的個體形態特征,并進一步用JEOLJEM- 1200EX透射電子顯微鏡觀察菌體形態。
常規生理生化方法按照文獻[20]的方法進行。16S rDNA序列分析:以菌株基因組DNA為模板,以16S rDNA通用引物(27F和1492R)擴增全長的16S rDNA序列。PCR產物經上海生工生物工程公司測序后,所得DNA序列在GenBank進行BLAST,對獲得的同源序列進行分析,用ClusterX4.0進行序列分析,采用Mega5.0鄰位相連法構建進化樹。
1.3 菌體培養
從斜面中將菌種轉接至裝100 ml LB培養基的250 ml三角瓶中,置于30℃、180 r·min-1搖床培養12 h,離心收集菌體(4℃、9000 r·min-1、10 min),并用磷酸緩沖液(50 mmol·L-1、pH 8.0)沖洗2次,得到降解用靜息細胞,再加入適量液體基礎鹽培養基配制成靜息細胞懸濁液。
1.4 DMS的降解實驗
在測定菌株利用DMS的生長情況時,使菌種接種量在5 mg·L-1。在培養條件優化及放大培養中,控制培養液初始生物量為25 mg·L-1進行降解。DMS初始濃度為50 mg·L-1,于30℃、180 r·min-1搖床培養。同時設未接種的對照組。定期取樣測定菌體生長和DMS的殘留情況。細菌的生長情況通過單位體積的生物量(干重)的值來進行檢測,剩余的DMS的量通過GC來測量。在相同的條件下,菌株JLM-8對DMS降解動力學分析采用不同的起始濃度(25、50、100、150、200、250和300 mg·L-1)。
1.5 響應面法優化DMS降解條件
利用響應面法優化菌株JLM-8對DMS的最佳降解條件。采用Design-Expert(version 8.0.6)軟件,依據Box-Benhnken的中心組合試驗設計原理,以溫度、pH和降解菌株初始接種量3個反應條件為自變量,以DMS的降解率(%)為響應值進行優化,因素和水平值見表1。
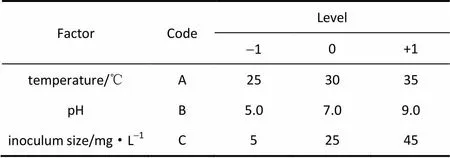
表1 試驗設計的因素及對應值
1.6 DMS的降解動力學模型
依據式(1)計算底物DMS的不同起始濃度與菌株JLM-8的比降解速率
式中,為比降解速率,h-1;為底物濃度,mg·L-1;為反應時間,h。
菌株JLM-8的比生長速率依據Haldane’s模型進行計算[21-22],其方程如下
式中,max為最大比降解速率,h-1;s為半飽和系數,mg·L-1;i為抑制常數,mg·L-1。
1.7 分析方法
DMS通過帶有FPD檢測器的安捷倫氣相色譜(HP-Innowax 硅膠毛細管柱,30 m×0.32 mm×0.5 μm,J&W Scientific,USA)測定,方法為:H2和空氣流速50 ml·min-1,載氣為N2,流速為200 ml·min-1,進樣口溫度、柱溫、檢測器溫度分別為180、100、180℃。每個樣品進樣量為200 μl。
2 實驗結果與討論
2.1 降解菌的分離和鑒定
經過馴化、富集、稀釋涂布、挑取單菌落等一系列步驟后,根據菌體群落形態的差異,篩選出一株菌體能高效降解DMS,將其命名為JLM-8。菌株JLM-8利用無機鹽培養基中的DMS作為唯一的C源和S源,10 h內能將50 mg·L-1的DMS降解完全。菌株革蘭染色呈陰性,桿狀,大小為(0.2~0.5)μm×(1.2~1.7)μm,無芽孢,平板上菌落呈小圓狀、白色、形態飽滿、光滑濕潤,易挑起,菌苔沿劃線生長。V-P試驗、H2S試驗、氧化酶試驗、淀粉水解試驗呈陽性,吲哚試驗、明膠液化試驗、甲基紅試驗、接觸酶試驗、精氨酸雙水解試驗、熒光色素試驗呈陰性。菌株能利用麥芽糖、檸檬酸和蘋果酸生長,不能利用甘露糖和乳酸。該菌對紅霉素和四環素有耐藥性,對于青霉素、氯霉素和慶大霉素敏感。以菌株的基因組DNA為模板PCR獲得 約1400 bp的16S rDNA擴增產物(GenBank:KP979740)。通過BLAST發現該菌16s rDNA序列與嗜麥芽寡養單胞菌模式菌株B6(GenBank:JQ579644)和.D457(GenBank:HE798556)的相似度分別為100%和99.4%。JLM-8的系統發育樹如圖1所示。根據菌株生理生化特性與16S rDNA系統發育樹分析,將JLM-8鑒定為嗜麥芽寡養單胞菌()。迄今為止,尚未有嗜麥芽單胞菌屬(spp.)的菌株具有DMS降解能力的報道。
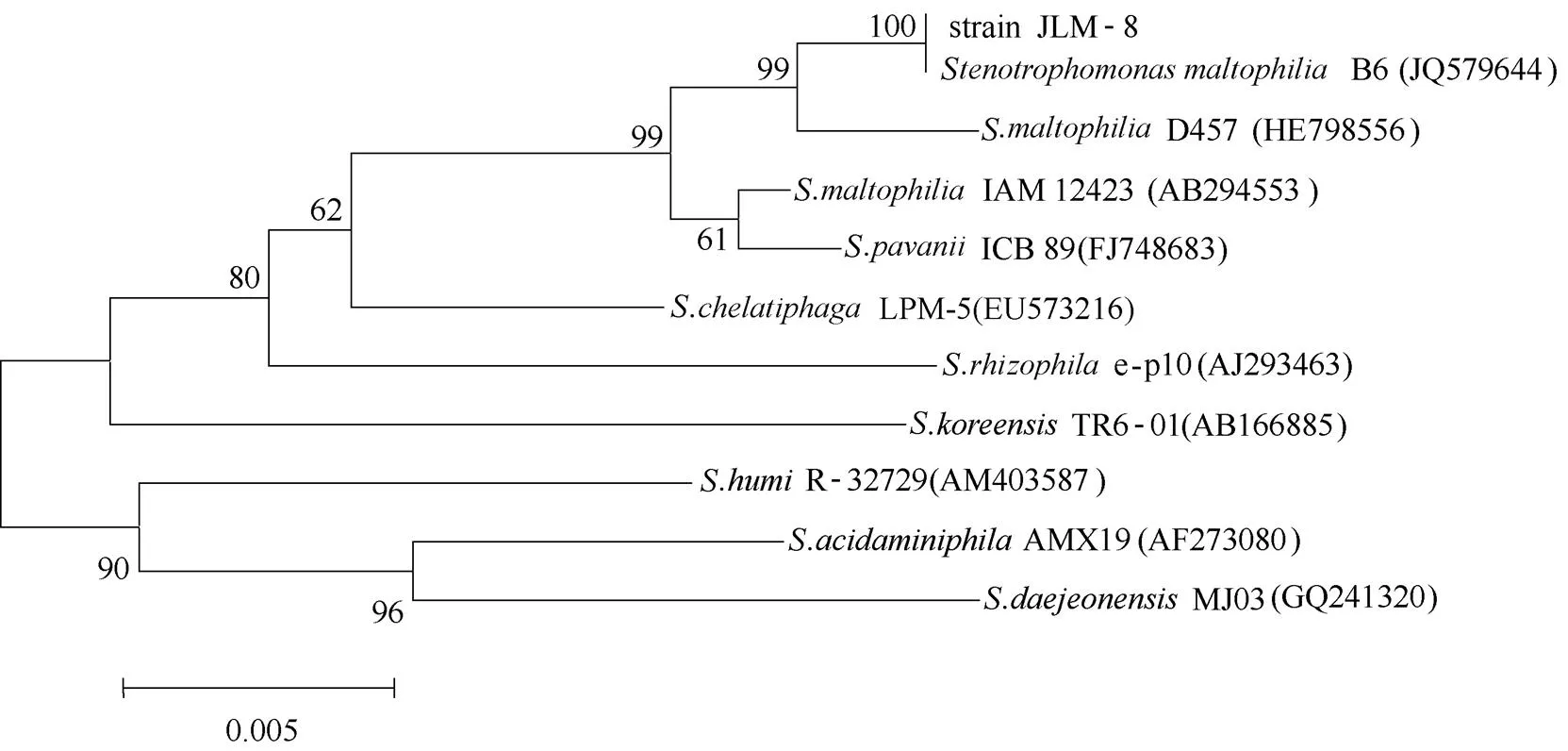
圖1 JLM-8與Stenotrophomonas屬中典型菌株的系統發育樹
2.2 菌株JLM-8利用DMS的生長特性
菌株JLM-8在MSM中以DMS為唯一碳源、硫源的降解過程及菌體的生長曲線如圖2所示。在接種后的2~8 h,底物DMS的降解速率最大,約90%。經過10 h后,DMS降解率接近100%。菌株JLM-8降解DMS的速率為6.25 mg·L-1·h-1,優于已報道的兩株細菌sp. 20B(5.65 mg·L-1·h-1)[15]和DS1(5.9 mg·L-1·h-1)[23]。經過約4 h的延滯期,菌體生長迅速增加,最終濃度達到26 mg·L-1。菌體在DMS降解完后繼續生長可能是降解中間產物沒有完全降解,JLM-8能利用中間產物繼續生長。
2.3 菌株JLM-8降解DMS的最佳降解條件
根據單因素試驗結果,設定溫度在25~35℃之間,初始pH范圍在5.0~9.0之間,接種量在5~45mg·L-1之間,以DMS降解率為響應值,經軟件Design Expert V8.0.7設計出響應面分析S試驗,結果見表2。用Design Expert對試驗數據(表2)中的DMS降解率的試驗數值進行多項式回歸擬合,可以得出各影響因子對響應值的影響,得到二次多項式方程如下
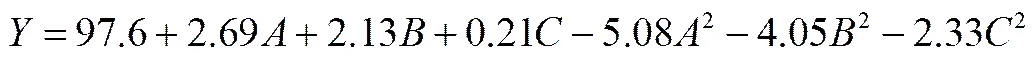
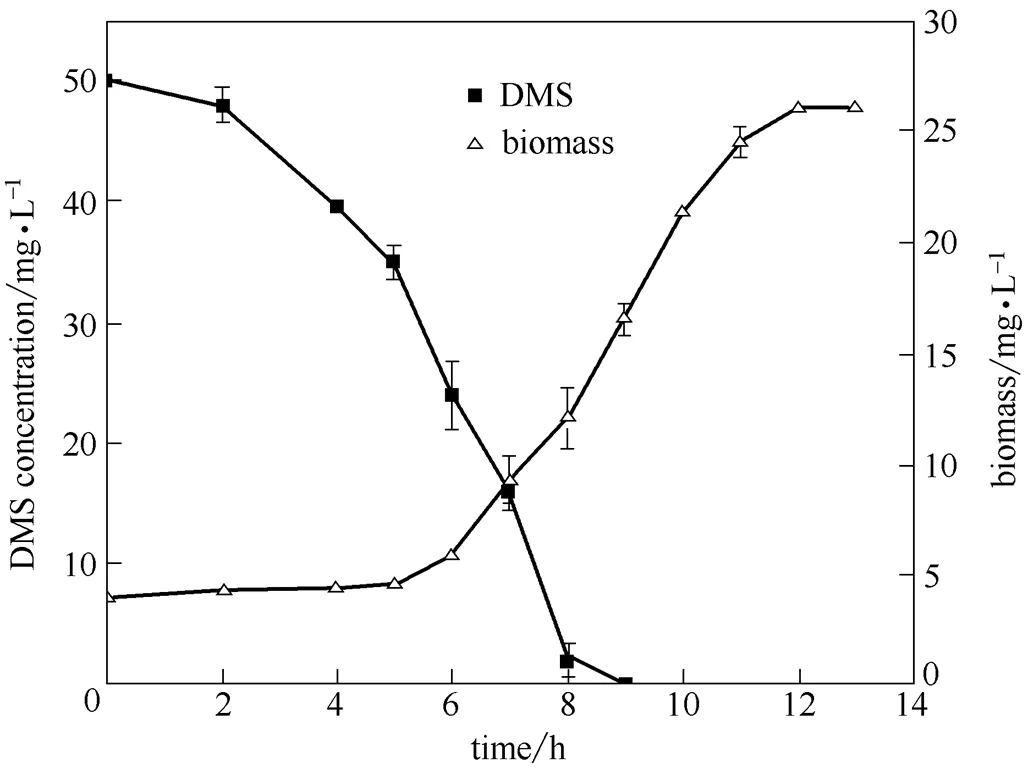
圖2 菌株JLM-8對DMS的降解曲線及生長曲線

表2 實驗方案與實際和預測響應值
式中,代表去除率,、、分別代表溫度、pH和接種量。
本試驗所擬合的模型的顯著系數<0.0001,該模型具有極高的顯著性,建立的模型具有較高的可靠性。在考察的幾個因素中,-溫度、-pH、2、2、2的值均小于0.01,說明這幾項對去除率的影響極顯著;而-接種量值大于0.05,說明對去除率的影響不顯著,可能是由于所選接種濃度超過對降解產生影響的變化閾值。在本回歸模型中,失擬指數0.0544>0.05,表明該二次方程失真不顯著,因此可以進一步分析。
當接種量為25 mg·L-1時,最佳降解條件為溫度31.3℃、pH7.5,最大預測降解率為98.2%。為了驗證上述模型準確性,按上述條件進行了試驗,得出的降解率數據為97.9%,這與預測值十分接近,表明該模型能很好地預測降解情況。
2.4 DMS起始濃度對菌株JLM-8降解的影響
不同DMS起始濃度下,菌株降解速率也不同。起始濃度為25、50、100 mg·L-1時,8 h內的降解率為100%。當濃度為150、200、250和300 mg·L-1,12 h的降解率分別為90%、85%、82.3%、75%。雖然菌株JLM-8是降解DMS的特定菌株,但在DMS降解過程中,由于其本身對微生物有一定的毒害作用,因此當濃度達到一定值時,會對降解過程產生抑制效應。為了定量描述這種抑制效應,采用Haldane’s模型對菌株降解過程進行動力學擬合,如圖3所示。菌株JLM-8降解DMS的比降解動力學參數:max2.37 h-1、s143.55 mg·L-1、i51.35 mg·L-1。所得相關系數20.996說明試驗數據與模型預測吻合度高。DMS臨界抑制濃度為78.46 mg·L-1(圖3),當DMS起始濃度低于此濃度時比降解速率隨濃度增加而逐漸增加,當大于該值時,比降解速率逐漸降低,說明底物對降解的抑制作用越顯著。
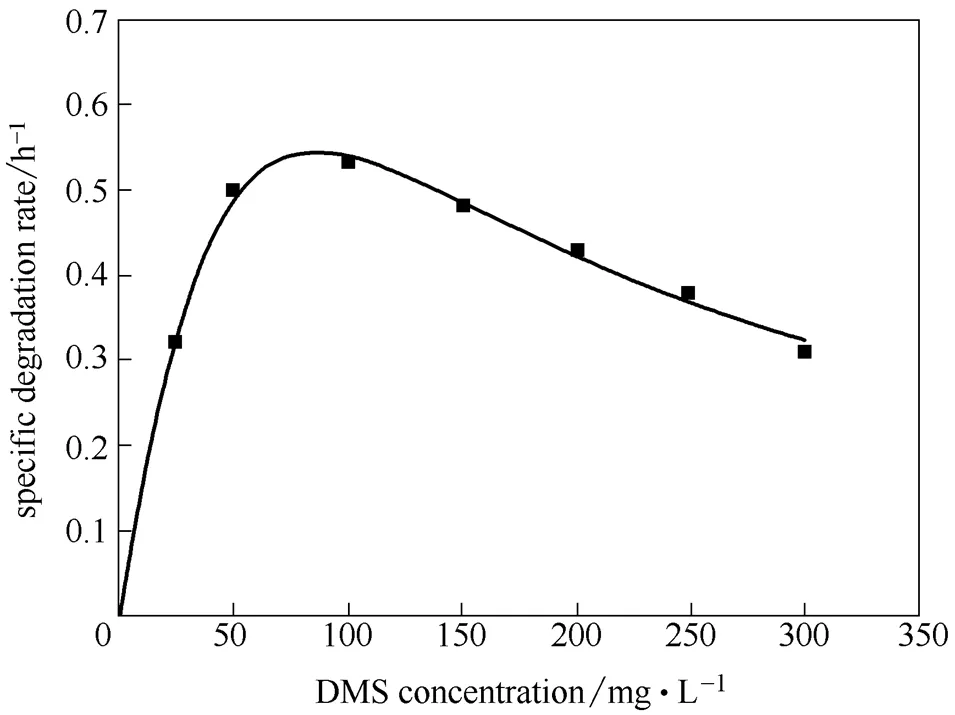
圖3 菌株JLM-8降解DMS的起始濃度與比降解速率的Haldane’s模型擬合
3 結 論
本文分離到一株可以降解DMS的嗜麥芽寡養單胞菌,研究了不同條件下該菌株的降解特性,主要結論如下。
(1)根據菌株生理生化特性與16S rDNA系統發育樹分析,將JLM-8鑒定為嗜麥芽寡養單胞菌。本研究是迄今為止首次報道嗜麥芽單胞菌屬(spp.)的菌株具有DMS降解 能力。
(2)考察了溫度、初始pH和接種量三單因素下DMS降解率,通過響應面法優化得到最佳降解條件:溫度31.3℃、pH7.5,接種量為25 mg·L-1,最大預測降解率為98.2%,試驗驗證降解率數據為97.9%,表明該模型能很好地預測降解情況。
(3)通過測定不同DMS起始濃度的降解速率,根據Haldane’s模型擬合菌株降解動力學參數:max2.37 h-1、s143.55 mg·L-1、i51.35 mg·L-1,相關系數20.996。證明試驗數據與模型預測吻合度高。
[1] Zhang Tingting (張婷婷), Qi Lei (祁蕾), Yu Yang (于洋), Yu Jiang (余江). Photolysis of dimethyl sulfide by microwave electrodeless discharge lamp [J].(化工學報), 2014, 65 (11): 4579-4585.
[2] van Gemert L J. ODOUR THRESHOLDS—Compilations of Odour Threshold Values in Air, Water and Other Media [M]. Netherlands: Oliemans Punter & Partners BV, 2003.
[3] Lomans B P, van der Drift C, Pol A, den Camp H J M Op. Microbial cycling of volatile organic sulfur compounds [J]., 2002, 59 (4): 575-588.
[4] Glindemann D, Novak J, Witherspoon J. Dimethyl sulfoxide (DMSO) waste residues and municipal waste water odor by dimethyl sulfide (DMS): the north-east WPCP plant of Philadelphia [J]., 2006, 40 (1): 202-207.
[5] Du Weiwei, Parker W. Modeling volatile organic sulfur compounds in mesophilic and thermophilic anaerobic digestion of methionine [J]., 2012, 46 (2): 539-546.
[6] Wei Z S, Li H Q, He J C, Ye Q H, Huang Q R, Luo Y W. Removal of dimethyl sulfide by the combination of non-thermal plasma and biological process [J]., 2013, 146:451-456.
[7] Rappert S, Müller R. Microbial degradation of selected odorous substances [J]., 2005, 25 (9): 940-954.
[8] Giri B S, Pandey R A. Biological treatment of gaseous emissions containing dimethyl sulphide generated from pulp and paper industry [J]., 2013, 142: 420-427.
[9] Hayes A C, Liss S N, Grant A D. Growth kinetics ofandspp. in mixed cultures degrading dimethyl sulfide and methanol [J]., 2010, 76 (16): 5423-5431.
[10] Jo W K, Shin M H. Applicability of a continuous-flow system inner-coated with S-doped titania for the photocatalysis of dimethyl sulfide at low concentrations [J]., 2010, 91 (10): 2059-2065.
[11] Suylen G M H, Kuenen J G. Chemostat enrichment and isolation ofEG [J]., 1986, 52 (4): 281-293.
[12] Sch?fer H. Isolation ofspp. from marine dimethylsulfide- degrading enrichment cultures and identification of polypeptides induced during growth on dimethylsulfide [J]., 2007, 73 (8): 2580-2591.
[13] Laanbroek H J, Gerards S. Competition for limiting amounts of oxygen betweenandgrown in mixed continuous cultures [J]., 1993, 159 (5): 453-459.
[14] Fuse H, Ohta M, Takimura O, Murakami K, Inoue H, Yamaoka Y, Oclarit J M, Omori T. Oxidation of trichloroethylene and dimethyl sulfide by a marinestrain containing soluble methane monooxygenase [J].,,, 1998, 62 (10): 1925-1931.
[15] Horinouchi M, Kasuga K, Nojiri H, Yamane H, Omori T. Cloning and characterization of genes encoding an enzyme which oxidizes dimethyl sulfide insp. strain 20B [J]., 1997, 155 (1): 99-105.
[16] Boden R, Kelly D P, Colin M J, Sch?fer H. Oxidation of dimethylsulfide to tetrathionate bysp. nov.: a new link in the sulfur cycle [J]., 2010, 12 (10): 2688-2699.
[17] Boden R, Colin M J, Sch?fer H. Dimethylsulfide is an energy source for the heterotrophic marine bacterium[J]., 2011, 322 (2): 188-193.
[18] Luo J, Agnew M P. Gas characteristics before and after biofiltration treating odorous emissions from animal rendering processes [J]., 2001, 22 (9): 1091-1103.
[19] Xiao Wu (肖武), Li Mingyue (李明月), Ruan Xuehua (阮雪華), He Gaohong (賀高紅), Du Jian (都健). Optimization of ethyl acetate process conditions for sodium bisulfate fluidized catalytic distillation using response surface methodology [J].(化工學報), 2014, 65 (11): 4465-4471.
[20] Liang Kaiqiang (梁凱強), Li Guoqiang (李國強), Jiang Shaojing (江紹靜), Li Shiqiang (李世強), Ma Ting (馬挺). Characteristics of chemotaxis movement towards crude oil of oil-degrading strainsp.6-1B [J].(化工學報), 2012, 63 (7): 2246-2251.
[21] Yu Jianming, Cai Wenji, Cheng Zhuowei, Chen Jianmeng. Degradation of dichloromethane by an isolated strainand its performance in a biotrickling filter [J]., 2014, 26 (5): 1108-1117.
[22] Chen Lan (陳嵐), Quan Yuheng (權宇珩), Li Zhiyong (李志勇). Kinetics analysis of ozone degradating 2,4-D pollutant in soil [J].(化工學報), 2014, 65 (8): 3255-3260.
[23] Endoh T, Kasuga K, Horinouchi M, Yoshida T, Habe H, Nojiri H, Omori T. Characterization and identification of genes essential for dimethyl sulfide utilization instrain DS1 [J]., 2003, 62 (1): 83-91.
Isolation and characterization of a novel dimethyl sulfide degrading strainJLM-8
QIU Jiguo, LI Aiwen, YE Jiexu, CHEN Jianmeng
College of Biological and Environmental EngineeringZhejiang University of TechnologyHangzhouZhejiangChina
Dimethyl sulfide (DMS) is one of the most important volatile organic sulfur compounds. Due to its malodorous smell and the extremely low odor threshold, DMS has become a critical issue in wastewater collection and treatment systems. In this study, a novel strain JLM-8, with capability of degrading DMS as sole carbon and sulfur source, was isolated from the active sludge of a pharmaceutical plant. Based on the morphological, physiological and biochemical properties as well as its 16S rDNA gene sequence analysis, the strain JLM-8 was identified as a member of. The strain could degrade approximately 100% of 50 mg·L-1DMS within 8 hours at pH 7 and 30℃. Response surface methodology (RSM) analysis showed that the optimum conditions for degradation were at pH 7.5 and 31.3℃, using an inoculum amount of 25 mg·L-1. Under these conditions, approximately 97.9% of DMS was degraded. The kinetic parametersmax,s, andiwere established to be 2.37 h-1, 143.55 mg·L-1, 51.35 mg·L-1, respectively. The critical inhibitor concentration was determined to be 78.46 mg·L-1.Research on the characterization of DMS degradable bacteria can provide a new theoretical and technical fundamental basis for bioremediation of DMS-contaminated environments.
dimethyl sulfide;; degradation; kinetics; environment
2015-05-29.
Prof.CHEN Jianmeng, jchen@zjut.edu.cn
10.11949/j.issn.0438-1157.20150746
Q 939.9
A
0438—1157(2015)08—3242—06
陳建孟。
邱吉國(1984—),男,博士,助理研究員。
中國博士后科學基金面上項目(2014M560495);浙江省教育廳科研項目(Y201329224);教育部“長江學者和創新團隊發展計劃”(IRT13096)。
2015-05-29收到初稿,2015-06-06收到修改稿。
supported by the China Postdoctoral Science Foundation (2014M560495), the Program of the Department of Education of Zhejiang Province (Y201329224) and the Program for Changjiang Scholars and Innovative Research Team in University (IRT13096).

