干擾素α-2b聯合利巴韋林治療后慢性丙型肝炎患者外周血細胞數量的變化及其臨床意義
馬琳媛,張 鵬,陳 倩,孔文麗,楊以良,李玉香,潘 煜
(1.吉林大學第一醫院肝膽胰內科,吉林 長春 130021;2.吉林大學第一醫院感染癥科,吉林 長春 130021)
丙型肝炎 (丙肝)是由丙肝病毒 (hepatitis C virus,HCV)引起,以肝臟損害為主的一組全身性感染性疾病,人對HCV普遍易感,我國北方地區HCV以1b和2a型所占比例較高[1]。目前全球HCV感染率約為3%,可引起慢性肝炎、肝纖維化和肝癌[2]。研究[3-5]顯示:干擾素聯合利巴韋林是目前治療慢性丙型肝炎的標準方案,且治療后肝纖維化程度可改善,肝癌發生率明顯降低。因此,慢性丙型肝炎抗病毒治療尤為重要。但抗病毒治療存在諸多不良反應,尤其是外周血細胞數量減少常可導致干擾素或利巴韋林藥物減量,嚴重者需要提前撤出治療,因此對治療效果產生極大的不良影響[6]。本研究將對普通干擾素α2b (IFN-α2b)聯合利巴韋林抗病毒治療的慢性丙型肝炎患者外周血細胞數量變化情況進行探討,歸納中性粒細胞、血紅蛋白和血小板變化規律,闡明基線病毒及宿主因素對外周血細胞數量變化的影響。
1 資料與方法
1.1 研究對象 選擇2009—2010年吉林大學第一醫院肝膽胰內科在吉林省扶余縣更新鄉和德勝鎮進行的流行病學調查中發現的慢性丙型肝炎患者343例,均為初治,診斷標準參照 《2010丙型肝炎防治指南》,排除標準:①失代償期肝硬化患者(符合腹水、出血性靜脈曲張、肝性腦病其中之一者);②同時并發慢性乙型肝炎、自身免疫性肝病和酒精性肝病的患者;③懷孕、甲狀腺功能紊亂、應用放射性藥物、存在心血管疾病、腫瘤等基礎疾病者;④外周血細胞水平過低不符合抗病毒治療指征者。其中男性246例,女性97例,患者平均年齡(49.8±7.8)歲,體質量指數(BMI)為(23.4±2.9)kg·m-2。肝纖維化分期:F1期129例 (48.1%),F2期90例 (33.6%),F3期28例 (10.4%),F4期21例 (7.8%),另外75例患者基線肝纖維化數據缺失。
1.2 主要試劑和儀器 血常規試劑盒由美國Beckman Coulter公司提供,肝功試劑盒由美國強生公司提供,HCV抗體試劑盒由英科新創 (廈門)有限公司提供,HCV核酸檢測試劑盒由德國羅氏診斷有限公司提供,HCV RNA基因分型多色熒光PCR試劑盒由北京巴奧瑞欣生物技術有限公司提供。COULTER Ac.T 5diff AL血液分析儀 (美國Beckman Coulter公司);VITROS 350生化分析儀 (美國強生公司),Thermo SCIENTIFIC MULTISKAN分析儀 (中國賽默飛世爾科技有限公司,COBAS AmpliPrep/COBAS TaqMan HCV Test儀 (德國羅氏公司),7500Real-Time PCR System (北京巴奧瑞欣生物技術有限公司)。
1.3 檢測方法 通過細胞化學光吸收和體積分析技術檢測血常規;全干化學生化分析儀檢測肝功;應用酶聯免疫標記法檢測HCV抗體;應用熒光定量PCR法檢測丙型肝炎病毒核酸,檢測限度15IU·mL-1;利用熒光定量PCR分型檢測HCV RNA基因分型。
1.4 治療方法 INF-α2b500萬U、隔日1次、皮下注射,利巴韋林15mg·kg-1·d-1口服;療程48周;在基線、第2周、12周、24周、36周和48周時對患者進行血常規、HCV RNA定量等檢測,治療結束后60、72和96周進行隨訪。當中性粒細胞、血紅蛋白及血小板降至規定值以下時依據 《2010丙型肝炎防治指南》進行減量或停藥處理,并長期隨訪觀察。
1.5 統計學分析 應用SPSS 18.0統計軟件進行數據處理。患者性別、肝纖維化分期、HCV基因型等計數資料多組間比較采用卡方檢驗,組間兩兩比較采用Fisher精確檢驗;年齡和BMI以表示,組間比較采用方差分析 (Anova);血常規、肝功等其他計量資料多組間比較采用Kruskal-Wallis檢驗,兩兩組間比較采用 Mann-Whitney U檢驗。
2 結 果
2.1 藥物誘導的外周血細胞數量減少發病率 治療過程中外周血細胞數量發生改變,其中中性粒細胞減少癥139例 (40.5%),貧血166 例(48.4%),血小板減少癥137例(39.9%)。此外,治療結束后仍有患者出現外周血細胞改變,60周時中性粒細胞減少癥2例 (1.0%),血小板減少癥3例(1.6%);72周時出現血小板減少癥1例(0.4%);96周出現貧血1例 (0.6%),血小板減少癥3例 (1.9%)。
2.2 治療過程中外周血細胞數量變化趨勢 治療2周時中性粒細胞即有明顯下降,至第12周時降到最低值,平均降低1.2×109L-1,12周后出現緩慢上升,治療結束時 (48周)雖較12周恢復明顯,但仍明顯低于治療前水平。停止治療后即48~60周中性粒細胞水平仍有明顯恢復,60周后趨于平穩,但仍稍低于治療前水平;而血紅蛋白(hemoglobin,Hgb)同中性粒細胞變化相似,治療2周時即有明顯下降,持續下降至12周時降到最低值,平均降低2.2g·dL-1,12~24周出現小幅度上升,但24~36周再次降至約12周時Hgb水平,36周后血紅蛋白呈現持續上升趨勢,治療結束時 (48周)仍遠低于治療前水平。停止治療后即48~72周Hgb水平仍有明顯恢復,72周后趨于平穩,與治療前基本持平;血小板計數在治療開始即有明顯下降,2~4周時稍有緩解,但仍明顯低于治療前水平,4周后再次下降,至12周時降至最低,平均下降25.7×109L-1,12周后持續上升至72周,略高于治療前水平。見表1。
表1 不同時間外周血細胞數量Tab.1 Number of cells in peripheral blood at different time ()

表1 不同時間外周血細胞數量Tab.1 Number of cells in peripheral blood at different time ()
3.5±1.4 2.3±0.9 2.3±0.9 2.3±0.9 2.4±1.1 HGB(g·dL-1) 15.4±2.4 14.0±2.4 13.5±2.3 13.3±2.1 13.8±1.9 PLT(×109L-1) 174.0±68.0 150.0±57.0 159.0±66.0 150.0±61.0 152.0±61.0 Variable 36weeks 48weeks 60weeks 72weeks 96w Variable 0week 2weeks 4weeks 12weeks 24weeks ANC(×109L-1)2.5±1.2 2.9±1.2 3.3±1.2 3.3±1.2 3.3±1.2 HGB(g·dL-1) 13.3±2.0 13.6±1.9 14.9±1.7 15.2±1.8 15.3±1.7 PLT(×109L-1) 156.0±62.0 164.0±61.0 171.0±62.0 183.0±74.eeks ANC(×109L-1)0 177.0±53.0
2.3 慢性丙型肝炎患者抗病毒治療過程中發生外周血細胞數量減少的影響因素 基線中性粒細胞絕對值、血小板計數、天門冬氨酸氨基轉移酶(AST)、丙氨酸氨基轉移酶 (ALT)和肝纖維化程度與中性粒細胞減少癥的發生及嚴重程度有關聯(P<0.05)。性別與貧血的發生有關聯 (P<0.05),基線Hgb水平與貧血的發生及嚴重程度均有關聯 (P<0.05)。性別、基線中性粒細胞絕對值、血小板計數、AST、ALT、γ-谷氨酰轉肽酶(γ-GT)和肝纖維化程度與血小板減少癥的發生有關聯 (P<0.05)。見表2~4。
3 討 論
干擾素聯合利巴韋林方案是目前公認的治療慢性丙型肝炎的標準方案,但存在諸多不良反應,其中外周血細胞數量減少是導致藥物減量或提前撤出治療的最常見原因之一,進而嚴重影響持續病毒學應答 (SVR)的實現[6]。

表2 基線因素對中性粒細胞數量減少的影響Tab.2 Influence of baseline factors in decline of number of neutrophils
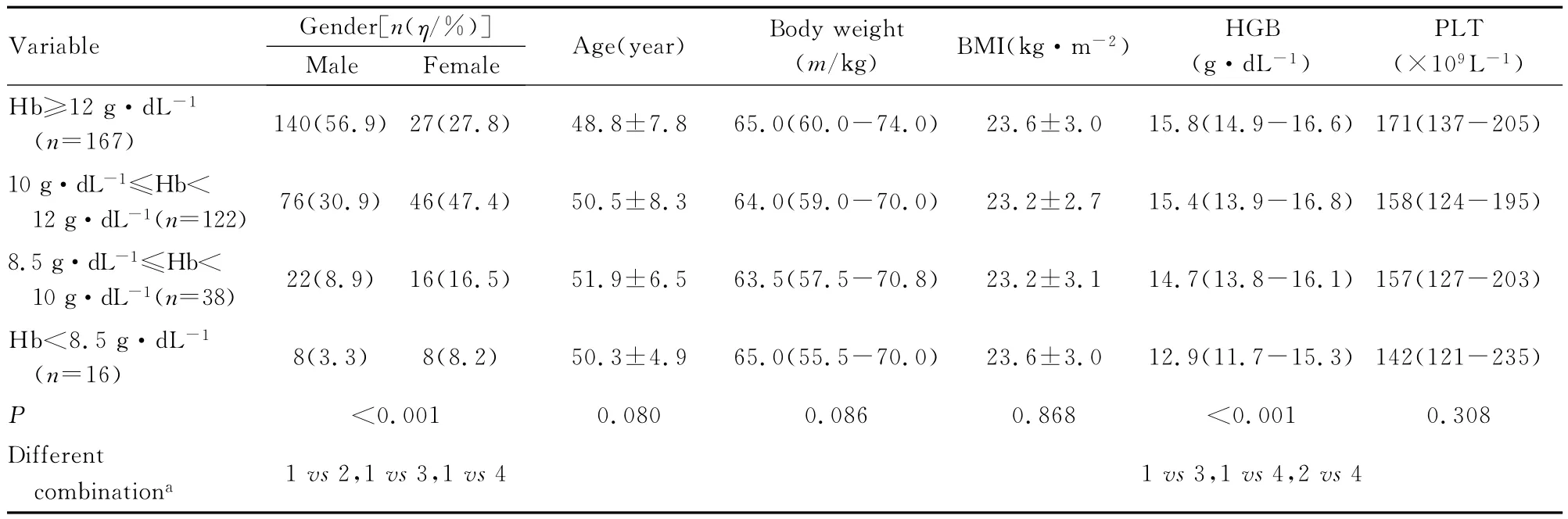
表3 基線因素對血紅蛋白數量減少的影響Tab.3 Influence of baseline factors in decline of number of hemoglobin
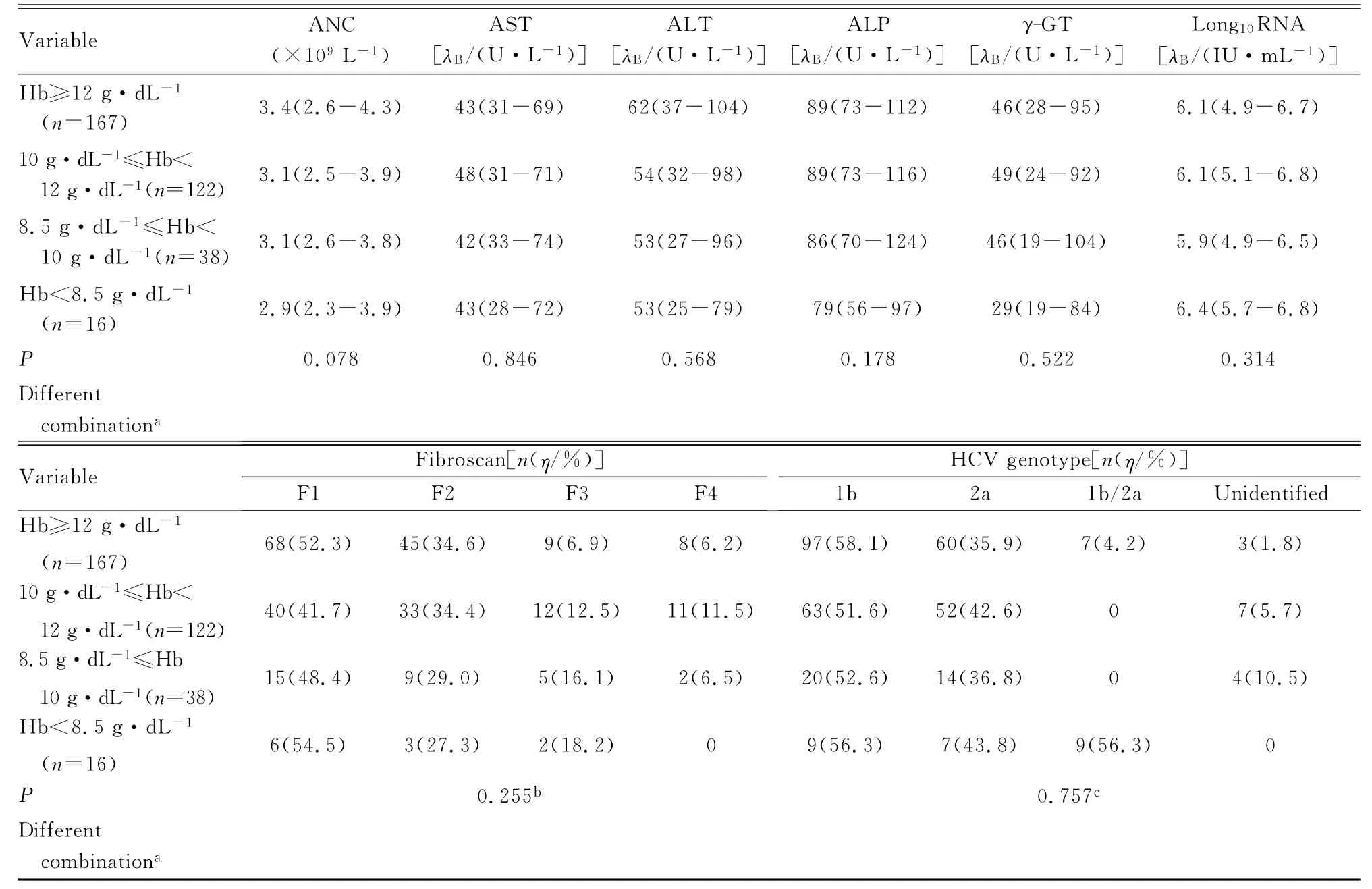
續表3

表4 基線因素對血小板計數減少的影響Tab.4 Influence of baseline factors in decline of number of plateletsin
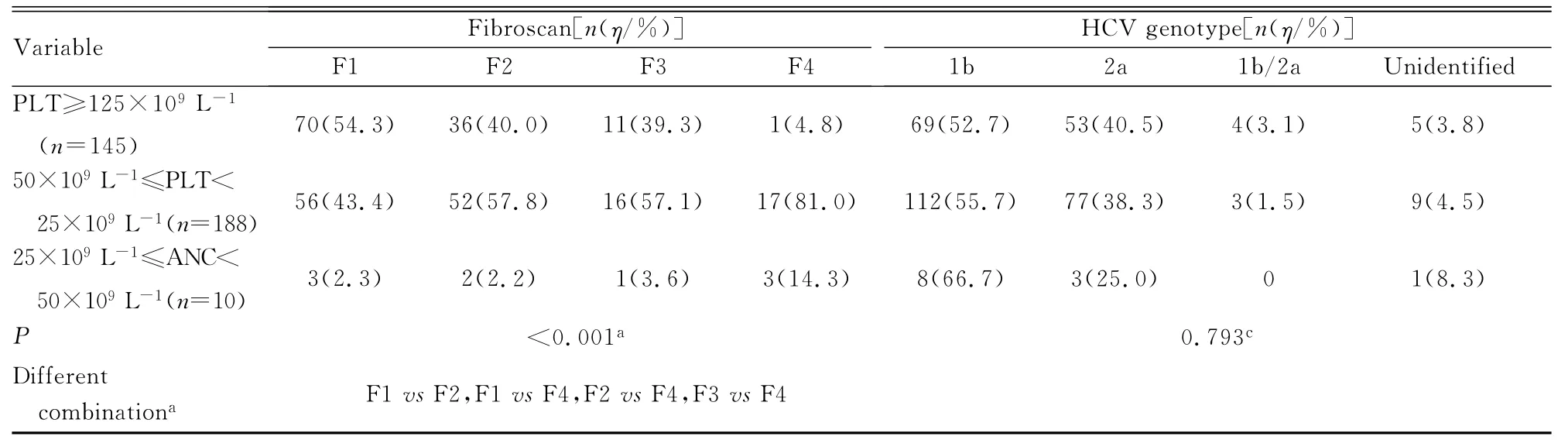
續表4
慢性丙型肝炎抗病毒治療過程中引發粒細胞減少癥及血小板計數降低的發生機制目前尚未完全明確,可能與干擾素治療過程中引發的一過性外周血細胞異常分布有關[7]。過去認為粒細胞減少還可能與INF-α對骨髓祖細胞增殖的直接抑制有關聯[8]。而近年幾項研究對此觀點提出了質疑,張永宏等[9]認為:粒細胞減少可能與粒細胞集落刺激因子或巨噬細胞粒細胞集落刺激因子分泌下降有關聯。此外,INF-α所致中性粒細胞計數下降可能與患者基因多態性即INF-α信號通路基因的單核苷酸多態性 (SNPs)有關聯,故表現為個體差異[10]。而血紅蛋白降低與干擾素及利巴韋林均有關聯,但利巴韋林對Hgb破壞作用更為顯著。利巴韋林通過細胞表面ES-核苷載體進入細胞發揮抗病毒作用,而這種載體也存在于紅細胞表面[11],因此利巴韋林在發揮抗病毒作用的同時也破壞了紅細胞,且多數學者認為利巴韋林相關性貧血具有藥物劑量依賴效應。
在本研究中,中性粒細胞減少癥發病率為40.5%,貧血發病率為48.4%,血小板減少癥發病率為 39.9%, 與 其 他 類 似 研 究[9,12-13]的 結 果 相符,但貧血的發病率明顯高于D’Avolio等[14-15]的兩項研究。但本研究中外周血細胞數量減少絕大多數為輕度,且未出現一例重度中性粒細胞減少或血小板減少患者,這與其他研究結果均不相同,考慮與本研究隨訪時間密集、臨床觀察細致,經臨床綜合評估后及時進行藥物減量有關聯。這一結果說明可以通過密切隨訪和臨床及時干預避免因為重度外周血細胞數量減少而導致停藥的現象。
本研究結果顯示:外周血細胞減少在第2周發病率最高,集中發病在2~14周,這與現有的相關研究[16-19]結果不符,這一結果需來自不同種族及不同地區的大樣本研究進行驗證,同時也提醒臨床醫生在抗病毒治療的前3個月更應密切監測外周血細胞數量變化并及時給予臨床干預,從而避免因外周血細胞數量減少而導致的藥物減量甚至停藥。
在對慢性丙型肝炎抗病毒治療過程中影響外周血細胞數量減少因素分析中本文作者發現:影響血小板減少的基線因素同影響中性粒細胞減少的因素相似,即基線中粒細胞絕對值及血小板水平越低、肝纖維化程度越重、基線AST和ALT越高,越易出現中性粒細胞及血小板減少。但二者不同的是性別對血小板降低有影響,而對中性粒細胞減少無影響,女性血小板降低發病率顯著低于男性,這一觀點在相關研究中并未發現,雌激素對血小板減少是否具有保護作用還需進一步研究。Lashin等[19]認為:中性粒細胞減少嚴重程度與性別有關聯,女性較男性更易發生中、重度中性粒細胞減少,這一現象在本研究中并未發現。本研究結果顯示:女性比男性貧血發生率高,基線Hgb水平越低,治療過程中越易發生貧血。且近年來性別對貧血的影響已引起較高重視,Scherzer等[20]認為:第4周男性Hgb水平下降較女性更明顯,而絕經后女性和男性相比4周Hgb水平下降程度并無明顯差異。本組研究對象平均年齡約50歲,女性貧血發病率明顯高于男性 (女性72.2%,男性43.1%),因此認為雌激素可能與利巴韋林相關溶血性貧血存在一定關聯,而相關機制目前仍在探討中。
[1]Su YY,Liu HX,Wang N.Hepatitis C virus genotypes in China:a systematic review [J].Zhonghua Liu Xing Bing Xue Za Zhi,2013,34 (1):80-84.
[2]Naderi M,Gholiopour N,Zolfaqhari MR,et al.Hepatitis C virus and vaccine development [J].Int J Mol Cell Med,2014,3 (4):207-215.
[3]Aqnesod D,De Nicolo A,Simiele M,et al.Development and validation of a useful UPLC-MS/MS method for quantification of total and phosphorylatedribavirin in peripheral blood mononuclear cells of HCV+patients [J].Pharm Biomed Anal,2014,90 (5):119-126.
[4]Hirakawa M, Ikeda K, Arase Y, et al.Hepatocarcinogenesis following HCV RNA eradication by interferon in chronic hepatitis patients [J].Int Med(Tokyo,Japan),2007,47 (19):1637-1643.
[5]Fernández-Rodríguez CM,Alonso S,Martinez SM,et al.Peginterferon plus ribavirin and sustained virological response in HCV-related cirrhosis:outcomes and factors predicting response [J].Ame J Gastroenterol,2010,105 (10):2164-2172.
[6]Oze T,Hiramatsu N,Yakushijin T,et al.Pegylated interferon alpha-2b (Peg-IFN α-2b)affects early virologic response dose-dependently in patients with chronic hepatitis C genotype 1during treatment with Peg-IFN α-2bplus ribavirin [J].Viral Hepatitis,2009,16 (8):578-585.
[7]白金錫,白貞子,鄭 艷.36例慢性丙型肝炎抗病毒副作用及對策 [J].中國實驗診斷學,2013,17 (2):346-347.
[8]Ganser A,Carlo-Stella C, Greher J,et al. Effect of recombinant interferons alpha and gamma on human bone marrow-derived megakaryocytic progenitor cells [J].Blood,1987,70 (4):1173-1179.
[9]Liu YL,Du XF,Chen XY,et al.Bone marrow suppression or active proliferation?An analysis of neutropenia after pegylated interferon treatment of patients with chronic hepatitis C [J].Scand J Infect Dis,2013,45 (12):939-943.
[10]Wada M,Marusawa H,Yamada R,et al.Association of genetic polymorphisms with interferon-induced haematologic adverse effects in chronic hepatitis C patients [J].J Viral Hepatitis,2009,16 (6):388-396.
[11]Khakoo S,Glue P, Grellier L,et al. Ribavirin and interferon alfa2bin chronic hepatitisC;assessment of possible pharmacokinetic and pharmacodynamic interactions [J].J Pharmacol,1998,46 (6):563-570.
[12]Hadziyannis SJ,Sette Jr H,Morgan TR,et al.PEGASYS International Study Group: Peginterferon-alpha2aand ribavirin combination therapy in chronic hepatitis C:a randomized study of treatment duration and ribavirin dose [J].Ann Intern Med,2004,140 (5):346-355.
[13]Manns MP, McHutchison JG, Gordon SC, et al.Peginterferon alfa-2bplus ribavirin compared with interferon alfa-2bplus ribavirin for initial treatment of chronic hepatitis C:a randomised trial [J].Lancet,2001,358 (9286):958-965.
[14]D’Avolio A,De NicolòA,Cusato J,et al.Association of ITPA polymorphisms rs6051702/rs1127354instead of rs7270101/rs1127354as predictor of ribavirin-associated anemia in chronic hepatitis C treated patients [J].Antiviral Res,2013,100 (1):114-119.
[15]D’Avolio A,Ciancio A,Siccardi M,et al.Inosine triphosphatase polymorphisms and ribavirin pharmacokinetics as determinants of ribavirin-associate anemia in patients receiving standard anti-HCV treatment [J].Ther Drug Moni,2012,34 (2):165-170.
[16]Rotman Y,Katz L,Cohen M,et al.Low weight predicts neutropenia and peginterferon alfa-2adose reductions during treatment for chronic hepatitis C [J].J Viral Hepatitis,2009,16 (5):340-345.
[17]Roomer R,Hansen BE,Janssen HLA,et al.Risk factors for infection during treatment with peginterferon alfa and ribavirin for chronic hepatitis C [J].Hepatology,2010,52 (4):1225-1231.
[18]Roomer R, Hansen BE, Janssen HLA, et al.Thrombocytopenia and the risk of bleeding during treatment with peginterferon alfa and ribavirin for chronic hepatitis C [J].J Hepatol,2010,53 (3):455-459.
[19]Lashin AH,Shaheen YA,Metwally MA,et al.Incidence and predictors of hematological side effects in chronic HCV Egyptian patients treated with pegylated interferon and ribavirin [J].Indian J Gastroenterol,2013,32 (5):316-323.
[20]Scherzer TM,St?ttermayer AF,Stauber R,et al.Effect of gender and ITPA polymorphisms on ribavirin-induced anemia in chronic hepatitis C patients [J].J Hepatol,2013,59 (5):964-971.

