EDTA法測定鹽水工序鈣鎂過程中金屬指示劑的僵化研究與消除
雷海萍
(中鹽青海昆侖堿業有限公司,青海 德令哈 817099)
EDTA法測定鹽水工序鈣、鎂過程中,有時會出現滴定快到達計量點時,EDTA置換指示劑的作用緩慢,引起終點的拖長,當發生這種現象時,會導致滴定結果偏大,降低實驗數據的準確性。經過大量的實驗,找到了消除該現象的方法,可提高實驗數據的準確性。
1 指示劑的僵化現象及消除
金屬指示劑與金屬離子形成的配合物在水中的溶解度小,使得滴定劑EDTA與金屬-金屬指示劑配合物(MIn)交換緩慢,終點拖長或終點顏色變化不明銳,這種現象就是指示劑的僵化現象。出現這種現象時對實驗結果的準確性影響較大。經過大量實驗,加入適量的乙醇溶液,接近終點時放慢滴定速度并劇烈振蕩,可有效消除指示劑的僵化現象。
2 實驗方法及結果分析
在測定鈣、鎂離子的原實驗過程中,加入乙醇溶液,方法如下:
吸取一定量的試液放入燒杯中加熱煮沸,加酸調pH值為弱酸性環境,加入掩蔽劑三乙醇胺,加入乙醇溶液,調溶液pH值至相應滴定條件,加入金屬指示劑,用滴定劑進行滴定,滴定至終點記錄數據,計算結果。
2.1 鈣的測定
用移液管吸取搖勻的精鹽水5.00mL,于300 mL三角瓶中,加入少許蒸餾水,加鹽酸溶液(1mol/L)調節pH為弱酸性并加熱至無氨味后,冷卻至室溫,加入3~5滴三乙醇胺,加入10~15mL乙醇溶液,用NaOH溶液調pH≥12(用pH試紙試之),加鈣試劑適量,搖勻,立即用0.002 5mol/L的EDTA標準溶液滴定至溶液由紫紅色變成純藍色為終點,記錄消耗的EDTA標準溶液的體積V1。
2.2 鎂的測定
用移液管取精鹽水5.00mL于300mL三角瓶中,加入少許蒸餾水,加鹽酸溶液(1mol/L)調節pH為弱酸性并加熱至無氨味后,冷卻至室溫,加入3~5滴三乙醇胺,加入10~15mL乙醇溶液,加10 mL氨—氯化銨緩沖溶液調pH=10,加鉻黑T指示劑適量,搖勻,立即用0.002 5mol/L的EDTA標準溶液滴定至溶液由紫紅色變為純藍色為終點,記錄消耗的EDTA標準溶液的體積為V2。
2.3 計算公式
Ca2+(mg/L)=(C×V1×40×1 000)/V樣
Mg2+(mg/L)=(C×(V2-V1)×24×1 000)/V樣
式中:V1——滴定鈣時消耗的EDTA標準溶液的體積,mL;
V2——滴定鎂時消耗的EDTA標準溶液的體積,mL;
V樣——參與實驗的樣品體積,mL;
C——EDTA標準溶液的濃度,mol/L;
40——鈣的摩爾質量;
24——鎂的摩爾質量。
3 與原實驗方法的結果比對
用5個樣品做實驗,每個樣品用加乙醇溶液和不加乙醇溶液的方法分別重復測量鎂6次,記錄實驗結果,進行比對,見表1。
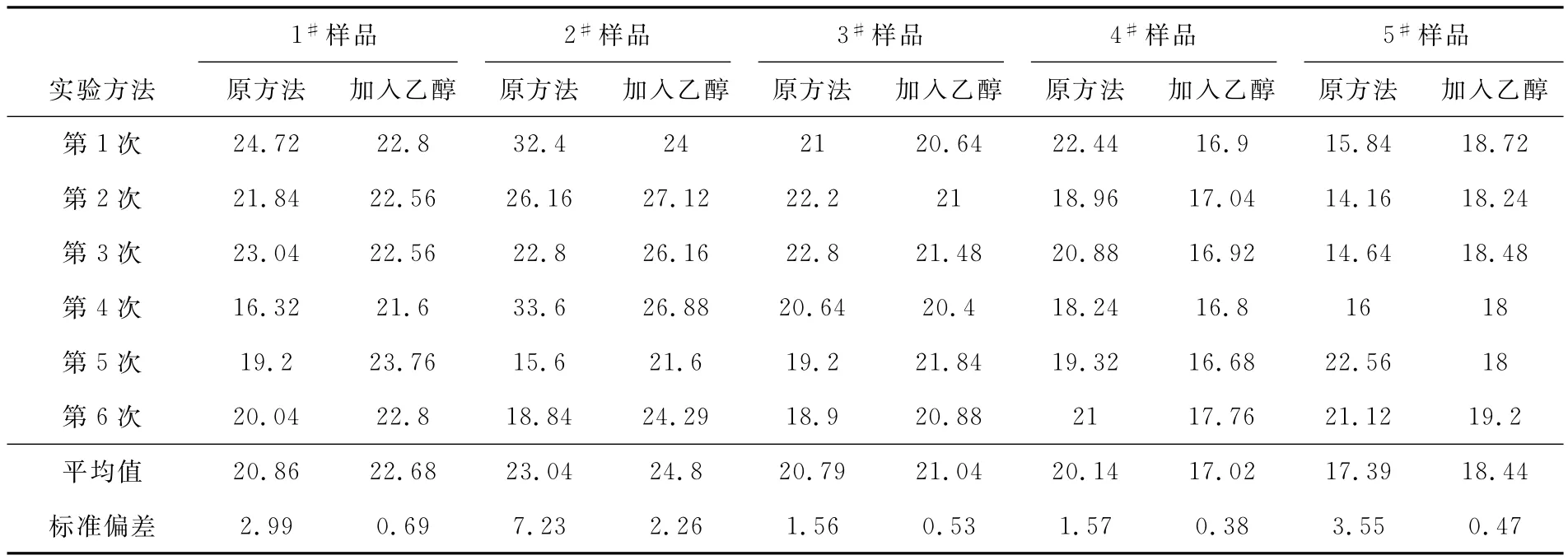
表1 檢測鎂的實驗結果對照表(單位:mg/L)
4 結 論
在測定鈣、鎂離子過程中加入適量的乙醇溶液,經實驗論證,可有效消除指示劑的僵化現象,大大提高實驗的穩定性,減少實驗誤差,提高分析數據的準確度和重現性,有利于生產指標的精細化控制。

