美國食品藥品監督管理局關鍵路徑計劃及其對我國醫療器械市場準入制度的啟示
邵玉波 李 非
美國食品藥品監督管理局關鍵路徑計劃及其對我國醫療器械市場準入制度的啟示
邵玉波①李 非②
目的:通過閱讀大量文獻對美國食品藥品監督管理局(FDA)關鍵路徑計劃進行研究,分析關鍵路徑計劃對我國醫療器械市場準入制度的貢獻與不足。方法:采用文獻綜述的方法對美國FDA關鍵路徑計劃進行分析研究。結果:我國應借鑒關鍵路徑計劃,改革現有醫療器械市場準入制度,提高效率,簡化程序,促進產品的安全與發展。結論:研究借鑒美國FDA關鍵路徑計劃,對于構建我國醫療器械市場準入路徑具有重要的指導意義。
食品藥品監督管理局;關鍵路徑計劃;醫療器械;市場準入路徑
DOI∶ 10.3969/J.ISSN.1672-8270.2015.11.037
[First-author’s address] National Institutes for Food and Drug Control, Beijing 100050, China.
保護公眾健康是美國食品藥品監督管理局(food drug fdministration,FDA)的使命,他主要通過以下三種途徑來實現該使命。第一,保證醫療產品的安全、有效;第二,促進醫療產品創新,讓更安全、更有效的產品以病人償付得起價格提供給公眾;第三,幫助公眾獲得其所需的準確、科學的信息。為了實現該使命,美國FDA提出了“關鍵路徑計劃”,以解決產品從基礎研究走向市場周期過長的危機,從而改善產品創新過程。
美國FDA于2004年首次發布了關于關鍵路徑的白皮書《創新/停滯:新醫療產品關鍵路徑上的挑戰與機遇》(Innovation/Stagnation:Challenge and Opportunity on the Critical Path to New Medical Products)[1]。該報告研究危機產生的原因及未來發展趨勢;分析以往對關鍵路徑有益的嘗試和發展,計劃未來的努力方向;號召通過行業、學術科研機構與FDA共同合作,識別關鍵問題和開發解決方案。
我國醫療器械市場準入路徑正處于關鍵的改革過程中,研究借鑒美國FDA關鍵路徑計劃對于構建我國醫療器械市場準入路徑,實現我國醫療器械兼顧安全和發展的長期目標具有十分重要的指導意義。本文通過閱讀大量文獻對美國FDA關鍵路徑計劃進行了研究,分析了關鍵路徑計劃對我國醫療器械市場準入制度的貢獻與不足。
1 美國FDA的關鍵路徑計劃
1.1 關鍵路徑計劃提出的背景
醫療器械產品的安全直接影響著公眾的生命安危。如何更好的對醫療器械產品進行監管,保證其安全性和有效性,已成為世界各國共同努力的目標。醫療器械的市場準入是產品上市前的必經之路,也是監管的重要環節。醫療器械市場準入路徑本身包含了“流水線”式的過程,如產品檢驗、臨床試驗、質量管理體系檢查、注冊評價等。美國FDA在2004年的研究中發現,創新產品的上市速度越來越慢,產品的研發與實際應用之間的距離不斷擴大。2004年的前10年間,行業在醫療產品研發的基礎投入增長了2.5倍,美國政府的在醫療產品研究的基礎投入增長了2.3倍;而醫療產品的申請反而減少了10%到90%不等,這表明醫療產品的開發已經跟不上基礎科學領域的創新[2]。美國FDA認為要集中努力為從基礎科學創新到醫療產品開發之間的過程提供充分的支持,這就迫切地需要在構建現代化關鍵路徑上取得突破。
1.2 關鍵路徑的內涵
關鍵路徑指的是新藥、新生物制品及新醫療器械的研發過程中的關鍵性環節[3]。企業經過基礎研究后,通過設計研發新品,新研發的產品需要經過臨床前和臨床試驗以及申報、審批過程,才能上市。在新產品的研發過程中,只有很少的一部分能順利通過關鍵路徑最終成活上市(如圖1所示)。
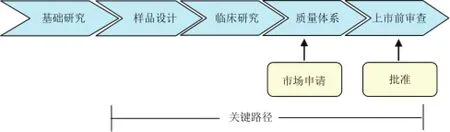
圖1 醫療產品市場準入的關鍵路徑
1.3 關鍵路徑計劃的主要內容
生物醫學的基礎研究成果理應能迅速轉變為提高公共健康的醫療器械產品,但是新產品的低產率卻未能使這些研究成果充分用于改善人類健康。一方面是因為新品的研發成本不斷上升,嚴重妨礙企業對高風險新項目的研發投入;另一方面,新品研發的高失敗率嚴重影響資源的有效配置,陳舊的評價工具如檢測、動物試驗及人體試驗也經常不能準確的預見一些潛在的安全問題,因而無法有效評估新的醫學技術。關鍵路徑計劃研究的內容主要是優先處理當前最迫切的醫療器械產品的研發路徑問題,使生物醫學基礎研究的成果能迅速轉變為提高公共健康的新產品。這些最優先研究的問題將列入關鍵路徑機遇清單,并從安全評價、臨床效果評價和產品實現三個維度進行研究。美國FDA認為清單中很重要的一項就是迫切需要構建一套新的產品研發支持工具集,以提高關鍵路徑上產品研發的可預測性和有效性,確保新的生物醫學基礎研究成果能更快更準確的轉變為有效的治療手段。
1.4 關鍵路徑計劃的進展
自美國FDA在2004年正式啟動了關鍵路徑計劃,其后的近10年間美國FDA堅持推動和實施關鍵路徑計劃,并且每年都發布計劃實施的活動和結果評估[3]。在2006年發布了《關鍵路徑機遇報告》;2007年發布了《開展中的主要關鍵路徑活動》;2008年發布了《財政支持的關鍵路徑活動》;2009年發布了《主要成果報告》;2010年發布了《受關鍵路徑計劃支持的項目報告》[4-5]。通過以上努力,美國FDA在促進產品創新上取得了顯著的成績。
在美國FDA構建和實施的產品研發支持工具集中,指導原則文件是美國FDA一直堅持并取得突出效果的市場準入工具。美國FDA發布指導原則的目的是解釋當前政府的政策和監管問題,代表了美國FDA對政策和問題的現行理解。指導原則內容包括設計、生產、銷售,測試;申報的處理、內容和評價;檢查和執法;科學問題。其中美國FDA醫療器械和放射產品中心至今已發布了很多指導原則,有效地提高了醫療器械產品研發關鍵路徑的可預測性和效率。
2 關鍵路徑計劃對我國醫療器械市場準入制度的啟示
2.1 我國研究現狀
雖然美國FDA在2004年就發起了革新性的關鍵路徑計劃,并逐步取得了成效,但是在我國僅僅引起監管當局和行業很少關注,在國家級醫藥期刊上公開發表的文獻只有2篇。李中華在2007年系統介紹了美國FDA關鍵路徑計劃的背景、科技要素和主要內容[6];常永亨在2009年介紹了美國FDA關鍵路徑計劃,并提出結合我國國情,研究發達國家經驗,設計我國的醫療器械市場準入路徑[7]。我國正處于關鍵的改革過程中,研究借鑒美國FDA關鍵路徑計劃對于我國醫療器械監管有著積極意義。
2.2 對我國醫療器械市場準入制度的啟示
美國FDA關鍵路徑計劃的核心價值主要體現在兩個方面:科學審評前移和優化準入路徑。科學審評前移是將市場準入過程中政府的服務職能前置或前移,有助于產品從研發階段就與法規、準入要求對接,從而設計出符合市場準入要求的產品,提高產品質量、縮短準入周期;優化準入路徑是減少市場準入過程中的風險和不確定性,有助于新產品、新企業的發展。
2.3 對于關鍵路徑計劃的借鑒
美國FDA實施關鍵路徑計劃是圍繞其監管使命,即保證醫藥產品安全有效,又促進創新進步,使公眾能夠獲得更有效、更便宜的產品。這與我國現階段醫療器械監管的使命是一致的。因此,應借鑒關鍵路徑計劃,改革我國監管方式,提高效率,簡化程序,促進醫療器械產品的安全與發展。
2.4 對于現有醫療器械市場準入制度的改革
為保證上市醫療器械產品的安全,各國都設立了市場準入制度。我國與美國FDA相比,醫療器械市場準入制度面臨不同的現狀:
(1)市場準入效率尚需完善。美國FDA從1976年發布聯邦食品、藥品和化妝品法有關醫療器械的修訂案,逐步形成成熟的醫療器械市場準入制度體系,主要包括分類、一般控制、510(k)程序、PMA審批、GMP、臨床試驗審批監查等。而我國2000年才將醫療器械正式納入監管體系,2004年發布第一個醫療器械注冊管理辦法,并于2014年進行了第一次修訂,文件中雖然明確了注冊的程序和職責,但在與風險相適應的審評模式改革方面尚需完善,例如美國FDA推行的實質性等同原則和簡化510(k)等手段,對提高產品注冊效率更有積極的意義。
(2)注冊審評資源不足已成為制約行業發展的因素。醫療、教育、住房是我國三大民生話題,醫療器械行業是構筑醫療體系的重要支撐點。醫療器械行業的快速發展給政府監管提出了新的挑戰。我國用于醫療器械研究和開發的公共和私人投資不斷增加,但是更加有效、更加支付得起的醫療器械產品推廣應用速度卻越來越慢。究其原因,主要是當前的醫療器械注冊審評資源嚴重不足,制約了行業發展。美國FDA從事醫療器械上市審查的人員有300余人,而歐盟進行醫療器械審查的公告機構達到74個。而中國目前在國家局層面從事醫療器械注冊技術審評的人員僅有70余人;各省級藥品監管部門從事醫療器械注冊技術審評的人員僅為140余人[8]。
(3)市場準入制度未能對行業良性發展提供有效的導向。成熟的市場準入制度不僅是產品上市前控制,更應該對行業的良性發展提供導向,包括鼓勵產品不斷創新;提高有效性的同時降低風險;促進企業完善自身質量管理;推動行業整合優化等。例如,風險管理活動不僅僅是對醫療器械制造商自我控制的要求,更是我國監管的強制性要求。作為責任主體,生產企業應該在醫療器械產品生命周期的所有階段執行風險管理[9-12]。然而我國很多企業的風險管理活動僅在產品市場準入階段準備的一份風險管理報告,市場準入未起到推動企業貫徹風險管理理念的作用。美國FDA具有成熟的市場準入制度體系,其關鍵路徑計劃重在發展新的、更可靠的安全性評價工具及相應標準[13]。我國市場準入制度建立尚處起步階段,行業發展需要更加科學、成熟的市場準入制度,應把改革重點放在構建現代化的醫療器械市場準入制度上[14]。
2.5 構建現代化的醫療器械市場準入關鍵路徑
目前,我國對醫療器械市場準入缺乏系統研究,以往文獻主要是介紹國外政府監管模式和經驗,未能提出我國市場準入路徑中存在的問題,以及客觀評價準入路徑的標準。美國FDA關鍵路徑計劃在這方面給了有益的啟示:
(1)應用關鍵路徑法。以此確定醫療器械市場準入規制中的關鍵環節;
(2)分析關鍵路徑上每個環節的問題。以此協調各方解除制約因素;
(3)主動改革醫療器械分類、臨床試驗、審評等機制。以此使醫療器械市場準入路徑更加安全、高效;
(4)發展新的安全性評價指南相應標準。以此指導行業通過關鍵路徑提高效率;
3 結語
借鑒美國FDA關鍵路徑計劃,構建我國醫療器械市場準入制度的重點應當是:分析醫療器械市場準入路徑中存在的問題,探討產生這些問題的原因并提出相應的解決方案;用管理學理論及關鍵路徑法客觀分析、闡述市場準入路徑的關鍵路徑及其規制;用模型方法建立關鍵路徑的模型;用風險分析方法評價模型對醫療器械安全有效的影響;用經濟學方法評價模型對醫療器械市場準入效率和成本的影響[15]。從建立模型、關鍵路徑法和模型評價的角度出發,比較研究國外如何通過改革分類模式、臨床試驗模式、510(k)注冊模式等關鍵路徑,以適應醫療器械行業和技術發展,構建適于我國的醫療器械市場準入制度。
[1]FDA.Innovation/Stagnation:Challenge and Opportunity on the Critical Path to New Medical Products.[EB/OL].[2004-03].http://www.fda.gov.
[2]FDA.Innovation/Stagnation: Critical Path Opportunity Report.[EB/OL].[2006-03].http:// www.fda.gov.
[3]FDA.Innovation/Stagnation:Critical Path Opportunity list.[EB/OL].[2006-03].http://www. fda.gov.
[4]FDA.Key FDA Critical Path Activities Under Way in 2007.[EB/OL].[2008-06].http://www. fda.gov.
[5]FDA.The Critical Path Initiative:Report on Key Achievements in 2009.[EB/OL].[2008-06]. http://www.fda.gov.
[6]李中華,郭翔宇.FDA的關鍵路徑計劃[J].中國醫藥技術經濟與管理,2007,1(4):84-90.
[7]常永亨,宓現強.FDA的關鍵路徑動議對我國醫藥監管的啟示[J].中國醫療器械信息,2009,15(6):22-26.
[8]王蘭明.中國醫療器械注冊管理工作的現狀與思考[J].中國醫療器械信息,2012,17(11):28-34.
[9]李非,呂大雷,梁文,等.醫療器械生產企業風險管理水平的影響因素研究及對策[J].中國醫療器械信息,2010,16(4):74-77.
[10] 常永亨.歐盟的醫療器械市場準入與第三方認證的區別[J].中國醫療器械雜志,2010,34(1):42-43.
[11]秦韶燕,崔濤,股海松,等.淺談韓國對醫療器械市場準入的要求[J].醫療衛生裝備,2015,36(5):124-126,131.
[12]王蘭明,王宿.美國歐盟醫療器械上市許可管理制度及其啟示[J].中國藥業,2012,21(24):1-5.
[13]王蘭明.關于推進醫療器械上市后安全性監測工作的探討[J].中國醫療器械信息,2009,15(4):48-52.
[14]黃莉婷,董齊,陸朝甫.我國醫療器械臨床應用監測與評價現狀[J].中國醫療設備,2013,28(11):63-66.
[15]岳偉.加快《醫療器械監督管理條例(修正案)》發布的重大意義[J].中國醫療器械雜志,2013,37(1):40-43.
Research on inspiration to medical device market access system from FDA's critical pathplan
SHAO Yu-bo, LI Fei
China Medical Equipment,2015,12(11)∶117-120.
Objective∶ Through reading a lot of literature on the critical path planning of FDA, analyzed the contribution and shortage of the critical path plan to China's medical device market access system. Methods∶ To analyze the critical path planning of FDA by using the method of literature review. Results∶ China should reference the critical path plan, reform the existing medical instrument market access system, improve the efficiency, simplify the procedure and promote the safety and development of the product. Conclusion∶ The research on the critical path planning of FDA is very important for the construction of China's modern medical device market access path.
Food drug fdministration; Critical path plan; Medical device; Market access path
邵玉波,女,(1977- ),碩士,工程師。中國食品藥品檢定研究院,從事有源醫療器械檢驗以及實驗室綜合業務管理工作。
1672-8270(2015)11-0117-04
R197.39
A
2015-07-27
①中國食品藥品檢定研究院 北京 100050
②遼寧省藥械審評與監測中心 遼寧 沈陽 110003

