正常前列腺組織磁共振彌散加權成像在不同b值下的最優擬合模型研究
智德波,邱本勝
中國科學技術大學生物醫學工程中心,合肥 230026
前列腺癌是世界上男性最常發的癌癥之一,尤其在西方國家,對人們的生命健康造成了極大的威脅[1]。隨著國內經濟的發展,中國人的生活方式越來越西方化,并且老齡化嚴重,國內前列腺癌的發病率也在逐漸上升。目前,前列腺特異性抗體檢測是最常用的前列腺癌檢查方法。其他的檢查方法還包括組織活檢、直腸指檢檢查和經直腸的超聲檢查。由于磁共振可以提供無創、高對比度的結構和功能成像,它已經成為一個強大的腫瘤診斷手段。在磁共振的諸多成像序列方法中,T1加權成像、T2加權成像和彌散加權成像(diffusion weighted imaging,DWI)已經用來對前列腺癌診斷和分級。T1和T2加權成像主要提供組織的結構圖像,而DWI是一種在活體組織檢查水分子擴散運動的最理想方法。表觀擴散系數(apparent diffusion coefficient,ADC)是DWI的一個重要參數,一般用來評估水分子在組織中的擴散速度,可以用來反映組織結構特性[2]。早在1965年基于梯度脈沖自旋回波(PGSE)實驗就提出了單指數彌散加權模型[3]。臨床診斷中,對DWI的分析通常都是基于單指數彌散加權模型,但是由于單指數彌散模型的建立是基于水分子的自由擴散運動,這與在人體組織內水分子的實際擴散狀態有差異,所以,單指數彌散模型不能對DWI的信號進行特別精確的擬合。在這次研究中,筆者利用兩種較復雜的模型(雙指數彌散模型和彌散峰度模型)對DWI信號擬合,比較兩個模型的擬合優度,并對所有的b值根據擬合結果進行分段,計算每個b值點擬合的信號強度值與圖像采集得到的信號強度的差值,如果該差值在連續的幾個b值上的平方和最小,將這些b值組合一起作為一個分段,則該模型為在此b值分段為最優擬合模型。
1 材料和方法
1.1 材料
共有11位健康男性(22~28歲,平均25歲)參加了這項研究,此研究已被安徽中醫藥大學第一附屬醫院倫理委員會批準通過,并獲得了所有參加者的書面知情同意書。
1.2 磁共振成像檢查
利用1.5 T MRI(Symphony,Siemens Medical systems,Erlangen,Germany)采集圖像數據。主要采集軸狀位DWI和標準的正交平面T2加權成像。DWI利用平面回波成像(EPI)序列:TR 4000 ms,TE 128 ms,翻轉角 90°,激勵次數 4,視野320 mm,矩陣256×208,層厚5 mm,從 0~3000 s/mm2中選取31個b值(0、50、100、150、200、250、300、350、400、450、500、550、600、700、800、900、1000、1100、1200、1300、1400、1500、1600、1700、1800、1900、2100、2300、2500、2700、3000 s/mm2)進行掃描,梯度場選取3個正交梯度方向。T2加權成像(T2WI)利用快速自旋回波(TSE)序列:TR 4000 ms,TE 128 ms,視野 230 mm,矩陣512×512,層厚3mm。
1.3 圖像及數據分析
采集圖像數據并將數據通過matlab編程進行統一處理,利用雙指數彌散模型和DKI模型函數公式作曲線擬合。因為已有研究表明雙指數彌散模型和DKI模型的擬合精確度要比單指數模型要高,所以,在這項研究中不再比較與單指數彌散模型的擬合差異[4-6]。
雙指數彌散模型[7]:
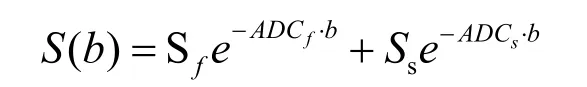
其中ADCf和ADCs分別代表ADC的快速擴散部分和慢速擴散部分。Sf和Ss是相應的幅值,Sf占的比例Sf/(Sf+Ss)可以用ffast表示[8]。在血管內和遠離細胞膜的結構部分,水分子彌散運動受到細胞膜和大分子等組分的限制較小,ADCf的值較大,擴散速率較快;在細胞膜和生物大分子周圍,水分子的擴散將受到阻礙,ADCs的值較小,彌散運動速率較慢。
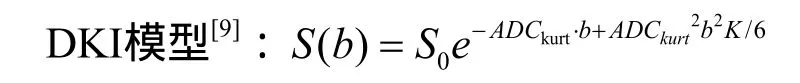
其中峰度(K)是一個無量綱的數據,代表彌散分布偏離高斯分布的程度。S(b)和S0分布代表b值為b和零時的信號強度。ADCkurt為表觀擴散系數。DKI作為DTI模型的延伸,同樣需要施加較多非線性相關方向的擴散敏感梯度場。
在T2加權成像的圖像引導下,在DWI圖像中選擇適合的層面手動畫取感興趣區域(region of interes,ROI),在前列腺中央區域DWI的圖像信號強度較均勻,在此區域選取ROI時,面積盡量大,從而對擬合結果影響較小,ROI的選擇在1名具有5年臨床診斷工作經驗的醫生的指導下進行,盡可能選取在圖像信號較均勻的部分,如圖 1。對彌散加權成像的圖像數據利用非線性最小二乘法Levenberg-Marquardt算法進行擬合。計算利用兩個函數模型擬合的參數值、調整后的決定系數R2(adjusted R2,考慮自由度在內)和均方根誤差(root mean square error,RMSE),并計算每個b值點兩個彌散模型的擬合值與原始圖像信號強度的差的平方,根據計算結果對b值進行分段,選取每個模型的擬合值與圖像原始信號強度差的平方較小的連續b值組合一起作為一個分段,計算每個分段中的RMSE,對每個b值的分段分別選取雙指數彌散模型和DKI模型RMSE較小的作為該分段的最佳擬合函數,并作統計分析。采用F檢驗對比兩個模型的擬合精度的顯著性差別,P<0.05時具有統計學顯著性意義。全部的參數數據用平均值±標準差(±s)表示。
2 結果
隨著b值的增高,DWI采集的圖像信噪比會下降,當b值達到3000 s/mm2時,圖像的信噪比已降低到非常低,但是根據指數函數的特性,高b值時信號強度趨于穩定,信號強度的衰減速率已經非常小,故即使有個別點的噪聲較大對整體的擬合結果影響也不大。通過matlab編程對兩個模型作曲線擬合和F檢驗,曲線的擬合結果如圖2所示。
計算擬合參數及RMSE并作統計分析,結果如表1所示。
結果證明雙指數彌散模型調整后的決定系數R2 略微大于DKI模型,雙指數彌散模型的擬合精確度顯著優于DKI模型(P<0.05)。因為不同的模型可以從不同的角度解釋生物組織水分子的擴散特性,所以,不同的模型在不同的b值擬合精度不同。從b值分段的RMSE來看,在500~1000 s/mm2時DKI模型的RMSE更小,代表DKI模型的曲線與雙指數彌散模型相比更接近于原始數據。在b值取0~500 s/mm和1000~3000 s/mm2 時,雙指數模型的RMSE更小,表示雙指數彌散模型的曲線更接近于原始數據。另外,通過編程計算出雙指數彌散函數模型和DKI函數模型中參數的值,如表2所示。
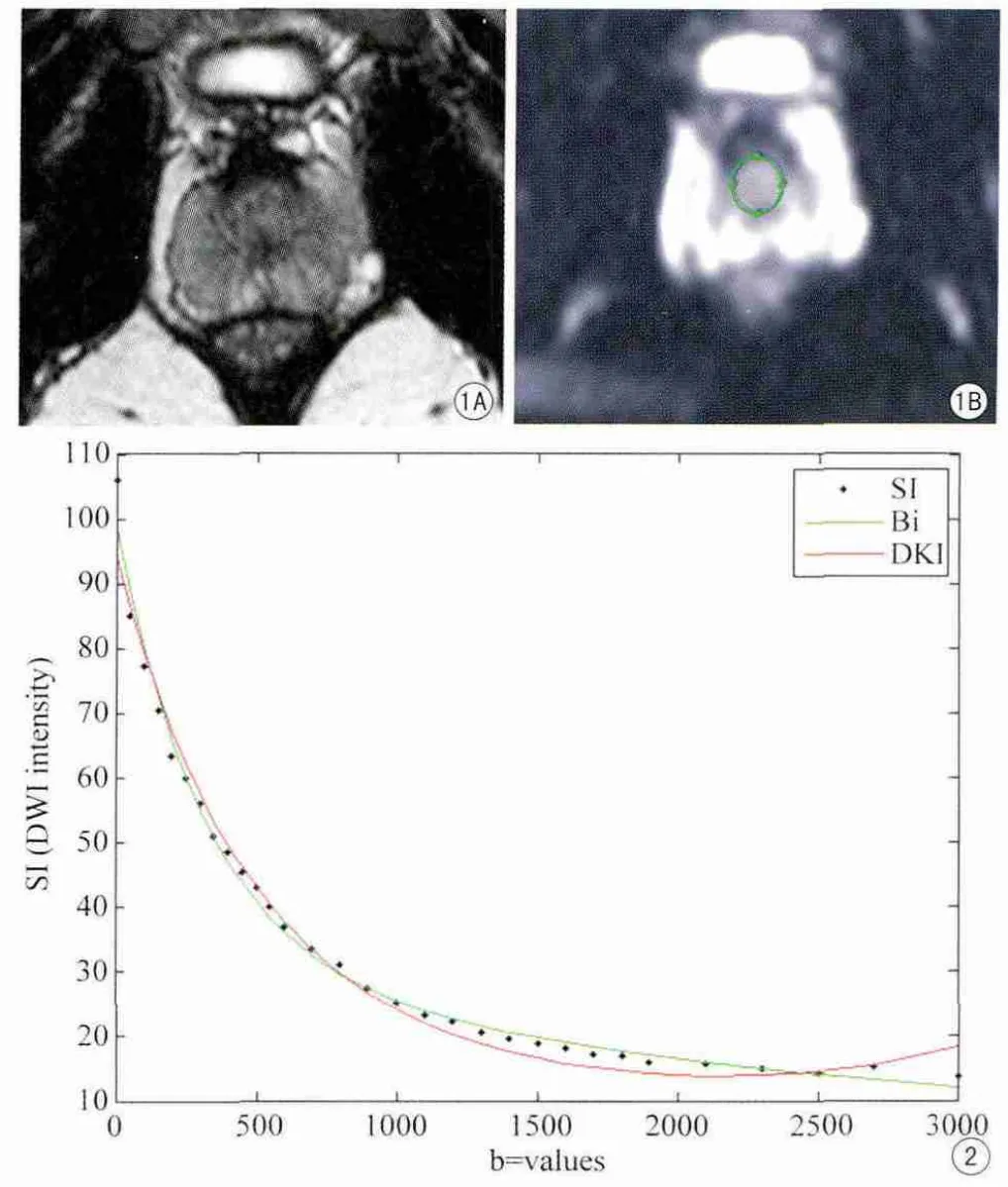
圖1 A:前列腺T2加權成像;B:ROI在DWI移行帶中,面積約60 mm2,采集DWI信號 圖2 雙指數彌散函數模型和DKI函數模型的擬合曲線。其中黑色圓點代表原始圖像采集到的DWI信號數據,綠色曲線代表雙指數模型,紅色曲線代表DKI模型Fig.1 A:The T2WI of prostate; B:ROIs on the transition zone were drawn on DWI,based on the T2WI.The area of each ROI was approximately 60 mm2.The signals of DWI can be measured.Fig.2 Diffusion-weighted signals intensities vs.b-values(black dots)of a subject and the fitting curves of biexponential diffusion model(green curve)and DKI model(red curve)
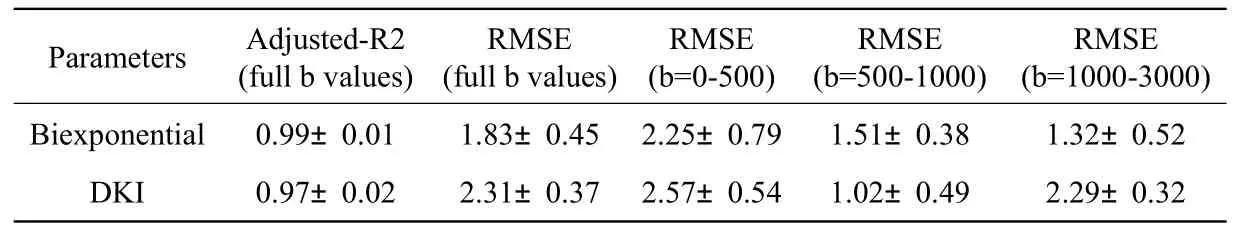
表1 雙指數彌散模型和DKI模型的擬合統計結果Tab.1 the statistical results of fi tting for biexponential diffusion model and DKI model

表2 雙指數彌散函數模型和DKI函數模型的參數值Tab.2 Parameters of the four DWI models
其中,ADC的單位是10-3mm2/s,ffast代表的是快速擴散組分所占的比例。可以看出,ADCf要遠大于ADCs,這是由于ADCf代表快速擴散ADC,受到細胞膜及生物大分子的影響較小,擴散較快。
3 討論
DWI已經被廣泛應用到腫瘤的診斷和分級中[10]。一般情況下,前列腺的DWI采用的b值是800~1000 s/mm2,b值的選擇對計算ADC值有很大的影響[11]。一些研究表明,當DWI采用高b值成像時,將有利于區分前列腺腫瘤和良性組織[12-13]。然而,當b值較高時,想要獲得高信噪比的圖像將面臨很大的挑戰,圖像會出現偽影和失真。有研究提出可以利用低b值的彌散圖像計算出高b值的彌散圖像,從而保證圖像的信噪比并且縮短成像時間,將有助于腫瘤的檢測[14-15]。由于單指數彌散模型對彌散加權圖像的信號擬合精度不夠高,如果利用其公式計算高b值的圖像將增大誤差,所以,利用更加精確的模型將會避免這種現象。雙指數彌散模型和DKI模型不僅在前列腺癌的診斷中得到了廣泛的應用,在其他組織也得到了很多的應用[16]。腦部和頸部的彌散加權成像中,利用DKI模型可以更加精確地擬合信號,并且K與ADC相關度比較低,可以作除ADC外一個額外的參數為診斷提供參考價值[17]。在乳腺癌檢查中,雙指數彌散模型可以利用ADC和ffast進行定量的計算,展現腫瘤區域的微環境,從而提高診斷的敏感度[18],乳腺腫瘤區域ADC值下降,這歸結于快速ADC部分比例下降,慢速ADC值較低且所占比例上升[19]。
在本研究中,選取ROI時選取過中央區域不同的位置,也選過一個盡可能大面積的ROI,數據表明信號強度變化不大,且ROI內信號強度的偏差較小,對曲線擬合影響不大,此外,已有研究采用這種選取方法并取得了較好的實驗效果[4,6-7]。
雖然已有研究證明雙指數彌散模型和彌散峰度模型都比單指數彌散模型的擬合精度要高[4-6],然而,這兩個模型中的任意一個模型都不能在所有的b值下有最好的擬合精度。在這次研究中,筆者將正常男性前列腺的多b值成像根據擬合結果分割成了3個b值的分段,在每個分段中只有一個彌散加權模型的擬合效果最好。雙指數彌散模型在低b值和高b值分段對DWI的信號擬合更精確,這歸結于它反映了低b值時的毛細血管的微循環和高b值時的真正的水分子擴散。而DKI模型更適合在500~1000 s/mm2,這剛好與前人的研究結果一致,即當用來計算ADCkurt、K值時,b值最好不要高于1000 s/mm2[4]。雙指數彌散模型中的快速ADC大于慢速ADC,這與水分子在細胞內外間隙受到更小的擴散阻礙和水分子受到細胞膜和細胞其他結構的阻礙降低擴散速度是對應的。DKI模型中的K值雖然沒有直接的研究表明其與生物組織結構的直接聯系,但是更多的參數將為臨床診斷提供更多可靠的參考。研究證實,ADCkurt和K可以用來區分前列腺良性 和惡性區域[20]。雙指數彌散模型和DKI模型能夠為臨床醫生的診斷提供更多定量的參數,但是相比于采用單指數彌散模型分析只需要至少兩個b值的彌散加權圖像,這些參數的計算需要3個或者4個以上b值的DWI圖像來支持。隨著b值數量的增多,通過利用回歸曲線擬合的方法計算出來的模型的參數將會使誤差更小。
本項研究證明,雙指數彌散模型和DKI模型對DWI信號的擬合精確度是不同的,在不同b值分段具有不同的最優擬合模型,將兩個彌散模型結合起來將提供一種潛在的方法為臨床的診斷提供更多的幫助。
[References]
[1]Mazaheri Y,Shukla-Dave A,Muellner A,et al.MR imaging of the prostate in clinical practice.Magnetic Resonance Materials in Physics Biology and Medicine,2008,21(6):379-392.
[2]Chen AP,Li HM,Yu H,et al.Preliminary study on pathomechanism of non-small-cell lung carcinoma using apparent diffusion coeffi cient.Chin J Magn Reson Imaging,2014,5(1):40-44.陳愛萍,李惠民,于紅,等.表觀擴散系數與非小細胞肺癌病理基礎初探.磁共振成像,2014,5(1):40-44.
[3]Stejskal EO,Tanner JE.Spin diffusion measurements:spin echoes in the presence of a time-dependent fi eld gradient.Journal of Chemical Physics,1965,42(1):288-292.
[4]Quentin M,Blondin D,Klasen J,et al.Comparison of different mathematical models of diffusion-weighted prostate MR imaging.Magn Reson Imaging,2012,30(10):1468-1474.
[5]Yuan J,Yeung DK,Mok GS,et al.Non-Gaussian analysis of diffusion weighted imaging in head and neck at 3T:a pilot study in patients with nasopharyngeal carcinoma.PLoS One,2014,9(1):e87024.
[6]Shinmoto H,Oshio K,Tanimoto A,et al.Biexponential apparent diffusion coeffi cients in prostate cancer.Magn Reson Imaging,2009,27(3):355-359.
[7]Liu X,Peng W,Zhou L,et al.Biexponential apparent diffusion coeffi cients values in the prostate:comparison among normal tissue,prostate cancer,benign prostatic hyperplasia and prostatitis.Korean J Radiol,2013,14(2):222-232.
[8]Mulkern RV,Barnes AS,Haker SJ,et al.Biexponential characterization of prostate tissue water diffusion decay curves over an extended b-factor range.Magn Reson Imaging,2006,24(5):563-568.
[9]Jensen JH,Helpern JA,Ramani A,et al.Diffusional kurtosis imaging:The quantification of non-Gaussian water diffusion by means of magnetic resonance imaging.Magnetic Resonance in Medicine,2005,53(6):1432-1440.
[10]Zhang HH,Mu XT,Wang H.Diffusion-weighted imaging at 3.0 T MR in diagnosis of lacrimal epithelial tumor.Chin J Magn Reson Imaging,2014,5(3):182-188.張荷煥,穆學濤,王宏.3.0 T MR擴散加權成像對淚腺上皮性腫瘤的診斷價值.磁共振成像,2014,5(3):182-188.
[11]Garcia Santos JM,Ordonez C,Torres del Rio S.ADC measurements at low and high b values:insight into normal brain structure with clinical DWI.Magn Reson Imaging,2008,26(1):35-44.
[12]Kitajima K,Takahashi S,Ueno Y,et al.Clinical utility of apparent diffusion coefficient values obtained using high b-value when diagnosing prostate cancer using 3 tesla MRI:comparison between ultra-high b-value(2000 s/mm2)and standard high b-value 1000 s/mm2).J Magn Reson Imaging,2012,36(1):198-205.
[13]Kim CK,Park BK,Kim B.High-b-value diffusion-weighted imaging at 3.0 T to detect prostate cancer:comparisons between b values of 1000 and 2000 s/mm2.American Journal of Roentgenology,2010,194(1):W33-W37.
[14]Blackledge MD,Leach MO,Collins DJ,et al.Computed Diffusionweighted MR Imaging May Improve Tumor Detection.Radiology,2011,261(2):573-581.
[15]Rosenkrantz AB,Chandarana H,Hindman N,et al.Computed diffusion-weighted imaging of the prostate at 3.0 T:impact on image quality and tumour detection.Eur Radiol,2013,23(11):3170-3177.
[16]Ding JL,Xing W,Chen J,et al.The comparison between monoexponential and biexponential function of multi-b DWI in evaluation of clear cell renal cell carcinoma.Chin J Magn Reson Imaging,2013,4(4):266-270.丁玖樂,邢偉,陳杰,等,腎透明細胞癌多b值DWI的單指數函數與雙指數函數分析比較.磁共振成像,2013,4(4):266-270.
[17]Jansen JF,Stambuk HE,Koutcher JA,et al.Non-gaussian analysis of diffusion-weighted MR imaging in head and neck squamous cell carcinoma:A feasibility study.AJNR Am J Neuroradiol,2010,31(4):741-748.
[18]Liu C,Liang C,Liu Z,et al.Intravoxel incoherent motion(IVIM)in evaluation of breast lesions:comparison with conventional DWI.Eur J Radiol,2013,82(12):e782-789.
[19]Tamura T,Usui S,Murakami S,et al.Comparisons of multi b-value DWI signal analysis with pathological specimen of breast cancer.Magn Reson Med,2012,68(3):890-897.
[20]Rosenkrantz AB,Sigmund EE,Johnson G,et al.Prostate cancer:feasibility and preliminary experience of a diffusional kurtosis model for detection and assessment of aggressiveness of peripheral zone cancer.Radiology,2012,264(1):126-135.

