人參和酶解人參中的人參二醇和人參三醇的含量比較
張念潔,曲新砉,劉洪亮
(1.延邊朝鮮族自治州產品質量檢驗所,吉林延吉133000;2.琿春綠源參業生物科技有限公司,吉林琿春133300)
人參和酶解人參中的人參二醇和人參三醇的含量比較
張念潔1,曲新砉2,劉洪亮1
(1.延邊朝鮮族自治州產品質量檢驗所,吉林延吉133000;2.琿春綠源參業生物科技有限公司,吉林琿春133300)
建立了高效液相法色譜測定人參和通過酶解工藝處理后的人參中的人參二醇和人參三醇的含量比較的方法。色譜條件:DiamonsilC18色譜柱,流動相為甲醇∶水,(95∶5)檢測波長為230 nm。結果樣品經提取,水解和衍生化等前處理后,人參二醇平均回收率為92.87%,RSD為2.18%(n=6);人參三醇為平均回收率91.7%,RSD為2.10%(n=6)。人參二醇1.6 ug~16ug內有良好的線性關系,r=0.9997。人參三醇1.6 ug~16ug內有良好的線性關系,r=0.999 1。
酶解人參二醇;人參三醇;衍生化;高效液相色譜
人參的主要成分是人參皂苷(Ginsenoside),人參皂苷中人參二醇和人參三醇具有脂溶性活性成分,毒性低、分子量小、易于通過血腦屏障的特點,對動脈粥樣硬化的形成有預防作用[1],人參二醇和人參三醇不僅具有降血脂、抗脂質過氧化反應、提高機體免疫力、預防感染等作用,還可產生抗疲勞、延緩衰老、調節中樞神經系統、提高機體免疫力、改善心腦血管供血不足、抑制腫瘤細胞生長等功效[2]。
現代藥理學研究表明,口服人參以后,主要人參皂苷在人的消化系統中被轉化成稀有人參皂苷后吸收起藥效,但因含量稀少大大限制了其應用,因此制備稀有人參皂苷具有重要意義。獲得大量、高純度的稀有人參皂苷,并開發成可用于臨床防治腫瘤的制劑將具有重要的科研意義和社會價值,這將對先導化合物的發現和創新藥物研究具有重要意義。
用于人參皂苷糖苷化合成的方法主要有化學合成法、酶解法和微生物轉化法[3]。酶解人參作為有效成分可直接被人體利用,且利用程度與腸內微生物分解能力無關,有效避免了服用人參的效能個體差異,提高了人參藥用成分的利用率。
人參皂苷經強酸水解得到人參二醇和人參三醇[4]。國內外對人參二醇和人參三醇的含量測定方法報道,比色法[5]、薄層色譜法[6]、高效液相法[7]以及超臨界流體色譜法[8]。本文采用衍生化試劑[9],反相高效液相色譜法對人參中酶解前后的人參二醇,人參三醇含量測定方法進行了研究比較。
1 材料與方法
1.1 儀器與試劑
日本島津LC-10AT型高效液相色譜儀:SPD-10AD紫外可見檢測器,SIL-10AD自動進樣器,SCL-10A系統監控器。
甲醇:色譜純;水:一級去離子水;甲醇配制的標準溶液儲備液(1mg/mL);甲醇稀釋相應的標準工作溶液;人參二醇(>99%)對照品Lot(AW017P)、人參三醇(>99%)對照品Lot(AW 016P):天津一方科技有限公司提供;3,5-二硝基苯甲酰氯(>98%):上海化成工業發展有限公司);人參酶解前后的樣品由琿春綠源參業生物科技有限公司提供[10]。
1.2 色譜分析條件
液相色譜條件及系統適應性實驗色譜柱為DiamonsilC18柱(4.6mm×250mm,5μm);流動相:甲醇:水(95∶5);流速:1.0mL/min;檢測波長為230 nm,色譜圖見圖1。
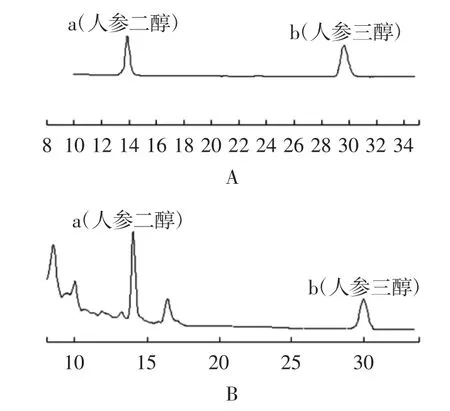
圖1 色譜圖Fig.1 HPLC chromatogram
1.3 對照品的制備
精密移取人參二醇對照品和人參三醇對照品,置于25mL量瓶中,用甲醇溶解稀釋至刻度,搖勻,得0.4mg/mL的對照品溶液作為儲備液。精密吸取對照品2mL,加3,5-DNB 20mg,無水吡啶0.3mL,置75℃水浴回流1 h,取出后減壓用氮氣吹干,殘渣用四氫呋喃溶解,定容5mL。
1.4 樣品的前處理
精密稱取人參提取物0.1 g,加入10mL45%乙醇超聲提取1 h,加濃硫酸2.0mL置75℃水浴回流4 h,冷卻后調pH6~7,環己烷提取3次,加Na2SO42 g脫洗液濃縮至近干,加入加3,5-DNB 20mg,無水吡啶0.3mL,置75℃水浴回流1 h,取出后減壓用氮氣吹干,殘渣用四氫呋喃溶解。定容5mL。過0.45μL濾膜,進樣。供液相色譜測定用。
精密稱取酶解人參提取物0.1 g,其余操作與人參供試品溶液制備相同,即得。
2 結果與討論
2.1 線性方程和方法檢測限
標準曲線的制備精密吸取人參二醇對照品和人參三醇對照品,2.0、4.0、6.0、8.0mL分別置10mL量瓶中,用四氫呋喃稀釋至刻度,搖勻,分別吸取20μL,注入液相色譜儀,按照1.2項下的方法測定,以對照品濃度為橫坐標,對照品峰面積為縱坐標,結果經回歸分析,人參二醇1.6 ug~16 ug內有良好的線性關系,回歸方程Y=119 914X+32 955,r=0.999 7。人參三醇1.6 ug~16 ug內有良好的線性關系,回歸方程為Y=86 139X+23 535,r=0.999 1。見表1。方法檢出限按S/N=3計算,人參二醇最低檢出線以信噪比為3∶1計算,人參二醇的低檢出線是1ug/kg,人參三醇的低檢出線是1ug/kg。
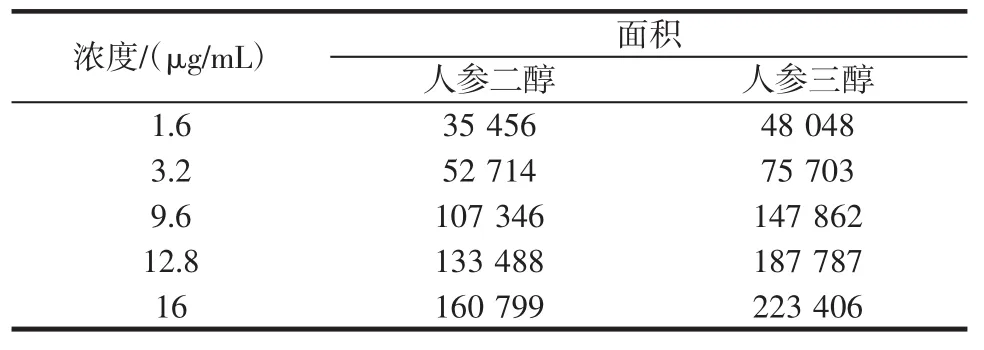
表1 濃度與面積關系Table1 Relationship of concentration and peak area
2.2 精密度實驗
按照對照品溶液制備方法(1.3),配制溶液,按照1.2項下的方法測定,連續進樣5次見表2。精密度實驗精密吸取人參二醇、人參三醇對照品溶液20μL,測定峰面積,結果人參二醇RSD為1.63%。人參三醇RSD為1.02%,見表2。
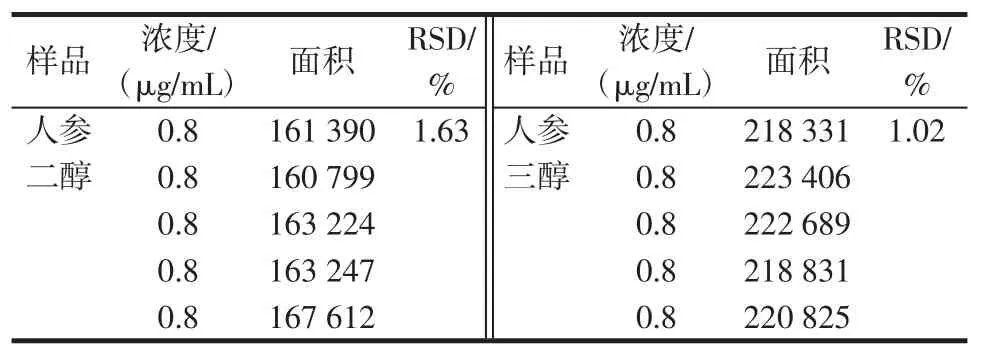
表2 精密度實驗Table2 Precision experiment
2.3 穩定性實驗
穩定性實驗樣品溶液,按照1.2項下的方法在0、2、4、8、16、24 h分別進樣20μL,測定峰面積,結果人參二醇RSD為1.81%,人參三醇RSD為1.23%,表明樣品溶液在24 h內保持穩定。見表3。
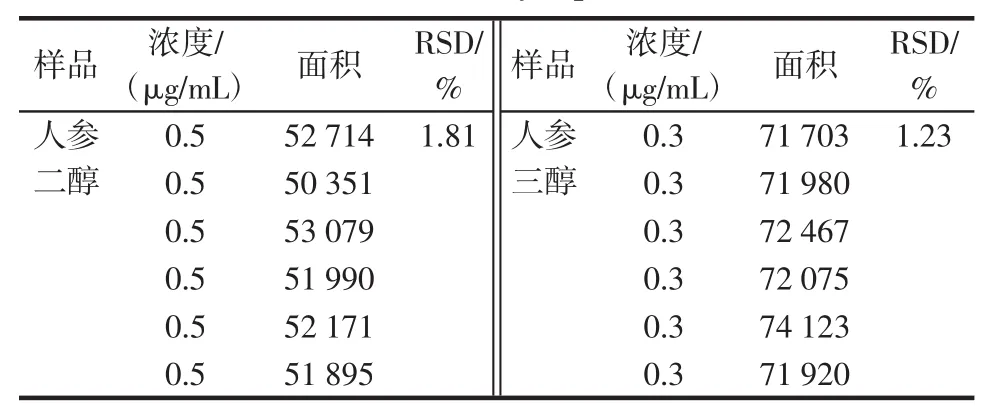
表3 穩定性實驗Table3 Stability experiments
2.4 重復性實驗
重復性實驗取同一批樣品6份,按“1.2”項方法測定峰面積,人參二醇RSD為1.50%,人參三醇RSD為1.36%。見表4。
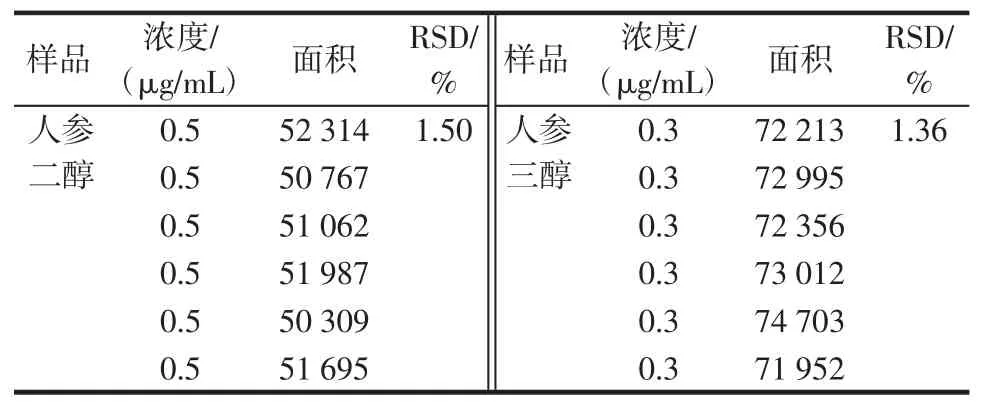
表4 重復性實驗Table4 Repeated experiment
2.5 加樣回收率實驗
加樣回收率實驗精密稱取人參樣品0.1 g,分別加入一定量的(3個梯度濃度)人參二醇,人參三醇對照品溶液,按“1..4”的制備方法及“1.2”項條件方法進行測定,結果見表5。

表5 加樣回收率的實驗結果(n=6)Table5 Results of recovery ratio
人參二醇平均回收率為92.87%,RSD為2.18%(n=6);人參三醇為平均回收率91.7%,RSD為2.10%(n=6)。
2.6 樣品的含量測定
取樣品按照1.2項下的方法測定,人參樣品中含有人參二醇的含量、人參三醇的含量見表6。

表6 樣品中的人參二醇和人參三醇的含量Table6 The contents of Panoxadiol and Panaxatriol in samples
3 結論
1)經過多種實驗方法的比較,最終選擇該檢測方法同時測出樣品中的人參二醇和人參三醇的含量,本方法快速靈敏,酸水解引起苷元結果的變化,主要得到人參二醇(Panoxdiol,PD),人參三醇(Panaxatriol,PT)及C-20差向異構體[9]。衍生化方法、回流的時間、溫度是整個實驗成敗的關鍵一環。經實驗對比,衍生化方法解決了人參二醇和人參三醇在無紫外吸收的情況下無法測定的問題。
2)最近十幾年來除了傳統的化學合成法外,酶解法和微生物轉化法被應用到這個領域中來,采用酶解法具有反應條件容易控制、酶系豐富、等許多化學合成法所不具備的優點。在工業化大規模制備稀有人參皂苷時首選酶解法和微生物轉化法[10]。通過本次試驗,樣品的含量測定結果顯示,酶解工藝處理過的人參中的人參二醇和人參三醇的含量均大大超過了普通人參中的人參二醇和人參三醇的含量,這與酶解工藝有關,提高了稀有人參皂甙的含量。這次試驗的結果為以后的制備人參皂苷制品提供了一定的參考價值。
[1]李鳳娥,孔繁利,孫新,等.人參二醇組皂苷(PDS)對血脂、血清NOMDA含量、SOD活力的影響[J].中國民康醫學2009,21(21):2653-2657
[2]劉英,華吉年,鄭月紅,等.人參二醇組皂甙和三醇組皂甙藥理作用的比較研究[J].吉林中醫藥,1999(2):57-60
[3]楊寧,楊世林,趙余慶.稀有人參皂苷糖苷化合成方法的研究進展[J].現代藥物與臨床2014,29(5):574-582
[4]曹青青,鄒澄.人參二醇和人參三醇氧化反應的研究[J].云南中醫學院學報 2013,36(6):4-6
[5]楊燕,羅志輝,晏全.荔枝核總皂甙的含量測定[J].化工時刊,2004,18(1):45-46
[6]張春紅,李向高,張連學,等.薄層掃描法測定人參總皂苷酸水解物中人參二醇的含量[J].特產研究2006(2):71-73
[7]張雷,王志才,陳燕萍.反相高效液相色譜法快速測定人參莖葉二醇組總皂苷含量[J].分析化學 2009(A02):176
[8]李云華,李修祿,虹嵐.超臨界流體色譜法測定三七及云南白藥中人參二醇和人參三醇的含量[J].藥學學報1991,26(10):764-767
[9]李章萬,徐秀榮,馮春瓊,等.高效液相色譜衍生化法測定紅參及生脈注射液中人參二醇和人參三醇的含量[J].華西藥學雜志1999,14(4):271-273
[10]劉發貴,張成中,鄭毅男.低極性人參皂苷制備研究進展[J].人參研究 2011(2):28-33
Simultaneous Determination of Residual of Panoxadiol and Panaxatriol Ginseng and Enzymolysis Ginseng by High Performance Liquid Chromatography
ZHANG Nian-jie1,QU Xin-xu2,LIUHong-liang1
(1.Yanbian State Product Inspection,Yanji133000,Jilin,China;2.Hunchun Luyuan Ginseng Industry Scienceand Technology Co.,Ltd.,Hunchun 133300,Jilin,China)
To establisha high performance liquid chromatography (HPLC)method for simultaneous determination of residual panoxadiol and panaxatriol Ginseng and enzymolysis Ginseng by HPLC external standard method.HPLC gradient elution method was used withmethanol -water(95∶5).DiamonsiC18 column was used,and panoxadiol and panaxatriol was determined at the detection wavelength of230 nm.The samples were treated by extraction,hydrolysis and derivation The averrage recovery and RSD of panoxadiol were 92.87% and 2.18%(n=6),respectively.The averrage recovery and RSD of panaxatriol were91.7%and 2.10%(n=6),respectively.The standard curve of panoxadiol was linear in the range of 1.6 ug-16 ug,r=0.999 7and The standard curve of panaxatriol was linear in the range of1.6 ug-16 ug,r=0.999 1.
enzymolysis;panoxadiol;panaxatriol;derivatization;HPLC
10.3969/j.issn.1005-6521.2015.06.007
2014-09-19
張念潔(1979—),女(漢),工程師,研究生,研究方向:分析化學(食品質量分析)。

