花蕓豆鐵蛋白的分離純化
田童童 江 英 張 建 王由美 魏永輝 張月茹 楊金月
(石河子大學食品學院,石河子 832000)
花蕓豆鐵蛋白的分離純化
田童童 江 英 張 建 王由美 魏永輝 張月茹 楊金月
(石河子大學食品學院,石河子 832000)
為了從花蕓豆中獲取純化的植物鐵蛋白,試驗利用鹽析及柱層析對花蕓豆中的鐵蛋白進行分離純化。研究表明,鐵蛋白提取的最佳工藝條件為:提取溫度53.79℃,樣液pH值為7.23,氯化鎂濃度511.15 mmol/L,檸檬酸三鈉濃度為685.24 mmol/L。該條件下模型預測花蕓豆中鐵蛋白的含量為4.40 mg/g,實際試驗值為(4.27±0.09)mg/g。經DEAE-Sepharose Fast Flow陰離子交換柱和Sephacryl S-500分子篩柱純化得到的電泳純鐵蛋白的相對分子質量為560 000,且只含有1種亞基,其相對分子質量為27 000。通過Western-Blot法對純化所得的花蕓豆蛋白質進行試驗驗證,結果確定該蛋白質為鐵蛋白。
花蕓豆 鐵蛋白 分離 純化
鐵蛋白具有調節鐵代謝平衡和解除亞鐵離子毒性的雙重功效。從細菌到植物再到人的鐵蛋白,其結構非常保守[1-2]。鐵蛋白是由24個亞基組成的中空球狀分子,每2個亞基反向平行形成1組,再由這12組亞基對構成1個近似正八面體,成4-3-2倍軸對稱。1個鐵蛋白分子中可貯存4 500個無機三價鐵化合物。脊椎動物鐵蛋白分子中存在重鏈和輕鏈2種類型亞基,每個亞基都由1個4α螺旋簇和1個短螺旋簇構成,其中重鏈型亞基包括1個亞鐵氧化紅心,能夠快速氧化亞鐵離子[3-5]。
植物鐵蛋白被認為是21世紀新型的補鐵功能因子[6]。在已經發現的植物中,只有豆科類植物是將其近90%的鐵儲藏于種子的鐵蛋白中[7]。鐵是生物體生存所必需的礦物質元素[8]。據世界衛生組織2005年統計數據表明,全球大約有35億人缺鐵。天然的鐵蛋白具有貯藏大量的鐵和調節細胞內鐵的動態平衡的雙重作用。它可以形成血紅素、鐵硫原子簇,這使得其在呼吸作用、氮的固定等生理代謝過程中起著舉足輕重的作用[9-11]。
花蕓豆(PhaseolusvulgarisLinn.sp)屬豆科菜豆屬一年生草本植物,其生物學名叫菜豆,其中鐵含量尤其豐富[12]。花蕓豆蛋白是一種優質蛋白質,其氨基酸譜與FAO建議的理想蛋白質必需氨基酸模式譜比較,除甲硫氨酸外,其余均高出22%~63%,其中賴氨酸高出 31%~47%[13]。
因此,本試驗以花蕓豆為研究對象,在單因素試驗的基礎上,利用響應面分析法優化鐵蛋白的提取工藝,且采用層析法對其進一步純化,以期為植物鐵蛋白的開發利用提供參考。
1 材料與方法
1.1 材料、試劑與儀器
花蕓豆:石河子市農貿市場;丙烯酰胺(Acr)、甲叉雙丙烯酰胺(Bis)、考馬斯亮藍R-250、十二烷基硫酸鈉(SDS)和四甲基乙二胺(TEMED):美國Sigma公司。
DEAE-Sepharose和Sephacryl S-500:美國GEHealthcare Bio-Sciences AB公司;PVDF膜:美國millipore公司;Mini-proteinⅢ:美國Bio-Rad公司。
1.2 方法
1.2.1 花蕓豆粗蛋白的制備
稱取1 kg花蕓豆浸泡于4℃雙蒸水中處理24 h。去皮后傾倒于 2倍體積的 PBS(0.05 mol/L KH2PO4-Na2HPO4,pH 7.0,1%PVP)中,30 min后勻漿2 min,過濾。清液于55℃下水浴10 min,冷卻至室溫,于3 500 r/min離心15 min,上清液即為粗提液[14]。
1.2.2 粗提液的鹽析
在粗提液中加入MgCl2晶體使其終物質的量濃度為500 mmol/L,靜置20 min后加入檸檬酸三鈉晶體使其終物質的量濃度為700 mmol/L,然后于4℃下靜置過夜。在12 000 r/min,4℃下離心30 min,此時的花蕓豆鐵蛋白不再溶于上清液。加入2倍體積上清液,離心10 min,棄上清,重復3~4次直至只有褐色沉淀。將沉淀溶于2倍體積蒸餾水中,離心30 min,棄上清。重復2次用5倍體積蒸餾水溶解沉淀,離心30 min,合并上清液。花蕓豆鐵蛋白鹽析后的溶液用pH 7.5的PBS緩沖液進行透析,透析液經抽濾后進行弱陰離子交換柱層析。
1.2.3 柱層析
1.2.3.1 陰離子交換柱層析
用 PBS(pH 7.5)平衡 DEAE-Sepharose Fast Flow后,將樣液上柱(1.6 cm×25 cm),用4倍體積PBS洗脫,再用含0~0.8 mol/L NaCl的600 mL PBS進行梯度洗脫,流速為1.0 mL/min,每管5 mL,分管收集。將具有鐵蛋白活性的收集液超濾濃縮到5 mL,以待進一步純化。
1.2.3.2 凝膠過濾柱層析
用含有0.15 mol/L NaCl的 PBS平衡 Sephacryl S-500,待上柱(1.6 cm×50 cm)后,再用含有0.15 mol/L NaCl的 PBS洗脫,流速為 0.5 mL/min,每管 5 mL,分管收集。
1.2.4 Ferrozine試劑法測定Fe濃度
用微量移液器取20μL待測溶液,加入250μL 30%TCA,再加入超純水使總體積達到1 mL。再于10 000 r/min離心1 min。取700μL上清液于新離心管中,依次向其中加入100μL飽和乙酸銨,62.5 μL 0.12 mol/L抗壞血酸,62.5μL 0.25 mol/L Ferrozine,最后加入超純水使總體積達到1 mL。4 h后,在562 nm下比色,得到吸光值A562nm,即可用于表示鐵含量(μg/dL)[15]。
1.2.5 Native-PAGE檢測蛋白質分子純度
用樣品緩沖液以1∶2(V/V)的比例稀釋樣品,樣品緩沖溶液中含有25%甘油,12.5%pH 6.8,0.5 mol/L Tris-HCl,1%溴酚藍,充分混合后參照 Laemmli方法進行 Native-PAGE[16]。電泳結束后用考馬斯亮藍G-250染色法進行染色[17]。
1.2.6 SDS-PAGE檢測蛋白質亞基純度
聚丙烯酰胺凝膠電泳(SDS-PAGE)參照Chalkley等[18?\報道的方法進行試驗。樣品分子質量的確定根據標準蛋白Marker的相對遷移率計算獲得。
1.2.7 蛋白免疫印跡(Western-Blot)
1.2.7.1 SDS-PAGE電泳
將純化后的蛋白質參照1.2.6部分電泳。
1.2.7.2 電轉移
將1.2.7.1獲得的電泳膠裁剪成適當大小,從上往下黑面、纖維板、濾紙、電泳膠、PVDF膜、濾紙、纖維板、白面依次放好,置于電泳槽中,于4℃條件下(100 mV,3 h)轉膜。
1.2.7.3 曝光顯影
將1.2.7.2得到的電泳條帶切成合適大小,用麗春紅染色0.5~1 min,依次用水、電轉液、水和TBST沖洗干凈;用含 2.5/100(m/V)無抗乳粉的TBST室溫下封閉2 h;加入一抗后置于4℃冷藏柜中過夜,然后用TBST沖洗干凈后;加入二抗后置于4℃冷藏柜中過夜,仍然用TBST沖洗干凈,然后用純水洗去TBST;膜與底物放映5 min后直接放與暗匣黑暗操作;曝光3 min、顯影液中漂洗3 min、定影液中漂洗1~3 min。
2 結果與分析
2.1 花蕓豆鐵蛋白提取條件的優化
試驗通過對可能影響花蕓豆鐵蛋白提取的4個因素(浸提液pH值、氯化鎂物質的量濃度、檸檬酸三鈉物質的量和提取溫度)進行詳細的單因素試驗分析,結果表明,在浸提液的 pH值7.0,氯化鎂物質的量濃度500 mmol/L,檸檬酸三鈉物質的量濃度700 mmol/L及加熱溫度55℃的條件下花蕓豆鐵蛋白含量為(3.89±0.07)mg/g。
在單因素結果的基礎上,為了得到花蕓豆鐵蛋白提取的最優工藝參數,利用響應面分析法對鐵蛋白的提取做了進一步的優化。響應面分析因素水平編碼如表1所示,試驗結果如表2所示,方差分析結果如表3所示。

表1 鹽析法提取鐵蛋白響應面分析因素水平編碼表
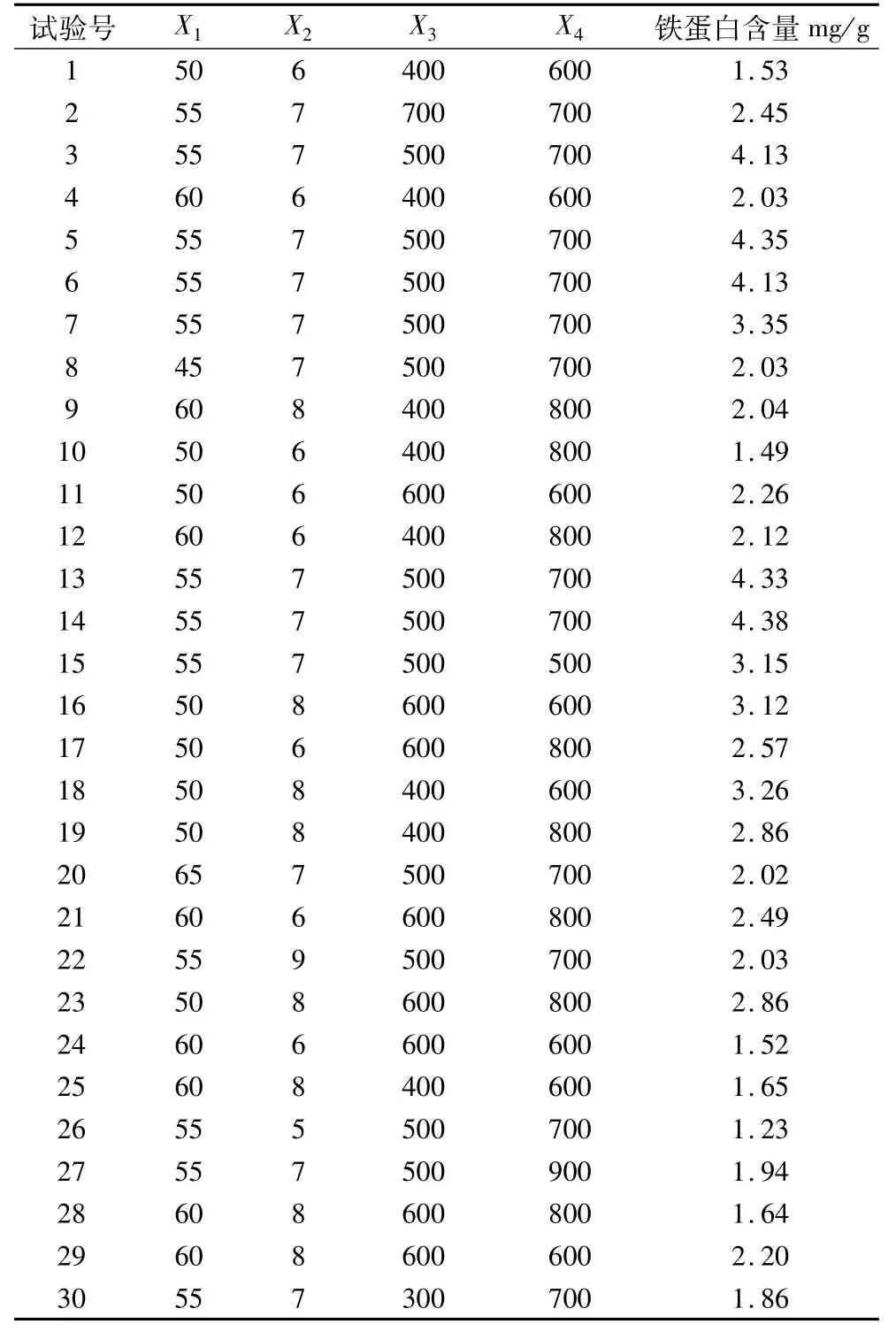
表2 中心組合設計試驗結果
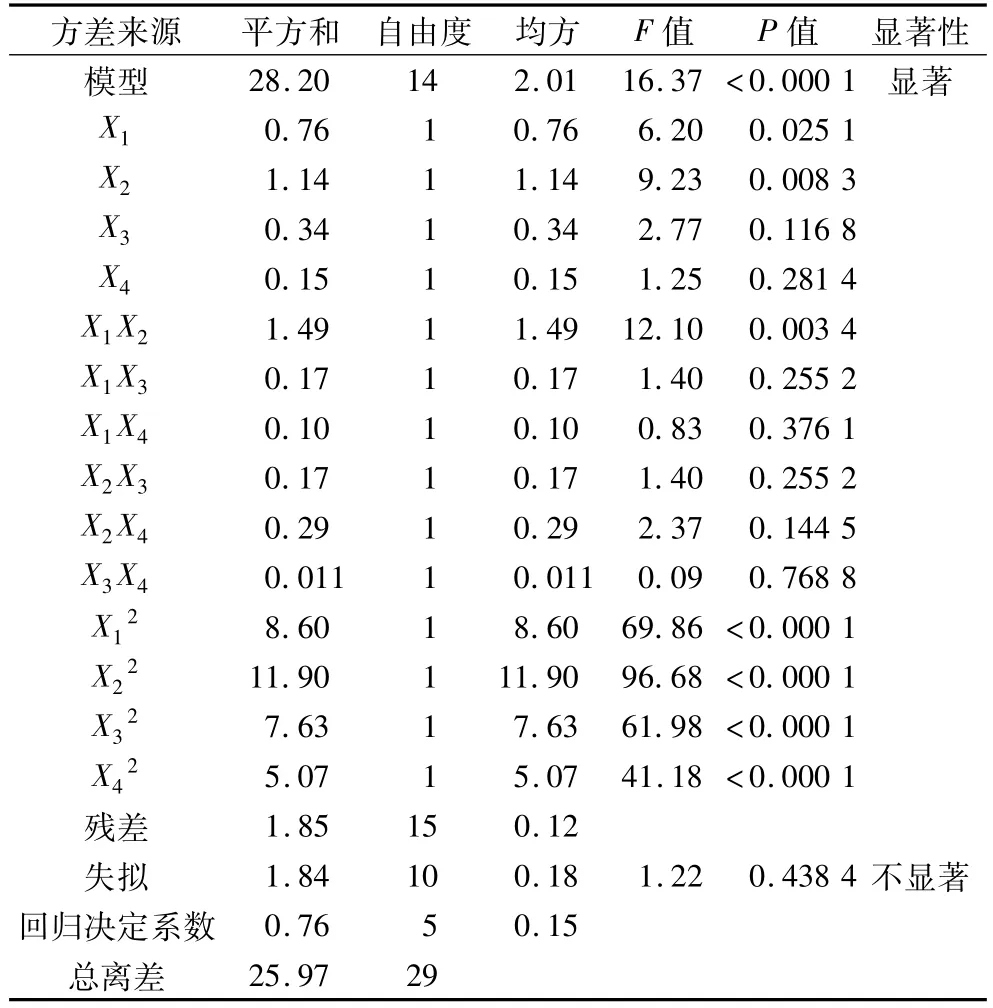
表3 方差分析結果
當P<0.05時,影響因素對響應值影響為差異顯著,當P<0.001時為差異高度顯著,P<0.000 1時為差異極顯著[19]。表 3中顯示模型的P<0.000 1,說明試驗模型具有高度的顯著性,失擬項的P=0.438 4>0.05,不顯著,表明響應面設計的模型與實際試驗擬合良好,模型的相關系數R2=93.86%,更加說明該模型的可信度較高。由表3可知,X1的P=0.008 3<0.05,表明 pH值起著顯著性的影響;X1的P=0.025 1<0.05,與X2相比不是很顯著,說明溫度的影響次于pH值。各個因素經過回歸擬合后,經解得到的鐵蛋白提取量的回歸方程為:
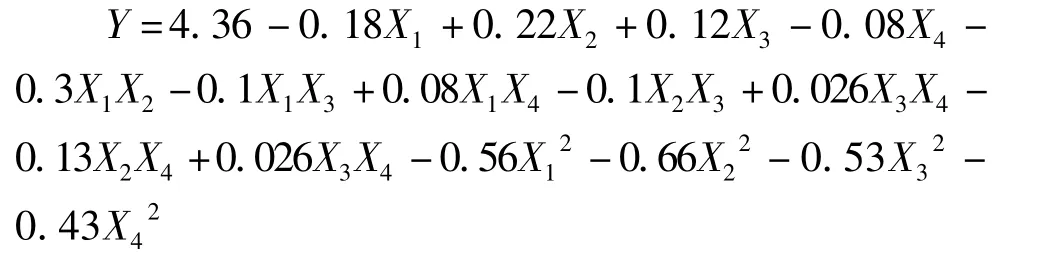
通過軟件求解方程,得出最優工藝條件為溫度53.79℃、pH為 7.23、氯化鎂物質的量濃度為511.15 mmol/L、檸檬酸三鈉物質的量濃度685.24 mmol/L,此時鐵蛋白達到4.40 mg/g。為檢驗模型的可靠性,課題組做了驗證試驗,結果顯示鐵蛋白提取率為(4.27±0.09)mg/g,與理論預測值基本吻合。
響應面分析方法的圖形是特定的響應面(Y)與對應的因素X1、X2、X3、X4構成的1個三維空間在二維平面上的等高圖,每個響應面對其中2個因素進行分析,另外2個因素固定在零水平。從中可以直觀地反映各因素對響應值的影響,從試驗所得的響應面分析圖上可以找到它們在提取過程中的相互作用,花蕓豆鐵蛋白提取回歸優化響應曲面如圖1所示。
由圖1可知,溫度、pH值、氯化鎂濃度和檸檬酸三鈉濃度4個因素之間相互作用對花蕓豆鐵蛋白含量均呈現出顯著的二次效應。結合方差分析表3中二次項的P值均小于0.01,表明各個因素之間的交互作用極顯著。從圖1a中可知溫度與pH值對鐵蛋白含量的影響曲面較陡,說明溫度與pH值的交互影響顯著,pH和檸檬酸三鈉的交互影響僅次于溫度與pH,如圖1e所示。由圖1b和圖1d及方差分析表3可知,溫度與氯化鎂及pH值與氯化鎂之間的交互作用程度是相同的。由圖1c和圖1f可知,溫度與檸檬酸三鈉濃度及氯化鎂和檸檬酸三鈉濃度之間的交互影響作用最小。綜上所述,影響花蕓豆鐵蛋白提取的各個因素之間既有相互促進的效果,又有相互制約的作用,說明在分離提取花蕓豆鐵蛋白時,要細致全面的考慮各因素之間的影響作用,要做到利用促進作用避免抑制作用,進而達到最佳的提取效果。
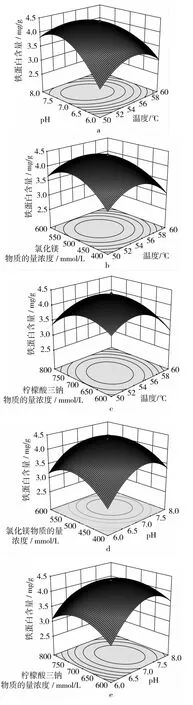
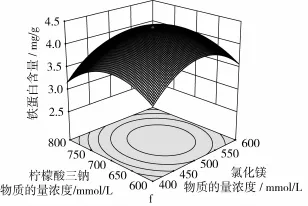
圖1 花蕓豆鐵蛋白提取響應曲面圖
2.2 花蕓豆鐵蛋白的純化
花蕓豆鐵蛋白樣品經DEAE-Sepharose Fast Flow陰離子交換柱和Sephacryl S-500分子篩柱洗脫圖譜分別如圖2~圖3所示。花蕓豆鐵蛋白純化過程中的電泳圖譜如圖4所示。
由圖2可知,花蕓豆鐵蛋白樣品經過DEAESepharose陰離子交換層析后得到1個較為明顯的吸收峰,經電泳檢測后顯示該峰下的蛋白質為雜質蛋白,如圖4a所示。將蛋白含量較高的收集管合并,超濾濃縮至5 mL,然后經過Sephacryl S-500分子篩柱進行層析純化。由圖3可知,凝膠層析后得到1個花蕓豆鐵蛋白吸收峰,經SDS-PAGE電泳檢測得知該峰下的蛋白質為電泳純的花蕓豆鐵蛋白,且只含有1個亞基,其相對分子質量約為27 000,如圖4b所示。凝膠層析純化后的鐵蛋白經過Native-PAGE檢測其相對分子質量為560 000,如圖5所示。
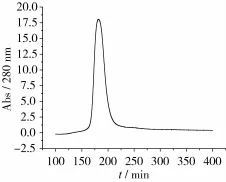
圖2 花蕓豆粗鐵蛋白經DEAE-Sepharose陰離子交換柱洗脫圖譜圖
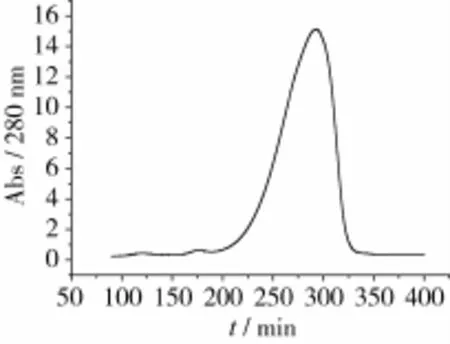
圖3 花蕓豆粗鐵蛋白經Sephacryl S-500凝膠層析柱的洗脫圖譜
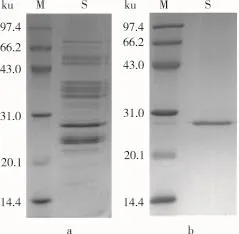
圖4 花蕓豆鐵蛋白純化過程中的SDS-PAGE電泳圖譜
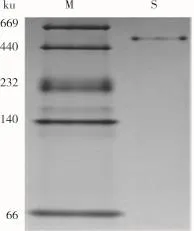
圖5 經過Sephacryl S-500凝膠層析柱后鐵蛋白樣品的Native-PAGE電泳圖譜
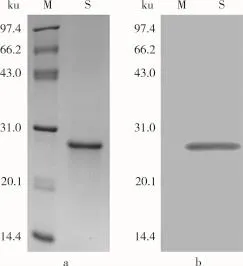
圖6 花蕓豆鐵蛋白Western-Blot分析結果
蛋白免疫采用的是抗體免疫反應,然后抗體再和二抗(其自身的抗體,具有顯色作用)結合,如果樣品中存在特定蛋白,經過曝光反應后,會發生顯影。反之,則不會發生變化。將從花蕓豆中純化的鐵蛋白經過SDS-PAGE分離后,其中一塊凝膠用考馬斯亮藍染色,如圖6a所示。另一塊凝膠中鐵蛋白轉移到聚偏二氟乙烯膜上與其抗體發生反應,然后再與二抗反應,最后曝光顯影。經過顯影后發現膠片上在相對分子質量為27 000處有條帶,如圖6b所示,說明純化的蛋白為鐵蛋白。
3 結論
3.1 花蕓豆鐵蛋白提取分離的最佳工藝參數為:溫度53.79℃、pH為7.23、氯化鎂物質的量濃度為511.15 mmol/L、檸檬酸三鈉物質的量濃度685.24 mmol/L,此時花蕓豆粕中鐵蛋白的提取率達到4.40 mg/g。經驗證,結果顯示鐵蛋白提取率為(4.27±0.09)mg/g,與理論預測值基本吻合。
3.2 樣品經陰離子交換層析后出現1個吸收峰,該處的樣品經SDS-PAGE電泳后顯示蛋白峰為雜質蛋白峰。將該段時間收集的蛋白液超濾濃縮至5 mL,然后上分子篩柱分離純化,收集樣品得到目標蛋白。經柱層析分離、純化所得的花蕓豆鐵蛋白達到電泳級,且只有一種相對分子質量為27 000的亞基。從花蕓豆中分離純化的蛋白質為鐵蛋白。
[1]Harrison P M,Arosio P.The ferritins:molecular properties,iron storage function and cellular regulation[J].Biochimica et Biophysica Acta:Bioenergetics.1996(3):161-203
[2]Chasteen N D,Harrison P M.Mineralization in ferritin:an efficient means of iron storage[J].Journal of Structural Biology,1999,126(3):182-194
[3]Zhao G H,Bou-Abdallah F,Arosio P,et al.Multiple pathways for mineral core formation in mammalian apoferrtion.The role of hydrogen peroxide[J].Biochemistry,2003,42(10):3142-3150
[4]Liu X F,Theil E C.Ferritins:dynamic management of biological iron and oxygen chemistry[J].Accounts of Chemical Research,2005,38(3):167-175
[5]Corsi B,Cozzi A,Arosio P,et al.Human mitochondrial ferritin expressed in HeLa cells incorporates iron and affects cellular iron metabolism[J].Journal of Biological Chemistry,2002,277(25):22430-22437
[6]云少君,趙廣華.植物鐵代謝及植物鐵蛋白結構與功能研究進展[J].生命科學,2012,24:809-816
[7]Ambe S,Ambe F,Nozuki T.Mossbauer study of iron in soybean seeds[J].Journal of Agricultural and Food Chemistry,1987,35(3):292-296
[8]Zhao GH.Phytoferritin and its implications for human health and nutrition[J].Biochimica et Biophysica Acta:General Subjects,2010,1800(8):815-823
[9]Grady J K,Chen Y,Chasteen N D,et al.Hydroxyl radical production during oxidative deposition of iron in ferritin[J].Journal of Biological Chemistry,1989,264(34):20224-20229
[10]Theil E C.Iron,Ferritin and Nutrition[J].Annual Review of Nutrition,2004,24:327-343
[11]Davila-Hicks P,Theil E C,Lonnerdal B.Iron in ferritin or in salts(Ferrous Sulfate)is equally bioavailable in nonanemic women[J].The American Journal of Clinical Nutrition,2004,80(4):936-940
[12]何照范.糧油籽粒品質及其分析[M].北京:中國農業出版社,1985
[13]卿曉紅,熊綠蕓.蕓豆不同品種的營養成分分析[J].貴州農學院學報,1996,15(2):59-61
[14]Laulhere J P,Laboure A M,Briat J F.Mechanism of the transition from plant ferritin to phytosiderin[J].Journal of Biological Chemistry,1989,264(6):3629-3635
[15]Carter P.Spectrophotometric determination of serum iron at the submicrogram level with a new reagent(ferrozine)[J].Analytical Biochemistry,1971,40(2):450-458
[16]Chalkley R J,Burlingame A L.Identification of GlcNAcylation sites of peptides and alpha-crystallin using Q-TOF mass spectrometry[J].Journal of the American Society for Mass Spectrometry,2001,12(10):1106-1113
[17]朱厚礎.蛋白質純化與鑒定指南[M].北京:科學出版社,1999,249-259
[18]Laemmli U K.Cleavage of structure proteins during the assembly of the head of bacteriophage T4[J].Nature,1970,277(5259):680-685
[19]丁仲鵑,畢玉芬,戴云,等.中心組合試驗設計響應面分析法優化蜂膠總多酚提取工藝[J].食品科學,2013,34(2):17-21.
Isolation and Purification of Ferritin from the Phaseolus vulgaris
Tian Tongtong Jiang Ying Zhang Jian Wang Youmei Wei Yonghui Zhang Yueru Yang Jinyue
(Food College of Shihezi University,Shihezi 832000)
In order to obtain the purified phytoferritin from thePhaseolusvulgaris,ferritin was isolated and purified through salting out method and column chromatography.As a result,the ferritin yield was up to(4.27±0.09)mg/g under the condition that extraction temperature 53.79℃,sample solutions pH 7.23,concentration of MgCl2511.15 mmol/L,concentration of sodium citrate 685.24 mmol/L.Ferritin of electrophoresis level,the molecular weight of 560 000,was obtained by further chromatographic purification which contains only one subunit of 27 000.Simultaneously,protein extracted from the phaseolus vulgaris was identified with the help of the Western Blot.The result revealed that the protein was ferritin.
phaseolusvulgaris,ferritin,isolation,purification
Q51
A
1003-0174(2015)09-0030-06
時間:2015-06-01 17:38
網絡出版地址:http://www.cnki.net/kcms/detail/11.2864.TS.20150601.1738.001.html
新疆生產建設兵團科技支疆專項計劃(2010ZJ13),石河子大學創新團隊(2011ZRKXTD-0803),石河子大學青年骨干教師培訓(3152SPXY01027)
2014-09-15
田童童,男,1990年出生,碩士,食品生物化學
張建,男,1979年出生,副教授,食品生物化學

