碳納米點為還原劑的納米金制備及其催化性能研究
楊瑞橋,張友玉
(1.湖南幼兒師范高等專科學校,中國常德 415000;2.湖南師范大學化學化工學院,中國長沙 410081)
金納米(AuNPs)由于其獨特的物理和化學性質受到研究者們的廣泛關注,在傳感器[1]、電子[2]、光學[3]、檢測[4]和催化領域[5]展現出良好的應用前景.比如,研究者們利用誘導AuNPs 聚集引起的顏色變化,構建了一系列的比色傳感器用于Hg2+[6]、葡萄糖[7]和DNA[8]等的檢測;基于AuNPs 可以降低電化學反應的超電勢和維持氧化還原的可逆性,構建了基于AuNPs 的電催化和電化學傳感器[9-10];同時AuNPs 還廣泛地應用于催化領域,如作為醇氧化的催化劑[11].
目前,AuNPs 制備通常是利用還原劑還原氯金酸,需加入一定量的鈍化劑或保護劑,以避免AuNPs 的聚集[12-14].合成過程中必須使用還原劑,如硼氫化鈉、檸檬酸鈉等.硼氫化鈉作為一種高活性的化學物質具有潛在的環境危害;而以檸檬酸鈉為還原劑則整個反應過程需要在沸水中進行,消耗能量.因此,發展一種環境友好與條件溫和的AuNPs 制備方法具有非常重要的意義.
本文發展了一種以熒光碳納米點(C-dots)為還原劑和穩定劑合成AuNPs 的方法,合成的納米金具有優異的催化性能,可將水中的對硝基酚催化還原成對氨基酚,并研究了其催化反應動力學,該結果對處理廢水中的酚類化合物具有參考價值.
1 實驗部分
1.1 儀器與試劑
試劑:氯金酸、乙二醇、氫氧化鈉、鹽酸、對硝基酚和硼氫化鈉購自國藥集團化學試劑有限公司.所有試劑均為分析純.水為實驗室自制雙重蒸餾水.
儀器:PL303 電子天平(梅特勒-托利多上海有限公司),ZNCL-G 磁力攪拌器(鞏義市予華儀器有限公司),JEOL-1230 型透射電鏡(JEOL,日本),UV-2450 型分光光度計(Shimazu,日本),F-4500 熒光光譜儀器(Hitachi,日本).
1.2 AuNPs 的合成
以乙二醇為原料通過電化學方法制備了C-dots,并將所得到的C-dots 作為還原劑和穩定劑合成了AuNPs.具體方法如下:以98 mL 乙二醇溶液和2 mL 0.5 g·mL-1的NaOH 溶液的混合液為電解液,鉑片為陰極和陽極,以20 V 的直流電電解1 h,得到C-dots 粗溶液.將粗溶液酸化后,經MW 1000 的透析膜透析2天得到C-dots 溶液.在室溫下,往0.1 mg·mL-1的C-dots 溶液中,加入0.2 mmol·L-1HAuCl4溶液,搖勻,靜置25 min,即制備得到AuNPs 溶液.
1.3 AuNPs 催化對硝基酚的還原
反應在150 mL 燒杯中進行.向燒杯中加入90 mL 濃度為7.6×10-5mol·L-1對硝基酚溶液和10 mL 濃度為7.2×10-1mol·L-1硼氫化鈉溶液,充分混勻,隨后加入0.052 mL 濃度為4.2×10-8mol·L-1的金納米粒子溶液.此時對硝基酚和硼氫化鈉的最終濃度分別為6.8×10-5mol·L-1和7×10-2mol·L-1.每兩分鐘記錄一次反應體系的紫外-可見吸收光譜,并記錄其400 nm 處的吸光度.
2 結果與討論
2.1 合成的C-dots 與AuNPs 的表征
通過透射電鏡,紫外-可見光譜和熒光光譜對合成的C-dots 和納米金進行了表征.圖1 為C-dots 的電鏡圖(TEM)和高分辨電鏡圖(HRTEM).可以看出C-dots 近球形,分布均勻,尺寸分布范圍為2~6 nm.HRTEM 顯示其具有晶格結構,其相應的晶格間距為0.20 nm,與石墨化的碳(111)面的晶格常數相同(JCPDS 26-1076).
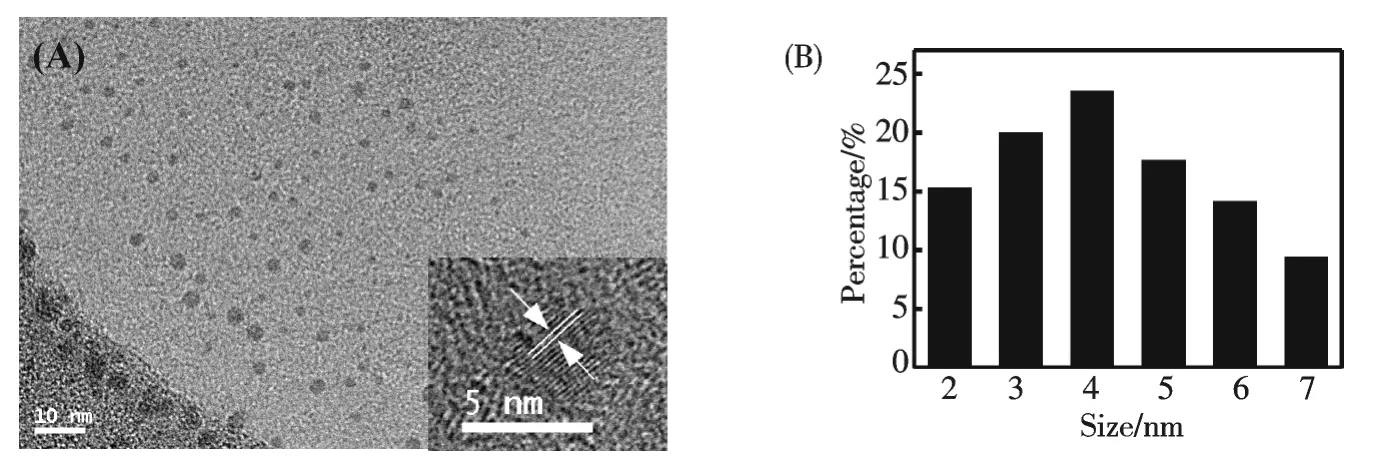
圖1 熒光碳納米點TEM 圖(A)和尺寸分布圖(B).插圖為單個熒光碳納米點的HRTEM 圖Fig.1 (A)Typical TEM image of as-synthesized C-dots,inset:HRTEM image of single C-dots;(B)Size distribution of C-dots
C-dots 的紫外-可見光譜圖如圖2(A)所示,由圖可見在262 nm 處有一個強的吸收峰,歸屬于π→π*躍遷.圖2(B)為C-dots 的熒光光譜圖,其最大激發波長為356 nm,相應的最大發射波長為453 nm,并且顯示出激發依賴的熒光性質.
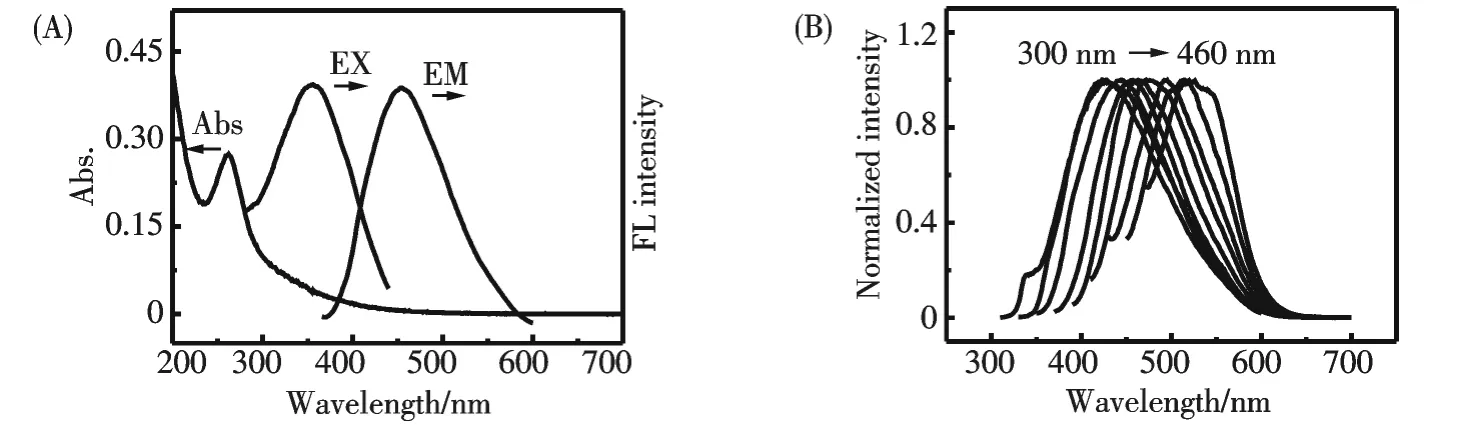
圖2 (A)所制得的熒光碳納米點的紫外-可見和熒光激發、發射光譜圖;(B)在不同激發光激發下的歸一化的熒光發射光譜圖Fig.2 (A)UV-vis spectra and FL spectra of as-synthesized C-dots.(B)Normalized FL emission spectra of C-dots at different excitation wavelengths
合成得到的AuNPs 表征結果如圖3所示.從圖3 中可以看出AuNPs 成球形,尺寸在14~18 nm 之間;HRTEM 結果揭示AuNPs 晶格間距為0.24 nm,與金(111)面晶格間距相符(JCPDS 04-0784);其紫外-可見光譜如圖4所示,在526 nm 處有一個明顯的吸收峰,對應于AuNPs 的特征表面等離子共振峰.由于乙二醇的羥基具有還原性,作者推測在以乙二醇為原料合成的C-dots 表面的仍保留有部分高活性的羥基,這部分羥基作為還原基團,將氯金酸還原成AuNPs.
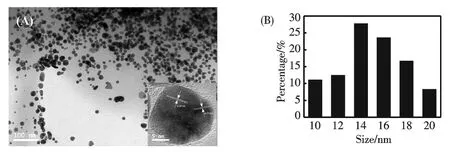
圖3 (A)AuNPs 的TEM 圖和(B)相應的尺寸分布圖.插圖為單個AuNPs 的HRTEM 圖Fig.3 (A)Typical TEM image of as-synthesized AuNPs,inset:HRTEM image of single AuNPs.(B)Size distribution of AuNPs
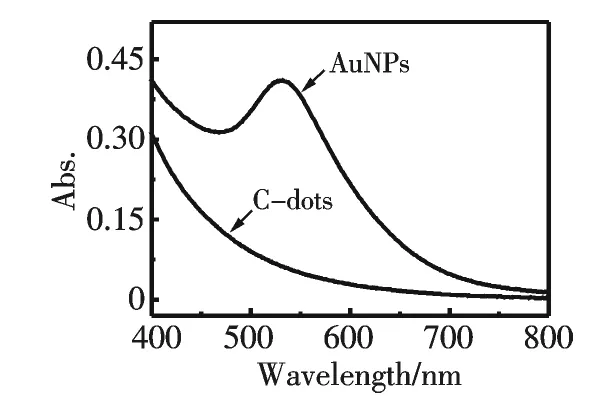
圖4 所制得的AuNPs 的紫外-可見光譜圖Fig.4 UV-vis spectra of as-synthesized AuNPs
2.2 AuNPs 的催化性能
AuNPs 的比表面積大,具有很強的活性,可用作優良的催化劑.作者研究了AuNPs 催化硼氫化鈉還原對硝基酚的反應.通過考察其紫外-可見光譜隨時間的變化計算求得AuNPs 對催化硼氫化鈉還原對硝基酚的反應速率常數,并在同樣的條件下,以傳統的檸檬酸鈉為還原劑制備的AuNPs 做對照,考察兩種方法制備的AuNPs 的催化活性.圖5A 為對硝基酚水溶液的紫外-可見光譜圖,對硝基酚的原始吸收峰位于317 nm 處,當加入硼氫化鈉后,生成對硝基酚鹽,其吸收峰紅移到400 nm 處,相應的顏色也由亮黃色變為黃綠色.盡管硼氫化鈉還原對硝基酚在熱力學上是可行的[15],但是在沒有催化劑的存在下這個反應卻很難進行.如圖5B所示,當反應體系中沒有加入AuNPs 時,吸收峰位移沒有明顯變化,說明在該實驗條件下無AuNPs 催化時對硝基酚不能被硼氫化鈉還原.當加入AuNPs 溶液后,反應體系即出現褪色,表明對硝基酚已經開始被硼氫化鈉還原,通過記錄反應體系的紫外-可見光譜隨時間的變化情況可以發現(圖6A),反應體系在400 nm 處的吸光度隨反應時間的延長逐漸降低,而在300 nm 處出現了一個新的吸收峰,為對硝基苯胺的特征吸收峰,表明AuNPs 成功地催化了硼氫化鈉還原對硝基酚.以檸檬酸鈉還原制備的AuNPs 替代熒光碳納米點還原制備的AuNPs,也達到了同樣的效果(圖6B),在實驗中,對硝基酚和硼氫化鈉的最終濃度分別為6.8×10-5mol·L-1和7×10-2mol·L-1,后者在反應中大大過量,因此可以近似認為硼氫化鈉在反應體系中的濃度不變,反應速率只與對硝基酚的濃度有關,反應為準一級反應.根據朗伯-比爾定律,反應體系在400 nm 處的吸光度值與溶液中對硝基酚的濃度成正比,因此對硝基酚在反應時間t 時400 nm 處的吸光度值At與未加入金納米粒子催化劑前400 nm 處的空白值A0的比值即為對硝基酚的濃度的比值Ct/C0.圖7A 為Ct/C0比值隨時間的變化曲線,從圖中可以看出,隨著時間的延長,Ct/C0的比值不斷減小.以ln(Ct/C0)與t 作圖(圖7B),得到的斜率即為AuNPs 催化硼氫化鈉還原對硝基酚反應的反應速率常數.經計算得到以C-dots 為還原劑和檸檬酸鈉為還原劑制得的AuNPs 催化硼氫化鈉還原對硝基酚反應的反應速率常數分別為0.13 min-1,0.15 min-1.結果表明,以C-dots 為還原劑所制備的AuNPs 與傳統方法檸檬酸鈉還原法制備的AuNPs 相比,其催化性能相近.
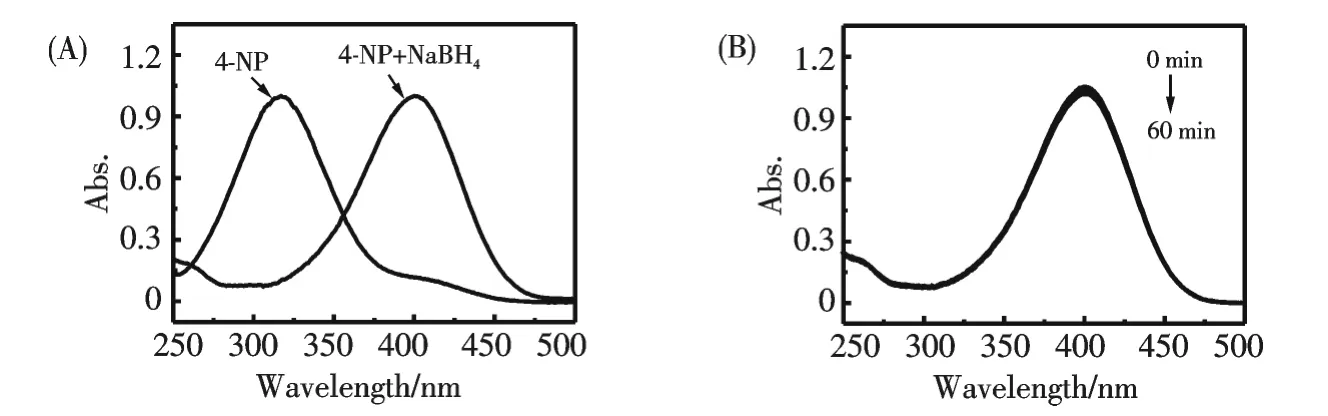
圖5 (A)對硝基酚與硼氫化鈉混合前后的紫外-可見光譜,(B)無催化劑AuNPs 存在下對硝基酚與硼氫化鈉混合溶液的紫外光譜Fig.5 (A)UV-vis spectra of 4-NP in the absence and presence of NaBH4.(B)Normalized absorption spectra of 4-NP and NaBH4 mixture in the absence AuNPs as catalyst
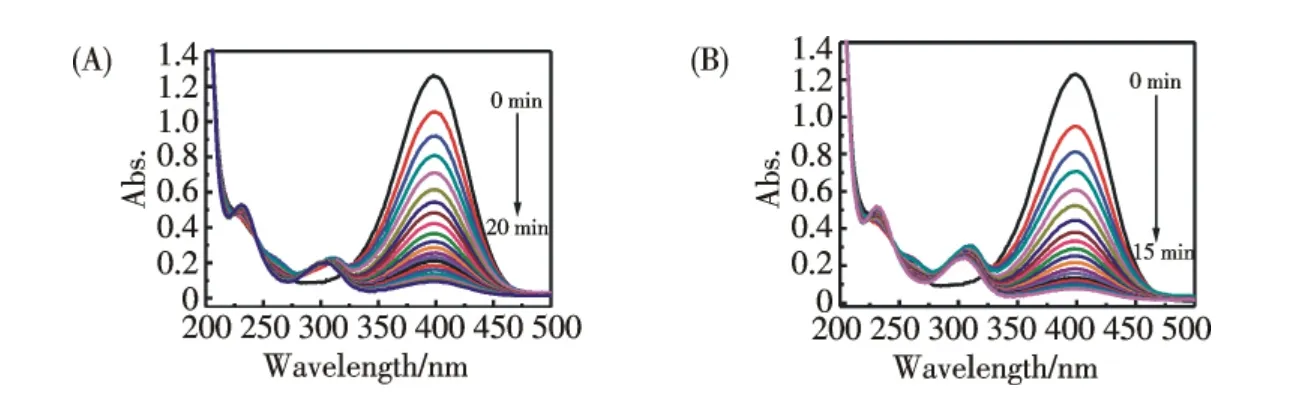
圖6 不同時間下AuNPs 催化硼氫化鈉還原對硝基酚的紫外-可見光譜圖.(A)用C-dots 還原的AuNPs,(B)用檸檬酸鈉還原的AuNPsFig.6 UV-vis spectra for the reduction reaction of 4-NP.AuNPs synthesized by(A)C-dots and(B)sodium citrate.
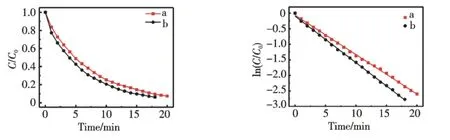
圖7 對硝基酚的還原反應動力學曲線.A:C/C0~t,B:ln(C/C0)~t.(曲線a 代表熒光碳納米點合成的AuNPs 為催化劑,曲線b 代表檸檬酸鈉合成的AuNPs 為催化劑)Fig.7 (A)Concentration of 4-NP versus reaction time for the reduction of 4-NP catalyzed by AuNPs synthesized by C-dots(a)and synthesized by sodium citrate(b),respectively.(B)The corresponding kinetic curves for the reduction of 4-NP catalyzed by AuNPs synthesized by C-dots(a)and synthesized by sodium citrate(b)
3 結論
以乙二醇為起始原料,經電化學方法成功地制得了熒光碳納米點,產物熒光碳納米點具有很強的還原性,能在無任何其他化學試劑和能量供給的情況下還原氯金酸制備AuNPs,制備的AuNPs 具有強的催化活性,能在溫和條件下催化硼氫化鈉還原對硝基酚的反應.
[1]SU J,ZHOU W,XIANG Y,et al.Target-induced charge reduction of aptamers for visual detection of lysozyme based on positively charged gold nanoparticles[J].Chem Commun,2013,49(69):7659-7661.
[2]LEE C H,QIN S,SAVAIKAR M A,et al.Room-temperature tunneling behavior of boron nitride nanotubes functionalized with gold quantum dots[J].Adv Mater,2013,25(33):4544-4548.
[3]SHIMADA T,IMURA K,OKAMOTO H,et al.Spatial distribution of enhanced optical fields in one-dimensional linear arrays of gold nanoparticles studied by scanning near-field optical microscopy[J].Phys Chem Chem Phys,2013,15(12):4265-4269.
[4]WANG J,WANG L,LIU X,et al.A gold nanoparticle-based aptamer target binding readout for ATP assay[J].Adv Mater,2007,19(22):3943-3946.
[5]LU Y M,ZHU H Z,LI W G,et al.Size-controllable palladium nanoparticles immobilized on carbon nanospheres for nitroaromatic hydrogenation[J].J Mater Chem A,2013,1(11):3783-3788.
[6]LIU D,QU W,CHEN W,et al.Highly sensitive,colorimetric detection of mercury(II)in aqueous media by quaternary ammonium group-capped gold nanoparticles at room temperature[J].Anal Chem,2010,82(23):9606-9610.
[7]JIANG Y,ZHAO H,LIN Y,et al.Colorimetric detection of glucose in rat brain using gold nanoparticles[J].Angew Chem,2010,122(28):4910-4914.
[8]LIU P,YANG X,SUN S,et al.Enzyme-free colorimetric detection of DNA by using gold nanoparticles and hybridization chain reaction amplification[J].Anal Chem,2013,85(16):7689-7695.
[9]SHAN C,YANG H,HAN D,et al.Graphene/AuNPs/chitosan nanocomposites film for glucose biosensing[J].Biosens Bioelectron,2010,25(5):1070-1074.
[10]LIU M,CHEN Q,LAI C,et al.A double signal amplification platform for ultrasensitive and simultaneous detection of ascorbic acid,dopamine,uric acid and acetaminophen based on a nanocomposite of ferrocene thiolate stabilized Fe3O4@Au nanoparticles with graphene sheet[J].Biosens Bioelectron,2013,48(1):75-81.
[11]ZHANG P I,QIAO Z A,JIANG X,et al.Nanoporous ionic organic networks:stabilizing and supporting gold nanoparticles for catalysis[J].Nano Lett,2015,15(2):823-828.
[12]ZHANG J,WANG L,PAN D,et al.Visual cocaine detection with gold nanoparticles and rationally engineered aptamer structures[J].Small,2008,4(8):1196-1200.
[13]YANG D,MA J,ZHANG Q,et al.Polyelectrolyte-coated gold magnetic nanoparticles for immunoassay development:toward point of care diagnostics for syphilis screening[J].Anal Chem,2013,85(14):6688-6695.
[14]TSUNOYAMA H,SAKURAI H,NEGISHI Y,et al.Size-specific catalytic activity of polymer-stabilized gold nanoclusters for aerobic alcohol oxidation in water[J].J Am Chem Soc,2005,127(26):9374-9375.
[15]JIN R,XING Y,YU X,et al.Facile synthesis of well-dispersed silver nanoparticles on hierarchical flower-like Ni3Si2O5(OH)4with a high catalytic activity towards 4-nitrophenol reduction[J].Chem Asian J,2012,7(12):2955-2961

