miR-335在急性缺血性腦卒中表達下調及對鈣調蛋白的調控作用
,,海軍,
(1.南華大學附屬第二醫院神經內科,湖南 衡陽 421001;2.南華大學附屬第二醫院急診科)
·臨床醫學·
miR-335在急性缺血性腦卒中表達下調及對鈣調蛋白的調控作用
袁梅1,湯永紅1,袁海軍2*,周成芳1
(1.南華大學附屬第二醫院神經內科,湖南 衡陽 421001;2.南華大學附屬第二醫院急診科)
目的檢測微小RNA-335在急性缺血性腦卒中(AIS)患者血清中的表達,并探討其對鈣調蛋白(CaM)調控的作用機制。方法采用實時熒光定量聚合酶鏈反應(qRT-PCR)法測定106例AIS患者及98例健康對照組血清中miR-335表達情況;用生物信息學數據庫查詢分析miR-335對鈣調蛋白編碼基因CALM1的靶向結合關系;脂質體轉染法將miR-335模擬物、抑制物以及相應陰性對照物分別轉染至人臍靜脈內皮細胞(HUVECs)中并進行細胞培養,采用逆轉錄PCR(RT-PCR)和Western blot分別檢測干預后HUVECs中鈣調蛋白mRNA和蛋白的表達水平。結果與健康對照組相比較,AIS組患者血清miR-335表達明顯下調(P<0.01);生物信息學軟件的查詢分析顯示CALM1存在miR-335潛在靶向結合位點;RT-PCR和Western blot檢測結果顯示miR-335模擬物組CaM mRNA和蛋白的表達水平較對照組顯著下降(P<0.01),而miR-335抑制物組CaM mRNA和蛋白的表達水平較對照組顯著增高(均P<0.05)。結論急性缺血性腦卒中患者血清miR-335表達明顯下降,表達下調的miR-335可能通過上調鈣調蛋白的表達從而發揮重要作用。
微小RNA-335; 鈣調蛋白; 急性缺血性腦卒中
鈣超載是腦缺血/缺血再灌注損傷的重要啟動因素,是導致急性缺血性腦卒中(acute ischemic stroke,AIS)患者腦組織損害和神經功能障礙的病理生理過程,最終可導致神經元凋亡。而鈣離子生理功能的發揮主要是由鈣調蛋白(calmodulin,CaM)來調節。以往研究發現腦缺血/缺血再灌注后,鈣調蛋白表達量明顯升高[1-2]。近年來,研究表明微小RNA(microRNA,miRNA)調控是基因在轉錄后表達的非常重要的調控機制,參與了細胞的增殖、分化和凋亡等生命過程的調控,并與腦卒中密切相關[3]。這提示是否存在特定的miRNA調控CaM表達參與腦卒中后的病理生理過程。研究顯示miR-335在腦缺血再灌注動物模型腦組織中表達有下調[4]。同時通過生物信息學數據庫預測發現鈣調蛋白編碼基因(CALM1)3′UTR區存在miR-335潛在的靶向結合序列,但目前缺少文獻報道。因此,本研究旨在檢測miR-335在急性缺血性腦卒中患者血清中的表達水平并探討miR-335是否靶向調控鈣調蛋白的表達。
1 資料與方法
1.1一般資料連續收集2013年6月~12月本院神經內科和急診科就診的發病14天內(≤14天)的急性缺血性腦卒中患者共106例,其中男60例,女46例,年齡67.6±6.2歲;對照組來自同期本院體檢中心健康普查的健康隨機個體,共98例,男56例,女42例,年齡65.9±6.8歲,兩組在性別、年齡上無統計學差異。缺血性腦卒中診斷和排除標準參考前期研究報道[3]。本研究經本院醫學倫理委員會批準,所有研究對象或家屬均知情同意并簽署知情同意書。
1.2材料與試劑人臍靜脈內皮細胞(HUVECs)購自于中南大學湘雅醫院中心試驗室,Trizol RNA抽提試劑(美國Invitrogen公司),逆轉錄試劑盒Rever Tra Ace?(日本TOYOBO公司),染料法實時熒光定量試劑盒SYBR?Premix Ex TaqTM(大連TAKARA公司),M-MLV逆轉錄試劑盒(美國Invitrogen公司),Lipofectamin 2000(美國Invitrogen公司),多克隆兔抗人鈣調蛋白抗體和山羊抗兔IgG-HRP抗體(美國ABclonal公司),miR-335模擬物、抑制物購自上海吉瑪生物工程公司,逆轉錄頸環引物以及PCR擴增引物由上海生工生物有限公司合成。
1.3實時熒光定量聚合酶鏈反應所有受測者均抽取靜脈血5 mL,常溫下3 000 r/min離心10 min,收集上層血清1 mL,于-20 ℃保存備用。采用Trizol法提取血清中總RNA,并用分光光度計檢測所提取RNA的質量。采用qRT-PCR法檢測各標本miR-335濃度。逆轉錄和PCR擴增均嚴格按照相應說明書進行操作。以cel-miR-39為內。miR-335頸環引物5′-GTC GTA TCC AGT GCA GGG TCC GAG GTA TCG CAC TGG ATA CGA CAC ATT T-3′,上游引物5′-CTC CAG CTG TCA AGA GCA ATA AC G AA-3′,下游引物5′- TCC AGT GCA GGG TCC GAG GT-3。cel-miR-39頸環引物5′-GTC GTA TCC AGT GCA GGG TCC GAG GTA TTC GCA CTG GAT ACG ACA AAG C -3′,上游引物5′-CAC TCC GTC ACC GGG TGT AAA TC-3′,下游引物5′- TCC AGT GCA GGG TCC GAG GT-3。PCR反應條件:95℃ 預變性2 min;95℃ 變性5 s,60℃退火30 s,72℃延伸40 s,40個循環。采用2-△△CT法計算各組miR-335的相對表達量。
1.4生物學軟件靶基因預測通過TargetScan和Miranda兩種生物信息學數據庫查詢來預測miR-335與鈣調蛋白編碼基因CALM1的靶向結合位點。
1.5細胞培養與轉染HUVECs細胞接種于6孔板中,加入含10%FBS的細胞培養液培養,在37 ℃ 5% CO2細胞培養箱中培養,約80%~90%融合時,采用脂質體Lipofectamine 2000方法瞬時轉染。轉染分5組:①模擬物干預組(miR-335-mimic組):加入has-miR-335 mimics;②模擬物陰性對照組(NC組):加入陰性對照;③抑制物干預組(miR-335-inhibitor組):加入has-miR-335-inhibitors;④抑制物陰性對照組(NC inhibitor組):加入NC inhibitor;⑤ 空白對照組(blank組):不加干預物。嚴格按照脂質體法進行轉染,6 h內用OMEM培養基進行培養,之后改用完全培養基培養48 h收取細胞沉淀,實驗重復3次。
1.6 RT-PCR檢測用Trlzol法分離各組轉染培養后的HUEVC中總RNA,并用分光光度計檢測所提取RNA的質量。采用RT-PCR法檢各組干預后鈣調蛋白mRNA的表達水平。逆轉錄反應及PCR均嚴格按照試劑盒說明書操作。用β-actin作為內參。PCR反應條件:94 ℃預變性5 min,94 ℃變性30 s,56 ℃退火30 s,72 ℃延伸30 s,30個循環。每組樣本實驗重復3次。PCR擴增引物見表1。
1.7 Western blot檢測蛋白提取和測定采用RIPA裂解液/BCA蛋白定量試劑盒。
表1鈣調蛋白基因RT-PCR引物

引物序列(5'-3')擴增產物長度CaLM1-F5'-TGAAGTGGATGCTGATGGTAATGG-3'CaLM1-R5'-CATAGTTGACTTGTCCGTCTCCAT-3'257bpβ-actin-F5'-CACTCTTCCAGCCTTCCTTCCT-3'β-actin-R5'-ACTCGTCATACTCCTGCTTGCT-3'315bp
配制12%分離膠、5%濃縮膠,加入約15 μg蛋白樣品,多余空用2×SDS上樣緩沖液補齊,然后進行電泳,電泳至溴酚蘭剛跑出即可終止電泳,進行轉膜,冰上轉膜1.5 h,室溫封閉2 h,加入1∶5 000稀釋的鈣調蛋白抗體4℃輕搖過夜,再加1∶10 000稀釋的二抗室溫孵育2 h,用PBST將膜清洗3次后采用ECL化學發光法進行顯色曝光。β-actin作為內參。用Amersham圖像分析系統對Western blot目的條帶進行光密度掃描,然后用Quantity One軟件進行灰度值分析,待測蛋白的灰度值/內參灰度值代表目的蛋白的表達量。所有實驗均重復3次。
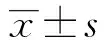
2 結 果
2.1兩組miR-335表達的比較血清miR-335在病例組(0.35±0.26)表達明顯低于對照組(1.21±0.32)(P<0.01)。
2.2生物學軟件靶基因預測結果通過TargetScan和Miranda生物信息學數據庫查詢分析發現鈣調蛋白編碼基因CALM1存在miR-335靶向結合位點,見圖1。

圖1 生物學軟件靶基因預測結果 通過生物信息數據庫查詢發現miR-335與CALM1存在靶向結合位點
2.3 miR-335對CALM1 mRNA表達的影響空白對照組、模擬物陰性對照組、抑制物陰性對照組3組CALM1 mRNA 表達差異無顯著性 (P>0.05);轉染miR-335模擬物后,HUVECs 表達mRNA的量明顯低于空白對照和模擬物陰性對照組(P<0.01);而轉染miR-335抑制物后,HUVECs 表達CALM1 mRNA的量明顯高于空白對照和抑制物陰性對照組(P<0.05),見圖2。這表明miR-335影響CALM1 mRNA穩定性。
2.4 miR-335對CaM蛋白表達的影響轉染miR-335模擬物后,HUVECs 表達CaM蛋白的量明顯低于空白對照組和陰性對照組(P<0.01);而轉染miR-335抑制物后,HUVECs 表達CaM蛋白的量明顯高于空白對照組和抑制物陰性對照組(P<0.01),見圖3。這表明miR-335能顯著抑制CALM1mRNA翻譯影響蛋白的表達水平。
3 討 論
本研究通過病例-對照研究發現急性缺血性腦卒中患者血清miR-335表達水平明顯下降,結合前期研究及生物學信息軟件分析,發現miR-335與鈣調蛋白的潛在調控關系,并進一步通過體外細胞實驗驗證了這種調控關系。

圖2 不同干預組CALM1 mRNA的相對表達量 A:CALM1 mRNA PCR跑膠條帶,M:Marker;1:空白對照組;2:miR-335模擬物組;3:miR-335抑制物組;4:模擬物陰性對照組;5:抑制物陰性對照組.B:為相應內參β-actin PCR跑膠條帶.C:相應結果統計圖.與空白對照組和模擬物陰性對照組相比較,*:P<0.01;與空白對照組和抑制物陰性對照組相比較,#:P<0.05
微小RNA(microRNA,miRNA)是一類內源性的19~25個核苷酸大小的非編碼RNA分子,包含特定堿基序列,稱為“種子序列”,能通過堿基互補匹配原則識別結合靶基因mRNA的3′UTR特異性序列,抑制靶mRNA的翻譯或導致其降解,在轉錄后水平沉默靶基因,對基因表達起著重要的調控作用。miRNA參與了細胞的代謝、增殖、分化和凋亡及個體發育等生命過程的調控。研究發現miRNA參與了神經系統的生長、發育、生理功能和疾病過程,也參與了動脈斑塊不穩定性、內皮功能障礙、腦水腫、炎癥、細胞凋亡等腦卒中中間環節的調控,與腦卒中有密切相關性[5-7]。識別和鑒定與腦卒中相關的miRNA,并明確其作用及調控機理,并把他們整合到基因調控網絡中是當前表觀遺傳醫學研究的熱點,也是腦卒中防治的熱點。腦卒中患者治療預后不佳,是臨床工作長期的難題。研究miRNA從RNA干擾這一表觀遺傳學角度認識腦卒中后腦損害,為尋找AIS患者腦保護治療的新靶點、研發新的藥物治療有著重要的社會意義和經濟價值。Samaraweera等[8]研究發現miR-335能下調HAND1和JAG1的表達水平,阻斷神經元的生長、分化,參與對神經元發育的調節,Tomé等[9]研究發現過度表達的miR-335能夠下調與細胞增殖、分化和凋亡相關的AP-1的表達,而Shu等[10]的研究發現使用mir-335拮抗劑(antagomir-335)后,下調miR-335可以使腫瘤細胞生長停滯、細胞凋亡,以往這些研究提示miR-335可能是神經元重要調控因子,異常表達的miR-335可能與神經系統疾病有密切相關性。更重要的是,最近有研究顯示miR-335在腦缺血再灌注動物模型腦組織中表達有下調[4],本研究通過大樣本的病例-對照研究,也發現急性缺血性腦卒中患者血清miR-335水平明顯下調,與健康對照組相比較有顯著性差異(P<0.01)。miRNA能夠自由通過血腦屏障[11],可見異常表達的miR-335可能在急性缺血性腦卒中病理生理過程中起重要作用,在進一步研究中,我們探討了miR-335影響AIS的可能機制。
大量研究表明鈣超載在腦缺血損傷的發病機制中起著重要的作用,而鈣離子生理功能的發揮主要是由鈣調蛋白來介導調節。以往有動物實驗研究發現腦缺血再灌注后,隨著神經元細胞內的鈣超載,大鼠腦組織的CaM活性與含量也明顯升高,再灌注后其升高較腦缺血后更為顯著[1],而前期研究也發現急性缺血性腦卒中患者血清鈣調蛋白表達明顯上調,且與神經功能缺損程度呈正相關[2]。通過生物信息學數據庫查詢分析發現鈣調蛋白編碼基因CALM1 3′UTR存在序列(GCUCUUG)與miR-335的“種子序列”堿基互補配對(見圖1),因而推測miR-335與鈣調蛋白之間可能存在負向調控關系。本研究通過脂質體轉染法將miR-335模擬物和抑制物轉染至HUVECs中并進行細胞培養,采用RT-PCR和Western blot分別檢測干預后HUVECs細胞中鈣調蛋白mRNA和蛋白的表達水平,發現miR-335可在mRNA和蛋白水平負向調控CaM的表達,從而推測在急性缺血性腦卒中患者腦細胞損害和神經功能障礙機制中存在miR-335對鈣調蛋白調節,下調的miR-335對鈣調蛋白基因表達抑制不足,導致腦組織鈣調蛋白過表達。
總之,本研究表明,在急性缺血性腦卒中下調的miR-335促進了鈣調蛋白表達上調,參與急性缺血性腦卒中鈣超載損害過程。本研究為開展針對急性缺血性腦卒中患者miR-335靶向治療提供實驗室依據。
[1] Tang LH,Xia ZY,Zhao B,et al.Phosphocreatine preconditioning attenuates apoptosis in ischemia-reperfusion injury of rat brain[J].J Biomed Biotechnol,2011,2011:107091.
[2] 袁梅,周成芳,夏健,等.急性缺血性腦卒中患者血清鈣調蛋白水平檢測及意義[J].中風與神經疾病雜志,2013,30(7):645-647.
[3] Jickling GC,Ander BP,Zhan X,et al.microRNA expression in peripheral blood cells following acute ischemic stroke and their predicted gene targets[J].PLoS One,2014,9(6):e99283.
[4] Dharap A,Bowen K,Place R,et al.Transient focal ischemia induces extensive temporal changes in rat cerebral microRNAome[J].J Cereb Blood Flow Metab,2009,29(4):675-687.
[5] Yuan M,Zhan Q,Duan X,et al.A functional polymorphism at miR-491-5p binding site in the 3′-UTR of MMP-9 gene confers increased risk for atherosclerotic cerebral infarction in a Chinese population[J].Atherosclerosis,2013,226(2):447 -452.
[6] Zhao H,Wang J,Gao L,et al.MiRNA-424 protects against permanent focal cerebral ischemia injury in mice involving suppressing microglia activation[J].Stroke,2013,44(6):1706-1713.
[7] Wang C,Ji B,Cheng B,et al.Neuroprotection of microRNA in neurological disorders (Review) [J].Biomed Rep,2014,2(5):611-619.
[8] Samaraweera L,Grandinetti KB,Huang R,et al.MicroRNAs define distinct human neuroblastoma cell phenotypes and regulate their differentiation and tumorigenicity[J].BMC Cancer,2014,14:309
[9] Tomé M,Sepúlveda JC,Delgado M,et al.miR-335 Correlates with senescence/aging in human mesenchymal stem cells and inhibits their therapeutic actions through inhibition of AP-1 activity[J].Stem Cells,2014,32(8):2229-2244.
[10] Shu M,Zheng X,Wu S,et al.Targeting oncogenic miR-335 inhibits growth and invasion of malignant astrocytoma cells[J].Mol Cancer,2011,10:59.
[11] Schwarzenbach H,Hoon DS,Pantel K.Cell-free nucleic acids as biomarkers in cancer patients[J].Nat Rev Cancer,2011,11:426-437.
NegativeRegulationofCalmodulinbymiR-335inAcuteIschemicStroke
YUAN Mei,TANG Yonghong,YUAN Haijun,et al
(DepartmentofNeurology,theSecondAffiliatedHospital,UniversityofSouthChina,Hengyang,Hunan421001,China)
ObjectiveThe miRNA dysfunction is suspected to be a contributing factor for many CNS pathologies including ischemic stroke.The present study investigates the expression of serum miR-335 in acute ischemic stroke (AIS),and explores the underlying mechanisms of miR-335 in acute ischemic stroke (AIS).MethodsBlood samples were obtained from AIS patients (n=106) and healthy controls (n= 98).MiR-335 was measured by using a quantitative real-time PCR.Bioinformatics database assay was used to determine whether calmodulin gene (CALM1) was the direct target of miR-335.The miR-335 mimics and inhibitors were transfected into human umbilical vein epithelial cells (HUVECs) with lipofectamine respectively.Calmodulin expression was determined by Western blot and reverse transcription-PCR (RT-PCR) in the cultured HUVECs.ResultsCompared with the healthy control group,the expression of serum miR-335 was significantly lower in patients with AIS group (P<0.01).In addition,bioinformatics database assay show that the CALM1 present the binding sites,which was potentially targeted by miR-335.Finally,Transfection of the miR-335 mimic inhibited the expression of CaM mRNA and protein in the HUVEC compared to the control group (P<0.01),while transfection of the miR-335 inhibitors increased the expression of CaM mRNA and protein (P<0.05).ConclusionMiR-335 down-regulation may increase the ischemic brain injury through up-regulating the expression of CaM.
microRNA-335; calmodulin; acute ischemic stroke
10.15972/j.cnki.43-1509/r.2015.03.010
2014-10-20;
2015-03-15
衡陽市科技計劃項目(2014KJ40).
*通訊作者,E-mail:yuanhaijun211@163.com.
R743.3
A
(此文編輯:朱雯霞)

