細菌類胡蘿卜素裂解酶酶解蝦青素工藝優化
朱明明,賀 靜,樊明濤,*,王樹林
細菌類胡蘿卜素裂解酶酶解蝦青素工藝優化
朱明明1,賀 靜1,樊明濤1,*,王樹林2
(1.西北農林科技大學食品科學與工程學院,陜西 楊凌 712100;2.青海大學農牧學院,青海 西寧 810016)
目的:從巴氏葡萄球菌發酵液中分離純化可降解類胡蘿卜素產香的酶,優化其降解蝦青素的反應,為后續鑒定產物提供依據。方法:利用高效液相色譜分析產物產量變化,應用正交試驗設計,采用DPS軟件進行二次多項式逐步回歸分析,優化蝦青素酶解反應條件。結果:類胡蘿卜素裂解酶具有催化蝦青素降解的活性。反應pH值、反應時間、反應溫度及其交互作用對產物產量均有極顯著影響(P<0.01),反應pH值和反應時間的交互作用對產物產量影響最大,其通徑系數為12.726 9。利用二次多項式逐步回歸得到蝦青素酶解的最佳反應條件:反應pH 4.5、反應時間7 min、反應溫度50 ℃,在此條件下蝦青素產物的產量總和可達到定義條件下的1.75 倍。結論:該類胡蘿卜素裂解酶對蝦青素降解具有很強的催化活性,得到了產物達到最大產量時的最優條件。
類胡蘿卜素裂解酶;蝦青素;產物產量;二次多項式逐步回歸
類胡蘿卜素是一類在自然界中廣泛存在的、由8 個異戊二烯單元相連、并且分子兩端各含有一個不飽和己烯環的一類四萜化合物的總稱,其中包括環化的或無環的胡蘿卜素,以及含有氧原子的胡蘿卜醇等[1-4]。蝦青素是一種紅色天然類胡蘿卜素,廣泛存在于鮭魚、蝦、蟹、觀賞魚和魚卵中以及植物葉、花和水果中[5-7]。蝦青素不僅具有著色功能[8-9]和抗氧化性[10-11],也可氧化裂解產生香氣物質。蝦青素的降解方法同類胡蘿卜素的降解方法,有物理降解(包括高溫氧化裂解、熱降解和光氧化降解等)、化學氧化降解和生物氧化(主要是酶催化降解)等[12-14]。經過降解,可以生成如氧化異佛爾酮、β-大馬酮、β-紫羅蘭酮類等C13化合物,這些化合物因為感官閾值較低而成為評價食品質量的重要指標[15-18]。由于微生物酶對蝦青素(類胡蘿卜素)降解有高度選擇性[19-20],降解產物大多為具有香氣的降異戊二烯化合物,所以,最近幾年在國際上頗受關注,已逐漸成為替代其理化降解的主要方法。
在改善沙棘酒香氣品質的研究中,首次從沙棘汁分離得到一株具有可降解類胡蘿卜素特性的細菌(經鑒定為巴氏葡萄球菌)[21];對該細菌產生的類胡蘿卜素裂解酶[22-23]進行分離純化并對其基本酶學性質進行研究。為進一步了解該類胡蘿卜素裂解酶的底物特異性,了解其對不同類胡蘿卜素底物的作用位點,需對降解中間產物進行研究[24]。由于酶解的中間產物極其不穩定,容易受時間、pH值和溫度影響而發生降解產生香氣物質,因此為了得到中間產物最大產物量進行后續研究和分析,本實驗以蝦青素為底物,通過二次多項式逐步回歸[25-26]對該類胡蘿卜素裂解酶降解蝦青素的產物進行優化,獲得最大產物量,并進行高效液相色譜-質 譜(high performance liquid chromatography-mass spectrometry,HPLC-MS)分析,以期為研究底物特異性提供依據。
1 材料與方法
1.1 材料與試劑
實驗室分離保存的巴氏葡萄球菌菌株TS-82。
蝦青素標準品(純度98%) 美國Sigma-Aldrich試劑公司;甲醇(色譜純) 美國Tidia公司;甲基叔丁基醚(色譜純) 上海Aladdin試劑有限公司;其他試劑均為國產分析純。
1.2 儀器與設備
HH恒溫水浴鍋 北京科偉永興儀器有限公司;HC-3018R高速冷凍離心機 安徽中科中佳科學儀器有限公司;LC-20A高效液相色譜 日本島津公司。
1.3 方法
1.3.1 類胡蘿卜素裂解酶純酶的制備
在37 ℃、130 r/min條件下,將TS-82在改良查氏培養基[22]中培養12 h。將所得發酵液在4 ℃、10 000 r/min離心10 min,取上清液即為粗酶液。粗酶液經過冷凍干燥濃縮后依次上樣于Mono Q10/100柱,高效制備液相色譜和Superdex peptide 10/300多肽分子篩對其進行分離純化,得到單一的類胡蘿卜素裂解酶純酶。
1.3.2 蝦青素標準品儲備液的配制
實驗中以蝦青素標準品為底物。將5 mg蝦青素和1 g吐溫-80溶于20 mL的二氯甲烷溶液中,避光條件下,在通風櫥中不斷振蕩直至二氯甲烷揮發干凈,加入52 mL無菌蒸餾水混勻,得橘黃色、清澈的儲備液,放置在4 ℃冰箱中待用。該儲備液濃度為160 μmol/L。
1.3.3 體外蝦青素酶解
將15 μg的純酶與280 μmol的底物混合,用蒸餾水定容至2 mL,在反應溫度30 ℃,pH 5.0條件下反應30 min,加入2 倍體積的丙酮溶液終止反應[19]。接著向反應物中加入2 倍體積的正己烷溶液,混合均勻,放置5 min后,5 000×g離心5 min,取上清液即提取出蝦青素及其酶解產物。將上清液在真空離心機中旋轉干燥,得到的殘余物溶解于2 mL丙酮溶液中,置于4 ℃條件下保存,用于HPLC分析。
1.3.4 蝦青素酶解的單因素試驗
體外實驗中均采用280 μmol底物和15 μg純酶進行酶解反應,反應體積2 mL。根據預實驗結果和參考文獻[24],選取了反應時間、反應pH值和反應溫度為考察因素進行酶解反應。該類胡蘿卜素裂解酶的最適反應溫度為60 ℃,最適反應pH值為3.0、由于反應溫度過高或反應pH值過低時,中間產物都極其容易降解,故設定如下考察范圍:設定反應溫度30 ℃、反應pH 5.0,考察反應時間0、15、30、45、60 min對蝦青素中間產物相對含量的影響,以反應15 min時得到的2 個產物的總相對含量為100%;設定反應溫度30 ℃、反應時間15 min,考察反應pH 4.0、4.5、5.0、5.5、6.0對蝦青素中間產物相對含量的影響,以pH 5.0條件下獲得的2 個產物的總相對含量為100%;設定反應pH 5.0、反應時間30 min,考察反應溫度30、40、50、60、70 ℃對蝦青素中間產物相對含量的影響,以反應溫度30 ℃條件下得到的2 個產物的總相對含量為100%。按照1.3.3節方法終止反應并提取蝦青素和酶解產物。
1.3.5 蝦青素酶解的正交試驗設計
在單因素試驗結果的基礎上,采用正交試驗設計方法安排蝦青素酶解產物條件優化的試驗,其因素水平具體見表1,通過考察蝦青素酶解產物的相對含量確定最佳的反應條件。

表 1 正交試驗設計因素與水平表Table 1 Factors and their coded levels used in orthogonal array design
1.3.6 蝦青素酶解反應的測定
1.3.6.1 色譜條件
采用HPLC法[19]測定底物的降解和產物的生成。色譜柱:C18反相柱(4.6 mm×250 mm,5 μm)。流動相A:甲醇-水-甲基叔丁基醚體積比30∶10∶1,流動相B:甲醇和甲基叔丁基醚等體積混合,采用梯度洗脫,梯度洗脫程序:0~30 min,0%~100%B,30~35 min,100%B,35~36 min,100%~0%B,36~51 min,0%B;柱溫30 ℃;流速1.0 mL/min;進樣量20 μL;檢測器:二極管陣列檢測器;檢測波長460 nm。
1.3.6.2 蝦青素標準曲線的繪制及含量測定
將蝦青素儲備液分別稀釋至40、80、120 μmol/L和160 μmol/L,以蒸餾水做空白,按照1.3.3節提取方法提取蝦青素,根據1.3.6.1節色譜條件得到不同底物濃度的峰面積,用所得數據作圖可得蝦青素溶液濃度與峰面積的線性關系。
1.3.6.3 底物轉化率
將15 μg純酶與280 μmol底物混合,用蒸餾水定容至2 mL,反應30 min,測定30 min內蝦青素的降解量。底物轉化率定義為在上述條件下每分鐘底物的降解量,單位μg/min。
1.3.6.4 產物相對含量
通過檢測波長460 nm條件下產物的峰面積可得到產物含量的變化。由于產物還未鑒定,故采用相對含量表示。實驗中選用2 個產物的峰面積總和代表產量總和。在單因素試驗基礎上,定義最優條件下得到的2 個產物峰面積總和為100%,其余條件獲得的產物峰面積總和換算為相對含量。
以上所有反應均為3 次平行,取平均值。
2 結果與分析
2.1 蝦青素酶解反應

圖 1 蝦青素酶解產物的液相色譜圖Fig.1 HPLC analysis of astaxanthin cleavage products by purified carotenoid cleavage enzyme in vitro assays
從圖1可以看出,類胡蘿卜素裂解酶具有很強的催化活性,反應30 min可看到顏色明顯發生變化。圖1a與圖1b的結果相比可看出,蝦青素(X)含量明顯降低,表明類胡蘿卜素裂解酶可以顯著地催化降解蝦青素標準品,而在蝦青素保留時間后的2 個峰的含量明顯增加,即生成產物1和2(命名為X1和X2)。同時測定了產物X1和X2在HPLC洗脫液中的最大吸收波長,其波長分別是472 nm和466 nm。
根據圖1中蝦青素含量的變化計算出30 min的轉化率為51.12%。與該酶作用于其他底物的催化效率相比,作用于蝦青素的催化效率與角黃素(52.84%)的效率相當,高于作用于β-8′-胡蘿卜醛(22.73%)和β-胡蘿卜素(40.4%),但低于作用于玉米黃質(71.78%)的催化效率[24],這與Hoffmann等[19]發現的類胡蘿卜裂解酶對蝦青素的催化效率遠高于玉米黃質和角黃素的催化效率有一定的差異。對于該酶對玉米黃質具有較好的催化活性的機理有待于進一步研究。
2.2 蝦青素標準曲線的建立
以波長460 nm處得到的蝦青素標準品峰面積為橫坐標,蝦青素標準品的濃度為縱坐標,繪制標準曲線,進行回歸分析。得回歸方程:y=0.02x-3.827(R2=0.985),式中:x為蝦青素的峰面積;y為蝦青素濃度/(μmol/L)。
2.3 單因素試驗結果

圖 2 反應時間對蝦青素酶解中間產物相對含量的影響Fig.2 Effects of incubation time on the relative content of apocarotenoids
2.3.1 反應時間對中間產物X1和X2相對含量的影響由圖2可看出,反應時間對中間產物相對含量有極顯著影響(P<0.01)。反應初期隨著反應時間的延長,蝦青素中間產物相對含量增加,這是因為酶催化蝦青素降解產生中間產物。反應15 min時,中間產物相對含量最高。隨著時間的延長,中間產物相對含量開始下降。這可能因為隨著時間的延長,中間產物自身不穩定,發生降解,因此反應時間選擇15 min為宜。
2.3.2 反應pH值對中間產物X1和X2相對含量的影響


圖 3 反應pH值對蝦青素酶解產物含量(a)、蝦青素轉化率(b)的影響Fig.3 Effects of pH on the relative content of apocarotenoids and the conversion efficiency of astaxanthin
如圖3a所示,反應pH值對中間產物相對含量的變化有極顯著影響(P<0.01),反應pH值為5.0時,中間產物相對含量最高。pH值大于5.0后中間產物相對含量明顯降低,這與pH值過高,酶活性受到抑制導致蝦青素轉化率降低相關。而pH值小于5.0時中間產物相對含量也出現明顯降低,分析其原因可能是由于中間產物易受pH值影響,在酸性條件下不穩定,發生降解。同時考察不同pH值對蝦青素酶解轉化率的影響,結果見圖3b。隨著pH值的升高,蝦青素轉化率逐步降低,這與該酶在酸性環境中的催化作用較強一致。當pH值達到6.0時,蝦青素轉化率幾乎為0,這是因為該類胡蘿卜素裂解酶的最適反應pH值為3.0,而在pH值達到6.0時幾乎完全失活造成的。
由于底物轉化率只與類胡蘿卜素裂解酶活性相關,而中間產物不僅受酶活影響,所處環境條件對其穩定性也有顯著性影響,在酸性條件下很不穩定,極其容易降解[24]。雖然催化活性高,底物含量大大減少,但中間產物一方面在酸性條件下不穩定,另一方面酶活性變高,而時間還是15 min時,中間產物已發生降解,兩方面導致產量也大大減少,轉化為具有香氣物質的終產物,因此并不是轉化率越高,中間產物相對含量越高,故從得到中間產物的最大相對含量考慮,反應pH值選擇5.0。2.3.3 反應溫度對中間產物X1和X2相對含量的影響
由圖4a看出,反應溫度對中間產物相對含量變化有極顯著影響(P<0.01)。反應溫度30 ℃時,中間產物相對含量最高。隨著溫度的升高,中間產物相對含量顯著降低,這是因為中間產物極其不穩定,溫度越高,其自身降解越快。而在溫度低于30 ℃時,由于酶的活性受到抑制,導致催化效率低,致使中間產物相對含量較低。同時考察不同溫度對蝦青素酶解轉化率的影響,結果見圖4b。反應溫度在30~60 ℃時蝦青素轉化率升高較快,而后隨著溫度上升,轉化率幾乎不變,在溫度高于70 ℃后蝦青素轉化率降低,這可能因為雖然隨著反應溫度的升高,酶的活性增加,催化蝦青素快速降解,但溫度過高破壞了酶的結構,使酶失活,從而影響蝦青素的降解。

圖 4 反應溫度對蝦青素酶解產物含量(a)、蝦青素轉化率(b)的影響Fig.4 Effects of temperature on the relative content of apocarotenoids and the conversion efficiency of astaxanthin
由于底物轉化率只與類胡蘿卜素裂解酶活性相關,而中間產物不僅受酶活影響,所處環境條件對其穩定性也有顯著影響,一方面在高溫條件下很不穩定,極其容易降解[24],另一方面酶活性變高,底物轉化率升高,但依舊15 min時中間產物已發生降解,因此并不是轉化率越高,中間產物相對含量越高,即從酶的活性和中間產物穩定性兩方面考慮,選擇反應溫度為30 ℃。
2.4 正交試驗及二次多項式逐步回歸分析
2.4.1 二次多項式回歸方程的建立
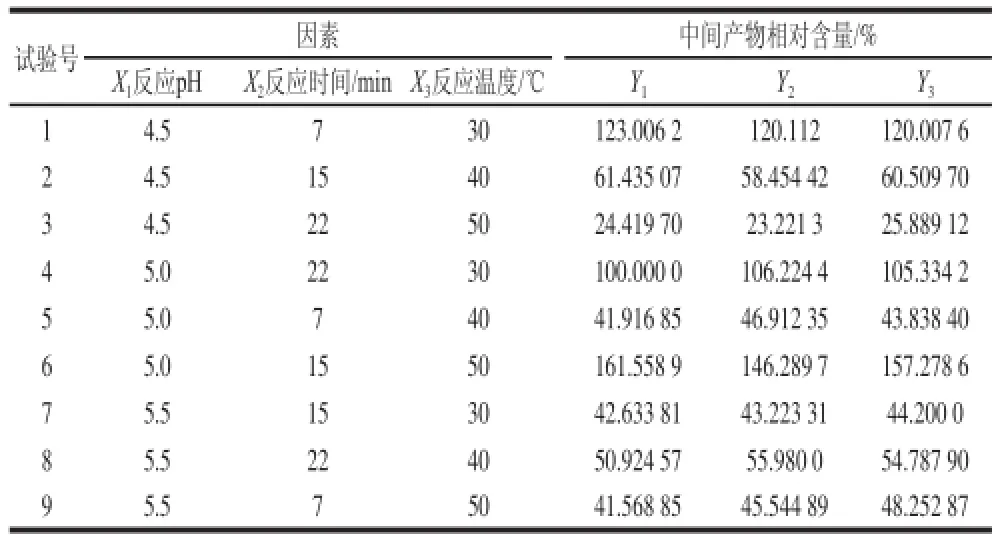
表 2 正交試驗設計結果與分析Table 2 Results and analysis of orthogonal array design
通過單因素試驗分別考察了反應pH值、反應時間和反應溫度對中間產物相對含量的影響后,選用正交試驗探討這3 個因素對中間產物相對含量的影響,結果見表2。
對正交試驗結果進行二次多項式逐步回歸分析,由DPS數據處理系統擬合得出數學模型的回歸方程:
Y=-1 064.22 +1 030.33X1-42.74X2-51.44X3-125.63X1X1-0.16X2X2+0.70X3X3+10.90X1X2-0.15X2X3
(式中:Y是2 個中間產物相對含量總和;此時定義反應時間30 min、pH 5.0、溫度30 ℃條件下的相對含量為100%)。同時得到二次多項式逐步回歸方程的相關統計學指標:相關系數R=0.997 7、F=490.501 3、P=0.000 1,調整后的相關系數Ra=0.996 7,剩余標準差s=3.426 1,Durbin-Waston統計量d=1.945 206 93。由以上回歸方程統計學指標可以看出,回歸方程能夠正確反映各因素與中間產物相對含量之間的關系,可靠性較高,同時因為R>Ra,Y回歸效果顯著。
2.4.2 反應pH值、反應時間、反應溫度及其交互作用對中間產物相對含量的影響

表 3 優化條件下各因素與中間產物相對含量的直接通徑系數Table 3 Direct path coefficients between main factors and the yield of apocarotenoids under optimized reactionconditions
從各影響因素的方程回歸系數來看,反應pH值、反應時間和反應溫度與中間產物相對含量的相關性與單因素試驗結果一致,而反應pH值和反應時間的交互作用與中間產物相對含量呈正相關關系,反應時間和反應溫度的交互作用與中間產物相對含量呈負相關關系。
在回歸方程條件下,各因素與中間產物相對含量的直接通徑系數見表3。各因素對中間產物相對含量的相對重要性按直接通徑系數(絕對值)從大到小排序依次是X1X2、X1、X3、X2、X2X3(X1與合并,X3與合并,X2與X22合并),即反應pH值和反應時間的交互作用(X1X2)對中間產物相對含量的影響較大,而反應時間和反應溫度的交互作用(X2X3)對其影響較小。
2.4.3 驗證實驗結果
回歸方程最終得到最高指標時各個因素組合為Y=194.844 6、X1=4.5、X2=7、X3=50,即反應pH值為4.5、反應時間7 min、反應溫度50 ℃,在此條件下的中間產物相對含量為定義條件下的2 倍。為檢驗預測結果的可靠性,采用上述優化酶解反應條件進行蝦青素酶解反應,3 次平行實驗得到的實際中間產物相對含量為定義條件下的1.75 倍,與最優理論值相近,比9 組試驗數據都高,說明此優化結果對實驗指導有一定的價值。
3 結 論
巴氏葡萄球菌菌株TS-82分離純化得到的類胡蘿卜素裂解酶具有催化蝦青素降解產香的功能,其中間產物X1和X2可通過HPLC檢測到,最大吸收波長分別是472 nm和466 nm。反應pH值、反應時間、反應溫度及其交互作用對中間產物相對含量均有極顯著作用(P<0.01),在優化條件下,反應pH值和反應時間的交互作用對中間產物相對含量影響最大,其通徑系數為12.726 9。二次多項式逐步回歸優化蝦青素酶解的最佳工藝條件為反應pH值4.5、反應時間7 min、反應溫度50 ℃,按此條件,蝦青素中間產物相對含量可達到定義條件下的1.75 倍。該方法可以提高產物含量,節省時間,為進一步研究產物結構和該酶的催化機理提供依據。
[1] NELIS H J, de LEENHEER A P. Microbial production of carotenoids used in foods and feeds[J]. Journal of Applied Bacteriology, 1991, 70(3): 181-191.
[2] 李福枝, 劉飛, 曾曉希, 等. 天然類胡蘿卜素的研究進展[J]. 食品工業科技, 2007, 28(9): 227-232.
[3] OHMIYA A, KISHIMOTO S, AIDA R, et al. Carotenoid cleavage dioxygenase (CmCCD4a) contributes to white color formation in chrysanthemum petals[J]. Plant Physiology, 2006, 142(3): 1193-1201.
[4] WACHE Y, RATULD A B, BELIN J M. Dispersion of β-carotene in processes of production of β-ionone by cooxidation using enzymegenerated reactive oxygen species[J]. Process Biochemistry, 2006, 41(11): 2337-2341.
[5] 魏東, 嚴小君. 天然蝦青素的超級抗氧化活性及其應用[J]. 中國海洋藥物, 2001, 20(4): 45-50.
[6] NAGUIB Y M A. Antioxidant activities of astaxanthin and relat ed carotenids[J]. Journal of Agricultural and Food Chemistry, 2000, 48(4): 1150-1154.
[7] JOHNSON E A, AN G H. Astaxanthin from microbial sources[J]. Critical Reviews in Biotechnology, 1991, 11(4): 297-326.
[8] CHOUBE RT G, BACCAU NAUD M. Colour changes of fillets of rainbow tr out (Oncorhynch us mykiss W.) fed astaxanthin or canthaxanthin during storage under cont rolled or modified atmosphere[J]. LWT-Food Scie nce and Technology, 2006, 39(10): 1203-1213.
[9] 陶正國, 鄺金媚, 陳小兵. 蝦青素對虹鱒著色及其生產性能影響[C]//中國林牧漁業經濟學會飼料經濟專業委員會第六屆學術交流大會. 北京: 中國飼料工業協會, 2009: 147-149.
[10] PAN C H, CHIEN Y H, WANG Y J, et al. Antioxidant defence to ammonia stress of chara cins (Hyphessobrycon eques Steindachner) fed diets supplemented with carotenoids[J]. Aquacul ture Nutrition, 2011, 17(3): 258-266.
[11] 曹秀明, 高越, 徐德林. 蝦青素保護活性氧所致線粒體損傷的作用[J].食品與藥品, 2011, 12(11): 412-414.
[12] KANEKO H, HARADA M. 4-Hydroxy-β-damascone a nd 4-hydroxydihyro-β-damascone from cigar tobacco[J]. Agricultural Biology Chemistry, 1972, 36(1): 168-171.
[13] 楊偉祖, 謝剛, 王寶興, 等. 煙草中β-胡蘿卜素的熱裂解產物的研究[J].色譜, 2006, 24(6): 611-614.
[14] 劉曉庚. 類胡蘿卜素的氧化降解及其對面粉品質的影響[J]. 食品科學, 2010, 31(19): 457-460.
[15] 王樹林, 樊明濤. 青海沙棘干酒與冰酒香氣成分的分析及比較[J].食品與發酵工業, 2010, 36(5): 120-125.
[16] 劉維涓. 胡蘿卜素降解反應研究進展[J]. 林產化學與工業, 2008, 28(3): 122-126.
[17] UENOJO M, PASTORE G M. β-Carotene biotransformation to obtain aroma compounds[J]. Ciência e Tecnologia de Alimentos, 2010, 30(3): 822-827.
[18] 詹軍, 劉沖, 賀帆, 等. 不同香型烤煙類胡蘿卜素降 解香氣物質與評吸質量分析[J]. 西南農業學報, 2011, 24(6): 2137-2142.
[19] HOFFMANN J, BONA-LOVASZ J, BEUTTLER H, et al. In vivo and in vitro studies on the carotenoid cleavage oxygenases from Sphingopyxis alaskensis RB2256 and Plesiocystis pacifica SIR-1 revealed their substrate specifi cities and non-retinal-forming cleavag e activities[J]. Febs Journal, 2012, 279(20): 3911-3924.
[20] MARASCO E K, VAY K, SCHMIDT-DANNERT C. Identification of carotenoid cleavage dioxygenases from Nostoc sp. PCC 7120 with different cleavage activities[J]. Journal of Biological Chemistry, 2006, 281(42): 31583-31593.
[21] WANG S L, FAN M T. 沙棘源微生物降解類β-胡蘿卜素芳香成分的研究[C]//第五屆國際沙棘協會大會. 西寧: 國際沙棘協會, 2011: 70.
[22] 麻俊俠, 樊明濤, 王樹林, 等. β-胡蘿卜素降解葡萄球菌化學合成培養基營養素的研究[J]. 食品科學, 2013, 34(5): 137-141.
[23] 賀靜, 朱明明, 王樹林, 等. 降解β-胡蘿卜素葡萄球菌的化學合成培養基研究[J]. 天津農業科學, 2014, 20(1): 5-9.
[24] ZHU M M, HE J, WANG S L, et al. In vitro study on the carotenoid cleava ge enzyme from Staphylicoccus pasteuri cleaving different substrates[J]. Journal of Food and Nutrition Reaserch, 2014, 2(7): 411-418.
[25] 陳林, 楊蕾, 王藝璇, 等. 二次多項式逐步回歸在狹葉仙鶴蘚生長研究中的應用[J]. 昆明學院學報, 2012, 34(3): 37-40.
[26] 關海寧. 二次逐步回歸優化超聲酶法提取大豆多糖工藝[J]. 中國釀造, 2012, 31(5): 53-55.
Optimization of Conditions for Astaxanthin Cleavage by a Bacterial Carotenoid Cleavage Enzyme
ZHU Mingming1, HE Jing1, FAN Mingtao1,*, WANG Shulin2
(1. College of Food Science and Engineering, Northwest A&F University, Yangling 712100, China;2. College of Agriculture and Animal Husbandry, Qinghai University, Xining 810016, China)
Objective: This work aimed to optimize the conditions for the degrada t ion of astaxanthin by a purifi ed carotenoid cleavage enzyme from Staphylococcus pasteuri. Methods: The degradation products were measured by HPLC. Orthogonal arrays design combined with quadratic polynomial stepwise regression analysis was applied to optimize the conditions for astaxanthin degradation. Results: The HPLC analysis showed that this carotenoid cleavage enzyme had the ability to degrade astaxanthin. pH, time, temperature and their interactions had significant effects on the contents of degradation products (P < 0.01). The interaction between pH and time showed the most signifi cant contribution to the contents of degradation products under the optimized conditions with a value of direct path coeffi cient of 12.726 9. The optimal reaction conditions were determined as follows: pH 4.5, and incubation at 50 ℃ for 7 min. Under these conditions, the total yield of degradation products was 1.75 times higher than the defi ned apocarotenoids yield. Conclusion: This carotenoid cleavage enzyme has a high ability to cleave astaxanthin. The optimal conditions for maximum yield of products have been obtained.
a carotenoid cleavage enzyme; astaxanthin; yield of apocarotenoids; quadratic polynomial stepwise regression analysis
Q556
A
1002-6630(2015)08-0001-05
10.7506/spkx1002-6630-201508001
2014-06-12
國家自然科學基金面上項目(31171728);國家自然科學基金青年科學基金項目(31060225)
朱明明(1989—),女,博士研究生,主要從事食品生物技術研究。E-mail:happyzhumingming@126.com
*通信作者:樊明濤(1963—),男,教授,博士,主要從事食品微生物及食品安全研究。E-mail:fanmt@nwsuaf.edu.cn

