鮐魚水溶性蛋白的提取及其揮發(fā)性成分分析
周家萍,張文濤,孟 夢(mèng),王躍猛,劉安軍,鄭 捷
鮐魚水溶性蛋白的提取及其揮發(fā)性成分分析
周家萍1,張文濤2,孟 夢(mèng)2,王躍猛2,劉安軍2,鄭 捷2
(1.天津科技大學(xué)現(xiàn)代分析技術(shù)研究中心,天津 300457;2.天津科技大學(xué)食品工程與生物技術(shù)學(xué)院,天津 300457)
以鮐魚為原料,通過單因素試驗(yàn)和響應(yīng)面試驗(yàn),確定鮐魚水溶性蛋白的最佳提取工藝條件為料液比1∶6.6(g/mL)、提取溫度27.7 ℃、提取時(shí)間3.8 h,得到的水溶性蛋白提取率為76.12%。將鮐魚原料和水溶解后樣品采用氣相色譜-質(zhì)譜儀進(jìn)行揮發(fā)性成分分析,結(jié)果表明,水溶性蛋白揮發(fā)性成分醇類物質(zhì)含量降低,酮類、醛類、呋喃類物質(zhì)含量都有了明顯提高。樣品經(jīng)過冷凍干燥后,呈淡黃色或黃色粉末,蓬松柔軟,易吸濕,易溶于水,水溶液性質(zhì)穩(wěn)定,略有魚香味。
鮐魚;水溶性蛋白;氣相色譜-質(zhì)譜法
鮐魚(Pneumatophorus japonicas),鱸形目,屬于鯖科,鮐屬。別名鮐鲅魚、青花魚、鯖魚等,為遠(yuǎn)洋暖水性中上、層高產(chǎn)量的洄游性魚類,是我國目前近海主要捕撈的經(jīng)濟(jì)魚種之一[1-4]。鮐魚分布廣、生長快、產(chǎn)量高,具有食物鏈較低、生命周期短、繁殖能力強(qiáng)、生長迅速、資源恢復(fù)能力強(qiáng)的特點(diǎn),是城鄉(xiāng)群眾喜食的魚類[5]。鮐魚魚肉厚實(shí),魚刺少,非常適合進(jìn)行深加工。同時(shí),研究表明,鮐魚是一種營養(yǎng)豐富的魚類,每100 g鮐魚肉中,含蛋白21.4 g、脂肪7.4 g、碳水化合物0.1 g、灰分1.1 g、鈣20 mg、磷226 mg、煙酸9.7 mg[6],由此可見,鮐魚具有較高的營養(yǎng)價(jià)值。鮐魚體內(nèi)還含有兩種營養(yǎng)價(jià)值很高的不飽和脂肪酸:二十碳五烯酸(eicosapntemacnioc acid,EPA)和二十二碳六烯酸(docosahexaenoic acid,DHA)。EPA和DHA具有促進(jìn)嬰幼兒和青少年智力發(fā)育、抗血小板凝聚、延緩血栓形成、預(yù)防心血管疾病、降血脂、抗動(dòng)脈硬化、抑制腫瘤生長、減少癌癥發(fā)病率等保健作用。因此,研究和開發(fā)利用經(jīng)濟(jì)價(jià)值較低的鮐魚資源,對(duì)其進(jìn)行深加工,提高其附加值,具有明顯的經(jīng)濟(jì)效益和社會(huì)效益[7-9]。
魚品加工過程中會(huì)產(chǎn)生大量富含蛋白的有機(jī)廢水,其蛋白質(zhì)量濃度可達(dá)到5~30 mg/mL(鮮牛奶的蛋白提取量約為28 mg/mL),直接排放不僅嚴(yán)重污染水體,同時(shí)造成極大的資源浪費(fèi)[10-12]。漂洗作為魚品加工的重要環(huán)節(jié),可去除魚肉中的有色物質(zhì)、腥臭成分、脂肪、血液、水溶性蛋白等[13]。然而,漂洗液中大量的水溶性蛋白如何回收利用,一直是人們非常關(guān)注的議題。目前,漂洗液中蛋白的回收方法研究尚處于起步階段,主要有膜分離法[14]、離子交換法[15]、絮凝法[16]、調(diào)節(jié)pH值法[17]、電阻加熱法[18]等,其中大部分方法成本較高,實(shí)際生產(chǎn)中較難實(shí)現(xiàn)。
本研究以鮐魚為試材,采用低成本的調(diào)pH值法回收漂洗過程中流失的水溶性蛋白,旨在全面開發(fā)飴魚營養(yǎng)價(jià)值,制備具有高效生物活性的蛋白物并開發(fā)系列保健食品,對(duì)鮐魚乃至水產(chǎn)品深加工具有重要指導(dǎo)意義。
1 材料與方法
1.1 材料與試劑
鮐魚購于華海批發(fā)有限公司,-20 ℃冷藏。
鹽酸、硫酸、無水葡萄糖、無水乙醇、磷酸氫二鉀(分析純) 天津江天化工技術(shù)有限公司;考馬斯亮藍(lán)G-250 美國Sigma公司。
1.2 儀器與設(shè)備
Sp-2120型紫外-可見分光光度計(jì)、RE-52A旋轉(zhuǎn)蒸發(fā)器 上海光譜儀器有限公司;HW·SY系列電熱恒溫水浴鍋 北京市長風(fēng)儀器儀表公司;752紫外-可見分光光度計(jì) 上海光學(xué)儀器廠;凱氏定氮儀 上海新嘉電子有限公司;LD4-40型臺(tái)式離心機(jī) 北京醫(yī)用離心機(jī)廠;4000MS氣相色譜-質(zhì)譜(gas chromatography-mass spectrometer,GC-MS)聯(lián)用儀 美國瓦里安技術(shù)有限公司。
1.3 方法
1.3.1 原料預(yù)處理
取冰鮮的鮐魚進(jìn)行解凍后宰殺,去頭部、內(nèi)臟及魚尾后,將魚身冷藏于-20 ℃冰箱中備用,實(shí)驗(yàn)時(shí)常溫自然解凍。每個(gè)單因素試驗(yàn)都采用同一批原料。
1.3.2 鮐魚水溶性蛋白的提取[19]
鮐魚解凍,切塊,按一定的料液比與蒸餾水進(jìn)行混合,混合物于均質(zhì)機(jī)中均質(zhì)5 min,于25 ℃浸提24 h,室溫4 390×g離心10 min取上清液,所得蛋白溶液置于-20 ℃冰箱冷凍,待冷凍干燥后,即得水溶性蛋白粉。
1.3.3 鮐魚水溶性蛋白成分測(cè)定
取凍干后的水溶性蛋白粉進(jìn)行成分測(cè)定,采用105 ℃干燥質(zhì)量恒定法測(cè)定水分含量,索氏抽提法測(cè)定粗脂肪的含量,微量凱氏定氮法測(cè)定粗蛋白的含量,馬弗爐灰化法測(cè)定灰分的含量。
1.3.3.1 水分含量測(cè)定
根據(jù)GB 5009.3—2010《食品中水分的測(cè)定》[20],采用直接干燥法進(jìn)行測(cè)定。
1.3.3.2 灰分含量測(cè)定
根據(jù)GB 5009.4—2010《食品中灰分的測(cè)定》[21]方法進(jìn)行測(cè)定。
1.3.3.3 蛋白含量測(cè)定
根據(jù)GB 5009.5—2010《食品中蛋白質(zhì)的測(cè)定》[22],采用半微量凱氏定氮法進(jìn)行測(cè)定。
1.3.3.4 脂肪含量測(cè)定
1.3.3.5 多糖含量測(cè)定
多糖含量的測(cè)定采用苯酚-硫酸法[24]。
1.3.3.6 粗纖維含量測(cè)定
根據(jù)GB/T 5009.10—2003《植物類食品中粗纖維的測(cè)定》[25],采用質(zhì)量法進(jìn)行測(cè)定。
1.3.4 鮐魚水溶性蛋白提取率的測(cè)定
水溶性蛋白提取率的測(cè)定采用Bradford法[26]。
1.3.4.1 牛血清蛋白標(biāo)準(zhǔn)曲線的制作
取11 支試管,編號(hào)為0、1、2、3、4、5、6、7、8、9、10,分別吸取牛血清蛋白標(biāo)準(zhǔn)液0.0、0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0 mL,于10 mL具塞試管中,各管加水至1.0 mL,加入5.0 mL預(yù)冷的考馬斯亮藍(lán)G-250染色液,混勻后靜置2 min,以0號(hào)管作空白對(duì)照,測(cè)定各管595 nm波長處的吸光度,以吸光度為縱坐標(biāo),蛋白質(zhì)量濃度為橫坐標(biāo)作曲線,得到標(biāo)準(zhǔn)曲線方程。
1.3.4.2 水溶性蛋白提取率的測(cè)定
常愛蘭從上到下翻了三四張,就再也沒有翻下去了,這個(gè)三四張足夠她怒不可遏了。她不顧李老師在跟前,對(duì)準(zhǔn)周小羽伸手就是一個(gè)響亮的耳光,沒等周小羽哭出聲來,她轉(zhuǎn)過身拾起一根棍子就劈頭蓋臉地朝周小羽打去。
取未知質(zhì)量濃度的蛋白液(通過適當(dāng)稀釋,使其質(zhì)量濃度控制在0.01~0.1 mg/mL范圍內(nèi)),加1 mL到試管內(nèi),再加入G-250染色液5 mL混勻,測(cè)其595 nm波長處的吸光度,同時(shí)做3 個(gè)平行實(shí)驗(yàn),根據(jù)標(biāo)準(zhǔn)曲線,求出未知蛋白液的質(zhì)量濃度。
1.3.5 蛋白提取率的計(jì)算[27]
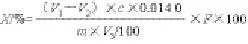
式中:X為樣品中蛋白提取率/%;V1為試劑消耗硫酸或鹽酸標(biāo)準(zhǔn)滴定液的體積/mL;V2為試劑空白消耗硫酸或鹽酸標(biāo)準(zhǔn)滴定液的體積/mL;V3為吸取消化液的體積/mL;c為硫酸或鹽酸標(biāo)準(zhǔn)滴定溶液濃度/(mol/L);m為試樣的質(zhì)量/g;F為氮換算為蛋白的系數(shù),計(jì)算采用6.25。
1.3.6 單因素試驗(yàn)
1.3.6.1 料液比對(duì)水溶性蛋白提取率的影響
準(zhǔn)確稱取10 g鮐魚,分別按料液比1∶2、1∶4、1∶6、1∶8、1∶10(g/mL)加入蒸餾水20、40、60、80、100 mL,調(diào)節(jié)pH值到7.0,在30℃條件的水浴鍋中保溫6 h,過濾,取濾液,濾渣重復(fù)提取2 次,將3 次濾液收集,利用考馬斯亮藍(lán)G-250法測(cè)定其水溶性蛋白提取率,進(jìn)行3 次平行試驗(yàn)。
1.3.6.2 提取溫度對(duì)水溶性蛋白提取率的影響
準(zhǔn)確稱取10 g鮐魚,按料液比1∶6(g/mL)加入蒸餾水60 mL,調(diào)節(jié)pH值到7.0,分別在20、30、40、50、60 ℃條件的水浴鍋中保溫6 h,過濾,取濾液,濾渣重復(fù)提取2 次,將3 次濾液收集,利用考馬斯亮藍(lán)G-250法測(cè)定其水溶性蛋白提取率,進(jìn)行3 次平行試驗(yàn)。
1.3.6.3 提取時(shí)間對(duì)水溶性蛋白提取率的影響
準(zhǔn)確稱取10 g鮐魚,按料液比1∶6(g/mL)加入蒸餾水60 mL,調(diào)節(jié)pH值到7.0,在30℃條件的水浴鍋中,分別保溫2、4、6、8、10 h,過濾,取濾液,濾渣重復(fù)提取2 次,將3 次濾液收集,利用考馬斯亮藍(lán)G-250法測(cè)定其水溶性蛋白提取率,進(jìn)行3 次平行試驗(yàn)。
1.3.6.4 提取次數(shù)對(duì)水溶性蛋白提取率的影響
準(zhǔn)確稱取10 g鮐魚,按料液比1∶6(g/mL)加入蒸餾水,調(diào)節(jié)pH值到7.0,在30 ℃條件的水浴鍋中保溫6 h,過濾,取濾液,將濾渣分別進(jìn)行重復(fù)提取1、2、3、4、5 次,將重復(fù)提取的濾液進(jìn)行分別收集,利用考馬斯亮藍(lán)G-250法測(cè)定其水溶性蛋白提取率,進(jìn)行3 次平行試驗(yàn)。
1.3.7 響應(yīng)面試驗(yàn)
根據(jù)單因素試驗(yàn)結(jié)果顯示的提取過程中各因素最佳水平,選取料液比、提取時(shí)間、提取溫度3 個(gè)對(duì)水溶性蛋白提取率影響較大的因素,在最佳水平附近選擇3 個(gè)水平,采用三因素三水平共17 個(gè)試驗(yàn)點(diǎn)的響應(yīng)分析試驗(yàn),零點(diǎn)試驗(yàn)重復(fù)5 次,用以提高試驗(yàn)誤差估計(jì)的靈敏度和準(zhǔn)確度。采用Box-Behnken設(shè)計(jì)和響應(yīng)面分析法優(yōu)化水溶性蛋白的提取條件[28]。
1.3.8 鮐魚水溶性蛋白揮發(fā)性成分測(cè)定
1.3.8.1 固相微萃取(solid phase microextraction,SPME)
將65 μm PDMS/DVB萃取頭于50 ℃條件下老化30 min。取5.0 mL樣品液,于15 mL頂空瓶中,立即旋蓋封口并固定于恒溫水浴鍋中,在設(shè)定溫度條件下加熱平衡30 min后將SPME針管穿透隔墊插入頂空瓶中,調(diào)整并固定在頂空瓶中的位置,推出已老化好的萃取頭以頂空方式萃取30 min,再將萃取頭縮回針管內(nèi)并立即插入氣相色譜進(jìn)樣口中,解吸10 min后取出萃取裝置。
1.3.8.2 檢測(cè)條件
氣相色譜條件:色譜柱VF-5MS氣相毛細(xì)管柱(30 m×0.25 mm,0.25 μm);初始溫度40℃,保持1.5 min后,以5.0 ℃/min升至200 ℃,再以10 ℃/min升至300 ℃,保持5 min;分流進(jìn)樣,分流比1∶5,進(jìn)樣口溫度250 ℃;載氣為高純度氦氣(99.999%),流速1 mL/min。質(zhì)譜條件:電離源為電子轟擊離子源;離子阱溫度150 ℃;GC-MS傳輸線溫度280 ℃;電子轟擊離子源電子能量為70 eV;溶劑延遲時(shí)間2 min。
1.3.8.3 揮發(fā)性風(fēng)味物質(zhì)的鑒定
根據(jù)Willey譜圖庫對(duì)GC-MS分析鑒定的揮發(fā)性成分進(jìn)行解析,將所有分析數(shù)據(jù)通過計(jì)算機(jī)檢索,并與有關(guān)文獻(xiàn)比較,再結(jié)合保留時(shí)間、質(zhì)譜等參數(shù)和方法確定揮發(fā)性成分的化學(xué)組成。利用譜圖庫工作站數(shù)據(jù)處理系統(tǒng)按峰面積歸一化法,求得各化學(xué)成分在揮發(fā)性風(fēng)味物質(zhì)中的相對(duì)含量。
2 結(jié)果與分析
2.1 鮐魚水溶性蛋白營養(yǎng)成分分析
取鮐魚水溶液提取浸出物經(jīng)凍干后的樣品,對(duì)其進(jìn)行成分分析,結(jié)果表明:樣品水分含量為1.02%,灰分含量為5.20%,蛋白含量為75.06%,脂肪含量為4.60%,多糖含量為10.92%,粗纖維含量為3.20%。主要成分為蛋白,故以下簡(jiǎn)稱為水溶性蛋白,進(jìn)行成分分析得到水溶性蛋白經(jīng)凍干后,呈淡黃色或黃色粉末,蓬松柔軟,易吸濕,易溶于水,水溶液性質(zhì)穩(wěn)定,略有魚香味。
2.2 鮐魚水溶性蛋白的提取條件優(yōu)化
2.2.1 單因素試驗(yàn)結(jié)果
2.2.1.1 料液比對(duì)鮐魚水溶性蛋白提取率的影響
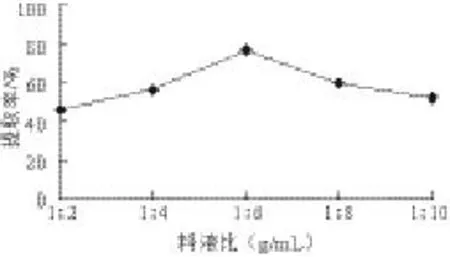
圖 1 料液比對(duì)鮐魚水溶性蛋白提取率的影響Fig.1 Effects of material-to-solvent ratio on the yield of water-soluble protein
由圖1可知,隨著溶劑用量增大,水溶性蛋白提取率也隨之增大;但在料液比1∶6之后,溶劑用量增加使提取率減小,溶劑用量過大會(huì)造成溶劑和能源的浪費(fèi),且會(huì)給濃縮過程帶來負(fù)擔(dān),所以確定料液比為1∶6。
2.2.1.2 提取溫度對(duì)鮐魚水溶性蛋白提取率的影響
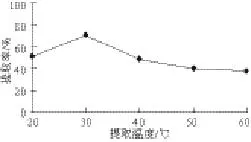
圖 2 提取溫度對(duì)鮐魚水溶性蛋白提取率的影響Fig.2 Effects of extraction temperature on the yield of water-soluble protein
提取溫度是影響提取效率的重要因素之一。隨著提取溫度的升高,鮐魚水溶性蛋白獲得相對(duì)高的提取率,原因可能是高溫溶劑容易促進(jìn)細(xì)胞壁上的多糖物質(zhì)分散到溶劑體系,弱化或者破環(huán)細(xì)胞壁的完整性,使得溶劑更加容易和水溶性蛋白接觸,從而提高提取率。但是溫度過高,提取率反而下降,可能是由于溫度過高,使得蛋白變性,因而提取率下降。
由圖2可知,隨著提取溫度的升高,蛋白提取率也隨之增大;但溫度升高到30 ℃之后,再繼續(xù)上升,水溶性蛋白提取率反而下降,這可能是由于蛋白的結(jié)構(gòu)被破壞,特別是水溶性蛋白中的活性蛋白。
2.2.1.3 提取時(shí)間對(duì)鮐魚水溶性蛋白提取率的影響
提取時(shí)間越長,溶劑越能夠充分滲透到鮐魚組織的各個(gè)部位,與蛋白物質(zhì)充分接觸并溶解,從而可以提高提取率,但是提取時(shí)間過長,可能會(huì)引起水溶性蛋白的變性。
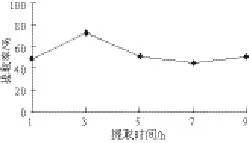
圖 3 提取時(shí)間對(duì)鮐魚水溶性蛋白提取率的影響Fig.3 Effects of extraction time on the yield of water-soluble protein
由圖3可知,隨著提取時(shí)間的延長,水溶性蛋白提取率不斷提高,但3 h之后,提取率呈現(xiàn)微下降趨勢(shì),因此確定提取時(shí)間為3 h。
2.2.1.4 提取次數(shù)對(duì)鮐魚水溶性蛋白提取率的影響
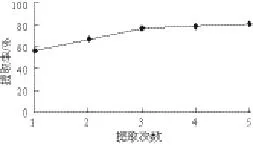
圖 4 提取次數(shù)對(duì)鮐魚水溶性蛋白提取率的影響Fig.4 Effects of extraction number on the yield of water-soluble protein
多次浸提可以提高鮐魚中水溶性蛋白的提取率。由圖4可知,水溶性蛋白提取率隨著提取次數(shù)的增加而增加,3 次浸提的蛋白提取率顯著高于2 次浸提的蛋白提取率,但4 次浸提的蛋白提取率與3 次浸提的蛋白提取率沒有明顯差異,故選用3 次浸提作為最終提取方案。
2.2.2 響應(yīng)面試驗(yàn)優(yōu)化鮐魚水溶性蛋白的提取條件
2.2.2.1 響應(yīng)面試驗(yàn)設(shè)計(jì)與結(jié)果
鮐魚水溶性蛋白的提取受到很多因素的影響,而且各個(gè)因素之間往往又相互影響相互作用,根據(jù)Box-Behnken試驗(yàn)設(shè)計(jì)原理,以3 個(gè)重要影響因素料液比(A)、提取溫度(B)、提取時(shí)間(C)為自變量,以水溶性蛋白提取率為響應(yīng)值,進(jìn)行三因素三水平試驗(yàn),將17個(gè)試驗(yàn)點(diǎn)的響應(yīng)值進(jìn)行回歸分析,響應(yīng)面分析試驗(yàn)設(shè)計(jì)與結(jié)果見表1。
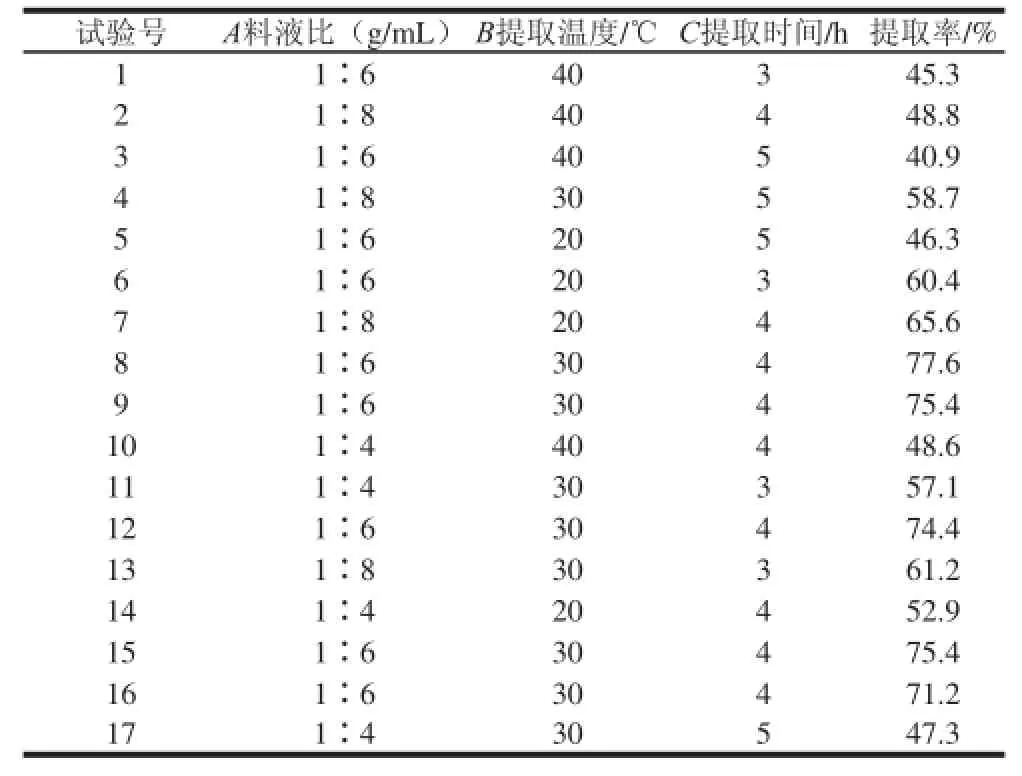
表 1 鮐魚水溶性蛋白提取響應(yīng)面分析方案及結(jié)果Table 1 Experimental scheme and results for reponse surface methodology
對(duì)試驗(yàn)結(jié)果進(jìn)行回歸分析,以鮐魚水溶性蛋白提取率為響應(yīng)值,經(jīng)回歸擬和后,各試驗(yàn)因素對(duì)響應(yīng)值的影響可通過如下回歸方程表示:提取率/%=74.80+3.55A-5.20B-3.85C-3.13AB+1.83AC+2.43BC-6.49A2-14.34B2-12.24C2。
2.2.2.2 模型方差分析
對(duì)模型進(jìn)行方差分析,用模型對(duì)水溶性蛋白提取率進(jìn)行分析和預(yù)測(cè),探討3 個(gè)因素對(duì)蛋白提取的影響,結(jié)果見表2。
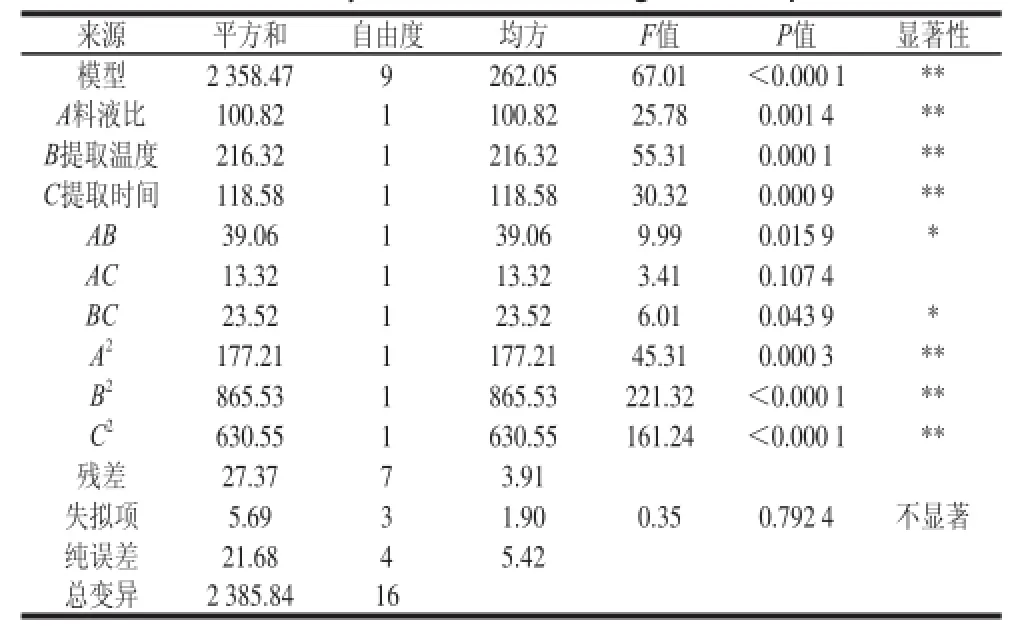
表 2 鮐魚水溶性蛋白提取回歸方程的方差分析結(jié)果Table 2 Analysis of variance of regression equation
由表2可知,對(duì)水溶性蛋白提取率所建立的回歸模型極顯著(P<0.01),失擬項(xiàng)不顯著(P>0.05),該模型的復(fù)相關(guān)系數(shù)R2為0.988 5,表明該模型與實(shí)際情況擬合較好。在所選的各因素水平范圍內(nèi),各因素對(duì)水溶性蛋白提取率的影響順序?yàn)椋禾崛囟龋咎崛r(shí)間>料液比。表2顯示,一次項(xiàng)A、B、C,二次項(xiàng)A2、B2、C2對(duì)水溶性蛋白提取率的影響極為顯著(P<0.01),交互項(xiàng)AB、BC對(duì)水溶性蛋白提取率的影響為顯著(P<0.05),交互項(xiàng)AC對(duì)水溶性蛋白提取率的影響不顯著。
2.2.2.3 鮐魚水溶性蛋白提取因素間的交互作用
響應(yīng)面分析見圖5~7。響應(yīng)面三維圖能直觀地反映出各因素對(duì)響應(yīng)值的影響程度及因素間交互作用的強(qiáng)弱。三維圖在平面上的投影即為等高線圖,等高線形狀反映了交互影響的強(qiáng)弱,圓形等高線表明兩因素的交互作用相對(duì)較弱;橢圓形等高線兩因素的交互作用相對(duì)較強(qiáng)[29]。
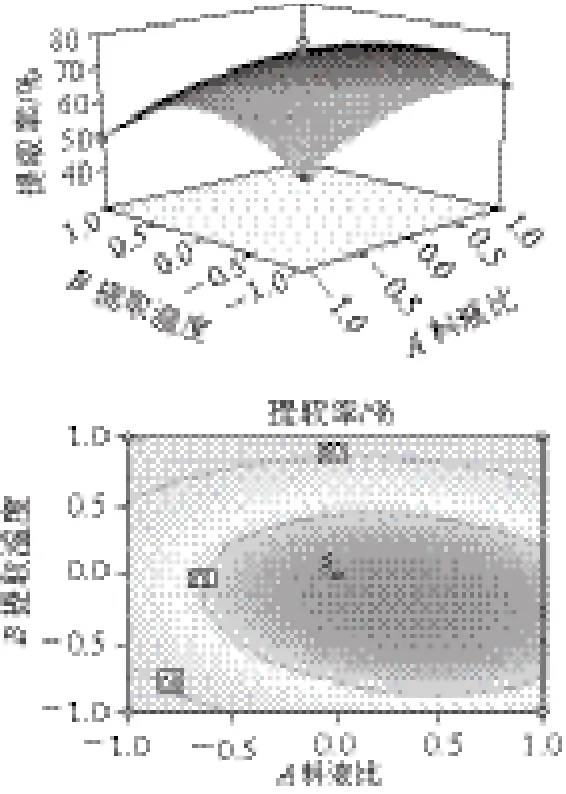
圖 5 料液比與提取溫度對(duì)鮐魚水溶性蛋白提取率的交互影響Fig.5 Effects of material-to-solvent ratio and extraction temperature on the yield of water-soluble protein
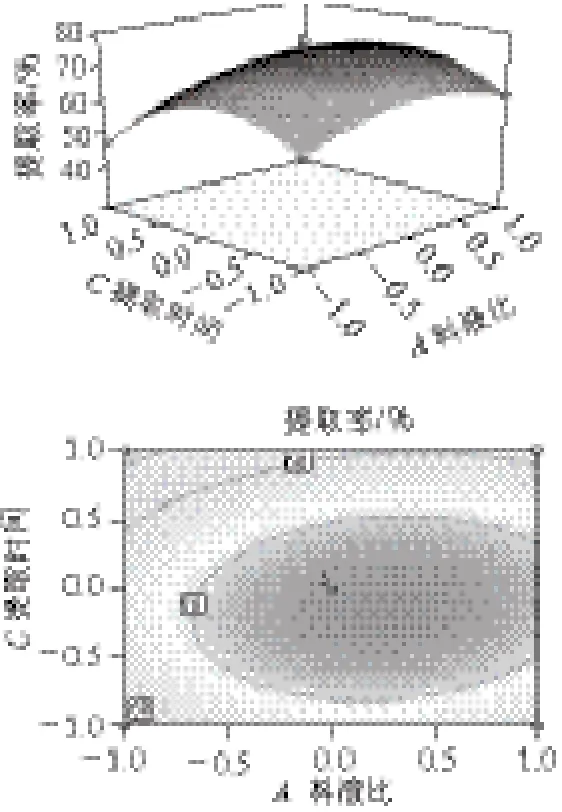
圖 6 料液比與提取時(shí)間對(duì)鮐魚水溶性蛋白提取率的交互影響Fig.6 Effects of material-to-solvent ratio and extraction time on the yield of water-soluble protein
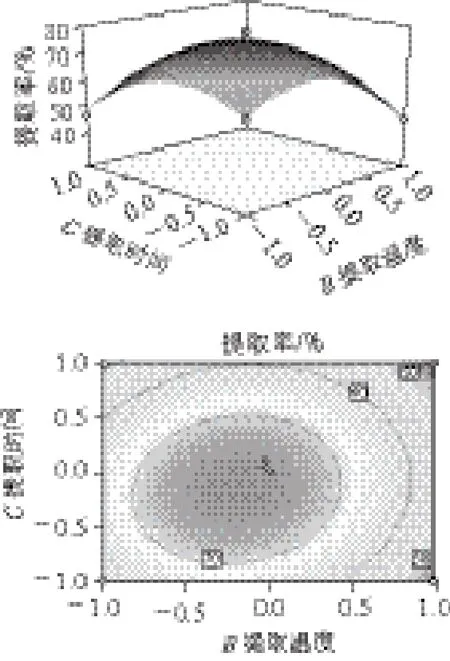
圖 7 提取時(shí)間與提取溫度對(duì)鮐魚水溶性蛋白提取率的交互影響Fig.7 Effects of extraction time and temperature on the yield of water-soluble protein
從圖5可以看出,當(dāng)料液比一定時(shí),提取溫度對(duì)鮐魚水溶性蛋白提取率的影響比較小,但是當(dāng)提取溫度一定時(shí),水溶性蛋白提取率隨溶劑用量的增大先增大后減少。從圖6可以看出,在料液比一定時(shí),隨著提取時(shí)間的延長,水溶性蛋白的提取率先是逐漸增大,當(dāng)達(dá)一定的提取時(shí)間時(shí),水溶性蛋白提取率又開始逐漸減小。但是當(dāng)提取時(shí)間一定時(shí),水溶性蛋白提取率隨溶劑用量的增大先升高后降低。從圖7可以看出,當(dāng)提取時(shí)間一定時(shí),提取溫度對(duì)鮐魚水溶性蛋白提取率的影響比較小。但當(dāng)提取溫度一定時(shí),隨著提取時(shí)間的延長水溶性蛋白提取率先增大后減小。分析其原因可能是由于蛋白變性,發(fā)生凝集,實(shí)驗(yàn)測(cè)得水溶性蛋白的量減少。
根據(jù)軟件分析結(jié)果結(jié)合實(shí)際得最優(yōu)化提取條件為料液比1∶6.612、提取溫度27.73℃、提取時(shí)間3.84 h,提取的水溶性蛋白提取率為76.24%。為了驗(yàn)證模型的有效性,固定提取條件在優(yōu)化條件下進(jìn)行驗(yàn)證實(shí)驗(yàn)。料液比1∶6.6、提取溫度27.7 ℃、提取時(shí)間3.8 h,實(shí)驗(yàn)結(jié)果顯示,水溶性蛋白提取率為76.12%。驗(yàn)證實(shí)驗(yàn)的實(shí)測(cè)值與預(yù)測(cè)值非常接近。
2.3 鮐魚水溶性蛋白揮發(fā)性成分分析
2.3.1 鮐魚水溶性蛋白揮發(fā)性成分的GC-MS總離子色譜圖
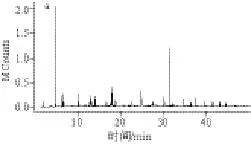
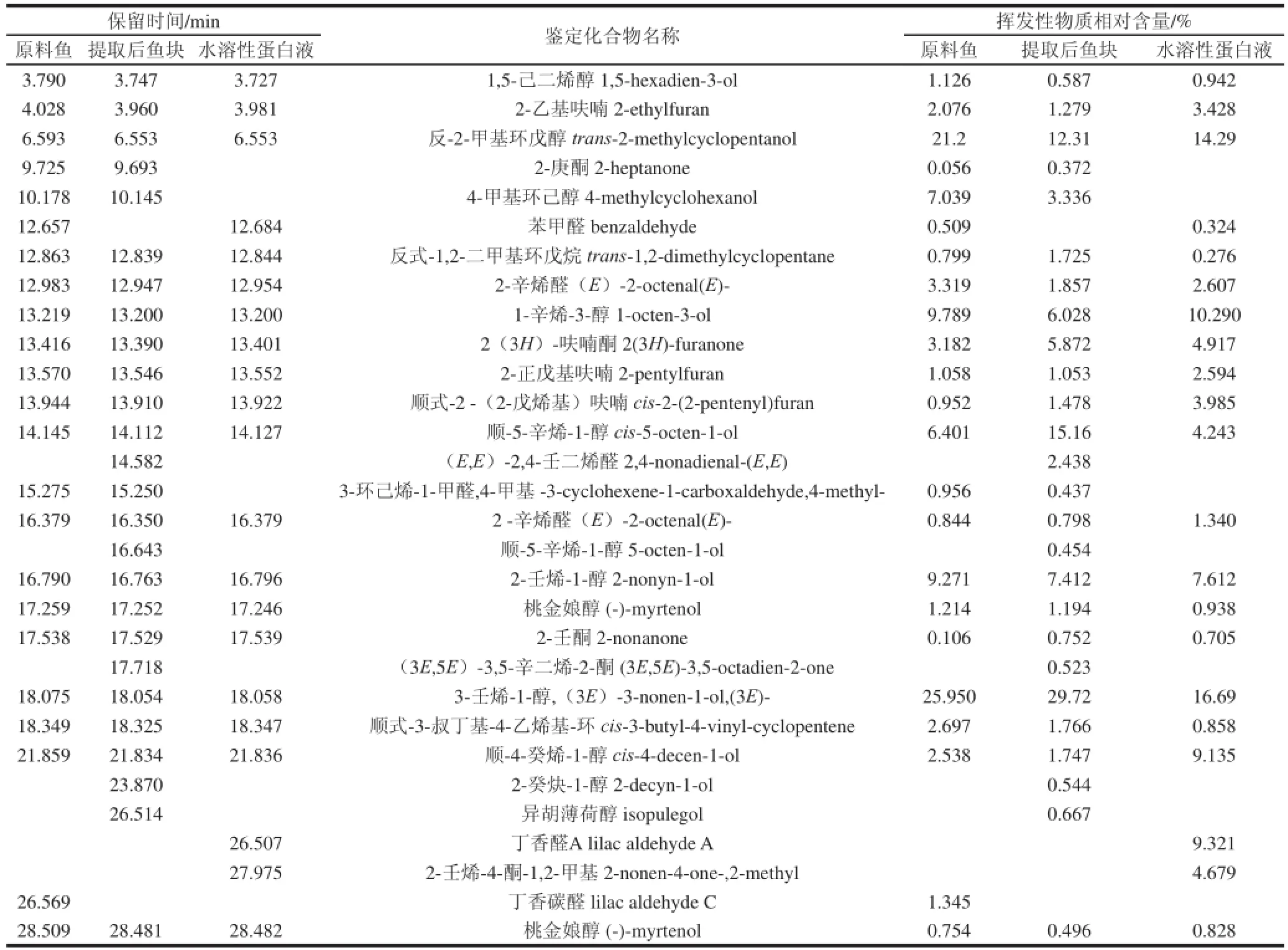
表 3 鮐魚水溶性蛋白的揮發(fā)性成分的GC-MS 分析Table 3 Volatile compounds identified from mackerel meat, water-soluble protein extract and extraction residue
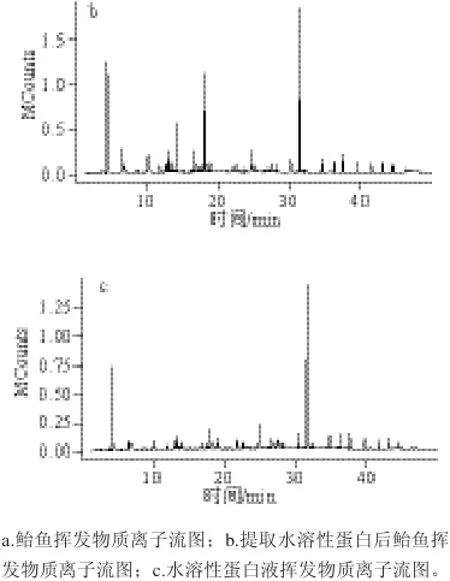
圖 8 鮐魚水溶解前后揮發(fā)性物質(zhì)的GC-MS分析總離子色譜圖Fig.8 GC-MS chromatograms of volatile compounds of mackerel meat, water-soluble protein extract and extraction residue
將鮐魚進(jìn)行水溶性蛋白提取,并分別對(duì)原料鮐魚、水溶性蛋白溶液、提取水溶性蛋白后的鮐魚魚塊進(jìn)行GC-MS分析,得到的總離子流色譜圖如圖8所示。
2.3.2 鮐魚水溶性蛋白的揮發(fā)性成分鑒定
對(duì)總離子色譜圖進(jìn)行分析表明,水溶解后的樣品揮發(fā)性成分發(fā)生了變化。通過計(jì)算機(jī)標(biāo)準(zhǔn)質(zhì)譜圖庫檢索、各組分的質(zhì)譜圖分析及與文獻(xiàn)報(bào)道的質(zhì)譜數(shù)據(jù)分析,并通過歸一化定量,其結(jié)果見表3。
表3結(jié)果表明,原料鮐魚在26.569 min產(chǎn)生的丁香碳醛,水溶解后不再含有。鮐魚原料中含有的苯甲醛進(jìn)入溶液中,水溶解后的鮐魚魚肉中也不再含有;而且,在14.582 min產(chǎn)生了(E,E)-2,4-壬二烯醛。16.643 min產(chǎn)生了順-5-辛烯-1-醇。17.718 min產(chǎn)生了(3E,5E)-3,5-辛二烯-2-酮。23.870 min產(chǎn)生了2-癸炔-1-醇。26.514 min產(chǎn)生了異胡薄荷醇。水溶解后的溶液中產(chǎn)生了2 種新物質(zhì),分別是在26.507 min產(chǎn)生了丁香醛A,在27.975 min產(chǎn)生了2-壬烯-4-酮-1,2-甲基。
原料鮐魚共含有23 種揮發(fā)性成分,其中醇類有10 種,醛類有5 種,呋喃類3 種,酮類占3 種,烷烴、芳香烴各1 種,相對(duì)含量分別為醇類占85.28%,醛類含量占6.97%,呋喃含量占4.09%,酮類含量占0.16%,烷烴、芳香烴含量占3.50%。
提取水溶性蛋白后的鮐魚魚塊含揮發(fā)性成分26 種,其中主要的揮發(fā)性風(fēng)味物質(zhì)仍為醇類,共含有13種,另外,還含有酮類4 種,醛類4 種,呋喃3 種,烷烴、芳香烴2 種,新產(chǎn)生3 種醇類,1 種酮類,1 種醛類。醇類含量有所下降,為79.65%,酮類含量有了提高,為7.52%,呋喃類、醛類、烴類含量都沒有明顯變化,分別為3.81%,醛類為5.53%,烷烴、芳香烴為3.49%。
水溶性蛋白溶液中揮發(fā)性成分物質(zhì)種類較少,為21 種,其中醇類9 種,醛類4 種,呋喃3 種,酮類3 種,烷烴、芳香烴各1 種。含量醇類為64.97%,醛類為13.59%,呋喃類為10.00%,酮類為10.30%,烷烴、芳香烴為1.14%。
3 結(jié) 論
鮐魚水溶性蛋白的最佳提取工藝條件為料液比1∶6.6、提取溫度27.7 ℃、提取時(shí)間3.8 h,提取的水溶性蛋白提取率為76.12%。將鮐魚原料和水溶解后樣品的揮發(fā)性成分進(jìn)行分析,結(jié)果表明,水溶性蛋白揮發(fā)性成分醇類物質(zhì)含量降低,酮類、醛類、呋喃類物質(zhì)含量都有了明顯提高。樣品經(jīng)過冷凍干燥后,呈淡黃色或黃色粉末,蓬松柔軟,易吸濕,易溶于水,水溶液性質(zhì)穩(wěn)定,略有魚香味。
[1] 王曉龍. 鮐魚魚油提取精制及抗氧化活性研究[D]. 舟山: 浙江海洋學(xué)院, 2014.
[2] 鄭平安, 孫靜, 全晶晶, 等. 貯藏溫度對(duì)鮐魚品質(zhì)的影響研究[J]. 核農(nóng)學(xué)報(bào), 2013, 27(1): 75-80.
[3] 王雪芹, 邢榮娥, 劉松, 等. 鮐魚蛋白酶解工藝優(yōu)化及酶解物的抗氧化活性測(cè)定[J]. 現(xiàn)代食品科技, 2013, 29(5): 1023-1028.
[4] 歐陽杰, 蔡淑君, 林蔚, 等. 鮐魚與魚糜脫脂方法的篩選研究[J]. 食品工業(yè)科技, 2011, 32(2): 211-216.
[5] 歐陽杰, 蔡淑君, 林蔚, 等. 多脂紅身魚魚糜脫脂方法的對(duì)比實(shí)驗(yàn)研究[J]. 食品科學(xué), 2009, 30(24): 179-182.
[6] 鄭平安. 鮐魚儲(chǔ)藏期品質(zhì)的變化及加工過程中風(fēng)味的研究[D]. 寧波: 寧波大學(xué), 2013.
[7] TSYBINA T A, DUNAEVSKY Y E, BELOZERSKY M A, et al. Digestive proteinases of yellow mealworm (Tenebrio molitor) larvae: purification and characterization of a trypsin-like proteinase[J]. Biochemistry (Moscow), 2005, 3(3): 300-305.
[8] KUMAR N S S, NAZEER R A. Functional properties of protein hydrolysates from different body parts of horse mackerel (Magalaspis cordyla) and croaker (Otolithes ruber)[J]. Mediterranean Journal of Nutrition and Metabolism, 2012, 5(2): 111.
[9] 曹萬新, 孟橘, 田玉霞. DHA的生理功能及應(yīng)用研究進(jìn)展[J]. 中國油脂, 2011, 36(3): 1-4.
[10] 施亞芳. 魚糜漂洗液蛋白質(zhì)回收研究[D]. 杭州: 浙江大學(xué), 2012.
[11] 逯慎杰, 梅術(shù)文, 劉秀河, 等. 魚糜廢水中蛋白質(zhì)等電沉淀的規(guī)律研究[J]. 食品工業(yè)科技, 2012, 33(18): 93-95.
[12] 衛(wèi)生部. GB 19301—2010 食品安全國家標(biāo)準(zhǔn): 生乳[S]. 北京: 中國標(biāo)準(zhǔn)出版社, 2010.
[13] 吳正奇, 李佳文, 石勇, 等. 淡水魚糜漂洗水中水溶性蛋白質(zhì)回收的研究[J]. 食品工業(yè), 2011, 32(1): 81-84.
[14] 李鵬. 漂洗次數(shù)對(duì)鯰魚魚糜品質(zhì)的影響及漂洗液中肌漿蛋白的回收與利用[D]. 天津: 天津農(nóng)學(xué)院, 2014.
[15] 徐明生, 陳錦屏, 上官新晨. 鯉魚抗菌精蛋白的分離純化及鑒定[J].食品工業(yè)科技, 2004, 25(10): 51-54.
[16] 張宗恩, 楊波. 用三氯化鐵回收魚糜漂洗液中的水溶性蛋白[J]. 水產(chǎn)科技情報(bào), 1997(5): 207-209.
[17] 徐律, 楊津生, 丁迎燕, 等. 魚糜漂洗水中蛋白質(zhì)的提取研究[J]. 飼料工業(yè), 2010, 31(16): 38-41.
[18] 許燕順, 高琪, 姜啟興, 等. 鰱魚糜漂洗液中蛋白質(zhì)分析與回收[J].食品與機(jī)械, 2012, 28(6): 89-92.
[19] 陳建旭. 靈芝水溶性蛋白與堿溶性多糖的提取和抗氧化性研究及靈芝漿的研制[D]. 廣州: 華南理工大學(xué), 2010.
[20] 衛(wèi)生部. GB 5009.3—2010 食品中水分的測(cè)定[S]. 北京: 中國標(biāo)準(zhǔn)出版社, 2010.
[21] 衛(wèi)生部. GB 5009.4—2010 食品中灰分的測(cè)定[S]. 北京: 中國標(biāo)準(zhǔn)出版社, 2010.
[22] 衛(wèi)生部. GB 5009.5—2010 食品中蛋白質(zhì)的測(cè)定[S]. 北京: 中國標(biāo)準(zhǔn)出版社, 2010.
[23] 衛(wèi)生部. GB 5009.6—2010 食品中脂肪的測(cè)定[S]. 北京: 中國標(biāo)準(zhǔn)出版社, 2010.
[24] IMAM H, LIAN S, KASIMU R, et al. Extraction of an antidiabetic polysaccharide from seeds of Ocimum basilicum and determination of the monosaccharide composition by precolumn high-efficiency capillary electrophoresisa[J]. Chemistry of Natural Compounds, 2012, 48(4): 653-654.
[25] 衛(wèi)生部. GB/T 5009.10—2003 植物類食品中粗纖維的測(cè)定[S]. 北京: 中國標(biāo)準(zhǔn)出版社, 2003.
[26] 陳毓荃. 生物化學(xué)實(shí)驗(yàn)方法和技術(shù)[M]. 北京: 科學(xué)出版社, 2002.
[27] 穆華榮. 食品分析[M]. 2版. 北京: 化學(xué)工業(yè)出版社, 2009: 221-223.
[28] REDDY L V A, JOSHI V K, REDDY O V S. Utilization of tropical fruits for wine production with special emphasis on mango (Mangifera indica L.) wine[J]. Microorganisms in Sustainable Agriculture and Biotechnology, 2012, 13: 679-710.
[29] 王梅英, 陳慧斌, 陳軍. 響應(yīng)面法優(yōu)化超聲波輔助提取巖茶總黃酮工藝研究[J]. 食品工業(yè)科技, 2011, 32(12): 327-330.
Extraction and Volatile Components of Mackerel Water-Soluble Proteins
ZHOU Jiaping1, ZHANG Wentao2, MENG Meng2, WANG Yuemeng2, LIU Anjun2, ZHENG Jie2
(1. Research Center for Modern Analysis Techniques, Tianjin University of Science and Technology, Tianjin 300457, China;2. College of Food and Biotechnology, Tianjin University of Science and Te chnology, Tianjin 300457, China)
By using a combination of one-factor-at-a-time method and response surface methodology, the optimal conditions for the extraction of water-soluble proteins from mackerel meat were determined as solid-liquid ratio of 1:6.6, extraction temperature of 27.7 ℃, and extraction time of 3.8 h. Experiments conducted under these conditions led to an extraction yield of 76.12%. Solid phase microextraction combined with GC-MS was used to analyze the volatile components of mackerel meat and the protein extract. The results showed that the content of alcohols decreased, whereas the contents of ketones, aldehydes, and furans in the extract markedly increased as compared to mackerel meat. The water-soluble proteins after freeze-drying were light yellow or yellow, fluffy and soft, could easily absorb moisture, and had good solubility and stability in water with a slight fishy flavor.
mackerel; water-soluble proteins; gas chromatography-mass spectrometry (GC-MS)
TS254
A
1002-6630(2015)08-0012-07
10.7506/spkx1002-6630-201508003
2014-07-03
國家自然科學(xué)基金青年科學(xué)基金項(xiàng)目(30471225);國家高技術(shù)研究發(fā)展計(jì)劃(863計(jì)劃)項(xiàng)目(2013AA102204)
周家萍(1987—),女,助理實(shí)驗(yàn)師,碩士,研究方向?yàn)闋I養(yǎng)與食品衛(wèi)生。E-mail:zhoujiaping@tust.edu.cn

