單環(huán)刺螠體壁多糖的分離純化、理化性質(zhì)及抗脂質(zhì)過氧化活性
朱佳利,陳依莎,牛慶鳳,李 濤,陳 蔭*
單環(huán)刺螠體壁多糖的分離純化、理化性質(zhì)及抗脂質(zhì)過氧化活性
朱佳利,陳依莎,牛慶鳳,李 濤,陳 蔭*
(浙江海洋學(xué)院食品與醫(yī)藥學(xué)院,浙江 舟山 316022)
為研究和開發(fā)單環(huán)刺螠中活性多糖成分,采用酶法提取和色譜分離技術(shù),從單環(huán)刺螠的體壁中提取分離 多糖組分,采用化學(xué)和儀器分析方法對其單糖組成、分子質(zhì)量等理化性質(zhì)進(jìn)行研究,并通過體外清除脂質(zhì)過氧化物實(shí)驗(yàn)對其進(jìn)行初步的活性評價(jià)。結(jié)果表明:采用木瓜蛋白酶和胰蛋白酶兩步酶解后,單環(huán)刺螠多糖(unicinctus polysaccharide,UP)得率為5.3%。通過離子交換柱層析分離純化后主要得到兩個(gè)組分UP-1和UP-2。UP-1是主要由葡萄糖(Glc)組成的高聚葡聚糖,分子質(zhì)量340 kD,而UP-2為組成復(fù)雜的類糖胺聚糖,分子質(zhì)量約為7.9 kD,主要含有葡萄糖(Glc)、半乳糖(Gal)、氨基葡萄糖(GlcN)和巖藻糖(Fuc),還含有少量的甘露糖(Man)和氨基半乳糖(GalN)。其單糖組成Man、GlcN、GalN、Glc、Gal、Fuc物質(zhì)的量比例為1.0∶1.47∶0.64∶6.49∶2.5∶3.0。和其他海洋動(dòng)物來源類糖胺聚糖類似,UP-2還含有少量的硫酸基,含量為7.4%。對UP-1和UP-2進(jìn)行初步體外抗氧化活性研究表明,類糖胺聚糖UP-2具有顯著的脂質(zhì)過氧化物清除活性,半數(shù)清除質(zhì)量濃度為5.0 mg/mL。
單環(huán)刺螠;多糖;分離純化;理化性質(zhì);抗氧化
單環(huán)刺螠(U rechis unicinctus)為螠蟲動(dòng)物門螠綱無管螠目刺螠科動(dòng)物,是無管螠目在我國沿海分布的唯一種類,俗稱“海腸子”。單環(huán)刺螠個(gè)體肥大,肉味鮮美,體壁肌富含蛋白質(zhì)和多種人體必需氨基酸,經(jīng)常食用海腸能夠起到溫補(bǔ)肝腎、壯陽固精的作用。自古以來,我國、日本和朝鮮沿海地區(qū)的居民均將單環(huán)刺螠作為名貴的海鮮食品,有較高的經(jīng)濟(jì)價(jià)值。膠東地區(qū)是我國單環(huán)刺螠的最大產(chǎn)地,是一種極有養(yǎng)殖開發(fā)前景的海洋動(dòng)物資源[1]。
研究[2-4]表明:單環(huán)刺螠體內(nèi)含有多種生物活性肽,如纖溶酶、速激肽和其他的一些多肽類,具有一定的抗腫瘤及提高小鼠免疫功能及抗血栓的活性。因此作為一種研究海洋生物活性物質(zhì)的良好材料,開展針對單環(huán)刺螠活性物質(zhì)的研究,對開發(fā)海洋藥用生物資源,促進(jìn)其養(yǎng)殖產(chǎn)業(yè)的發(fā)展和提高經(jīng)濟(jì)產(chǎn)值起到積極的推動(dòng)作用。單環(huán)刺螠由于其豐富的營養(yǎng)價(jià)值又被人們稱為“裸體海參”,而海參多糖是海參中重要的活性成分,多糖也是很多海洋動(dòng)物中的主要的活性物質(zhì),具有多種生物活性。本實(shí)驗(yàn)對單環(huán)刺螠體壁中的多糖進(jìn)行提取分離純化和理化性質(zhì)研究,為其多糖類活性物質(zhì)的開發(fā)提供重要參考。
1 材料與方法
1.1 材料與試劑
單環(huán)刺螠購于青島齊東路水產(chǎn)市場,由浙江海洋學(xué)院趙盛龍教授鑒定確認(rèn)。
單糖標(biāo)準(zhǔn)品、牛血清蛋白標(biāo)準(zhǔn)品 美國Sigma公司;不同分子質(zhì)量葡聚糖標(biāo)準(zhǔn)品 美國Fluka公司;Folin-酚乙液、重蒸酚 北京鼎國生物工程公司;95%乙醇、丙酮、濃硫酸、咔唑、四硼酸鈉、對二甲氨基苯甲醛、1-苯基-3-甲基-5-吡唑啉酮(1-phenyl-3-methyl-5-pyrazolone,PMP)、酒石酸鉀鈉、碳酸鈉、硫酸銅、硫酸鉀、硫酸鈉、三氟乙酸、溴化鉀、硫代巴比妥酸、乙酰丙酮等均為分析純 國藥集團(tuán)化學(xué)試劑有限公司。
1.2 儀器與設(shè)備
TD5K低速大容量離心機(jī) 長沙東旺實(shí)驗(yàn)儀器有限公司;HH-1型恒溫水浴鍋 國華電器有限公司;UV-1100型紫外-可見分光光度計(jì) 上海美譜達(dá)儀器有限公司;AKTA FPLC快速蛋白質(zhì)液相色譜儀 瑞典Pharmacia Biotech公司;1260高效液相色譜儀 美國Agilent公司;Nicolet 5700傅里葉紅外光譜儀 美國Thermo Nicolet公司;FD-1000真空冷凍干燥機(jī)、旋轉(zhuǎn)蒸發(fā)儀 上海愛朗儀器有限公司;Model 818數(shù)字pH計(jì)上海奧立龍公司;FD-1C-50冷凍干燥機(jī) 北京博醫(yī)康實(shí)驗(yàn)儀器有限公司。
1.3 方法
1.3.1 單環(huán)刺螠體壁多糖的提取[5]
單環(huán)刺螠從一端剪開后棄掉體腔液和內(nèi)臟并用清水洗凈,剪碎后勻漿。丙酮攪拌脫脂過夜,離心棄去上清液,沉淀40 ℃烘干過夜后粉碎。取單環(huán)刺螠體壁粉按1∶20(g/mL)加入蒸餾水,并調(diào)節(jié)pH 8~9于80 ℃堿化12 h,然后調(diào)節(jié)pH 6.8,加入質(zhì)量分?jǐn)?shù)1%木瓜蛋白酶在60 ℃水浴中消化4 h,接著采用胰蛋白酶水解3 h、提取溫度60 ℃、pH 10、加酶量0.5%(質(zhì)量分?jǐn)?shù))。提取完成后調(diào)pH值至中性后100 ℃水浴加熱15 min滅酶。兩步酶解以保證多糖分子充分的釋放和溶解。在離心機(jī)中4 500 r/min離心20 min后取上清液,減壓濃縮至原體積的1/20后,使用95%乙醇沉淀多糖,使乙醇終體積分?jǐn)?shù)約為80%,于4 ℃冰箱中放置過夜。離心后獲得的多糖重新溶解后采用截留相對分子質(zhì)量為3 500的透析袋于純水中連續(xù)透析2 d后濃縮后冷凍干燥。采用Seveg法除蛋白后得到單環(huán)刺螠多糖(unicinctus polysaccharide,UP)。
1.3.2 單環(huán)刺螠體壁多糖的分離純化
將粗多糖溶于少量蒸餾水中,配制成50 mg/mL多糖溶液,在AKTA FPLC快速蛋白純化系統(tǒng)上,采用陰離子交換柱Q Sepharose Fast Flow柱(2.6 cm×50.0 cm)以0~2 mol/L的NaCl溶液線性洗脫,根據(jù)線性洗脫結(jié)果確定梯度洗脫的條件,自動(dòng)部分收集(每管收集7 mL)后以苯酚-硫酸法檢測各梯度中多糖組分的位置,分別收集相應(yīng)梯度的多糖組分,透析脫鹽后濃縮凍干得純化后多糖樣品。
1.3.3 單環(huán)刺螠體壁多糖的單糖組成分析
海洋動(dòng)物多糖中一般單糖組成比較復(fù)雜,本實(shí)驗(yàn)采用完全酸水解后PMP柱前衍生高效液相色譜法分析其單糖組成。采用PMP衍生化方法[6],對等濃度配制的單糖標(biāo)準(zhǔn)品和各多糖全水解后產(chǎn)物進(jìn)行PMP衍生,然后進(jìn)行液相色譜分析。色譜條件為:Agilent XDB-C18色譜柱;柱溫:35 ℃;流動(dòng)相:磷酸鹽緩沖液(pH6.7)-CH3CN(83∶17,V/V);流速:1.0 mL/min;檢測器:二極管陣列檢測器(diode array detector,DAD)(245 nm)。
1.3.4 單環(huán)刺螠體壁多糖的分子質(zhì)量分布
采用高效凝膠滲透色譜法[7]分析單環(huán)刺螠多糖的純度及分子質(zhì)量范圍,色譜條件:色譜柱:Shodex Ohpak SB-804HQ凝膠色譜柱(300 mm×7.8 mm);柱溫:35℃;流動(dòng)相:0.1 mol/L的Na2SO4溶液;流速:0.5 mL/min;檢測器:示差檢測器(refractive index detector,RID)。
1.3.5 單環(huán)刺螠體壁多糖的理化性質(zhì)研究
以葡萄糖為標(biāo)準(zhǔn)品,采用硫酸-苯酚法測定總糖含量[8]。以牛血清蛋白為標(biāo)準(zhǔn)品,采用Folin-酚法測定蛋白含量[9]。以葡萄糖醛酸作為標(biāo)準(zhǔn)品,采用咔唑-硫酸法測定糖醛酸含量[10]。以硫酸鉀為標(biāo)準(zhǔn)品,采用氯化鋇-明膠比濁法測定硫酸根含量[11]。采用Elson-Morgan法,以氨基葡萄糖為標(biāo)準(zhǔn)測定氨基糖含量[12]。
1.3.6 單環(huán)刺螠體壁多糖的紅外光譜分析
采用KBr壓片法,將約為0.1 mg多糖樣品與適量干燥溴化鉀粉末研磨混合均勻后,研制成透明薄片在Nicolet Nexus 470型紅外光譜進(jìn)行測定。紅外光譜儀測定參數(shù):背景掃描次數(shù)32次;掃描范圍400~4 000 cm-1;分辨率4.0 cm-1;檢測器:氘化三甘氨酸硫酸酯檢測器(deuterated triglycine sulfate detector detector,DTGS)[13]。
1.3.7 抗脂質(zhì)過氧化活性分析
用0.1 mol/L pH 7.45的磷酸鹽緩沖液(phosphate buffered saline,PBS)配制卵黃懸液(V(卵黃)∶V(PBS) = 1∶25),吸取卵黃懸液0.4 mL,在試管中分別加入不同質(zhì)量濃度(0、2、4、6、8、10 mg/mL)的被測溶液1.0 mL,再加入0.4 mL 25 mmol/L的硫酸亞鐵,用0.1 mol/L pH 7.45的PBS補(bǔ)充至4 mL,37 ℃水浴恒溫振蕩器中振蕩15 min,取出后加入1.0 mL 20%的三氯乙酸靜置10 min,3 500 r/min離心10 min,吸取4 mL上清液加入2 mL 0.8%的硫代巴比妥酸,加塞,放入沸水浴中15 min,冷卻后,以空白管(6 mL PBS代替)調(diào)零,532 nm波長處比色測定吸光度;不加樣品管的吸光度A0,樣品管的吸光度A,以2,6-二叔丁基-4-甲基苯酚(butylated hydroxytoluene,BHT)作為陽性對照,樣品抗氧化活性用對卵黃脂蛋白脂質(zhì)過氧化的抑制率表示[14],即:

式中:I為抑制率/%;A0為對照管的吸光度;A為樣品的吸光度。
2 結(jié)果與分析
2.1 單環(huán)刺螠體壁多糖的提取與分離純化
動(dòng)物中含有豐富的蛋白質(zhì),很多動(dòng)物多糖和蛋白質(zhì)通過共價(jià)鍵相連接,蛋白酶水解法和堿水解是目前動(dòng)物多糖提取過程中使蛋白質(zhì)和聚糖分離廣泛應(yīng)用的兩種方法。堿提多糖是基于蛋白多糖中的糖肽鍵對堿的不穩(wěn)定性,但也存在部分糖苷鍵降解的問題,濃度不易過大。為保證多糖成分充分的釋放本實(shí)驗(yàn)采用稀堿水解后木瓜蛋白酶和胰蛋白酶進(jìn)一步酶解,以除掉其結(jié)合蛋白,并進(jìn)一步使用Seveg法去除游離的蛋白,最終多糖的得率為5.3%(基于烘干后原料)。
根據(jù)多糖的電荷分布不同,采用陰離子交換柱層析對單環(huán)刺螠體壁粗多糖進(jìn)行分離純化。根據(jù)線性洗脫選擇梯度洗脫條件,最終確定以純水和0.25 mol/L NaCl溶液進(jìn)行梯度洗脫(圖1),苯酚-硫酸檢測后分別按峰收集,濃縮透析除鹽,凍干得到水洗、0.25 mol/L洗脫組分,水洗組分為白色粉末狀,鹽洗組分為淡黃色粉末,分別命名為UP-1和UP-2,二者得率分別為45%和30%(基于粗多糖)。
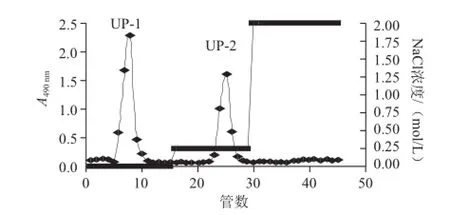
圖 1 單環(huán)刺螠粗多糖在Q Sepharose Fast Flow柱上的梯度洗脫圖Fig.1 Gradient elution profile of the crude polysaccharides on Q sepharose fast flow column
2.2 單環(huán)刺螠體壁多糖的單糖組成分析
對單環(huán)刺螠體壁多糖水洗組分UP-1和鹽洗組分UP-2進(jìn)行單糖組成分析表明,二者的單糖組成存在很大差異(圖2)。UP-1單糖組成為葡萄糖(Glc),表明UP-1為一種葡聚糖。而UP-2單糖組成較為復(fù)雜,主要含有葡萄糖(Glc),以及半乳糖(Gal)、氨基葡萄糖(GlcN)、巖藻糖(Fuc)和少量的甘露糖(Man)、氨基半乳糖(GalN)。從單糖組成可以看出UP-2為組成復(fù)雜的類糖胺聚糖,其單糖組成Man、GlcN、GalN、Glc、Gal、Fuc物質(zhì)的量比例為1∶1.47∶0.64∶6.49∶2.5∶3.0。
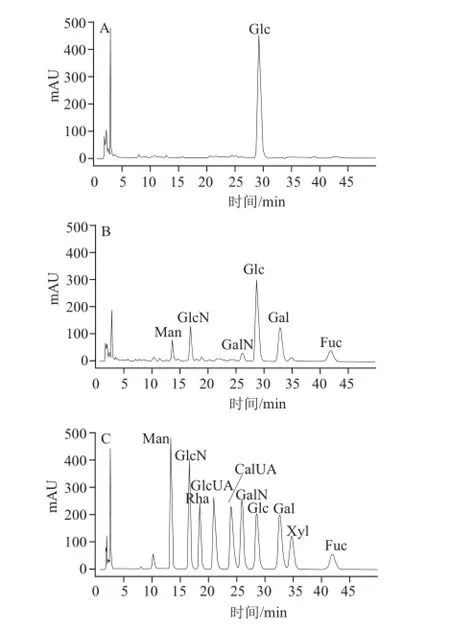
圖 2 PMP柱前衍生UP-1(A)、UP-2(B)和10 種單糖標(biāo)準(zhǔn)品(C)高效液相色譜圖Fig.2 HPLC chromatograms of UP-1 (A), UP-2 (B) and mixture of ten monosaccharide standards (C) using pre-column derivatization with 1-phenyl-3-methyl-5-pyrazolone (PMP)
2.3 體壁多糖的分子質(zhì)量分析
對離子交換柱層析純化組分UP-1和UP-2進(jìn)行純度和分子質(zhì)量分析。如圖3所示,經(jīng)過純化后UP-1和UP-2純度較高,特別是UP-2呈現(xiàn)單一對稱峰。二者在相對分子質(zhì)量上也存在很大差異,UP-1分子質(zhì)量約為340 kD,而UP-2分子質(zhì)量約為7.9 kD。
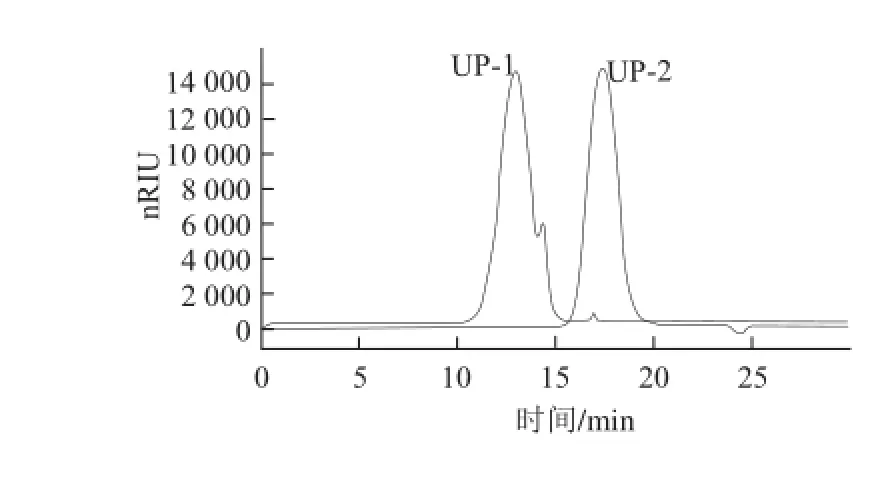
圖 3 UP-1和UP-2的高效凝膠滲透色譜圖Fig.3 HPGPC chromatograms of UP-1 and UP-2
2.4 單環(huán)刺螠體壁多糖的理化性質(zhì)分析
多糖的理化性質(zhì)為多糖進(jìn)一步的結(jié)構(gòu)鑒定和活性篩選提供重要的參考價(jià)值。通過紫外分光光度法對UP-1和UP-2的理化性質(zhì)進(jìn)行比較分析。UP-1總糖含量較高94.7%,不含有蛋白和硫酸基。UP-2總糖含量為67%,可能是由于氨基糖在硫酸-苯酚反應(yīng)中不顯色及其他單糖對顯色反應(yīng)的干擾造成了誤差[15]。UP-2含有3%左右的蛋白,16%的氨基糖,另外,和很多其他來源的海洋類糖胺聚糖一樣,UP-2含有少量的硫酸基取代,含量為7.4%。
2.5 單環(huán)刺螠體壁多糖的紅外光譜分析

圖 4 UP-1和UP-2的紅外光譜Fig.4 IR spectra of UP-1 and UP-2
對UP-1和UP-2的紅外光譜進(jìn)行比較分析(圖4)可知,二者的結(jié)構(gòu)存在很大差異。UP-1的紅外光譜是典型的多糖紅外光譜。3 405 cm-1處的信號為多糖OH的伸縮振動(dòng)吸收峰;在2 930 cm-1附近處的信號為糖環(huán)上的次甲基和亞甲基中的C—H伸縮振動(dòng)的吸收峰;1 021、1 085 cm-1和1 160 cm-1處的吸收信號為C—O和C—O—C的伸縮振動(dòng),三者的同時(shí)存在表征了吡喃糖環(huán)的伸縮振動(dòng)峰;850 cm-1處的吸收表明糖基中存在α構(gòu)型;932 cm-1處的吸收表明UP-1的葡聚糖為D-構(gòu)型;1 640 cm-1處的吸收為多糖類物質(zhì)常見的微量水分締合羥基造成。由此可以初步推測UP-1主要由α-D-吡喃葡萄糖構(gòu)成。而UP-2在3 400 cm-1附近有更強(qiáng)的吸收,示意除了O—H的伸縮振動(dòng)外還有氨基N—H的伸縮振動(dòng);1 651 cm-1和1 400 cm-1的強(qiáng)和中強(qiáng)吸收,分別是C=O的對稱伸縮振動(dòng)和非對稱伸縮振動(dòng),表明UP-2中羰基的存在,最有可能為乙酰基的羰基,推測UP-2中存在乙酰基取代。1 540 cm-1為N—H的彎曲振動(dòng);在1 239 cm-1處有弱的吸收,示意O—SO3—的S=O 鍵伸縮振動(dòng),進(jìn)一步表明UP-2中存在硫酸基的取代。綜合以上分析可知,UP-2為部分硫酸取代的富含氨基的雜多糖,可能存在乙酰基取代[13,16]。
2.6 單環(huán)刺螠體壁多糖的抗脂質(zhì)過氧化作用
糖胺聚糖是很多海洋生物如海參、扇貝的重要活性成分,具有廣泛的生物活性,而調(diào)節(jié)血脂是其重要的活性之一。研究表明海洋糖胺聚糖能夠有效地降低脂質(zhì)過氧化物的產(chǎn)生,通過自由基的清除達(dá)到調(diào)節(jié)心血管并延緩衰老的作用[17]。為快速表征單環(huán)刺螠體壁多糖對脂質(zhì)過氧化物的清除作用,采用體外抗脂質(zhì)過氧化模型對其清除自由基活性進(jìn)行評價(jià)。如圖5所示,通過對比分析,體壁多糖中的類糖胺聚糖成分UP-2和UP-1相比,體現(xiàn)出良好的體外抗脂質(zhì)過氧化活性,在10 mg/mL時(shí)對自由基的清除率超過80%,其半數(shù)清除質(zhì)量濃度為5.0 mg/mL。表明單環(huán)刺螠體壁多糖存在較好的脂質(zhì)過氧化物清除作用,而類糖胺聚糖的活性要優(yōu)于葡聚糖,推測類糖胺聚糖是單環(huán)刺螠體壁多糖的主要活性成分,其生物活性有待進(jìn)一步深入開發(fā)。
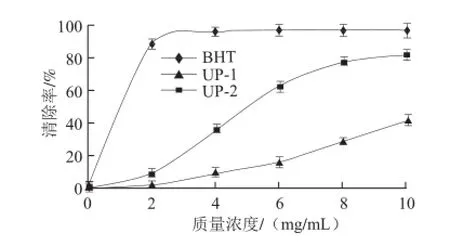
圖 5 UP-1和UP-2的脂質(zhì)過氧化物清除曲線Fig.5 Inhibition curves of lipid peroxidation by UP-1 and UP-2
3 討 論
單環(huán)刺螠以其對硫化物的耐受力及富含活性多肽而受到關(guān)注,對其多糖類活性成分的研究較少。本實(shí)驗(yàn)對單環(huán)刺螠體壁多糖進(jìn)行系統(tǒng)分析。很多海洋動(dòng)物中含有硫酸化類糖胺聚糖。不同來源的類糖胺聚糖在硫酸基含量、單糖組成和分子質(zhì)量上均有很大的區(qū)別。海參中的糖胺聚糖由乙酰氨基半乳糖、葡萄糖醛酸和巖藻糖組成,鮑魚中的硫酸化糖胺聚糖主要含有半乳糖、葡萄糖、木糖、巖藻糖和葡萄糖醛酸。海灣扇貝中主要含有硫酸化的氨基己糖、己糖醛酸,還含少量的鼠李糖、巖藻糖、木糖、半乳糖和葡萄糖,魷魚墨中含有的類糖胺聚糖由乙酰氨基半乳糖、葡萄糖醛酸和巖藻糖組成,由此可見海洋動(dòng)物是糖胺聚糖的重要來源[14,18-21]。單環(huán)刺螠來源糖胺聚糖分子質(zhì)量分布與大部分海洋糖胺聚糖類似,為8 kD,低于20 kD,也存在一定的硫酸基取代,但單糖組成上存在很大的區(qū)別。單環(huán)刺螠主要含有葡萄糖、半乳糖和氨基己糖,還含有少量的甘露糖和巖藻糖,不含有糖醛酸,表明單環(huán)刺螠來源的類糖胺聚糖為結(jié)構(gòu)較為新穎的海洋類糖胺聚糖。
海洋糖胺聚糖具有豐富的生物活性,在免疫調(diào)節(jié)、抗腫瘤、抗凝血和調(diào)節(jié)血脂等方面都具有顯著的生物活性。扇貝裙邊糖胺聚糖可顯著抑制荷瘤小鼠腫瘤生長,與環(huán)磷酰胺聯(lián)用有減毒增效的作用,且有增強(qiáng)小鼠的免疫功能[22]。刺參酸性黏多糖能顯著地抑制小鼠S180腫瘤和乳癌細(xì)胞DNA的合成。王靜鳳等[23]研究表明日本刺參能增強(qiáng)B細(xì)胞、T細(xì)胞、NK細(xì)胞和巨噬細(xì)胞等的功能,從而促進(jìn)荷瘤小鼠細(xì)胞免疫、體液免疫和非特異性免疫效應(yīng)細(xì)胞殺傷體內(nèi)的腫瘤細(xì)胞。劉宗保等[24]發(fā)現(xiàn)刺參糖胺聚糖在200~250 mg/L質(zhì)量濃度范圍表現(xiàn)出抗風(fēng)疹病毒活性,呈一定的量效關(guān)系,并無明顯細(xì)胞毒性作用。張佩文等[25]研究發(fā)現(xiàn)玉足海參酸性黏多糖抗凝血作用顯著,可延長血漿凝血酶時(shí)間、活化部分凝血活酶時(shí)間、血漿凝血酶原時(shí)間,目前已開發(fā)為具有抗凝和降低血脂的功效的藥品。閔詩剛等[26]研究表明:烏賊墨多糖能極其顯著地降低白細(xì)胞、血小板、紅細(xì)胞數(shù)量和過氧化氫酶的活力,代償性升高丙二醛含量,對環(huán)磷酰胺引起的免疫系統(tǒng)和抗氧化能力損傷,有顯著的拮抗作用及促進(jìn)其快速恢復(fù)的功效。而對單環(huán)刺螠體壁糖胺聚糖初步體外活性研究表明,其也呈現(xiàn)良好的體外脂質(zhì)過氧化物的清除活性,提示其可能存在調(diào)節(jié)血脂、預(yù)防動(dòng)脈粥樣硬化相關(guān)的活性,具有進(jìn)一步深入研究的價(jià)值[27]。
本實(shí)驗(yàn)以單環(huán)刺螠的體壁為原料提取其中的多糖成分,采用多種化學(xué)分析方法和現(xiàn)代儀器分析技術(shù)對其理化性質(zhì)、單糖組成及分子質(zhì)量等進(jìn)行研究,結(jié)果表明單環(huán)刺螠體壁含有5%左右的多糖類物質(zhì),且多糖分為兩大類型:一類為高分子質(zhì)量的中性葡聚糖,另一類為組成較為新穎的硫酸化類糖胺聚糖,分子質(zhì)量為7.9 kD,主要由葡萄糖、氨基葡萄糖和氨基半乳糖組成,還含有甘露糖、半乳糖和巖藻糖,硫酸基含量為7%。初步活性研究顯示單環(huán)刺螠體壁糖胺聚糖為主要的活性多糖成分,極具開發(fā)價(jià)值。為開發(fā)單環(huán)刺螠這一經(jīng)濟(jì)海產(chǎn),促進(jìn)高值化利用,其糖胺聚糖深入的生物活性有待進(jìn)一步研究。
[1] 王雷, 劉海梅, 彭鴿, 等. 單環(huán)刺螠營養(yǎng)成分及體內(nèi)活性物質(zhì)的研究進(jìn)展[J]. 魯東大學(xué)學(xué)報(bào): 自然科學(xué)版, 2011, 27(4): 342-345.
[2] 蔣仲青, 劉萬順, 韓寶芹, 等. 單環(huán)刺螠纖溶酶的分離純化及溶栓活性的初步研究[J]. 中國海洋大學(xué)學(xué)報(bào): 自然科學(xué)版, 2009, 39(增刊1): 138-142.
[3] 趙歡, 韓寶芹, 劉萬順, 等. 單環(huán)刺螠多肽抗腫瘤及對小鼠免疫功能的調(diào)節(jié)作用[J]. 中國天然藥物, 2008, 6(4): 302-306.
[4] 刁勇, 居海亮, 許瑞安. 單環(huán)刺螠抗血栓組分的分離純化和藥效學(xué)研究[J]. 中國生化藥物雜志, 2007, 28(3): 199-200.
[5] 殷秀紅, 趙峽, 張紫恒, 等. 紫貽貝多糖的提取、分離和基本理化性質(zhì)分析[J]. 中國海洋藥物, 2011, 30(2): 12-18.
[6] CHEN Yin, MAO Wenjun, TAO Hongwen, et al. Structural characterization and antioxidant properties of an exopolysaccharide produced by the mangrove endophytic fungus Aspergillus sp. Y16[J]. Bioresource Technology, 2011, 102(11): 8179-8184.
[7] 李佩佩, 陳雪昌, 張玉榮, 等. 海洋紅細(xì)菌Lentibacter algarum胞外多糖的分離純化及結(jié)構(gòu)解析[J]. 生物工程學(xué)報(bào), 2014, 30(3): 455-463.
[8] DUBOIS M, GILLES K A, HAMILTON J K. Colorimetric method for determination of sugars and related substances[J]. Analytical Biochemistry, 1956, 28(3): 350-356.
[9] BENSADOUN A, WEINSTEIN D. Assay of proteins in the presence of interfering materials[J]. Analytical Biochemistry, 1976, 70(1): 241-250.
[10] BITTER T, MUIR H M. A modified uronic acid carbazole reaction[J]. Analytical Biochemistry, 1962, 4(4): 330-334.
[11] TERHO T, HARTIALA K. Method for determination of the sulfate content of glycosamino glycans[J]. Analytical Biochemistry, 1971, 41(2): 471-477.
[12] 張維杰. 糖復(fù)合物生化研究技術(shù)[M]. 2版. 杭州: 浙江大學(xué)出版社, 1999: 18.
[13] 王長云, 管華詩, 李八方. 扇貝氨基多糖的紅外光譜分析[J]. 海洋湖沼通報(bào), 1994(3): 32-39.
[14] LIU Xin, SUN Zhengliang, ZHANG Miansong, et al. Antioxidant and antihyperlipidemic activities of polysaccharides from sea cucumber Apostichopus japonicus[J]. Carbohydrate Polymers, 2012, 90(4): 1664-1670.
[15] 蘇暢, 夏文水, 姚惠源. 氨基葡萄糖和乙酰氨基葡萄糖的測定方法[J].食品工業(yè)科技, 2003, 24(6): 74-77.
[16] SHINGEL K I. Determination of structural peculiarities of dextran, pullulan and γ-irradiated pullulan by Fourier-transform IR spectroscopy[J]. Carbohydrate Research, 2002, 337(16): 1445-1451.
[17] 董曉靜. 波紋巴非蛤糖胺聚糖抗氧化與降血脂活性研究[D]. 湛江:廣東海洋大學(xué), 2010.
[18] 文松松, 趙峽, 于廣利, 等. 海洋動(dòng)物多糖研究進(jìn)展[J]. 中國海洋藥物雜志, 2008, 28(4): 46-51.
[19] CHEN Shiguo, XU Jie, XUE Changhu, et al. Sequence determination of a non-sulfated glycosaminoglycan-like polysaccharide from melanin-free ink of the squid Ommastrephes bartrami by negativeion electrospray tandem mass spectrometry and NMR spectroscopy[J]. Glycoconjugate Journal, 2008, 25(5): 481-492.
[20] 王玲, 陳健, 姜建國, 等. 沙海參多糖的分離和特性研究[J]. 現(xiàn)代食品科技, 2008, 24(7): 655-658.
[21] 李冬梅, 譚鳳芝, 楊靜峰, 等. 皺紋盤鮑臟器多糖的分離純化及鑒定[J].水產(chǎn)科學(xué), 2007, 26(9): 485-488.
[22] 邢軍, 劉賽, 王海桃, 等. 扇貝裙邊糖胺聚糖抗腫瘤作用和對荷瘤小鼠免疫功能的影響[J]. 中國醫(yī)院藥學(xué)雜志, 2008, 28(2): 90-93.
[23] 王靜鳳, 王奕, 趙林, 等. 日本刺參的抗腫瘤及免疫調(diào)節(jié)作用研究[J].中國海洋大學(xué)學(xué)報(bào), 2007, 37(1): 93-96.
[24] 劉宗保, 王笑峰, 馬忠兵, 等. 刺參糖胺聚糖抗風(fēng)疹病毒的初步研究[J].齊魯醫(yī)學(xué)雜志, 2008, 23(5): 507-511.
[25] 張佩文, 駱蘇芳, 鐘春寧, 等. 玉足海參酸性粘多糖的抗凝血作用[J].中國藥理學(xué)與毒理學(xué)雜志, 1998, 2(2): 98-101.
[26] 閔詩剛, 王光, 鐘杰平, 等. 烏賊墨多糖對大鼠外周血及血液中抗氧化能力影響[J]. 食品研究與開發(fā), 2011, 32(2): 123-125.
[27] 焦緒棟, 安傳鋒, 王福亮, 等. 單環(huán)刺螠廢棄內(nèi)臟中粗多糖的提取工藝優(yōu)化[J]. 食品科學(xué), 2013, 34(2): 27-30.
Purification, Physicochemical Properties and Anti-Lipid Peroxidation Activity of Polysaccharides from Body of Urechis unicinctus
ZHU Jiali, CHEN Yisha, NIU Qingfeng, LI Tao, CHEN Yin*
(School of Food and Pharmacy, Zhejiang Ocean University, Zhoushan 316022, China)
This study aimed to extract polysaccharides from the body wall of Urechis unicinctus by sequential enzymatic digestion with papain and trypsin and to purify the crude extract by anion exchange column chromatography. The physical and chemical properties such as monosaccharide composition and molecular weight of the purified polysaccharides were investigated on the basis of chemical and modern spectroscopic analysis. Then the antioxidant activity in vitro of the polysaccharides was evaluated. The results showed that the yield of polysaccharides extracted from the body wall of Urechis unicinctus was 5.3%. Two polysaccharides, namely UP-1 and UP-2, were purified from the crude polysaccharides by anionexchange chromatography. UP-1 was a neutral polysaccharide composed of mainly glucose with a molecular weight of 340 kD. UP-2 was a heteropolysaccharide with a molecular weight of about 7.9 kD. UP-2 consisted of mannose, glucosamine, galactosamine, glucose, galactose and fucose at a molar ratio of 1.0:1.47:0.64:6.49:2.5:3.0. The monosaccharide composition revealed that UP-2 was a glycosaminoglycan-like polysaccharide. Like most of glycosaminoglycan-like polysaccharides from marine animals, UP-2 contained 7.4% sulfate ester. The glycosaminoglycan-like polysaccharide had a wide range of bioactivities and better anti-lipid peroxidation activity than UP-1 as evidenced by its EC50value at 5.0 mg/mL.
Urechis unicinctus; polysaccharide; purifi cation; physicochemical property; antioxidant activity
R151.2
A
1002-6630(2015)08-0162-05
10.7506/spkx1002-6630-201508029
2014-07-16
浙江自然科學(xué)基金項(xiàng)目(LQ14H300001);中國海洋大學(xué)海洋藥物教育部重點(diǎn)實(shí)驗(yàn)室開放基金項(xiàng)目(KLMD(OUC)201402)
朱佳利(1992—),女,本科生,主要從事海洋藥物研究。E-mail:342457383@qq.com
*通信作者:陳蔭(1984—),男,副教授,博士,主要從事海洋藥用生物資源開發(fā)研究。E-mail:mojojo1984@163.com

