離子色譜 乙酸定量法測定殼聚糖脫乙酰度
林智威,王艷花,盧珩俊,陳梅蘭*
離子色譜 乙酸定量法測定殼聚糖脫乙酰度
林智威,王艷花,盧珩俊,陳梅蘭*
(浙江樹人大學生物與環境工程學院,浙江 杭州 310015)
建立離子色譜-電導法測定甲殼素發酵液中乙酸根含量,以確定甲殼素脫乙酰化過程中脫乙酰度。樣品前處理為取發酵液放入無菌離心管中,以10 000 r/min離心15 min,取上清液過0.45 μm醋酸纖維濾膜后進樣分析,將檢測的乙酸值換算成脫乙酰度。結果表明,該方法達到很好的分離效果,在0.5~25.0 mg/L范圍內呈現良好的線性關系,回收率為95.04%~102.25%,相對標準偏差不大于2.99%,與目前常用的酸堿滴定法和電位滴定法相比,具有簡單、快捷、數據準確等特點,適用于生產企業對甲殼素脫乙酰化過程的實時監控及甲殼素脫乙酶的優化,可為工業化殼聚糖脫乙酰度的監測以及評價降解酶活性提供一定依據。
殼聚糖;甲殼素;脫乙酰度;乙酸;離子色譜法
甲殼素又稱幾丁質,是一種由N-乙酰-D-葡萄糖胺單體通過β-1,4-糖苷鍵連接而成的直鏈高分子化合物(圖1),其廣泛存在于蝦、蟹等甲殼動物,以及部分植物、細菌和真菌等生物中,年平均產量接近100億 t,是僅次于纖維素的第二大類天然高分子化合物。殼聚糖為甲殼素經脫乙酰化的產物,是由β-(1,4)-2-氨基-2-脫氧-β-D-葡萄糖單元和β-(1,4)-2-乙酰胺基-2-脫氧-β-D-葡萄糖單元組成的共聚物(圖2),也是迄今發現的唯一天然堿性多糖,具有良好生物相溶性,在生物醫學及制藥等方面的應用極其廣泛,例如在控制膽固醇、抑制細菌活性、預防和控制高血壓、吸附和排泄重金屬、提高免疫效果等方面具有較好的療效[1-2]。

圖 1 甲殼素的化學結構式Fig.1 Chemical structural formula of chitin
目前,國內外甲殼素脫乙酰的方法有化學降解法、物理降解法和脫乙酰酶降解法。其中脫乙酰酶降解法因其特異性和高的選擇性、降解過程溫和、耗能低等特點而優于其他兩種降解方法[3-5],具有較大的發展空間。然而目前通過篩選得到的甲殼素脫乙酰酶活性較低,應用于工業化還需要進一步篩選和優化,生產企業還是以堿法降解為主。在脫乙酰酶的優化過程中,甲殼素脫乙酰度是脫乙酰酶活性選擇的依據,也是殼聚糖產品質量的重要指標之一。直至目前,國內外沒有統一的脫乙酰度的檢測方法。國內企業主要采用酸堿滴定法[6]或膠體滴定法[7]。這兩種方法操作簡單、技術要求低,但是酸堿滴定終點判斷誤差較大,重復性不好[8],而膠體滴定法雖然比較穩定,重復性較好,但是誤差也很大,有時測定的脫乙酰超過100%。許多學者對脫乙酰度的檢測方法進行了研究,如電位滴定法[9]、酶前處理電位滴定法[10]、氫溴酸鹽法[11]、光折射率傳感法[12]、熱分析法[13]、元素分析法[14]、一階導數紫外光譜法[15]、紅外光譜[16-18]、核磁共振法[19-21]、X射線衍射法[22]和圓二色譜法[23]等。在這些方法中,電位滴定法的誤差較大,氫溴酸鹽法和苦味酸分光光度法實驗耗時太長,一階導數紫外光譜法由于乙酰氨基葡萄糖和氨基葡萄糖的最大吸收峰有重疊引起干擾,影響檢測結果。元素分析基于碳氮比的不同,甲殼素中殘余氮對檢測結果影響很大。核磁共振法準確度雖高,但儀器價格昂貴使用成本高,不易推廣。因此,建立一種操作簡便、準確度高的甲殼素脫乙酰度的檢測方法非常必要。本實驗基于甲殼素不論堿法降解或是酶法降解后脫除的乙酰基最后均變成乙酸鹽或乙酸的事實,通過測定乙酸根的含量,進而推算甲殼素的脫乙酰度,考慮到該方法簡單準確,可監控甲殼素實際生產的脫乙酰度。

圖 2 殼聚糖的化學結構式Fig.2 Chemical structural formula of chitosan
1 材料與方法
1.1 試劑與儀器
甲殼素 浙江金殼生物化學有限公司;配制淋洗液用碳酸鈉、碳酸氫鈉為優級純;發酵液 浙江樹人大學活潑教師實驗室;發酵使用的培養基由常量營養鹽和兩種微量元素溶液組成,其中常量營養鹽含磷酸二氫鉀、硫酸鎂、氯化鈉、氯化鈣、氯化銨、蛋白胨等;微量元素溶液1由鹽酸、氯化鎂、氯化鈷、氯化鋅、硼酸、氯化銅、氯化鎳和 鉬酸鈉組成,微量元素溶液2由乙二胺四乙酸二鈉(disodium ethylenediaminetetraacetate dihydrate,EDTA-2Na)及氯化亞鐵組成;培養基使用的試劑(均為分析純) 杭州華東醫藥股份有限公司。實驗用水為超純水由Milli-Q純水儀純化(電阻率18.2 MΩ·cm)。
IC-2010離子色譜儀(帶自動進樣器、抑制方法是膠抑制、檢測方法是電導檢測) 日本Tosoh公司;高壓蒸汽滅菌鍋、SKY-2102C型溫振蕩培養箱、SW-CJ-2FD型凈化工作臺 蘇州凈化設備有限公司。
1.2 方法
1.2.1 發酵
根據前期培養基優化實驗的結果,在超凈臺上將徹底滅菌的足量培養基分別分裝至已滅菌的三角瓶中,用接種環接入足量已培養好的菌株,再向其中加入適量甲殼素,16 層紗布封口,在恒溫振蕩培養箱中振蕩培養。
1.2.2 樣品前處理
取發酵液2 mL放入無菌離心管中,10 000 r/min離心15 min,去除樣品中的菌體,取上清液過0.45 μm醋酸纖維濾膜,再取0.5 mL定容至25 mL容量瓶,搖勻后放入樣品瓶進樣分析。將檢測的乙酸換算成脫乙酰度。
1.2.3 色譜條件
離子交換柱:保護柱TOSOH TSKguardcolumn SuperIC-AZ(4.6 mm×1 cm),分析柱TOSOH TSKgel SuperIC-AZ (4.6 mm×15 cm,4 μm);柱溫:40 ℃;進樣量:30 μL;淋洗液:1.9 mmol/L NaHCO3+3.2 mmol/L Na2CO3;流速:0.5 mL/min;膠抑制電導檢測。
1.3 脫乙酰度的計算[24]
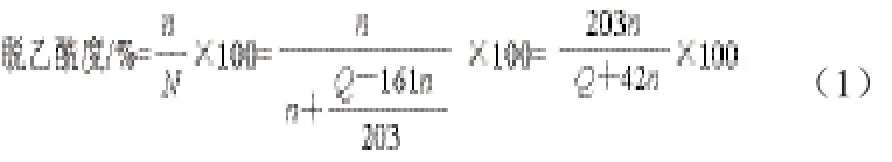
式中:Q為樣品質量/g;n為發酵過程中脫去乙酰基的糖殘基的物質的量,以檢測出發酵液中乙酸的物質的量代替;N為樣品總的糖殘基的物質的量;161為脫乙酰度為100%時殼聚糖殘基的平均相對分子質量;203為脫乙酰度為0時殼聚糖殘基的平均相對分子質量。
2 結果與分析
2.1 淋洗液的選擇
通過多次實驗,淋洗液為1.9 mmol/L NaHCO3+3.2 mmol/L Na2CO3,流速:0.5 mL/min時,發酵液中陰離子能完全分離,具體見圖3。
在1.2.3節的色譜條件下,乙酸的線性范圍由標準溶液0.5、1.0、2.0、5.0、10.0、20.0、25.0 mg/L制得。重復性由0.5 mg/L的標準溶液重復進樣6 次求得,相對標準偏差為0.18%。檢出限(RSN=3)為0.48μg/L,如表1所示。

圖 3 發酵液中7 種陰離子標準色譜圖Fig.3 Standard chromatogram of seven anions in the fermented fluid

表 1 線性范圍、重復性及檢出限Table 1 Linear range, reproducibility and limits of detection
為了進一步考察基體對結果的影響,在最佳實驗條件下,對一個發酵48 h的甲殼素發酵液樣品進行分析,測得乙酸質量濃度為5.13 mg/L,并按樣品測定值的20%、50%和80%即1.0、2.5、4.0 mg/L進行加標測定,測定結果見表2,回收率為95. 04%~102.25%。發酵液樣品按照1∶10稀釋的譜圖見圖4。

Table 2 Recoveries of spiked samples (n=3)表 2 加標回收率實驗結果(n = 3)

圖 4 樣品稀釋色譜圖Fig.4 Chromatogram of 10-fold diluted sample
2.2 EDTA的影響
考慮到發酵液中使用了EDTA,而EDTA由4 個乙酸基組成,在發酵過程中可能生成乙酸會對測定結果產生影響,因此在其他培養條件相同的條件下,不添加甲殼素進行發酵,對發酵液進行處理后進樣檢測,發現在乙酸保留時間位置不出峰。可見,乙酸對方法不產生影響。
2.3 乳酸的影響
考慮到甲殼素在酶的作用下可能生成乳酸或生成的乙酸在酶的作用下轉換成乳酸,進而對測定結果產生影響,因為乳酸和乙酸兩峰有一些重疊。實驗檢測了100 個發酵液樣品,發現有2 個樣品檢測到很小的乳酸峰。因此可認為甲殼素發酵基本不會生成乳酸,也不會對測定結果產生影響。
2.4 脫乙酰度的計算
脫乙酰度為甲殼素轉換成殼聚糖的轉換率,或是 其脫乙酰基率。目前酸堿滴定法計算公式見式(2)或(3)[25]:

式(2)、(3)中:C1和C2分別為鹽酸和氫氧化鈉的濃度;V1為加入鹽酸的體積;V2為滴定耗用的氫氧化鈉的體積;m為被測溶液殼聚糖產品的質量;M為殼聚糖的平均相對分子質量(161)。
由公式(2)和(3)可知,只有純品(100%)甲殼素脫去乙酰基,用上式公式得到的殼聚糖含量可以看作是脫乙 酰度的百分率,嚴格來講是殼聚糖的質量百分率。當不純的甲殼素即在總鏈節上既有殼聚糖分子鏈,也有甲殼素分子鏈時上述公式計算都會出現誤差,而在公式(1)中,發酵液中生成乙酸的量是真實甲殼素脫乙酰基后產生的,因此測定發酵液中乙酸的含量計算脫乙酰度是正確的。生產企業在用甲殼素作為原料生產殼聚糖時,可直接測定發酵液中的乙酸按公式(1)計算脫乙酰度作為控制生產工藝質量標準,脫乙酰度越大,甲殼素轉換為殼聚糖的得率越高。廠方對最終殼聚糖質量指標的確定一般按公式(2)、(3)進行計算。因此在實際生產中,脫乙酰度指標,可用作生產過程中工藝內控標準,殼聚糖含量可作為殼聚糖質量指標。
為了進一步衡量該方法的可行性,與傳統滴定法的比較。取按1.2.1節方法發酵后發酵液進行乙酸含量的檢測,最按公式(1)計算得到的脫乙酰度為44.62%,以得到的殼寡糖產品,用滴定法按公式(2)計算,得出的脫乙酰度為48.01%,兩者有一定的差異,這可能是甲殼素本身含有殼聚糖分子鏈有關。
3 結 論
通過離子色譜測定經脫乙酰酶作用后甲殼素中乙酸根含量的測定,以便評估甲殼素的脫乙酰度以及脫乙酰酶的活性。該方法達到了很好的分離效果,回收率為95.04%~102.25%,在0.5~25.0 mg/L范圍內呈現良好的線性效果,相對標準偏差不大于2.99%,該方法簡單準確,即使樣品的發酵液中含Mo,整個分析時間只需要30 min即可完成,可以用于甲殼素工業化中脫乙酰度的實時監測。
[1] 蔣挺大. 殼寡糖[M]. 2版. 北京: 化學工業出版社, 2007: 51-57.
[2] 張元鑫, 陳曉冬. 脫乙酰殼聚糖-三氟乙酸對變異鏈球菌的體外抑菌效果[J]. 大連醫科大學學報, 2011, 33(5): 441-443.
[3] HUTADILOK N, MOCHIMASU T, HISMORI H, et al. The effect of N-substitution on the hydrolysis of chitosan by an endo-chitosanase[J]. Carbohydrate Research, 1995, 268: 143-149.
[4] DAVID P, MANSSUR Y, MARK S. Unusual susceptibility of chitosan to enzymatic-hydrolysis[J]. Carbohydrate Research, 1992, 237: 325-332.
[5] YALPANI M, PANTALEONE D. An examination of the unusual susceptibilities of aminoglycans to enzymatic-hydrolysis[J]. Carbohydrate Research, 1994, 256(1): 159-175.
[6] 徐文峰, 廖曉玲. 堿量法測定殼聚糖脫乙酰度的研究[J]. 分析試驗室, 2008, 27(增刊1): 218-221.
[7] 楊文智, 祝小靜, 李海鷹, 等. 膠體滴定法測定殼聚糖脫乙酰度[J].河北大學學報: 自然科學版, 2010, 30(3): 285-288.
[8] NANDOR B, PAL S. Limitations of pH-potentiometric titration for the determination of the degree of deacetylation of chitosan[J]. Carbohydrate Research, 2007, 342(1): 124-130.
[9] 賈之慎, 李奇彪. 雙突躍電位滴定法測定殼聚糖脫乙酰度[J]. 化學世界, 20 01, 42(5): 240-244.
[10] ZHANG Yongqin, ZHANG Xiaoyang, DING Ruoran, et al. Determination of the degree of deacetylation of chitosan by potentiometric titration preceded by enzymatic pretreatment[J]. Carbohydrate Polymers, 2011, 83(2): 813-817.
[11] 林瑞洵, 蔣蘇洪, 張慕珊. 脫乙酰度測定方法[J]. 化學通報, 1992, 63(3): 39-42.
[12] 何煒欣, 譚春華, 黃旭光. 光折射率傳感用于殼聚糖脫乙酰度的測定[J]. 高等學校化學學報, 2013, 34(2): 474-478.
[13] 朱巖. 熱分析法測定殼聚糖的脫乙酰化度[J]. 化學工程師, 1999(2): 19-20.
[14] DOS SANTOS Z M, CARONI A L, PEREIRA M R, et al. Determination of deacetylation degree of chitosan: a comparison between conductometric titration and CHN elemental analysis[J]. Carbohydrate Research, 2009, 344(18): 2591-2595.
[15] TAN S C, KHOR E, TAN T K, et al. The degree of deacetylation of chitosan: advocating the first derivative UV-spectrophotometry method of determination[J]. Talanta, 1998, 45(4): 713-719.
[16] KASAAI M R. A review of several reported procedures to determine the degree of N-acetylation for chitin and chitosan using infrared spectroscopy[J]. Carbohydrate Polymers, 2008, 71(4): 497-508.
[17] BEIL S, SCHAMBERGER A, NAUMANN W, et al. Determination of the degree of N-acetylation (DA) of chitin and chitosan in the presence of water by first derivative ATR FTIR spectroscopy[J]. Carbohydrate Polymers, 2012, 87(1): 117-122.
[18] MAMONI D, FEDERICA C, ELIZABETH G, et al. Statistical approach to the spectroscopic determination of the deacetylation degree of chitins and chitosans[J]. Carbohydrate Polymers, 2011, 86(1): 65-71.
[19] LAVERTU M, XIA Z, SERREQI A N, et al. A validated1H NMR method for the determination of the degree of deacetylation of chitosan[J]. Journal of Pharmaceutical and Biomedical Analysis, 2003, 32(6): 1149-1158.
[20] de ALVARENGA E S, de OLIVEIRA C P, BWLLATO C R. An approach to understanding the deacetylation degree of chitosan[J]. Carbohydrate Polymers, 2010, 80(4): 1155-1160.
[21] KASAAI M R. Determination of the degree of N-acetylation for chitin and chitosan by various NMR spectroscopy techniques: a review[J]. Carbohydrate Polymers, 2010, 79(4): 801-810.
[22] ZHANG Y, XUE C, XUE Y. Determination of the degree of deacetylation of chitin and chitosan by X-ray powder diffraction[J]. Carbohydrate Research, 2005, 340(11): 1914-1917.
[23] ZHANG H, STEVEN H. In vitro degradation of chitosan by a commercial enzyme preparation: effect of molecular weight and degree of deacetylation[J]. Biomaterials, 2001, 22(12): 1653-1658.
[24] 吳小勇, 曾慶孝, 曾峰, 等. 堿量法測定殼聚糖脫乙酰度計算公式中存在的一個問題的探討[J]. 廣州食品工業科技, 2004, 20(4): 96-97.
[25] 烏通恩, 王萍亞, 夏淼. 論殼聚糖及脫乙酰度的測定[J]. 浙江海洋學院學報, 2003, 22(1): 77-82.
Determination of Degree of Deacetylation of Chitosan by Ion Chromatographic Quantitation of Acetic Acid
LIN Zhiwei, WANG Yanhua, LU Hengjun, CHEN Meilan*
(College of Biological and Environmental Engineering, Zhejiang Shuren University, Hangzhou 310015, China)
Chitosan is the product of chitin deacetylation. Therefore, the degree of deacetylation can be obtained by determining the content of acetic acid. In this paper, a method was developed to assess the degree of deacetylation of chitosan by quantitating acetic acid concentration using ion chromatography. The fermented liquid was centrifuged in sterile centrifuge tubes at 10 000 r/min for 15 min to remove the bacterial cells. Then the supernatant fluid was filtered through a 0.45 μm cellulose acetate membrane and injected into ion chromatography system. Good chromatographic separation was achieved. This method had good linearity in the range of 0.5–25.0 mg/L and its recoveries ranged from 95.04% to 102.25%, with relative standard deviation (RSD) lower than 2.99%. It is simple, quick and more accurate as compared with the traditional titration method and can be used to monitor deacetylation of chitin and optimize deacetylase activity.
chitosan; chitin; degree of deacetylation; acetic acid; ion chromatography
TS201.2
A
1002-6630(2015)08-0171-04
10.7506/spkx1002-6630-201508031
2014-04-21
浙江省自然科學重點基金項目(Z14B070002);國家國際科技合作專項(CB10-06)
林智威(1995—),男,本科生,研究方向為食品分離與分析。E-mail:mxt644143284@163.com
*通信作者:陳梅蘭(1964—),女,教授,本科,研究方向為色譜分離分析。E-mail:rain-lake@163.com

