不同粒徑納米金標記二抗增強表面等離子共振檢測E. coli O157∶H7
楊 陽,李榮卓,毛祿剛,劉 霞*
不同粒徑納米金標記二抗增強表面等離子共振檢測E. coli O157∶H7
楊 陽,李榮卓,毛祿剛,劉 霞*
(湖南農業大學食品科學技術學院,食品科學與生物技術湖南省重點實驗室,湖南 長沙 410128)
基于雙通道表面等離子共振(surface plasmon resonance,SPR)傳感器,結合不同粒徑的金納米粒子(Au nanoparticle,AuNPs)標記多克隆抗體(polyclonal antibody,PAb)作為第二抗體,采用氨基偶聯的方法將PAb固定在傳感器表面作為第一抗體,采用三明治夾心法進行了檢測大腸桿菌O157∶H7(E. coli O157∶H7)的研究。考察3 種粒徑的AuNPs作為標記物,增強SPR響應信號檢測E. coli O157∶H7的能力。結果表明,增強效果最佳的AuNPs粒徑為17.79 nm,其可檢測到的E. coli O157∶H7的最低濃度為10 CFU/mL。
金納米粒子;E. coli O157∶H7;表面等離子共振傳感器;標記;不同粒徑
隨著食品產業飛速的發展,食品安全問題越來越得到消費者的關注。據統計,在各種食物中毒事件中,以細菌引起的食物中毒最多。其中大腸桿菌O15 7∶H7(E. coli O157∶H7)是最常見的細菌致病菌[1-2]。目前,檢測E. coli O157∶H7常用的方法有聚合酶鏈式反應(poly merase chain reaction,PCR)[3]、酶聯免疫(enzyme-linked immune sorbent assay,ELISA)法[4]、生物傳感器法[5]等。其中,免疫生物傳感器由于其特異性強、快速簡便的優點,已廣泛應用于E. coli O157∶H7的檢測。特別是表面等離子共振(surface plasmon resonance,SPR)傳感器[6]具有無需標記,能實時監測反應動態過程,操作簡單、靈敏度高,已被廣泛應用于各個研究領域[7-9]。國內外已有關于SPR生物傳感器檢測E. coli O157∶H7的報道,Si Chengyan等[10]將抗體固定在傳感器表面,基于SPR直接法檢測E. coli O157∶H7,檢測限為105CFU/mL。應用納米材料可大幅度提高SPR傳感器的檢測靈敏度[11],尤其是金納米粒子(Au nanoparticles,AuNPs),由于具有微弱的帶電配體的結合層,具有特殊的穩定性,可以與生物分子發生非共價鍵的靜電吸附[12],且生物分子活性基本不發生改變,標記用量少等優點而被廣泛應用于生物檢測。AuNPs標記抗原或抗體的三明治法檢測E. coli O157∶H7已有報道,劉霞等[13]應用AuNPs標記抗體的方法檢測了補體C4,與直接法檢測相比,靈敏度提高了20 倍。Eum等[14]基于AuNPs的增強響應信號作用,應用三明治夾心法,將AuNPs-抗體作為二抗,原抗體為一抗檢測E. coli O157∶H7,結果表明在標記AuNPs的前提下響應信號比沒有標記的高3.8 倍。
本實驗分別將不同粒徑的AuNPs標記E. coli O157∶H7 PAb作為第二抗體,以固定在SPR傳感器芯片表面的PAb作為第一抗體,應用三明治夾心法[15]對E. coli O157∶H7進行檢測,比較了3 種不同粒徑的AuNPs增強SPR響應信號的能力,篩選出最佳尺寸的AuNPs,并應用篩選出的AuNPs進行實際樣品的加標回收率實驗。此方法簡單快速,為SPR傳感器在實際樣品中的檢驗提供技術參考。
1 材料與方法
1.1 試劑與儀器
無水乙醇、營養肉湯(nutrient broth,NB)、檸檬酸三鈉、四氯金酸(HAuCl4·H2O)、牛血清白蛋白(bovine serum albumin,BSA) 國藥集團化學試劑有限公司;3-巰基丙酸(3-mercapto propionic acid,MPA)、N-羥基琥珀酰亞胺(N-hydroxysuccinimide,NHS)、乙基二甲基胺丙基碳化二亞胺(1-ethyl-3-(3-dimethylami-nopropyl) carbodiimide hydrochloride,EDC)美國Sigma-Aldrichg公司;E. coli O157∶H7由湖南省食品藥品檢驗研究院提供(出血性大腸埃希氏菌二代菌株,編號為CICC21530,中國工業菌種保藏中心);羊抗O157∶H7 PAb 美國International Lab公司;實驗所用試劑均為分析純。
HJ-1型恒溫磁力攪拌器 江蘇醫療儀器廠;雙通道2000 SPR傳感器和芯片 美國Biosensing Instrument公司;UV-2450型紫外-可見分光光度計 日本島津公司;JSM-6380LV型透射電子顯微鏡 日本電子株式會社;磷酸鹽緩沖液(150 mmol/L NaCl+20 mmol/L Na2HPO4·12H2O,pH 7.4);實驗用水為去離子水;實驗所用玻璃器皿、磷酸鹽緩沖液、去離子水及槍頭均經高壓滅菌。
1.2 方法
1.2.1 AuNPs合成及表征
采用檸檬酸三鈉還原法制備AuNPs[16],具體步驟如下:分別取0.5 mL質量分數為1%氯金酸溶液于三角瓶中,加入49.5 mL去離子水,在磁力攪拌器200 r/min攪拌并加熱至沸騰,沸騰后分別快速加入新配制的1、1.5、2 mL質量分數為1%的檸檬酸三鈉溶液,繼續加熱攪拌10 min。溶液顏色由灰色變成黑色,最后變成透亮的紅色后停止加熱,再攪拌10 min。室溫冷卻后分裝到離心管中并分別采用透射電子顯微鏡(transmission electron microscopy,TEM)和紫外-可見分光光度計(ultravioletvisible spectrophotometer,UV-Vis)進行表征。
1.2.2 AuNPs-PAb復合物的制備及表征
應用目測法測定PAb最適標記量,將PAb逐級稀釋后,各取等體積分別加入到一系列裝有1 mL AuNPs的離心管中,離心5 min后,在上述各管內再分別加入0.1 mL質量分數為10%的NaCl溶液調節pH值至7.4,混勻靜置2 h以上觀察結果。若加入PAb不足以穩定AuNPs的離心管,即呈現由紅變藍的聚沉現象,而加入PAb達到或超過最低穩定量的離心管則AuNPs的紅顏色不變。其中含PAb最低的離心管即含穩定1 mL AuNPs的必需蛋白量[17]。根據用已標記的AuNPs的總量計算出所需要的待標記PAb的總量(實際實驗中增加20%的量),然后在電磁攪拌器的攪拌下,將PAb溶液逐滴加入AuNPs溶液中(pH 7.4),1 mg的PAb大約5 min加完;在磁性攪拌器的攪拌下,加入pH 7.4的BSA作為封閉劑,并使其最終質量分數為1%。得到的混合液用2 000 r/min離心20 min,去除沉淀,即除去部分大顆粒的AuNPs。所得上清液用10 000 r/min離心60 min后小心除去上清液,即除去未結合的PAb。所得沉淀(AuNPs-PAb復合物)用磷酸鹽稀釋并用TEM進行表征。
1.2.3 PAb在傳感器表面的固定
室溫條件下,采用滴加的方法,將濃度為10 mmol/L的MPA乙醇溶液滴加在裸露的芯片表面,室溫孵育過夜,次日芯片用乙醇以及二次水反復沖洗,再用氮氣吹干,使MPA在芯片上形成穩定的單分子膜,然后將芯片組裝在SPR傳感器上。通入新配制的EDC/NHS(0.4 mol/L∶0.1 mol/L)活化MPA中的羧基,流速為40 μL/min;再通入的質量濃度為111.2 μg/mL的PAb(磷酸鹽緩沖液配制)溶液,流速為5 μL/min,將其固定在傳感器芯片表面,最后通入1% BSA封閉芯片表面的非特異性吸附位點。
1.2.4 SPR檢測
通入一定濃度的E. coli O157∶H7標準菌液,流速為10 μL/min,使其與芯片表面的PAb充分反應,然后再分別通入3 種粒徑的AuNPs-PAb復合物進行檢測,檢測過程原理圖如圖1所示。每次反應完畢后以20 μL/min的流速通入10 mmol/L的NaOH溶液,將傳感器表面AuNPs-PAb與E. coli O157∶H7的結合物沖掉至基線穩定后,然后通入其他濃度的E. coli O157∶H7,重復上述步驟,每個濃度的E. coli O157∶H7至少重復檢測3 次。
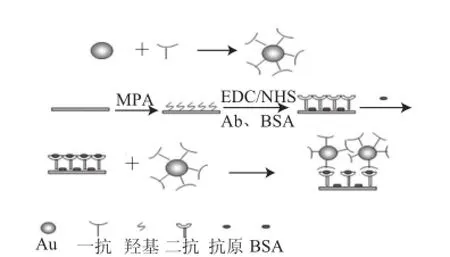
圖 1 檢測過程原理圖Fig.1 Principle schematic of E. coli O157∶H7 detection
1.2.5 實際樣品的制備及加標回收率實驗
購買自湖南農業大學紅旗市場的涼菜,烘箱烘48 h,用滅菌后的研缽研碎,稱取2.5 g加入22.5 mL無菌水混合均勻,過濾后4 ℃冰箱備用。
稀釋樣液加入E. coli O157∶H7標準菌液,加標后E. coli O157∶H7的最終濃度為106CFU/mL。調節流速為10 μL/min,通入實際樣品加標溶液,進行3次重復檢測,計算回收率。每次檢測后采用10 mmo l/L的NaOH溶液使傳感器表面再生。
2 結果與分析
2.1 AuNPs的表征
應用檸檬酸鈉還原法成功制備了3 種不同粒徑的AuNPs,圖2A分別為3 種粒徑AuNPs的TEM圖,AuNPs粒子形狀較統一,分散也較均勻,并且隨著還原劑檸檬酸三鈉量的不同,粒子粒徑逐漸增大,粒子數量減少。通過使用粒徑分布計算軟件分析了3 種粒子的粒徑,可知此次實驗制備的AuNPs平均粒徑分別為17.79、28.22 nm和34.05 nm(圖2B)。圖3為AuNPs的UV-Vis光譜,3種粒徑的AuNPs在520 nm左右均出現了其紫外特征吸收峰,而且紫外吸收峰隨著顆粒尺寸的增大而出現了紅移,與文獻[18]報道相一致。
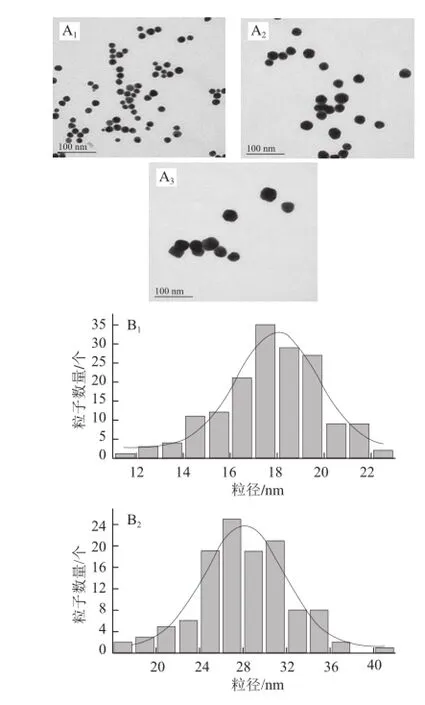
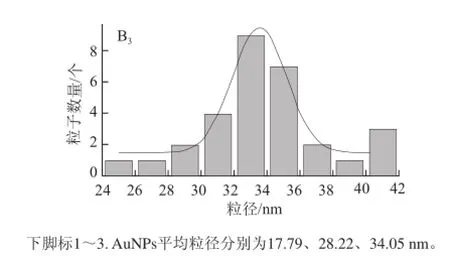
圖 2 AuNPs TEM圖(A)和粒徑分布圖(B)Fig.2 TEM images (A) and size distribution histograms (B) of AuNPs
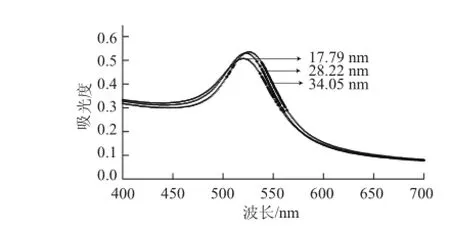
圖 3 AuNPs的UV-Vis光譜Fig.3 UV-visible absorption spectra of AuNPs
2.2 AuNPs-PAb的表征
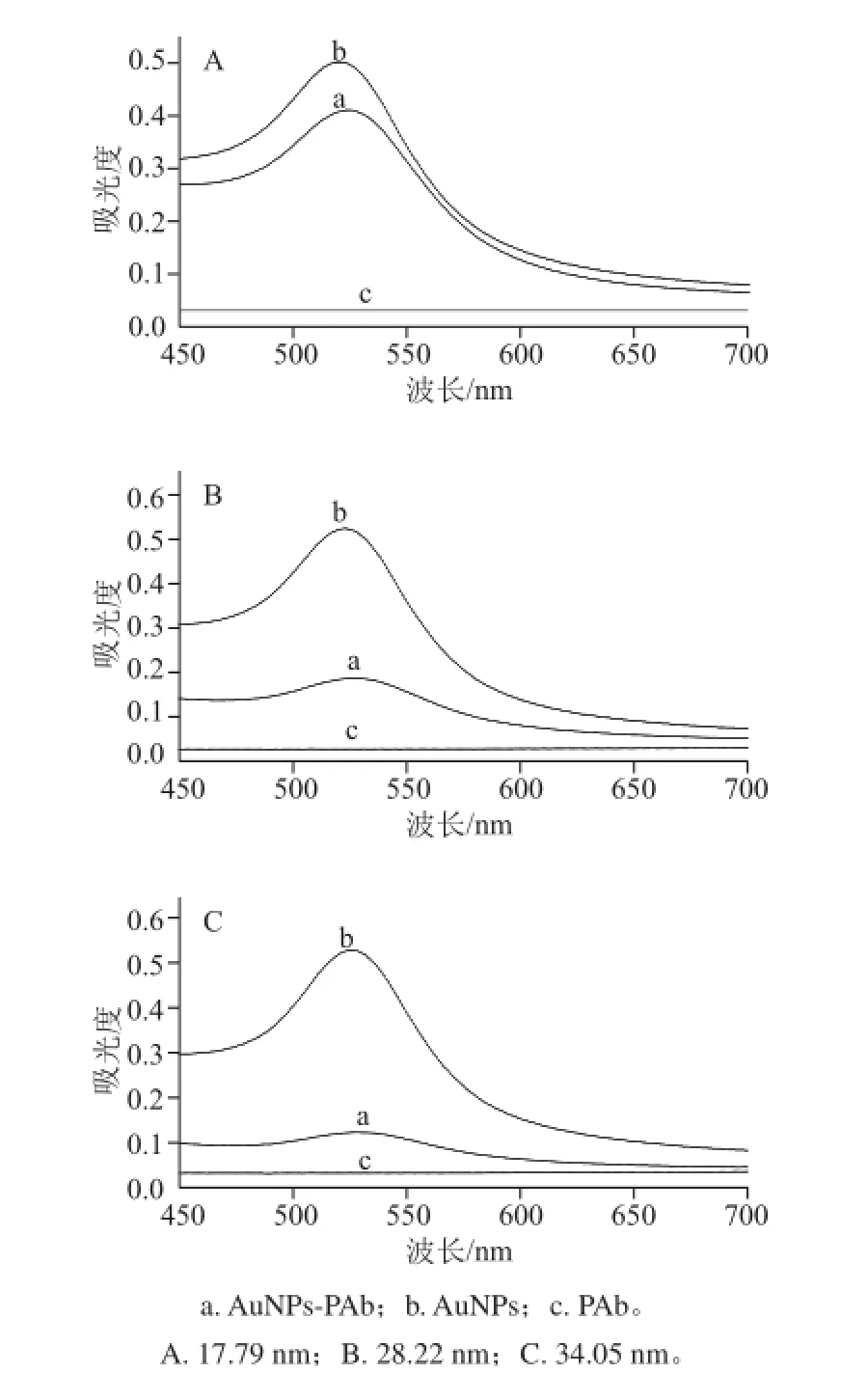
圖 4 AuNPs標記前后以及抗體的UV-Vis光譜Fig.4 UV-visible absorption spectra of PAb, AuNPs and AuNPs-PAb
由圖4中曲線c可看出,PAb沒有特征峰,而圖4中曲線b可以明顯看出,3 種粒徑的AuNPs分別在波長520 nm左右處都出現了特征吸收峰,但PAb被AuNPs標記后(圖4中曲線a),AuNPs-PAb復合物在525 nm左右出現了吸收峰,AuNPs-PAb復合物的特征吸收峰與AuNPs的特征吸收峰相比,出現了紅移現象,這是因為AuNPs-PAb復合物形成之后,粒子粒徑變大所致,與文獻[18]報道相一致。另外,也可看出AuNPs-PAb復合物的吸光度明顯下降,PAb被AuNPs成功標記。
2.3 SPR檢測結果
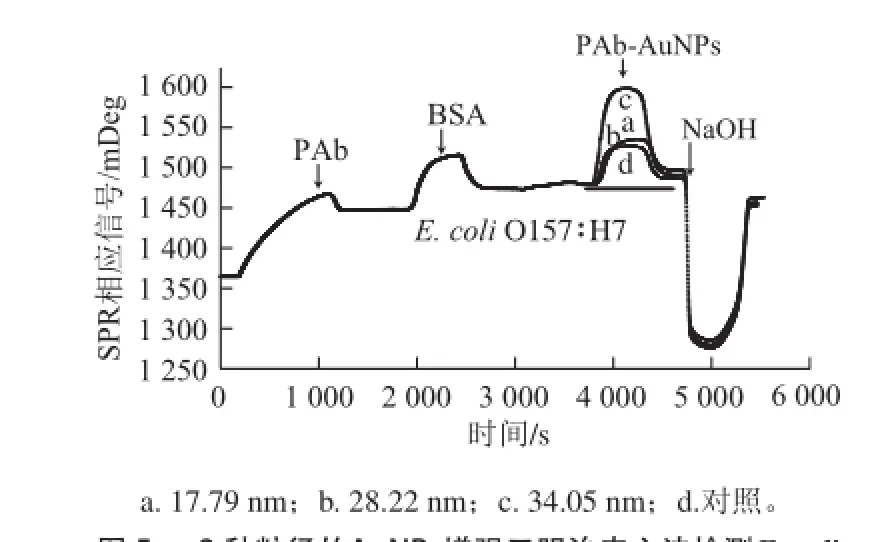
圖 5 3種粒徑的AuNPs增強三明治夾心法檢測E. coli O157∶H7的動力學曲線Fig.5 SPR dynamics curves of AuNPs of three different sizes enhanced sandwich assay for E. coli O157∶H7 detection
PAb在SPR芯片表面自組裝成穩定的抗體分子膜后,分別向流通池中通入不同菌液濃度的E. coli O157∶H7,然后通入AuNPs-PAb復合物進行檢測,整個實驗的SPR動力學曲線如圖5所示(以菌液濃度為108CFU/mL E. coli O157∶H7為例)。從圖5可明顯看出,通入PAb后立刻引起了SPR的響應信號,1 200 s基本達到平衡,SPR響應信號的變化(Δθ)值為82 mDeg,說明PAb已經被成功的固定在傳感器表面。當傳感器表面被PBS沖洗后,注入BSA也引起了SPR響應信號的變化,說明傳感器芯片表面的空位點已被BSA封閉。此時,注入E. coli O157∶H7引起的SPR響應信號的變化并不是很明顯,當E. coli O157∶H7完全與一抗結合后,再注入AuNPs-PAb的復合物時,引起了明顯的SPR響應信號的變化(注入AuNPs-PAb前的基線與注入AuNPs-PAb后響應信號經過高峰平臺期后下降并穩定的基線的差值),可明顯看出粒徑為17.79 nm的AuNPs標記二抗產生的SPR響應信號改變值最大,其次分別為粒徑34.05 nm和28.22 nm的AuNPs,這主要是由于AuNPs的比表面積增大了PAb的承載量,使復合物的折射率明顯增大及AuNPs的表面等離子體子(surface plasmons,SP)與金膜本身的SP發生了耦合的原因。待反應完成之后通入10 mmol/L NaOH使傳感器表面再生。
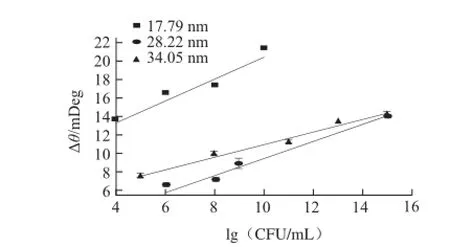
圖 6 3種粒徑檢測不同濃度E. coli O157∶H7的工作曲線Fig.6 Working curves for detecting different concentrations of E. coli O157∶H7 based on different sizes of AuNPs
如圖6所示,隨著E. coli O157∶H7濃度的增加,SPR響應的變化值也隨之增加,17.79 nm AuNPs增加SPR響應信號的變化值最為明顯,其次為34.05 nm,最后為28.22 nm,與圖5所示結果一致。當E. coli O157∶H7的濃度為108CFU/mL,粒徑分別為17.79、28.22 nm和34.05 nm的AuNPs標記二抗所引起的SPR響應信號的變化值分別為17.415、7.2373 mDeg和9.9403 mDeg,相對標準偏差分別為8.019%、7.723%和9.306%。這表明,檢測相同濃度的E. coli O157∶H7,17.79 nm AuNPs增強SPR的效果幾乎是28.22 nm和34.05 nm的AuNPs的2 倍。而且E. coli O157∶H7的濃度越大,17.79 nm AuNPs增強SPR的效果越強,而28.22 nm和34.05 nm的增強效果趨于平緩,當E. coli O157∶H7的濃度為1015CFU/mL時,兩者產生的SPR信號基本差不多。
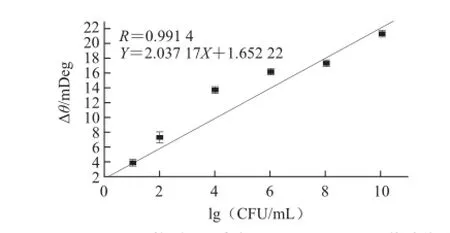
圖 7 17.79 nm AuNPs檢測不同濃度E. coli O157∶H7的線性關系曲線Fig.7 Linear relationship curve of SPR assay for detection of E. coli O157∶H7 at different concentrations using 17.79 nm AuNPs
一般來說,在一定的粒徑范圍內,隨著AuNPs粒徑的增加,SPR響應信號也隨之增強。Zeng Shuwen等[19]系統地研究了AuNPs粒徑對于SPR響應信號的影響規律,研究表明當AuNPs的粒徑小于40 nm時,SPR響應信號隨著粒徑的增大而增加;當AuNPs粒徑大于40 nm時,SPR響應信號隨著粒徑的增大反而減小。而本實驗獲得的AuNPs標記二抗增強SPR響應信號的最佳粒徑為17.79 nm,其次是34.05 nm,最后為28.22 nm。這或許是以下兩個原因導致的綜合效應,一是由于粒徑較大的AuNPs被PAb包被后,導致AuNPs-PAb復合物粒徑更大,當AuNPs-PAb復合物與芯片表面的E. coli O157∶H7結合時,導致空間位阻的效應更明顯;二是由于E. coli O157∶H7本身也比較大(0.5~1.5 μm),當粒徑較大的AuNPs-PAb復合物與其結合后,使得傳感器表面的介質膜厚度比較大,導致SPR靈敏度下降[20]。圖7是增強效果最佳粒徑的AuNPs(17.79 nm)檢測E. coli O157∶H7的線性關系曲線,其最低可檢測到的濃度為10 CFU/mL,線性范圍為10~1010CFU/mL,相關系數為0.991 4,線性回歸方程為Y=2.037 17X+1.652 22。
2.4 實際樣品加標回收率
應用17.79 nm的AuNPs采用同樣的方法進行了實際樣品的加標回收率實驗。為了保證檢測的準確性,樣品經長時間的烘干處理,確認其無微生物存活后,進行加標實驗。實際樣品中的E. coli O157∶H7加標量是106CFU/mL,SPR響應信號的變化值是18.284 mDeg,同濃度的E. coli O157∶H7標準品的SPR響應信號的變化值為16.603 mDeg,其加標回收率為110.12%,相對標準偏差為1.37%,說明該方法的準確度高、重復性好。
3 結 論
本實驗采用檸檬酸三鈉還原法合成了3 種不同粒徑(17.79、28.22、34.05 nm)的AuNPs,并將不同粒徑的AuNPs標記E. coli O157∶H7的PAb制備的AuNPs-PAb復合物作為二抗,利用氨基偶聯的方法將PAb固定在傳感器表明作為一抗,采用三明治夾心法,應用雙通道SPR傳感器(一個通道作為參比通道)對E. coli O157∶H7進行了高靈敏的檢測,考察3 種粒徑的增強能力,篩選出增強效應最佳的粒徑為17.79 nm。此方法可明顯增強SPR的檢測靈敏度,且操作時間短、試劑用量少、靈敏度高。
[1] AHN K C, KLEIN E, TARR I P. Isolation of patients acutely infected with Escherichia coli O157:H7: low-tech, highly effective prevention of hemolytic uremic syndrome[J]. Clinical Infectious Diseases, 2008, 46(8): 1197-1199.
[2] PHILLIPS C A. The epidemiology, detection and control of Escherichia coli O157[J]. Journal of the Science of Food and Agriculture, 1999, 79(11): 1367-1381.
[3] 巢強國, 楊學明, 葛宇, 等. PCR法檢測食品中大腸桿菌O157:H7[J].食品科學, 2010, 31(8): 212-215.
[4] SUNWOO H H, WANG W W, SIM J S. Detection of Escherichia coli O157:H7 using chicken immunoglobulin Y[J]. Immunology Letters, 2006, 106(2): 191-193.
[5] XU Lijian, DU Jingjing, DENG Yan, et al. Electrochemical detection of E. coli O157:H7 using porous pseudo-carbon paste electrode modified with carboxylic multi-walled carbon nanotubes, glutaraldehyde and 3-aminopropyltriethoxysilane[J]. Journal of Biomedical Nanotechnology, 2012, 8(6): 1006-1011.
[6] FERNáNDEZ F, SáNCHEZ-BAEZA F, MARCO M P. Nanogold probe enhanced surface plasmon resonance immunosensor for improved detection of antibiotic residues[J]. Biosensors and Bioelectronics, 2012, 34(1): 151-158.
[7] LANG T, HIRSCH T, FENZL C, et al. Surface plasmon resonance sensor for dissolved and gaseous carbon dioxide[J]. Analytical Chemistry, 2012, 84(21): 9085-9088.
[8] LIU Ying, CHENG Quan. Detection of membrane-binding proteins by surface plasmon resonance with an all-aqueous amplification scheme[J]. Analytical Chemistry, 2012, 84(7): 3179-3186.
[9] NAGATSUKA T, UZAWA H, SATO K. Localized surface plasmon resonance detection of biological toxins using cell surface oligosaccharides on glyco chips[J]. ACS Applied Materials and Interfaces, 2013, 5(10): 4173-4180.
[10] SI Chengyan, YE Zunzhong, WANG Yixian, et al. Rapid detection of Escherichia coli O157:H7 using surface plasmon resonance (SPR) biosensor[J]. Spectroscopy and Spectral Analysis, 2011, 31(10): 2598-2601.
[11] TAYLOR A D, LADD J, YU Qiuming, et al. Quantitative and simultaneous detection of four food borne bacterial pathogens with a multi-channel SPR sensor[J]. Biosensors and Bioelectronics, 2006, 22(5): 752-758.
[12] LEUNG P T, POLLARD K D, MALAN G P, et al. Modelling of particleenhanced sensitivity of the surface-plasmon-resonance biosensor[J]. Sensors and Actuators B: Chemical, 1994, 22(3): 175-180.
[13] LIU Xia, SUN Ying, SONG Daqian, et al. Sensitivity-enhancement of wavelength-modulation surface plasmon resonance biosensor for human complement factor 4[J]. Analytical Biochemistry, 2004, 333(1): 99-104.
[14] EUM N S, YEOM S H, KWON D H, et al. Enhancement of sensitivity using gold nanorods-antibody conjugator for detection of E. coli O157: H7[J]. Sensors and Actuators B: Chemical, 2010, 143(7): 784-788.
[15] SAFENKOVA I V, ZHERDEV A V, DZANTIEV B B. Correlation between the composition of multivalent antibody conjugates with colloidal gold nanoparticles and their affinity[J]. Journal of Immunological Methods, 2010, 357(1/2): 17-25.
[16] FRENS G. Controlled nucleation for the regulation of the particle size in monodisperse gold suspensions[J]. Nature, 1973, 241: 20-22.
[17] 王凱. 使用SPR生物傳感器快速檢測微生物的實驗研究[D]. 長春:吉林大學, 2003.
[18] 孫秀蘭, 張銀志, 邵景東, 等. 黃曲霉毒素B1抗體和納米金顆粒的相互作用機理[J]. 高等學校化學學報, 2007, 28(8): 1449-1453.
[19] ZENG Shuwen, YU Xia, LAW W C, et al. Size dependence of AuNP-enhanced surface plasmon resonance based on differential phase measurement[J]. Sensors and Actuators B: Chemical, 2013, 176(1): 1128-1133.
[20] 趙曉君. 表面等離子體子共振化學和生物傳感器的研究[D]. 長春:吉林大學, 1999.
Detection of E. coli O157:H7 Based on Au Nanoparticles of Different Sizes Labeled Second Antibody Enhanced Surface Plasmon Resonance
YANG Yang, LI Rongzhuo, MAO Lugang, LIU Xia*
(Hunan Province Key Laboratory of Food Science and Biotechnology, College of Fo od Science and Technology, Hunan Agricultural University, Changsha 410128, China)
Escherichia coli O157:H7 (E. coli O157:H7) was detected by a sandwich method with Au nanoparticles (AuNPs) of different sizes labeled E. col i O157:H7 polyclonal antibody (PAb) as the second antibody and PAb immobilized on the sensor surface as the first anti body using a dual-channel surface plasmon resonance (SPR) sensor. The abil ities of second antibodies labeled with AuNPs of three different sizes to enhance SPR signal were compared. As a result, the optimal AuNPs size was found to be 17.79 nm and the minimum detectable concentration of E. coli O157:H7 was 10 CFU/mL.
AuNPs; E. coli O157:H7; surface plasmon resonance (SPR); labeling; different particle sizes
S951.42
A
1002-6630(2015)08-0201-05
10.7506/spkx1002-6630-201508037
2014-07-18
國家自然科學基金青年科學基金項目(31201375);公益性行業(農業)科研專項(201303084)
楊陽(1990—),女,碩士研究生,研究方向為食品安全與控制。E-mail:769968476@qq.com
*通信作者:劉霞(1976—),女,副教授,博士,研究方向為食品分析、食品營養與安全。E-mail:liuxiaspr@aliyun.com

