固相萃取-高效液相色譜法檢測油炸豬肉中丙烯酰胺
邵美麗,郝星宇,劉 巍,2,崔承遠,袁兆豐,董 鑫
固相萃取-高效液相色譜法檢測油炸豬肉中丙烯酰胺
邵美麗1,郝星宇1,劉 巍1,2,崔承遠1,袁兆豐1,董 鑫1
(1.東北農業大學食品學院,哈爾濱 黑龍江 150030;2.佳木斯出入境檢驗檢疫局,黑龍江 佳木斯 154002)
建立油炸豬肉中丙烯酰胺的固相萃取-高效液相色譜檢測方法。油炸豬肉樣品經正己烷脫脂,2 mol/L氯化鈉溶液提取,乙酸乙酯萃取,固相萃取小柱凈化后,以甲醇-水(5∶95,V/V)為流動相,Hypersi10DS2-C18色譜柱分離,內標法定性、定量分析丙烯酰胺。結果表明:丙烯酰胺的定性檢出限為6 μg/kg,定量檢出限為20 μg/kg,線性定量范圍0.05~1.00 μg/mL,線性相關系數(R2)為0.999 8,本方法的加標回收率穩定在90%~92%范圍,相對標準偏差小于3.5%。
油炸豬肉;丙烯酰胺;固相萃取;高效液相色譜
丙烯酰胺是一種不飽和酰胺,具有神經毒性、生殖毒性、遺傳毒性及潛在致癌性[1-4]。研究表明,不僅在富含碳水化合物的高溫油炸食品中含有大量的丙烯酰胺[5-6],燒烤、油炸的肉類如烤羊肉串(23 μg/kg)、油炸雞翅(214 μg/kg)及煎牛排(251 μg/kg)等食品中也含有一定量的丙烯酰胺[7-9]。在我國,豬肉是最常食用的一種肉類,油炸更是人們常用的一種烹飪方式,建立油炸豬肉中丙烯酰胺的檢測方法及安全限量,對于避免因過多攝入油炸豬肉而引發丙烯酰胺蓄積毒性是非常有必要的。
食品中丙烯酰胺的檢測方法主要有氣相色譜法、氣相色譜-串聯質譜法、高效液相色譜法、液相色譜-串聯質譜法[10-13]等。其中氣相色譜-串聯質譜法和液相色譜-串聯質譜法既有色譜對化合物的分離能力,又有質譜特異性,具有檢出限低(食品中丙烯酰胺的最低檢出限可達1 μg/kg),靈敏度高,且能夠提供測量組分的分子質量和結構信息等特點。但這兩種方法的缺點是所用到的儀器價格非常昂貴,檢測費用高,且氣相色譜-質譜法的樣品需先經過衍生化,操作比較復雜,不適用于大規模的推廣[14-17]。與其相比,高效液相色譜法對儀器要求不高,檢測成本低,且具有較好的分離效果和較低的檢出限,適于大規模推廣[18]。固相萃取技術是目前常用的樣品前處理方法,其操作簡單,富集效率較高[19-21]。故本研究結合固相萃取技術,建立油炸豬肉中丙烯酰胺的高效液相色譜檢測方法。
1 材料與方法
1.1 材料、試劑與儀器
新鮮豬肉 哈爾濱市購。
丙烯酰胺標準品(純度≥99%)、甲基-丙烯酰胺標準品(純度≥98%) 美國Sigma公司;甲醇(色譜純) 百靈威科技有限公司;乙酸乙酯、正己烷、環己烷、氯化鈉、石油醚(均為分析純) 天津市天力化學試劑有限公司。
2487高效液相色譜系統、Oasis HLB固相萃取柱美國Waters公司;Hypersi10DS2-C18色譜柱 大連伊力特分析儀器有限公司;高速冷凍離心機 上海安亭科學儀器廠;QF-3800氮氣吹干儀 北京博峰天成科技有限公司;YZ-1531-B多功能油炸鍋 廣東容聲電器股份有限公司。
1.2 方法
1.2.1 樣品處理
1.2.1.1 提取
取10 g粉碎后的油炸豬肉樣品,加入0.01 mg/mL甲基丙烯酰胺內標液500 μL,然后加入40 mL正己烷,超聲振蕩脫脂15 min,棄去正己烷層,重復此操作2 次。然后加入50 mL 2 mol/L氯化鈉溶液,磁力攪拌20 min,以8 000 r/min的轉速離心15 min,取上清液,重復此操作2 次。向上清液加入10 mL乙酸乙酯,靜置10 min后,收集上層溶液,重復此操作2 次。將收集到的萃取液,氮氣吹干,加入3 mL超純水溶解,備用。
1.2.1.2 凈化
依次用3 mL甲醇和3 mL超純水活化平衡Oasis HLB固相萃取柱,然后將上述樣品提取液過Oasis HLB固相萃取小柱,棄去流出液,再用3mL超純水洗脫,收集全部洗脫液,用0.45 μm濾膜過濾后進行色譜分析。
1.2.2 色譜條件
色譜柱:Hypersi10DS2-C18色譜柱(4.6 mm×250 mm,5 μm);進樣量:20 μL;進樣溫度:30 ℃;流速:0.8 mL/min;流動相:甲醇-水(5∶95,V/V);檢測波長:205 nm,利用保留時間定性,峰面積定量。
1.2.3 標準曲線的繪制
配制1 mg/mL的丙烯酰胺儲備液,進一步稀釋得0.05、0.1、0.15、0.2、0.25、0.4、0.6、0.8、1 μg/mL的丙烯酰胺標準溶液。同時以0.1 μg/mL甲基丙烯酰胺作內標溶液。依次測定不同質量濃度丙烯酰胺及其內標的峰面積,以丙烯酰胺和甲基丙烯酰胺內標的質量濃度比為橫坐標,以丙烯酰胺和甲基丙烯酰胺內標的峰面積比為縱坐標,繪制標準曲線,計算丙烯酰胺含量。
1.3 數據分析
數據采用Statistix 8.1軟件包中Linear Models程序進行處理,數據以±s表示。
2 結果與分析
2.1 色譜條件的優化
2.1.1 流動相的選擇
丙烯酰胺是極性很強的化合物,因此在進行色譜分離時流動相的選擇非常重要[22]。本研究比較了6種不同體積分數的甲醇溶液(0%、5%、25%、50%、75%、100%)作為流動相的分離效果。結果表明,以純水和純甲醇為流動相時,沒有出現色譜峰;以25%、50%、75%的甲醇溶液作流動相時,甲基丙烯酰胺的峰形較差,同時以50%的甲醇溶液做流動相時,基線較不穩定。而以5%的甲醇溶液作為流動相時,丙烯酰胺的保留時間和峰形都較理想,基線平穩且無明顯漂移的現象,色譜峰的分離效果也比較好(色譜圖略)。故最終選擇5%的甲醇溶液作流動相。
2.1.2 進樣溫度的選擇
本實驗比較了20、30、40 ℃ 3 個不同進樣溫度對丙烯酰胺分離效果的影響。結果表明,3 個溫度條件下色譜峰的保留時間差別不大。但進樣溫度為20 ℃時,色譜圖的基線不夠平穩;進樣溫度為40 ℃時,丙烯酰胺色譜峰分離效果不好,故選擇30 ℃作為最佳的進樣溫度(色譜圖略)。
2.1.3 檢測波長的選擇
丙烯酰胺的檢測波長文獻報道不一致,其中最大波長可達260 nm[23],而所述最小僅197 nm[24]。為提高方法的靈敏度和準確性,在進樣前先采用紫外-可見分光光度計對1 μg/mL的丙烯酰胺標準液以及0.1 μg/mL的甲基丙烯酰胺內標液在190~350 nm波長范圍內進行吸光度全掃描,結果顯示在波長為205 nm左右時有最大吸收波長。故本研究分別比較200、205、210 nm 3 個波長條件下丙烯酰胺的分離檢測效果。結果表明,在所選的3 個檢測波長條件下,丙烯酰胺和甲基丙烯酰胺均有最大吸收峰,且出峰時間和峰面積均相近,但在波長為200 nm和210 nm時,丙烯酰胺的峰有一定的拖尾現象。故選擇205 nm作為丙烯酰胺的最佳檢測波長(色譜圖略)。
2.2 樣品提取方法的優化
2.2.1 提取溶劑的選擇
丙烯酰胺可不同程度的溶解于水、甲醇、乙醇和乙酸乙酯等多種溶劑,且在水中溶解度最大。而與水相比,高濃度的氯化鈉溶液在提取丙烯酰胺的同時可使樣品中的蛋白質發生鹽析作用,從而有效抑制其乳化的過程,可進一步提高丙烯酰胺的回收率,故高濃度氯化鈉溶液也是一種良好的丙烯酰胺提取溶劑。本研究分別選取2 mol/L氯化鈉溶液和純水作為提取溶劑,再分別配合磁力攪拌和超聲振蕩兩種方式進行丙烯酰胺的提取。結果表明,采用超聲振蕩時,氯化鈉溶液和純水的丙烯酰胺回收率分別為90.0%和72.6%;采用磁力攪拌時,氯化鈉溶液和純水的丙烯酰胺回收率分別為95.9%和85.5%(表1)。可以看出,2 mol/L的氯化鈉溶液作為提取溶劑,并結合磁力攪拌的方式進行樣品中丙烯酰胺提取的效果最好。
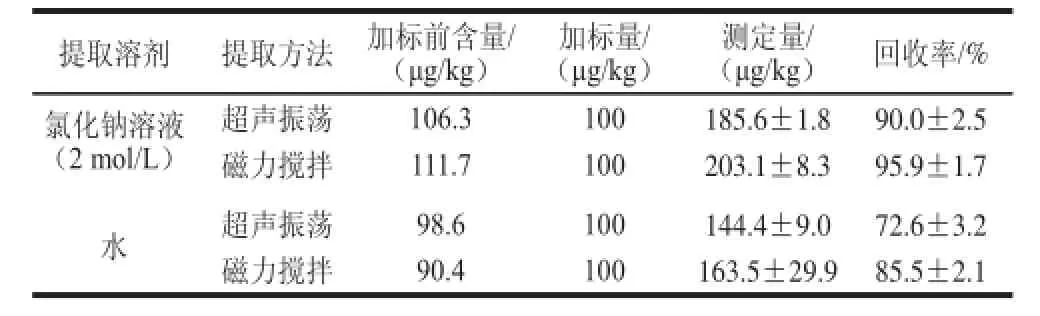
表 1 不同提取溶劑方法加標回收率測定結果(n=3)Table 1 Recovery rates of acrylamide with different eluents and methods (n= 3)
2.2.2 脫脂溶劑的選擇
油炸豬肉中大量油脂的存在會嚴重影響丙烯酰胺的提取純化以及檢測的過程,故需對樣品進行脫脂處理。由于丙烯酰胺不溶于烷烴化合物,故本研究分別選取正己烷、環己烷、石油醚3 種溶劑對樣品進行脫脂,并比較脫脂過程中三者對丙烯酰胺回收率的影響。結果表明,正己烷、石油醚和環己烷進行樣品脫脂后,丙烯酰胺的損失率分別為1.7%、2.3%和4.5%,這說明脫脂步驟并不會對丙烯酰胺的提取造成很大影響(表2)。相比而言,正己烷作為脫脂溶劑時丙烯酰胺標準品溶液的損失率最小,故選擇正己烷作為脫脂溶劑。

n=3)=3 Table 2 Loss rates of acrylamide with different degreasant (表 2 不同脫脂劑損失率測定結果(Table 2 Loss rates of acrylamide with different degreasant (n = 3) = 3)
2.2.3 乙酸乙酯萃取次數的選擇
由圖1可知,萃取1 次時,丙烯酰胺回收率只有35%,萃取2 次時回收率提高到55.3%,萃取3 次時的回收率顯著增加到84.6%。當繼續增加萃取次數到4 次和5 次時,丙烯酰胺的回收率沒有明顯增長,說明萃取次數達到3 次時,已可將丙烯酰胺充分萃取出來,故確定乙酸乙酯萃取次數為3 次。
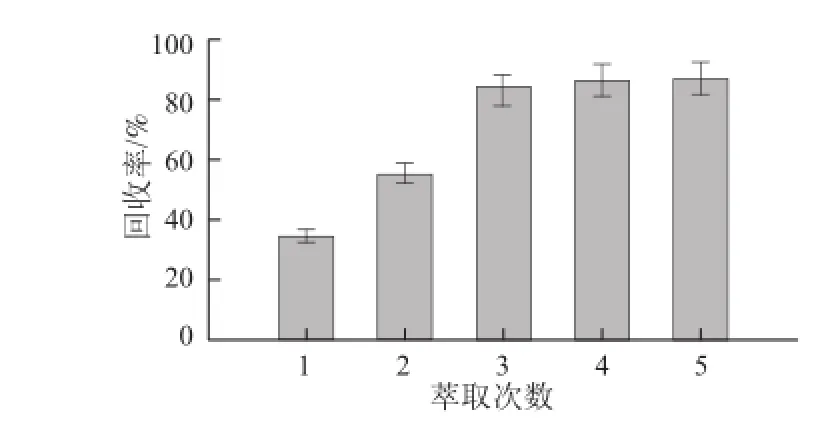
圖 1 乙酸乙酯液液萃取次數對丙烯酰胺回收率的影響(n=33)Fig.1 Effect of number of extraction cycles with ethyl acetate on the recovery of acrylamide (n = 3)
2.3 固相萃取條件的優化
2.3.1 洗脫劑的選擇
固相萃取可有效提高丙烯酰胺的回收率并有效減少雜質[25]。本研究選用HLB固相色譜柱對樣品進行純化處理,分別選用超純水以及25%、50%、75%、100%的甲醇溶液作為洗脫液,并分別對質量濃度為0.05、0.25、1.00 μg/mL的丙烯酰胺標準品進行洗脫,比較丙烯酰胺的回收率。由圖2可知,當選用純水進行洗脫時,3 種質量濃度的丙烯酰胺回收率分別為93.6%、87.3%、92.3%。隨著甲醇比例的增加,丙烯酰胺的回收率均有所下降。當甲醇體積分數增長到75%時,已檢測不到0.05 μg/mL的丙烯酰胺。故本實驗選擇超純水作為洗脫溶劑。
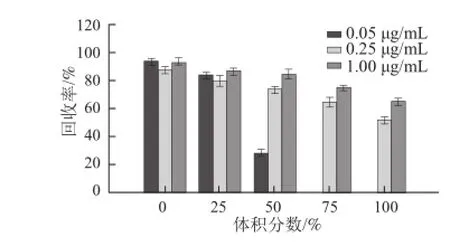
圖 2 不同體積分數甲醇溶液作為洗脫液時丙烯酰胺的固相萃取回收率(n=3)=3Fig.2 Effect of eluent (methanol) concentration on the recovery of acrylamide (n = 3)
2.3.2 洗脫液體積的選擇
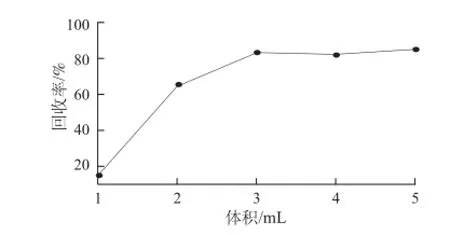
圖 3 丙烯酰胺淋洗曲線Fig.3 Acrylamide elution curve with different eluent volumes
由圖3可知,隨著超純水體積不斷增加,丙烯酰胺的回收率逐漸升高。當超純水體積達到3 mL時,丙烯酰胺回收率達到83.5%。隨后再增加洗脫劑體積,丙烯酰胺回收率并沒有明顯增加,由此說明用3 mL的水就可將丙烯酰胺基本洗脫出來,再加大洗脫量并不能更大程度地提高回收率,故從經濟的角度講,選擇3 mL為洗脫體積較合適。
2.4 方法評價
2.4.1 線性關系與最低檢出限
丙烯酰胺在0.05~1.00 μg/mL之間,峰面積和質量濃度呈良好的線性關系,回歸方程為y=0.981 4x+0.262 3,線性相關系數R2為0.999 8。以信噪比為3的條件下計算得出丙烯酰胺的最低檢出限(定性檢出限)為6 μg/kg,以信噪比為10的條件下計算得出丙烯酰胺的定量檢出限為20 μg/kg。丙烯酰胺標準品色譜圖見圖4。
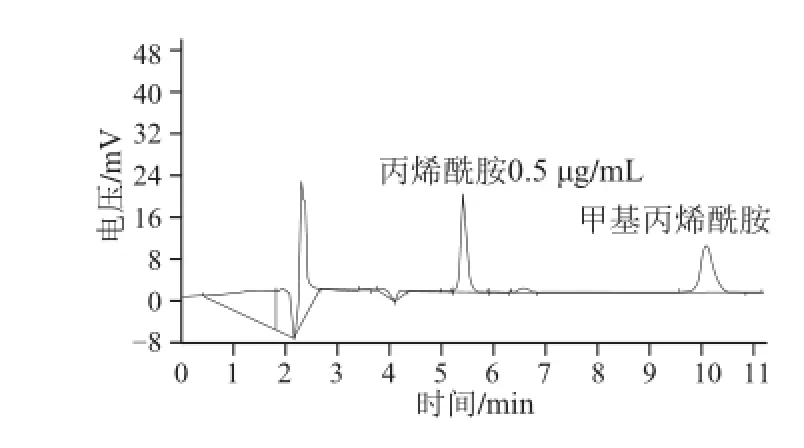
圖 4 丙烯酰胺標品高效液相色譜圖Fig.4 HPLC Chromatogram of acrylamide standard
2.4.2 精密度與回收率

表 3 高效液相色譜方法檢測油炸豬肉中丙烯酰胺的加標回收率(n=5)Table 3 Recoveries of acrylamide spiked in deep-fried pork by the HPLC method (n= 5)
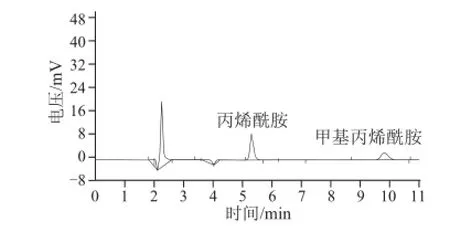
圖 5 實際樣品高效液相色譜檢測圖Fig.5 HPLC chromatogram of real sample
回收率可以反映出待測物質在樣品分析處理過程中的損失程度,回收率越高說明損失越少,其方法的準確度也就越高。分別按照50、100、200 μg/kg的加標水平向樣品中加入丙烯酰胺標準品,計算平均回收率(表3)。結果表明,丙烯酰胺的加標回收率在90%~92%之間,相對標準偏差小于3.5%,說明本研究的樣品準備方法和高效液相色譜檢測方法可靠、精密度高。油炸豬肉中丙烯酰胺的加標前含量為108 μg/kg,其檢測色譜圖見圖5。
3 結 論
本實驗建立了油炸豬肉中丙烯酰胺的固相萃取-高效液相色譜檢測方法。該方法通過正己烷脫去樣品之中的脂類,經過氯化鈉溶液提取和乙酸乙酯萃取后,采用固相萃取柱的固相萃取,可較好地除去干擾雜質,大大提高樣品的凈化程度,該法定性檢出限達6 μg/kg,定量檢出限為20 μg/kg,回收率在90%~92%之間,相對標準偏差小于3.5%。本方法操作簡便、快速,對所需液相色譜儀器要求較低,可在大多數實驗室中進行,具有較好的推廣價值。
[1] ORACZ J, NEBESNY E, ZYZELEWICZ D. New trends in quantifi cation of acrylamide in food products[J]. Talanta, 2011, 86(30): 23-34.
[2] BENFORDA D, BOLGER P M, CARTHEW P, et al. Application of the margin of exposure approach to substances in food that are genotoxic and carcinogenic[J]. Food and Chemical Toxicology, 2010, 48(Suppl 1): 2-24.
[3] BUSK L. Acrylamide: a case study on risk analysis[J]. Food Control, 2010, 21(12): 1677-1682.
[4] SKOG K, VIKLUND G. Processing contaminants: acrylamide[J]. Encyclopedia of Food Safety, 2014, 2: 363-370.
[5] FOOT R J, HAASE N U, GROB K, et al. Acrylamide in fried and roasted potato products: a review on progress in mitigation[J]. Food Additives and Contaminants, 2007, 24(Suppl 1): 37-46.
[6] SKOG K, VIKLUND G. Processing contaminants: acrylamide[J]. Encyclopedia of Food Safety, 2014, 5: 363-370.
[7] ROSEN J, HEILENAS K E. Analysis acrylamide in cooked foods by liquid chromatograohy tandem mass spectrometry[J]. Analyst, 2002, 127(7): 880-882.
[8] VINCI R M, MESTDAGH F, MEULENAER B D. Acrylamide formation in fried potato products-present and future, a critical review on mitigation strategies[J]. Food Chemistry, 2012, 133(4): 1138-1154.
[9] ZHANG Yu, XU Weizhong, WU Xiaoqin. Addition of antioxidant from bamboo leaves as an effective way to reduce the formation of acrylamide in fried chicken wings[J]. Food Additves and Contaminants, 2007, 24(3): 242-251.
[10] BIEDERMANN M, GROB K. In GC-MS, acrylamide from heated foods may be coeluted with 3-hydroxy propionitrile[J]. European Food Research and Technology, 2008, 227(3): 945-948.
[11] EEROLA U, HOLLEBEKKERS K, HALLIKAINEN A, et al. Acrylamide levels in Finnish foodstuffs analysed with liquid chromatography tandem mass spectrometry[J]. Molecular Nutrition and Food Research, 2007, 51(2): 239-247.
[12] SUN Shiyu, FANG Yun, XIA Yongmei. A facile of acrylamide in starchy food by using a solid extraction-GC strategy[J]. Food Control, 2012, 26(2): 220-222.
[13] WANG Haiyan, FENG Feng, GUO Yong, et al. HPLC-UV quantitative analysis of acrylamide in baked and deep-fried Chinese foods[J]. Journal of Food Composition and Analysis, 2013, 31(1): 7-11.
[14] MIZUKAMI Y, KOHATA K, YAMAGUCHI Y. Analysis of acrylamide in green tea by gas chromatography-mass spectrometry[J]. Journal of Agricultural and Food Chemistry, 2006, 54(19): 7370-7377.
[15] 程劼, 蘇曉鷗, 張維. 氣相色譜-串聯四極桿質譜測定餐廚廢棄物中的丙烯酰胺[J]. 中國農業科學, 2012, 45(16): 3373-3381.
[16] ZYZAK D V, SANDERS R A, STOJANOVI M, et al. Acrylamide formation mechanism in heated foods[J]. Journal of Agricultural and Food Chemistry, 2003, 51(16): 4782-4787.
[17] RUFIAN-HENARES J A, MORALES F J. Determination of acrylamide in potato chips by a reversed-phase LC-MS method based on a stable isotope dilution assay[J]. Food Chemistry, 2006, 97(3): 555-562.
[18] PALEOLOGOS E K, KONTOMINAS M G. Determination of acrylamide and methacrylamide by normal phase high performance liquid chromatography and UV detection[J]. Journal of Chromatography A, 2005, 1007(2): 128-135.
[19] JIANG Donglei, SUN Xiulan, ZHANG Yinzhi. Preparation and application of acrylamide molecularly imprinted solid-phase extraction materials[J]. Analytical Methods, 2012, 4(11): 3760-3766.
[20] 程雷, 鄭炎夏, 徐虹, 等. 固相萃取-高效液相色譜-串聯質譜法測定食品中的丙烯酰胺[J]. 食品科學, 2012, 33(2): 231-234.
[21] TEKKELI S E, ONAL C, ONAL A. A review of current methods for the determination of acrylamide in food products[J]. Food Analytical Methods, 2012, 5(1): 29-39.
[22] MICHALAK J, GUJSKA E, KUNCEWICZ A. RP-HPLC-DAD studies on acrylamide in cereal-based baby foods[J]. Journal of Food Composition and Analysis, 2013, 32(1): 68-73.
[23] 孫秀蘭, 紀劍, 安璐, 等. 丙烯酰胺樣品前處理及其檢測方法研究進展[J]. 食品與生物技術學報, 2013, 32(5): 456-459.
[24] 廖燕芝, 黃輝, 楊代明, 等. GC-MS測定食品中丙烯酰胺含量的定量方法比較[J]. 食品與機械, 2013, 29(5): 91-94.
[25] XIE Shanling, WANG Kai, ZHU Ruizhi, et al. Solid phase extractionultra performance liquid chromatography for the determination of acrylamide in mainstream cigarette smoke[J]. Mendeleev Communication, 2009, 19(6): 344-345.
Determination of Acrylamide in Deep-Fried Pork by Solid Phase Extraction-High Performance Liquid Chromatography
SHAO Meili1, HAO Xingyu1, LIU Wei1,2, CUI Chengyuan1, YUAN Zhaofeng1, DONG Xin1
(1. College of Food Sciences, Northeast Agricultural University, Harbin 150030, China;2. Jiamusi Entry-Exit Inspection and Quarantine Bureau, Jiamusi 154002, China)
A method for the determination of acrylamide in deep-fried pork has been proposed using solid phase extraction (SPE) and high performance liquid chromatography (HPLC). Samples were degreased with n-hexane and extracted sequentially with 2 mol/L sodium chloride solution followed by ethyl acetate. Then the extract was cleaned up on an Oasis HLB solid phase extraction column and separated on a Hypersi10DS2-C18chromatographic column with a mobile phase consisting of methanol and water (5:95, V/V). Acrylamide was analyzed quantitatively by internal standard method. The results showed that the limit of qualitative detection of the proposed method was 6 μg/kg, and the limit of quantitative detection was 20 μg/kg. The standard curve was linear within the range of 0.05–1.00 μg/mL with a correlation coefficient of 0.999 8. The recoveries of the spiked sample ranged between 90% and 92% with a relative standard deviation (RSD) lower than 3.5%. This method proved to be simple, fast and highly sensitive.
deep-fried pork; acrylamide; solid-phase extraction; high performance liquid chromatography
TS201.6
A
1002-6630(2015)08-0231-05
10.7506/spkx1002-6630-201508043
2014-07-04
黑龍江省自然科學基金項目(C201303);黑龍江省教育廳科學技術研究項目(12541045);
“十二五”國家科技支撐計劃項目(2012BAD28B00-01-02)
邵美麗(1974—),女,副教授,博士,研究方向為食品安全控制。E-mail:shml0915@163.com

