VIGS技術在甜菜上的應用
VIGS技術在甜菜上的應用
龔攀1,2,崔杰2*,李俊良2,羅成飛2,楊虎臣2
(1.哈爾濱工業大學生命科學與技術學院,哈爾濱 150000;
2.哈爾濱工業大學食品科學與工程學院,哈爾濱 150090)
摘要:病毒誘導基因沉默(VIGS)是一種應用于研究植物基因功能的反向遺傳學手段。相對于基因敲除及轉基因等方法,它具有時間短、成本低、高通量等優點。隨著甜菜全基因組的測序完成,為盡早對大量序列信息進行注釋和功能鑒定,急需建立甜菜VIGS體系。本文采用目前應用最廣泛的煙草脆裂病毒載體在農桿菌的介導下侵染甜菜幼苗葉片,同時設立對照。提取甜菜幼苗葉片總RNA,并反轉錄成cDNA,設計特異引物進行RT-PCR檢測。結果表明:在侵染植株上檢測到了煙草脆裂病毒特異條帶,證明該病毒可以對甜菜進行侵染,這一結果為下一步建立甜菜VIGS體系奠定了基礎。
關鍵詞:甜菜;病毒誘導基因沉默;煙草脆裂病毒;RT-PCR
中圖分類號:TS242.2文獻標志碼:A
收稿日期:2014-11-12;修回日期:2014-12-05.
基金項目:國家自然科學
作者簡介:熊偉,男,漢族,博士,副教授,碩士生導師,研究方向:細胞分子生物學;E-mail: xwailp@163.com.
doi:10.3969/j.issn.1672-5565.2015.01.05
Application of Virus-Induced Gene Silencing inBetaVulgaris
GONG Pan1,2, CUI Jie2*,LI Junliang2,LUO Chengfei2,YANG Huchen2
(1.SchoolofLifeScienceandTechnology,HarbinInstituteofTechnology,Harbin150000,China;
2.SchoolofFoodScienceandEngineering,HarbinInstituteofTechnology,Harbin150090,China)
Abstract:Virus-induced gene silencing is an effective method of reverse genetics research for gene function analysis in plants. Compared with gene knockout, transgene and some other methods, it has many advantages such as faster, low-cost and high-throughput. With the accomplishment of Beta vulgaris′ complete genome sequencing,the functional characterization of a large number of sequences need to be identified . It is important to develop a rapid method of VIGS functional analysis system of beet genes. In this paper, we mediated the TRV (Tobacco rattle virus) infection of sugar beet seedlings by Agrobacterium while Tobacco rattle virus is currently the most widely used viral vectors. Total RNA was extracted from the beet leaf and reverse transcribed into cDNA, we designed specific primers used in RT-PCR to detect the virus on the infected beet. The results demonstrated that the virus could infect beet, which laid the foundation for the next VIGS system established in Beta vulgaris.
Keywords:Beta vulgaris;Virus-induced gene silencing ; Tobacco rattle virus;RT-PCR
病毒誘導基因沉默(virus-induced gene silencing, VIGS)是一種RNA介導的植物防御病毒機制,是基于轉錄后基因沉默(post-transcriptional gene silencing ,PTGS)的技術[1]。VIGS相對于目前一些成熟的功能基因組學工具有以下優點:(1)VIGS周期短,相對容易實施。VIGS可以在短期內產生特定基因功能喪失表型從而快速分析其功能特性[2];(2)VIGS避免了植物遺傳轉化。一旦VIGS系統建立后,在遺傳轉化較為困難中的植物中進行基因功能分析相對容易[3];(3)VIGS允許對產生致死表型基因進行功能性分析。它可以用來研究胚胎發育、出苗率及活力相關基因[3-5];(4)VIGS可以克服功能冗余。使用VIGS沉默保守區域,多個相關的基因或基因家族都可以被同時沉默[6-7];(5)VIGS能夠及時沉默組織特異性基因。例如,只在植物開花或穗發育期進行侵染從而沉默特定器官。此外,VIGS還可以用于快速沉默特定基因突變體,或過表達特定基因的植株,從而可以短時間內研究大量復雜的抗逆基因間的相互作用[8]。 VIGS也可作為其它轉錄后基因沉默的補充方法。
目前在植物上應用的VIGS病毒載體主要分為三類:RNA病毒載體、DNA病毒載體及衛星病毒載體。煙草脆裂病毒(TRV)屬于RNA病毒,是目前是應用最廣泛的病毒載體,具有病毒癥狀較輕、沉默效率高、持續時間長以及能夠侵染分生組織等優點[10-11],同時它是植物中寄主范圍最廣的病毒,50多科雙子葉和單子葉植物中約400多個品種易受該病毒侵染,并在許多寄主上侵染的同時不引起癥狀[12]。TRV基因組中含有兩條RNA鏈,RNA1能編碼RNA依賴的RNA聚合酶基因、運動蛋白以及16K富含半胱氨酸的蛋白[13],RNA2能夠編碼外殼蛋白以及包含用來克隆目標基因的酶切位點[8],兩條鏈構建成一個雙元載體,TRV成功誘導沉默需要RNA1和RNA2同時滲透。
2013年,德國馬克斯-普朗克分子遺傳學研究所和西班牙國家基因組調控中心等機構共同發布了甜菜的全基因組測序信息[9],這對于甜菜育種、基因功能鑒定等研究具有里程碑意義。由于甜菜獲得穩定的遺傳轉化體較為困難,鑒于VIGS體系的優異性,開發一種針對于甜菜的病毒誘導基因沉默體系對于鑒定大量的基因序列信息具有重要的意義。在本研究中利用構建好的煙草脆裂病毒載體系統對甜菜進行了侵染實驗,研究TRV病毒對甜菜的侵染效果,為下一步構建甜菜VIGS體系及基因功能鑒定奠定基礎。
1材料與方法
1.1植物材料與培養
甜菜品種為哈爾濱工業大學食品學院甜菜遺傳育種課題組培育的二倍體材料CL7,植株在人工氣候箱培養,培養條件為晝/夜溫度22/18 ℃,光/暗周期16 h/8 h,相對濕度(RH)50%~70 %。以出苗15天左右(2片真葉甜菜)和出苗40天左右(6片真葉甜菜)為材料進行侵染實驗。
1.2菌株與質粒
農桿菌菌株GV3101,質粒pTRV1,pTRV2-PDS(PDS基因來源于番茄)由江蘇省農業科學院生物技術所惠贈。
LB固體培養基含50 mg·L-1卡那霉素,25 mg·L-1利福平。農桿菌重懸液含200 mM乙酰丁香酮,10 mM MES和10 mM MgCl2。
1.3引物設計
反轉錄特異引物:TCCCCTATGGTAAGACAATGAG[14],位于TRV2鏈下游。
RT-PCR病毒檢測引物:F: GGAGTTGAAGAGTTATT
ACCGAAGG;R: CCGGAATTCGAAACTCAAATGCTACCAA,位于編碼TRV病毒外殼蛋白基因上,用于檢測病毒擴散程度[14]。
1.4農桿菌感受態制備
(1)挑取GV3101單菌落接種于2 mL LB液體培養基(利福平25 mg·L-1)中,28 ℃過夜培養。
(2)吸取1 mL菌液接種至50 mL LB液體培養基(利福平25 mg·L-1)中,28 ℃,200 rpm,培養至OD600 = 0.5。
(3)冰浴10 min后,4 000 rpm離心5min,用10 mL預冷 0.15 M NaCl懸浮洗滌1~2次。4 000 rpm離心5 min,用2 mL預冷20 mM CaCl 懸浮。
(4)冰浴30 min后加入20%的甘油(V/V),分裝,液氮速凍1 min,儲存在-70 ℃。
1.5轉化
(1)將各1 μg質粒pTRV1,pTRV2-PDS分別轉化農桿菌,冰浴30 min。
(2)液氮速凍1 min,立即37 ℃水浴5 min。
(3)加入1 mL LB液體培養基,28 ℃,150 rpm 培養2~3h,4 000 rpm離心1 min。
(4)棄上清,加入100 μL LB液體培養基,混勻,涂抗性平板,28 ℃培養2天。
1.6農桿菌侵染甜菜
(1)將含有pTRV1和pTRV2-PDS農桿菌28 ℃分別過夜培養至OD600 =1.0~2.0,收集菌體,用重懸液懸浮培養至OD600≈0.8,28 ℃避光靜置3~4 h。
(2)將含有pTRVl和pTRV2-PDS的農桿菌等量混合。
(3)選擇甜菜內輪葉片背部,用針頭輕輕劃破,注射滲透葉片。
(4)接種5個星期后,觀察表型。
1.7RT-PCR檢測病毒侵染情況
(1)Trizol法提取實驗組、對照組葉片總RNA。
(2)cDNA第一鏈合成使用Takara 公司PrimeScriptTMII 1st strand cDNA Synthesis Kit,按說明書操作。對照組使用隨機引物,實驗組使用反轉錄特異引物。
(3)以cDNA為模板,使用病毒檢測引物進行PCR擴增。
(4)電泳及分析圖像。
2結果與分析
2.1甜菜葉片病毒侵染實驗
我們對2片真葉和6片真葉期的甜菜葉片進行了農桿菌侵染,同時設置兩組對照組,一組為僅注射重懸液的甜菜幼苗,另一組為注射了包含pTRV1和pTRV2-PDS侵染液的2片真葉期番茄幼苗,5周后,觀察植株葉片變化。
從甜菜實驗組表型看到,2葉期和6葉期侵染實驗組葉片均出現了輕微卷曲和局部顆粒狀突起,表現出輕微的侵染癥狀(圖1 B, C),說明煙草脆裂病毒可能對甜菜產生了影響。
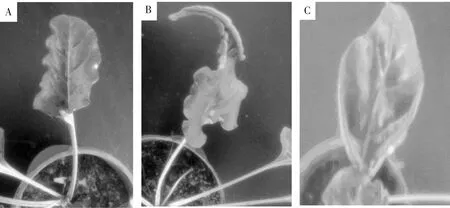
圖1 侵染5周后葉片表型變化
注:A:甜菜對照組;B:6葉期甜菜侵染植株;C:2葉期甜菜侵染植株。
Notes: A: the beet control group; B: 6-leaf stage infected beet; C: 2-leaf stage infected beet.
在侵染約5周后,以番茄作對照組可以看到,從第4~6片真葉開始出現漂白現象(如圖2B),比預計的15~20天時間晚了許多,說明本研究中設置的培養條件對于病毒在番茄上的繁殖傳播并不是最適宜的。
在侵染約7周后,甜菜實驗組,2葉期侵染和6葉期侵染相繼出現了部分葉片葉緣局部變黃并略顯透明的現象(如圖2C,D),并且2葉期侵染甜菜出現的部位相對較多,進一步表明病毒對甜菜產生了侵染效果,并且幼苗期甜菜更適合病毒的積累繁殖。由于PDS基因在植物中相對較為保守,雖然在pTRV2上構建的靶基因是來源于番茄的PDS基因,但對甜菜也產生了部分影響。
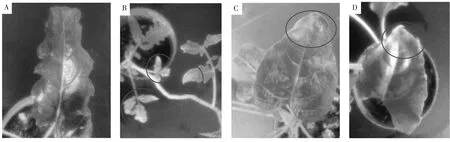
圖2 侵染7周后葉片表型變化
注:A:甜菜對照組;B:侵染5周后番茄對照組;C:6葉期甜菜侵染植株;D:2葉期甜菜侵染植株。
Notes: A: the beet control group; B: the infected tomato group after 5 weeks; C: 6-leaf stage infected beet plant; D: 2-leaf stage infected beet plant.
2.2病毒侵染植株分子檢測
為檢測TRV在甜菜植株中的擴散情況,對出現葉片局部漂白的甜菜老葉及新生嫩葉分別提取總RNA,質量檢測合格后,用于下步進行半定量RT-PCR檢測。
分別取對照及處理組甜菜葉片200 mg提取總RNA,經瓊脂糖電泳,結果見圖3。在18 s和28 s區域有明顯條帶,表明其完整性良好,可用于后續實驗。
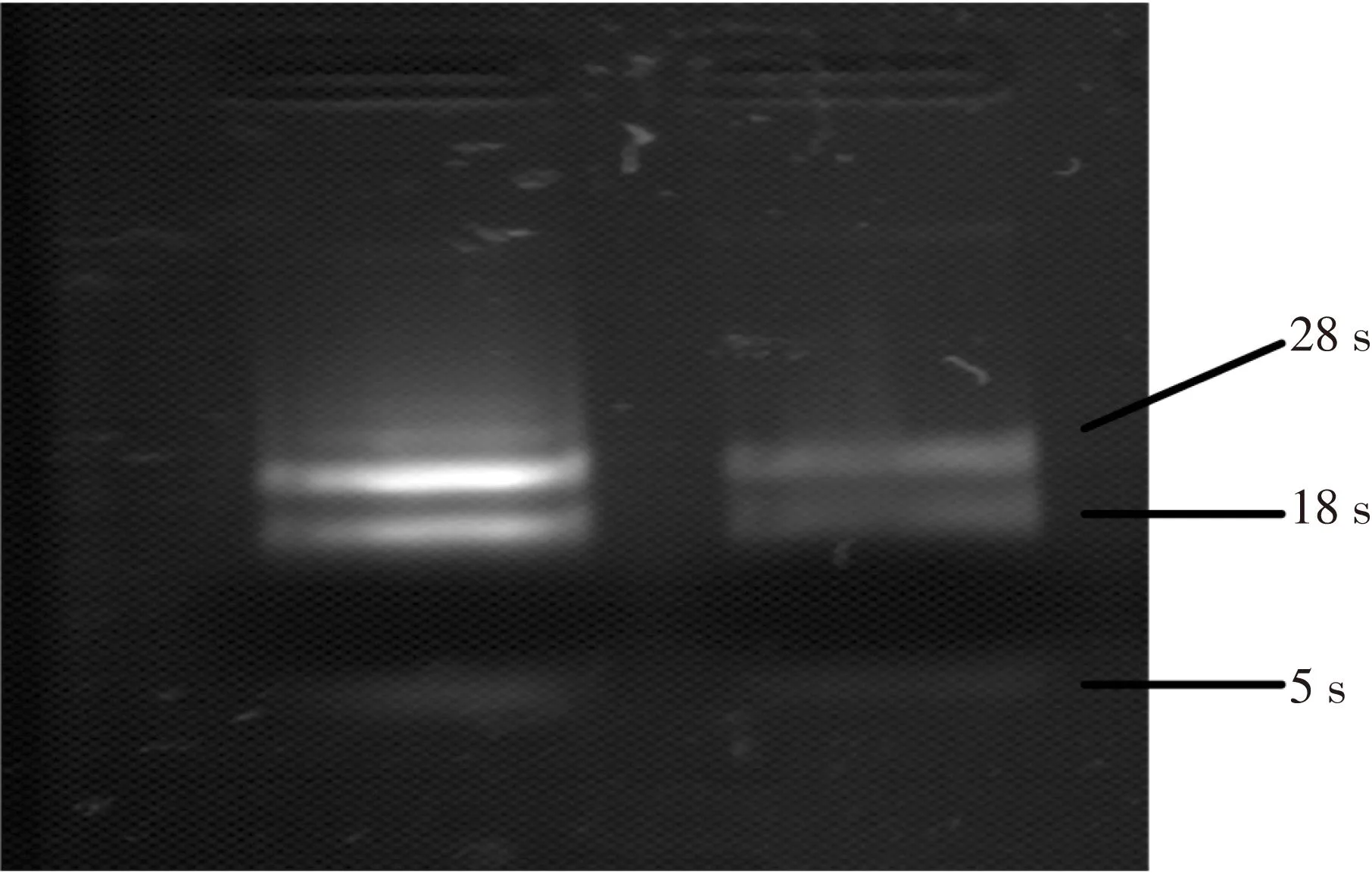
圖3 甜菜葉片總RNA電泳圖
上述提取的RNA經反轉錄成cDNA后進行RT-PCR,結果表明,接種病毒后,病毒積累的情況各不相同,在2葉期和6葉期侵染的植株老葉及2葉期侵染的植株新生嫩葉中均檢測到目標片段,但在6葉期侵染植株嫩葉中沒有檢測到(見圖4),表明TRV病毒對于甜菜具有一定的侵染能力;研究結果還表明,在本研究中設置的培養條件下,該病毒對于較小的植株侵染能力較強,但是擴散能力對于較大的植株來講較弱,因此,今后還需進一步優化培養條件。
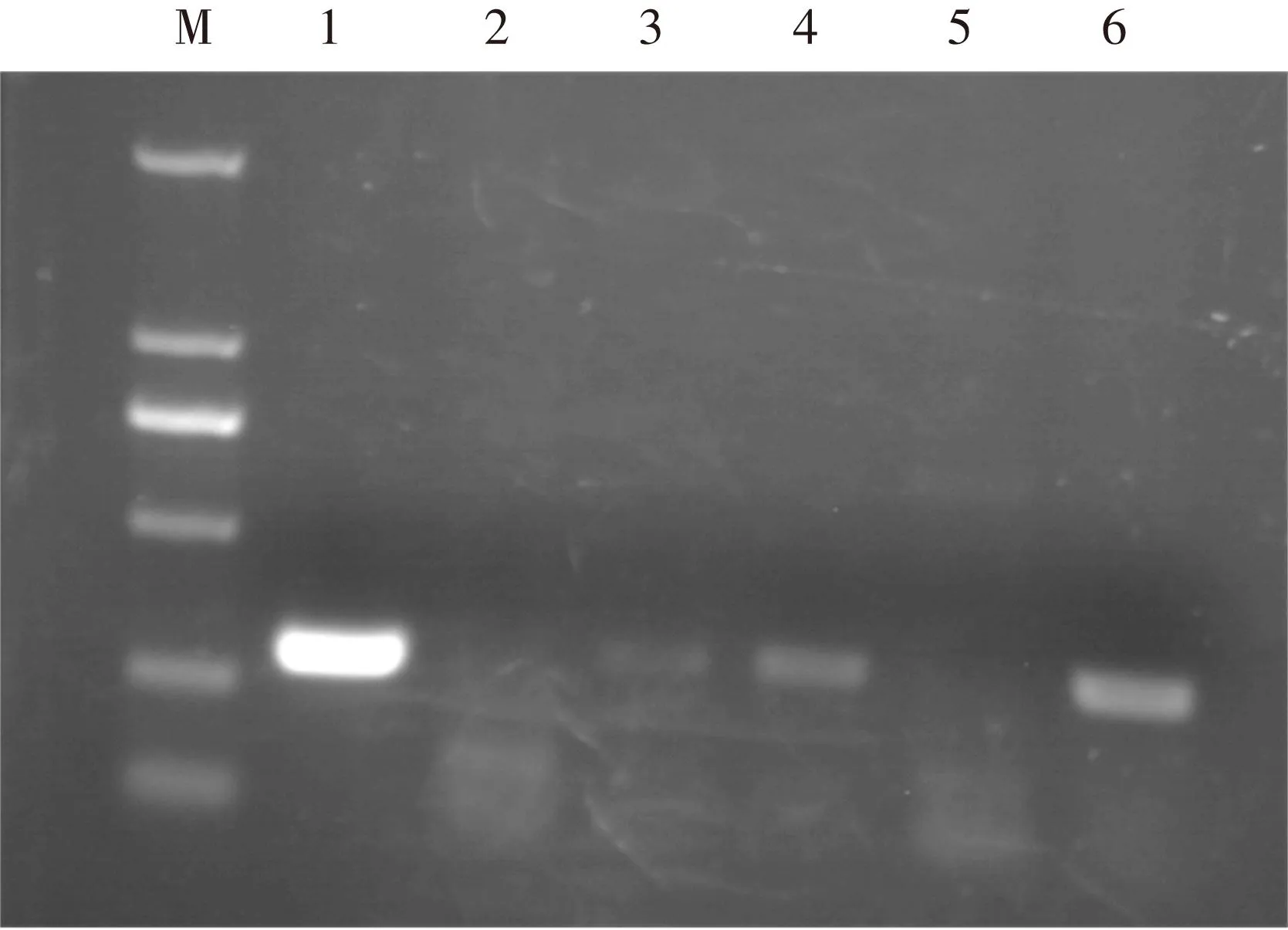
圖4 病毒侵染RT-PCR檢測圖
注:M:Marker DL 2000;1~6:不同cDNA模板PCR產物;1:質粒pTRV2;2:未侵染葉片;3:2葉期侵染嫩葉;4:2葉期侵染老葉;5:6葉期侵染嫩葉;6:6葉期侵染老葉。
Notes: M: Marker DL 2000; 1~6: different cDNA template PCR product; 1: plasmid pTRV2; 2: uninfected leaf; 3: 2-leaf stage infected tender leaf; 4: 2-leaf stage infected old leaf; 5: 6-leaf stage infected tender leaf; 6: 6-leaf stage infected old leaf .
3討論
利用煙草脆裂病毒在甜菜上建立VIGS體系是可行的。煙草脆裂病毒侵染甜菜后,會產生輕微的侵染癥狀,對于甜菜的生長發育影響不是很大。本研究結果顯示,煙草脆裂病毒在甜菜中的擴散能力相對于其他植物諸如煙草、番茄等較弱,環境對于病毒的擴散繁殖能力有很大的影響,植物的培育條件與VIGS的沉默效果密切相關[15]。因此,可以在進一步的工作中探索病毒在甜菜上更為適宜的生長環境,或者改變侵染的方法,或這可以考慮采取幼苗全株浸泡于侵染液。
PDS(八氫番茄紅素脫氫酶基因)是影響類胡蘿卜素合成的限速酶之一,沉默該基因會導致葉綠素合成受限,植物葉片會出現漂白的跡象[16]。該基因通常用作建立VIGS體系的標志性基因,因此,今后進一步研究將甜菜PDS基因構建到pTRV2上進行甜菜VIGS體系建立及利用該體系鑒定甜菜基因功能將是下一步工作的重點。
參考文獻(References)
[1]LU R, MARTIN-HERNANDEZ A M, PEART J R, et al. Virus-induced gene silencing in plants[J]. Methods, 2003, 30 (4): 296-303.
[2]DINESH-KUMAR S P, ANANDALAKSHMI R, MARATHE R, et al. Virus-induced gene silencing[J]. Methods Mol Biol, 2003, 236: 287-294.
[3]BURCH-SMITH T M ,ANDERSON J C ,MARTIN G B, et al. Applications and advantages of virus-induced gene silencing for gene function studies in plants[J]. The Plant Journal, 2004, 39(5):734-746.
[4]RATCLIFF F, MARTIN-HERNANDEZ A M, BAULCOMBE D C. Technical advance. Tobacco rattle virus as a vector for analysis of gene function by silencing [J]. The Plant Journal, 2001, 25(2):237-245.
[5]LIU Y, NAKAYAMA N, SCHIFF M, et al. Virus induced gene silencing of a deficiens ortholog in nicotiana benthamiana [J].Plant Molecular Biology,2004,54(5):701-711.
[6]EKENGREN S K, LIU Y, SCHIFF M, et al. Two mapk cascades, NPR1, and TGA transcription factors play a role in ptomediated disease resistance in tomato [J]. The Plant Journal. 2003, 36:905-917.
[7]HE X, ANDERSON J C, DEL POZO O, et al. Silencing of subfamily I of protein phosphatase 2A catalytic subunits results in activation of plant defenseresponses and localized cell death [J]. The Plant Journal. 2004, 38:563-577.
[8]LIU Y, SCHIFF M, DINESH-KUMAR S P. Virus-induced gene silencing in tomato [J]. The Plant Journal, 2002, 31(6):777-786.
[9]DOHM J, MINOCHE A, HOLTGRWE D, et al. The genome of the recently domesticated crop plant sugar beet beta vulgaris [J]. Nature, 2014, 505(7484):546-549.
[10]VALENTINE T, SHAW J, BLOK V C, et al. Efficient virus-induced gene silencing in roots using a modified tobacco rattle virus vector [J]. Plant Physiol, 2004, 136(4):3999-4009.
[12]呂坤. 棉花病毒誘導的基因沉默體系的建立及其在棉花抗黃萎病中的應用[D].南京:南京農業大學,2013.
Lü Kun. Establishment of virus-induced gene silence in cotton and its application in cotton resistance to verticillium wilt [D].Nanjing: Nanjing Agricultural University, 2013.
[13]MACFARLANE S A. Molecular biology of the tobraviruses [J]. J Gen Virol,1999,80(pt11):2799-2807.
[14]王心宇,呂坤,蔡彩平,等. TRV病毒介導的基因沉默體系在棉花中的建立及應用[J]. 作物學報,2014,(08):1356-1363.
WANG Xinyu, Lü Kun, CAI Caiping, et al.Establishment and application of TRV-mediated Virus-induced gene silencing in cotton [J]. Acta Agronomica Sinica, 2014, (08):1356-1363
[15]宋震,李中安,周常勇.病毒誘導的基因沉默(VIGS)研究進展[J]. 園藝學報,2014,(09):1885-1894.
SONG Zhen, LI Zhongan, ZHOU Changyong.Research advances of Virus-induced gene silencing (VIGS) [J]. Journal Article, 2014, (09):1885-1894.
[16]朱海生,李永平,溫慶放,等. 草莓八氫番茄紅素脫氫酶基因pds的克隆及特征分析[J]. 園藝學報,2011,38(01):55-60.
ZHU Haisheng, LI Yongping, WEN Qingfang, et al. Cloning and characterization of pds gene in fragaria ananass [J]. Journal Article, 2011, 38(01):55-60.

