虹鱒傳染性造血器官壞死病核酸疫苗工程菌發酵工藝研究
趙景壯,徐黎明,劉淼,曹永生,劉紅柏,尹家勝,盧彤巖
(中國水產科學研究院黑龍江水產研究所,黑龍江 哈爾濱 150070)
虹鱒傳染性造血器官壞死病核酸疫苗工程菌發酵工藝研究
趙景壯,徐黎明,劉淼,曹永生,劉紅柏,尹家勝,盧彤巖
(中國水產科學研究院黑龍江水產研究所,黑龍江 哈爾濱 150070)
急性傳染性造血器官壞死病(infectious hematopoietic necrosis,IHN)嚴重威脅虹鱒Oncorhynchus mykiss養殖業,造成嚴重的經濟損失,核酸疫苗已成為虹鱒IHN疾病預防的研究熱點。本研究首先檢測虹鱒IHN核酸疫苗工程菌的遺傳穩定性,結果顯示工程菌在連續培養30代后,仍能保持穩定的質粒拷貝數。質粒酶切結果表明:連續培養30代后的質粒依然保持良好的完整性。在篩選高拷貝工程菌的基礎上,又研究核酸疫苗的高密度發酵培養基、補料及發酵時間。結果表明:最優的發酵培養基配方為:1.2%胰蛋白胨(Tryptone)、2.4%酵母提取物(Yeast Extract)、0.5%甘油、0.017 mol·L-1KH2PO4、0.072 mol·L-1K2HPO4;補料配方為:3%胰蛋白胨、1.5%酵母提取物、50%甘油,最佳發酵時間為16h。本研究可為虹鱒IHN核酸疫苗的規模化生產提供參考。
虹鱒;傳染性造血器官壞死病;核酸疫苗;發酵
傳染性造血器官壞死病(infectious hematopoietic necrosis,IHN)是一種嚴重威脅鮭鱒的急性傳染病[1-3]。它主要感染魚類的脾臟和腎臟等造血組織,引起組織壞死[4],根據魚種、魚齡、病毒菌株及飼養環境的不同,死亡率在80%~100%[5,6]。近年來IHN在我國頻繁暴發,使我國的鮭養殖業經濟損失嚴重[7-10]。IHN的病原為傳染性造血器官壞死病毒(infectious hematopoietic necrosis virus,IHNV),其表面糖蛋白(glycoprotein,G)是病毒表面的主要抗原,與病毒的毒力強弱直接相關,目前多將其基因作為疫苗研制的主要基因[11-13]。
核酸疫苗又稱基因疫苗,是近年來新興的研究領域,主要分為DNA疫苗和RNA疫苗。它主要是將編碼抗原蛋白的基因克隆到真核表達載體上,然后通過注射將重組質粒帶入動物細胞,利用宿主細胞的轉錄系統合成外源抗原蛋白,激活機體免疫反應[14]。目前在預防虹鱒IHN疾病的研究中,已廣泛應用DNA核酸疫苗[5,15,16]。
為了能夠獲得高產量的虹鱒傳染性造血器官壞死病DNA核酸疫苗,本研究在篩選高拷貝工程菌的基礎上,通過研究DNA疫苗的高密度發酵條件,以期為虹鱒傳染性造血器官壞死病核酸疫苗的規模化生產奠定基礎。
1 材料與方法
1.1 材料與儀器
1.2 高拷貝工程菌株的篩選
將本實驗室保存的DH5α/pcDNA3.1-G工程菌在含有100μg·mL-1氨芐青霉素(Amp+)的LB固體培養基上劃線,37℃倒置培養12h后,挑取單菌落于含有100μg·mL-1Amp+的液體培養基中,置于搖床中37℃180r·min-1振蕩培養。當菌體的OD600達到0.4~0.6時,12 000r·min-1離心收集菌體,抽提工程菌株細胞內的質粒,并選擇質粒提取含量最高的菌株作為發酵用種子,進行工程菌的甘油保種并保存于-80℃。
1.3 工程菌質粒穩定性檢測
將本研究中篩選所得的高拷貝工程菌株按1%比例接種于含有100μg·mL-1Amp+的LB液體培養基中,37℃180r·min-1振蕩培養12h后再次按1%比例接種到含有同濃度Amp+的LB液體培養基中進行傳代培養,重復上述傳代操作30次。每次傳代前留取樣品,檢測質粒穩定性。
1.4 發酵培養基的篩選
本研究設計4種發酵用培養基,培養基A:1% Tryptone、0.5%Yeast Extract、1%NaCl;培養基 B:1.6%Tryptone、1%Yeast Extract、0.5%NaCl;培養基C:1.2%Tryptone、2.4%Yeast Extract、0.5%甘油(glycerol)、0.017mol·L-1KH2PO4、0.072 mol·L-1K2HPO4;培養基D:0.5%Tryptone、1.5%Yeast Extract、1%葡萄糖(glucose)、0.009mol·L-1KH2PO4、0.25mol·L-1K2HPO4。以上4種培養基滅菌后均加入微量元素貯存液,終濃度為 1mL·L-1。微量元素貯存液配方如下:0.01mol·L-1FeSO4·7H2O、0.01mol·L-1MnCl2·4H2O、0.01mol·L-1CoSO4·7H2O、0.01mol·L-1CaCl2、0.006mol· L-1CuCl2·2H2O、0.004mol·L-1ZnSO4·7H2O。發酵結束后分別檢測菌體OD600、菌體濕重、質粒含量,篩選出最佳發酵培養基。
1.5 發酵補料的篩選
本實驗通過單因素實驗、Plackett-Burman實驗、最陡爬坡實驗和響應面優化發酵法確定了百香果酸奶最佳發酵工藝。結果表明:以果汁添加量、白砂糖添加量和發酵溫度為自變量,響應面法優化得出百香果酸奶的最佳發酵工藝為白糖添加量7.4%,接種量0.1%,百香果果汁添加量5.5%,發酵溫度42.7℃,發酵時間5 h。在此條件下,酸奶感官評分約達到94.33分,與預測值(93.9705分)基本相符,此結果可充分驗證該試驗模型的可靠性。實驗檢測出百香果酸奶的酸度為73°T,乳酸菌檢測數為5.8×108 mL-1,大腸桿菌沒有檢測出。本實驗研制的百香果酸奶的品質完全符合國家發酵乳的標準[15]。
本研究共設計3種補料,補料Ⅰ:3%Tryptone、1.5%Yeast Extract、50%glycerol;補料Ⅱ:3%Tryptone、1.5%Yeast Extract、50%glucose;補料Ⅲ:5% Tryptone、3%Yeast Extract。發酵結束后分別檢測菌體OD600、菌體濕重、質粒含量,篩選出最佳補料配方。
1.6 發酵培養參數
取-80℃凍存的菌種接種于LB液體培養基中,37℃180r·min-1振蕩培養10h后,按1%的比例轉接到新的LB液體培養基中。待振蕩培養10h后,按1%的比例接種于10L發酵罐內(培養基體積為7L)進行發酵培養。溫度設定為37℃,轉速250r·min-1,罐壓控制在0.01 Mpa左右,pH用氨水和磷酸自動調至(7.0±0.1)。發酵過程中,溶氧控制在30%以上,前期溶氧低于30%時采用提高攪拌轉速增加溶氧,每次轉速提高50r·min-1;當攪拌槳轉速達到最大值時(700r·min-1),采用補料添加速率控制溶氧,當罐體內溶氧高于或低于30%時,分別加快或減慢補料添加速度,發酵時間為18h。發酵過程中每1h取少量發酵液檢測菌體OD600、菌體濕重、質粒含量,確定最佳發酵時間。
2 結果與分析
2.1 高拷貝工程菌的遺傳穩定性
工程菌經連續傳代培養后,質粒DNApcDNA3. 1-G在大腸桿菌DH5α中能夠保持穩定的質粒拷貝數(圖1);經過30代的傳代培養后對質粒進行酶切。結果顯示:在1 725bp處出現特異性條帶,表明質粒依然保持了完整性(圖2),即DH5α/pcDNA3. 1-G可以作為發酵所用的工程菌。
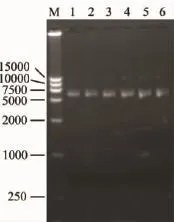
圖1 連續傳代30次質粒穩定性檢測Fig.1 Plasmid stability in 30 consecutive batches
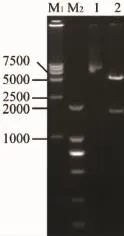
圖2 傳代30次后質粒酶切檢測Fig.2 Identification of plasmid in 30 consecutive batches by dual-digestion
2.2 發酵培養基的篩選結果
將遺傳穩定的高拷貝工程菌DH5α/pcDNA3. 1-G菌株分別接種到4種體積均為500mL的發酵篩選培養基中,37℃180r·min-1振蕩培養12h后分別收集發酵菌體,抽提質粒。發酵結果表明,經過12h的搖瓶發酵后,培養基C的配方更加適合工程菌株的高密度生長及高產量質粒的復制。
2.3 補料的成分
3種補料配方的發酵結果表明,添加了3種補料后工程菌的菌體量明顯提高,其中添加補料Ⅰ后菌體量及單位工程菌的質粒含量都明顯優于其他2種補料。

表1 不同培養基對菌體密度和質粒產量的影響Tab.1 Effect of different media on the cell density of and plasmid DNA yield in the bacterial strain
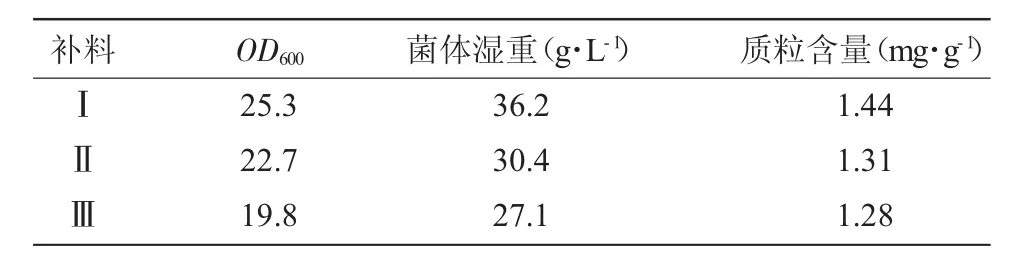
表2 不同補料組成對菌體密度和質粒產量的影響Tab.2 Effect of ingredients of feed medium on the cell densityandplasmidDNAyieldinthebacterialstrain
2.4 發酵時間的影響
發酵過程中每1h取少量發酵液檢測菌體OD600及質粒含量,結果表明:隨著工程菌的發酵培養,質粒的含量也逐漸增加,當發酵16h時單位工程菌的質粒含量達到最高值,此后,雖然工程菌的OD600和質粒含量都仍有增加,但是單位工程菌的質粒含量卻下降,因此16h為最佳的發酵培養時間。
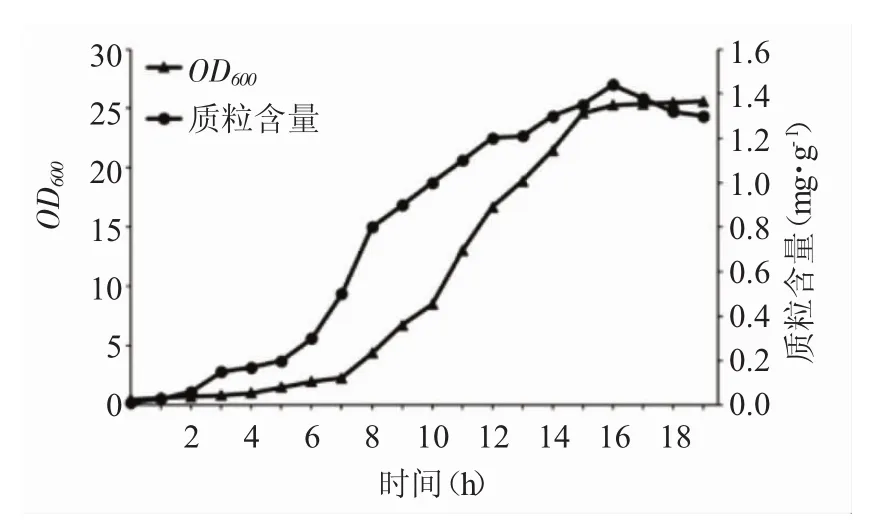
圖3 不同培養時間對質粒發酵結果的影響Fig.3 Influence of culture period on fermentation product
3 討論
核酸疫苗具有構建簡單、免疫效果好、保護期長、生產成本低、使用安全等優點,而被廣泛應用于魚類疾病的免疫預防中[14]。生產核酸疫苗的成本是限制其應用的主要瓶頸之一,能否用低成本獲得高產量的核酸疫苗也是疫苗生產的關鍵技術[17]。
傳統的發酵工藝利用細菌高密度發酵獲得重組蛋白,而目前的核酸疫苗發酵工藝普遍采用補料-分批發酵的方式進行。當發酵過程中培養基的營養成分不足時,采用流加補料的方式提高菌體生長密度以及核酸的表達量[18-20]。核酸的發酵生產不同于常規的高密度培養,獲得高密度的生物產量不一定能夠獲得高的質粒產量。在核酸的發酵過程中要考慮到核酸的容積比(mg/L),只有獲得了相對較高的核酸容積比才能夠降低發酵核酸疫苗的成本。因此摸索、優化核酸發酵條件是核酸疫苗生產中不可忽略的重要因素。
菌體核酸的穩定性直接影響到最終核酸疫苗的表達量,在高密度發酵擴增菌體時核酸容易丟失[21]。本研究在優化DH5α/pcDNA3.1-G的發酵工藝前,建立了穩定的發酵工程菌株,并檢測了其遺傳的穩定性。結果表明:連續傳代30次后,工程菌仍然有穩定的遺傳性,能夠用于建立大規模發酵過程中的種子庫。本研究選擇了4種大腸桿菌常用的培養基,并對其改良后進行了發酵篩選。結果表明,培養基C的配方更適合DH5α/pcDNA3.1-G菌株的高密度發酵。培養基C和D含有的碳及氮源量高于培養基A、B,其中的磷酸鹽緩沖性對穩定發酵過程中的pH起到了一定的緩沖作用。培養基C比D更加適用于核酸疫苗的發酵,可能是其利用甘油替代葡萄糖的緣故。在發酵的過程中,當菌體的比生長速率超過了一定值后會產生大量的乙酸,而大腸桿菌能夠直接利用葡萄糖而產生大量的乙酸,抑制細菌的生長和質粒的復制,并且菌體比生長速率太快不利于質粒的大量復制[22-24]。利用甘油代替葡萄糖,不但能夠降低發酵過程中乙酸的產量,還能降低大腸桿菌的比生長速率,獲得較高的菌體生物量及質粒產量[22]。
本研究對發酵中補料的篩選結果表明,添加補料Ⅰ后,菌體量及單位工程菌的核酸含量都明顯優于其他2種補料。Danquah等[25]的研究也表明,采用甘油為碳源進行的補料培養中,核酸的產量明顯提高。這可能是由于本研究采用甘油為補料中主要碳源,并以恒速流加的補料方式更加符合菌株及目的產物的生產特性。本研究中對發酵時間的摸索表明,發酵2~4h后質粒復制速率升高,16h時單位菌體的質粒含量達到峰值;隨后,雖然菌體的OD600有緩慢的升高,但是單位菌體的質粒含量反而下降,說明在菌體的生長進入對數生長后期時,質粒出現了部分丟失,這可能是由于培養基的養分消耗殆盡,影響了菌體的遺傳穩定性。因此發酵16h后結束發酵,不但可以獲得高產量的質粒,還能減低發酵的生產成本。
本研究對虹鱒傳染性造血器官壞死病核酸疫苗的發酵工藝進行了初步研究。結果表明:培養基C:1.2%Tryptone、2.4%Yeast Extract、0.5%glycerol、0.017mol·L-1KH2PO4、0.072mol·L-1K2HPO4;補料Ⅰ:3%Tryptone、1.5%Yeast Extract、50%glycerol更加適合虹鱒傳染性造血器官壞死病核酸疫苗的發酵;發酵16h能夠獲得高產量的核酸疫苗。
[1]Lapatra S E.The use of serological techniques for virus surveillance and certification of finfish[J].Annual Review ofFish Diseases,1996,6(6):15-28.
[2]Amend D F.Detection and transmission of infectious hematopoieticnecrosisvirusinrainbowtrout[J].JWildlDis, 1975,11(4):471-478.
[3]Anderson E,Clouthier S,Shewmaker W,et al.Inactivated infectious hematopoietic necrosis virus(IHNV)vaccines[J].Journal ofFish Diseases,2008,31(10):729-745.
[4]Amend D F,Yasutake W T and Mead R W.A hematopoietic virus disease of rainbow trout and sockeye salmon[J]. Transactions of the American Fisheries Society,1969,98(4):796-804.
[5]Alonso M and Leong J A.Licensed DNA vaccines against infectious hematopoietic necrosis virus(IHNV)[J].Recent Patents on DNAand Gene Sequences,2013,7(1):62-65.
[6]Xu L,Liu M,ZhaoJ,et al.Epitope mappingofthe infectious hematopoietic necrosis virus glycoprotein by flow cytometry[J].BiotechnologyLetters,2014,36(10):2109-2116.
[7]徐立蒲,王靜波,曹歡,等.北京地區鮭鱒魚類傳染性造血器官壞死病的監測分析與防控[J].科學養魚,2016(4): 54-56.
[8]余澤輝,耿毅,汪開毓,等.四川地區一株傳染性造血器官壞死病毒的分離鑒定及系統發育分析[J].水產學報, 2015,39(5):745-753.
[9]趙羽涵,徐黎明,劉淼,等.傳染性造血器官壞死病毒新疆株的分離與鑒定[J].水產學雜志,2016,29(1):12-16.
[10]李曉菲,溫書香,張越,等.一株傳染性造血器官壞死病病毒的分離和鑒定[J].黑龍江畜牧獸醫,2016,6(11): 161-164.
[11]Corbeil S,Lapatra S E,Anderson E D,et al.Evaluation of the protective immunogenicity of the N,P,M,NV and G proteins ofinfectious hematopoietic necrosis virus in rainbowtrout Oncorhynchus mykiss using DNA vaccines[J]. Diseases ofAquatic Organisms,1999,39(1):29-36.
[12]Emmenegger E J,Meyers T R,Burton T O,et al.Genetic diversity and epidemiology of infectious hematopoietic necrosis virus in Alaska[J].Diseases of Aquatic Organisms,2000,40(3):163-176.
[13]趙景壯,徐黎明,劉淼,等.魚類傳染性造血器官壞死病病毒糖蛋白的截短表達及免疫原性檢測[J].細胞與分子免疫學雜志,2014,30(12):1238-1242.
[14]郝貴杰,沈錦玉,潘曉義.核酸疫苗的研究進展及其在魚類免疫中的應用[J].大連水產學院學報,2007,22(2):142-148.
[15]Ballesteros N A,Alonso M,Saint-Jean S R,et al.An oral DNA vaccine against infectious haematopoietic necrosis virus(IHNV)encapsulated in alginate microspheres induces dose-dependent immune responses and significant protection in rainbow trout(Oncorhynchus mykiss)[J]. Fish and Shellfish Immunology,2015,45(2):877-888.
[16]Penaranda MM,Lapatra S E and Kurath G.Specificity of DNA vaccines against the U and M genogroups of infectious hematopoietic necrosis virus(IHNV)in rainbow trout(Oncorhynchus mykiss)[J].Fish and Shellfish Immunology,2011,31(1):43-51.
[17]Prather K J,Sagar S,MurphyJ,et al.Industrial scale production of plasmid DNA for vaccine and gene therapy: plasmid design,production,and purification[J].Enzyme and Microbial Technology,2003,33(7):865-883.
[18]Silva F,Queiroz J A and Domingues F C.Plasmid DNA fermentation strategies:influence on plasmid stability and cell physiology[J].Applied Microbiologyand Biotechnology,2012,93(6):2571-2580.
[19]張明森,丘力功,韋劍,等.利用菌體生長限制效應的HBVDNA疫苗發酵工藝[J].中國藥物經濟學,2013,8(8):27-29.
[20]OMahonyK,FreitagR,HilbrigF,et al.Strategies for high titre plasmid DNA production in Escherichia coli DH5α[J].Process Biochemistry,2007,42(7):1039-1049.
[21]彭艷,李平,劉蘋,等.pUC118-ski/DH5α工程菌發酵工藝的優化[J].中國生物制品學雜志,2012,25(4):495-498.
[22]付強,郭廣君,程立坤,等.核酸疫苗上游生產工藝探討[J].動物醫學進展,2014,35(12):140-143.
[23]張泉,郭曉宇,袁維峰,等.用于質粒DNA規模化生產的大腸桿菌發酵培養基的篩選[J].中國生物工程雜志, 2006,27(1):102-105.
[24]Doelle H W,Ewings K N and Hollywood N W.Regulation ofglucose metabolism in bacterial systems[M]//Microbial Reactions.Springer Berlin Heidelberg,1982:1-35.
[25]Danquah M K and Forde G M.Development of a pilot-scale bacterial fermentation for plasmid-based biopharmaceutical production using a stoichiometric medium[J].Biotechnology and Bioprocess Engineering,2008,13(2):158-167.
Engineering Bacterial Fermentation of DNA Vaccine Against Rainbow Trout Infectious Hematopoietic Necrosis
ZHAO Jing-zhuang,XU Li-ming,LIU Miao,CAO Yong-sheng,LIU Hong-bai,YIN Jia-sheng,LU Tong-yan
(Heilongjiang River Fisheries Research Institute,Chinese Academy of Fishery Sciences,Harbin 150070,China)
Infectious hematopoietic necrosis(IHN),as one of the most serious disease causing acute,systemic and virulent disease in rainbow trout Oncorhynchus mykiss,often results in serious economic losses in rainbow trout industry.The DNA vaccine against IHN has been widely studied to make the efficient protection.The genetic stability of engineering bacteria was first studied and the engineering bacterium with high copy was screened in order to obtain high yield of IHN DNA vaccine.The results showed that the engineering bacteria maintained stable plasmid copy number in thirty-generation succession culture,and the plasmid remained good integrity according to enzyme digestion.The optimal medium for fermentation was screened in the medium of 2%Tryptone,2.4%Yeast Extract,0.5%glycerol,0.017 mol·L-1KH2PO4and 0.072 mol·L-1K2HPO4.It was found that the optimal feeding was comprised of 3% Tryptone,1.5%Yeast Extract,50%glycerol during the culture time of 16 h.The optimal condition for IHN DNA vaccine fermentation provides a reference for the large-scale production of rainbow trout IHN DNA vaccine.
rainbow trout;infectious hematopoietic necrosis virus;DNA vaccine;fermentation
Q785;S917
A
1005-3832(2016)06-0014-05
2016-09-20
國家科技支撐計劃(2012BAD25B02);中央級公益性科研院所基本科研業務費專項(HSY201410);黑龍江省冷水性魚類種質資源及增養殖重點開放實驗室(201104).
趙景壯(1987-),男,助理研究員.E-mail:zhaojingzhuang1987@163.com
盧彤巖(1967-),女,研究員.E-mail:lutongyan@hrfri.ac.cn

