十六烷基三甲基溴化銨改性沸石對腐殖酸的吸附性能研究*
張國珍 高小波 武福平 楊 光 鞏師俞
(蘭州交通大學環境與市政工程學院,甘肅 蘭州 730070)
腐殖酸是動植物殘骸腐爛后形成的一類具有復雜結構的大分子有機酸,一般存在于地表水、土壤、河流、有機沉淀物中[1],其分子內含有羧基、羰基等多種活性官能團[2]。腐殖酸主要包括黃腐酸、富里酸和親水性小分子有機物[3],是環境污染物的重要絡合劑或吸附劑,對各種污染物的環境行為、毒性和生物有效性有重要影響。另外,在水廠消毒時,腐殖酸還會產生對人體有較大毒害作用的消毒副產物[4]48。因此,去除水中的腐殖酸對當前水環境治理具有重要的現實意義。
去除水中腐殖酸主要有吸附法、強化絮凝法、光電化學法等[5]。其中,吸附法具有處理高效、費用低廉和操作簡單等優點,被認為是去除水中腐殖酸最有效的方法。大孔隙的吸附劑(如活性炭等)在吸附

表1 沸石的主要化學成分
腐殖酸過程中,其孔隙很容易被腐殖酸大分子絡合物堵塞[6],進而影響吸附性能。沸石表面孔隙較小,吸附性能受孔隙堵塞影響相對較弱;但由于沸石表面的親水官能團和負電荷,導致其對腐殖酸的吸附性能不佳[7]。陽離子表面活性劑改性沸石對水中多種污染物有較好的去除效果[8]611-612。因此,選擇合適的陽離子表面活性劑對沸石進行改性是必要的。目前,許多學者已經考察了十六烷基三甲基溴化銨(CTAB)改性沸石對水中菲、硝酸鹽、鉻酸鹽、三氯生等的吸附性能[8]611-617,[9-11]。
本研究以CTAB為改性劑,制備了CTAB改性沸石,用于吸附水中的腐殖酸。考察了pH、吸附時間及腐殖酸初始濃度對CTAB改性沸石吸附腐殖酸的影響;分別擬合了吸附等溫方程和反應動力學方程;采用掃描電子顯微鏡(SEM)、X射線光電子能譜儀(XPS)、傅立葉轉換紅外光譜分析儀(FTIR)對沸石改性前后進行結構表征,以期為水環境治理中腐殖酸的去除提供基礎依據。
1 材料及方法
1.1 材料與儀器
沸石為選自甘肅省白銀市的天然斜發沸石,呈磚紅色,用去離子水反復沖洗后煮沸,于105 ℃烘干后過30目篩備用。沸石的主要化學成分如表1所示。
試劑:CTAB、NaOH、HCl均為分析純;腐殖酸為化學純。
儀器:752紫外—可見分光光度計、JSM-5600LV型SEM、VG ESCALAB-210型XPS、IRPrestige-21型FTIR。
1.2 腐殖酸溶液的配制
稱取一定質量的腐殖酸,加入去離子水攪拌,用NaOH溶液調節pH為10.0左右,攪拌使其充分溶解,用0.45 μm醋酸纖維酯濾膜過濾后得到腐殖酸溶液。
1.3 腐殖酸濃度的測定
溶液中腐殖酸濃度采用紫外分光光度法測定[12],采用254 nm波長處的吸光度來表征。
1.4 CTAB改性沸石的制備
稱取沸石10 g,加入0.02 mol/L的100 mL CTAB溶液中,在恒溫振蕩器上控制溫度為25 ℃、轉速為120 r/min,振蕩24 h,用去離子水反復沖洗干凈,置于90 ℃的恒溫干燥箱中烘干,即制得CTAB改性沸石。
1.5 吸附實驗
稱取1 g CTAB改性沸石,分別投加到100 mL一定腐殖酸初始濃度的溶液中,用HCl溶液調節pH,在溫度為25 ℃、轉速為200 r/min條件下恒溫振蕩一段時間后,進行過濾,測定腐殖酸濃度,根據式(1)和式(2)計算吸附容量。

(1)
(2)
式中:qe為平衡吸附容量,mg/g;c0為腐殖酸初始質量濃度,mg/L;ce為腐殖酸平衡質量濃度,mg/L;V為腐殖酸溶液體積,L;m為吸附劑質量,g;qt為腐殖酸t時刻吸附容量,mg/g;ct為腐殖酸t時刻質量濃度,mg/L;t為吸附時間,min。
1.6 熱力學和動力學擬合模型
1.6.1 吸附等溫方程
Langmuir吸附等溫方程和Freundlich吸附等溫方程分別見式(3)和式(4)[13]。
(3)
qe=KFce1/n
(4)
式中:qm為最大吸附容量,mg/g;KL為Langmuir吸附常數,L/mg;KF為Freundlich吸附常數,mg1-1/n·L1/n/g;n為經驗常數。
1.6.2 反應動力學方程
準一級反應動力學方程和準二級反應動力學方程分別見式(5)和式(6)[14]:
(5)
(6)
式中:k1為準一級反應動力學常數,min-1;k2為準二級反應動力學常數,g/(mg·min)。
1.7 結構表征
采用SEM進行形貌分析,分辨率可達3.5 nm;采用XPS測定元素組成;采用FTIR進行紅外光譜分析,波數為400~4 000 cm-1。
2 結果與討論
2.1 吸附時間的影響
控制腐殖酸初始質量濃度為10 mg/L、pH為7.0,考察吸附時間對CTAB改性沸石吸附腐殖酸的影響,結果如圖1所示。由圖1可知,CTAB改性沸石對腐殖酸的吸附容量和去除率均隨著吸附時間的延長而增加,在吸附時間為180 min時,吸附容量達到0.23 mg/g,去除率達到23.0%。吸附時間大于180 min后,吸附容量和去除率的增長均趨于緩和。為盡可能縮短吸附時間,CTAB改性沸石對腐殖酸的吸附時間選擇180 min。

圖1 吸附時間對CTAB改性沸石吸附腐殖酸的影響Fig.1 Effect of adsorption time on humic acid adsorption by CTAB modified zeolite
2.2 腐殖酸初始濃度的影響
設置腐殖酸初始質量濃度分別為1、3、5、10、15、20 mg/L,調節pH為7.0,吸附180 min后,考察腐殖酸初始濃度對CTAB改性沸石吸附腐殖酸的影響,結果如圖2所示。由圖2可知,隨著腐殖酸初始質量濃度由1 mg/L增大到20 mg/L,CTAB改性沸石對腐殖酸的吸附容量逐漸增加,從0.04 mg/g增加到0.44 mg/g。這是由于腐殖酸表面帶有負電荷,在水中易與CTAB改性沸石帶有的正電荷相互作用[15]。而隨著腐殖酸初始濃度增加,CTAB改性沸石對腐殖酸的去除率逐漸降低,與ANIRUDHAN等[16]的研究結果一致。綜合考慮CTAB改性沸石對腐殖酸的吸附容量和去除率,在腐殖酸的初始質量濃度為10 mg/L時,吸附容量為0.33 mg/g,去除率為32.5%,吸附容量和去除率相對較高,因此選擇腐殖酸的初始質量濃度為10 mg/L。
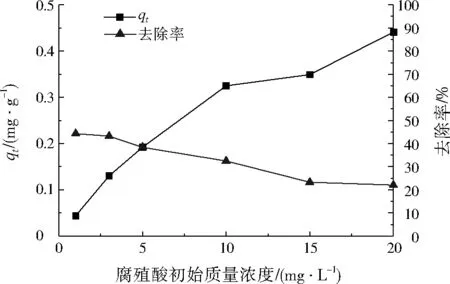
圖2 腐殖酸初始質量濃度對CTAB改性沸石吸附腐殖酸的影響Fig.2 Effect of humic acid initial mass concentration on humic acid adsorption by CTAB modified zeolite
2.3 pH的影響
控制腐殖酸初始質量濃度為10 mg/L、吸附時間為180 min,調節pH為3.0、5.0、7.0、9.0、11.0,考察pH對CTAB改性沸石吸附腐殖酸的影響,結果如圖3所示。由圖3可知,隨著溶液pH的增大,CTAB改性沸石對腐殖酸的吸附容量不斷減小:pH為3.0時,吸附容量為0.37 mg/g;pH為11.0時,吸附容量為0.09 mg/g。這是由于隨著溶液pH的增大,OH-濃度增大,中和了CTAB改性沸石表面的正電荷,使CTAB改性沸石對腐殖酸的吸附容量減小。腐殖酸的去除率隨pH的變化與吸附容量的變化一致。由此可見,酸性條件有利于CTAB改性沸石對腐殖酸的吸附。雖然pH為7.0時,CTAB改性沸石對腐殖酸的吸附容量僅為0.16 mg/g,小于pH為3.0時的吸附容量,但考慮到實際水體pH接近中性,故將pH定為7.0。

圖3 pH對改性沸石吸附腐殖酸的影響Fig.3 Effect of pH on humic acid adsorption by CTAB modified zeolite
2.4 吸附等溫方程的擬合
設置溫度為25 ℃、轉速為200 r/min、pH為7.0、腐殖酸初始質量濃度分別為1、3、5、10、15、20 mg/L,分別利用Langmuir吸附等溫方程和Freundlich吸附等溫方程進行非線性擬合(見圖4),吸附等溫方程相關參數見表2。擬合Langmuir吸附等溫方程和Freundlich吸附等溫方程時,R2分別為0.998、0.967,說明CTAB改性沸石對腐殖酸的吸附更符合Langmuir吸附等溫方程,因此CTAB改性沸石對腐殖酸的吸附機制為單分子層吸附,并且吸附位點是等效的[4]51。

圖4 吸附等溫方程擬合結果Fig.4 Fitting results of adsorption isotherm equations

Langmiurqm/(mg·g-1)KL/(L·mg-1)R2FreundlichKF/(mg1-1/n·L1/n·g-1)nR20.6380.1470.9980.1021.8310.967
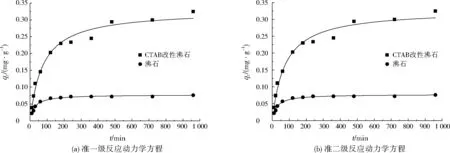
圖5 反應動力學方程擬合結果Fig.5 Fitting results of reaction kinetic equations

項目qe/(mg·g-1)準一級反應動力學方程k1/min-1R2準二級反應動力學方程k2/(g·mg-1·min-1)R2沸石0.0825.1180.9840.5130.984CTAB改性沸石0.3374.8590.9780.0410.978
2.5 反應動力學方程的擬合
在溫度為25 ℃、轉速為200 r/min、腐殖酸初始質量濃度為10 mg/L,pH為7.0條件下,分別利用準一級反應動力學方程和準二級反應動力學方程對沸石和CTAB改性沸石吸附腐殖酸的過程進行非線性擬合(見圖5),反應動力學方程相關參數見表3。k1、k2能反映沸石或CTAB改性沸石對腐殖酸的吸附速率,k1、k2越大,說明對腐殖酸的吸附速率越快。由表3可知,利用準一級反應動力學方程和準二級反應動力學方程擬合時,CTAB改性沸石對腐殖酸的吸附速率明顯快于沸石。擬合準一級反應動力學方程和準二級反應動力學方程時,沸石的R2均為0.984,CTAB改性沸石的R2均為0.978,說明沸石或CTAB改性沸石吸附腐殖酸的過程均可利用準一級反應動力學方程或準二級反應動力學方程進行擬合。CTAB改性沸石對腐殖酸的平衡吸附容量明顯大于沸石,可以看出CTAB改性沸石對腐殖酸的吸附性能優于沸石。

圖6 SEM分析結果Fig.6 Results of SEM analysis

注:1—Si;2—C;3—O;4—Na。圖7 XPS分析結果Fig.7 Results of XPS analysis
2.6 結構表征
2.6.1 SEM分析
對沸石和CTAB改性沸石進行SEM分析,結果如圖6所示。由圖6可知,沸石表面和CTAB改性沸石表面均凹凸不平,但CTAB改性沸石的溝槽、凹坑較少,且表面顏色較淺,說明CTAB改性沸石已負載CTAB,但未引起晶體結構變化。
2.6.2 XPS分析
對沸石和CTAB改性沸石進行XPS分析,結果如圖7和表4所示。CTAB改性沸石中C占22.43%,相比沸石中C所占比例明顯增加。這主要是由于CTAB中含有大量季銨型陽離子,而沸石經CTAB改性的過程中,季銨型陽離子通過離子交換作用將官能團表面的C附著于沸石表面,這有利于提高CTAB改性沸石對腐殖酸的吸附性能。
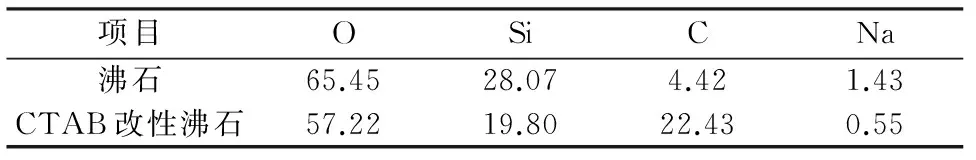
表4 主要元素的質量分數
2.6.3 FTIR分析
對沸石、CTAB改性沸石和吸附實驗后的CTAB改性沸石進行FTIR分析,結果如圖8所示。由圖8可知,CTAB改性沸石相比沸石,在2 850、2 920 cm-1處出現甲基和亞甲基的伸縮振動吸收峰,表明CTAB改性沸石已負載CTAB,與SEM分析結果(見圖6)一致。對于吸附實驗后的CTAB改性沸石,3 500~3 700 cm-1處有大量的鋸齒峰,源于醇和酚的羥基伸縮振動;2 200~2 400 cm-1處出現較寬的吸收峰,源于苯酚、醇與羧酸的羥基伸縮振動;1 500~2 000 cm-1處的鋸齒峰源于羧酸、酰胺、酯等的羰基伸縮振動。因此,經過吸附實驗,腐殖酸已大量被CTAB改性沸石吸附。

圖8 FTIR分析結果Fig.8 Results of FTIR analysis
3 結 論
(1) 在溫度為25 ℃、轉速為200 r/min的條件下,選擇pH為7.0、腐殖酸初始質量濃度為10 mg/L、吸附時間為180 min,CTAB改性沸石對腐殖酸的吸附容量為0.16 mg/g。
(2) 吸附等溫方程的擬合結果表明,Langmuir吸附等溫方程比Freundlich吸附等溫方程的擬合效果更好,說明CTAB改性沸石對腐殖酸的吸附機制為單分子層吸附。準一級反應動力學方程和準二級反應動力學方程均可以描述CTAB改性沸石對腐殖酸的吸附。
(3) 與沸石相比,CTAB改性沸石中C所占比例明顯增加,改性效果良好;CTAB改性沸石上出現了亞甲基、甲基的伸縮振動吸收峰,說明CTAB改性沸石已負載CTAB;吸附實驗后的CTAB改性沸石出現羥基與羰基伸縮振動吸收峰,說明腐殖酸已被大量吸附。
[1] 曾憲成.腐植酸從哪里來,到哪里去[J].腐植酸,2012(4):1-10.
[2] 王海濤,朱琨,魏翔,等.腐殖酸鈉和表面活性劑對黃土中石油污染物解吸增溶作用[J].安全與環境學報,2004,4(4):52-55.
[3] 王津南,李愛民,張龍,等.吸附法去除水體中腐殖酸的研究進展[J].環境污染與防治,2008,30(8):73-74.
[4] 方金鵬,張盼月,曾光明,等.改性斜發沸石吸附水中腐殖酸的研究[J].中國給水排水,2008,24(23).
[5] 王亞軍,馬軍.水體環境中天然有機質腐殖酸研究進展[J].生態環境學報,2012,21(6):1155-1165.
[6] SUMMERS R S,ROBERTS P V.Activated carbon adsorption of humic substances:Ⅱ.size exclusion and electrostation interactions[J].Journal of Colloid & Interface Science,1988,122(2):382-397.
[7] 趙艷玲,閆鳳美,張軍麗,等.沸石的交聯殼聚糖改性及對腐殖酸的吸附研究[J].化學世界,2014,55(7):396-397.
[8] 李佳,林建偉,詹艷慧,等.溴化十六烷基吡啶改性沸石對水中菲的吸附作用[J].環境科學,2014,35(2).
[9] 李小建,王德漢.改性沸石對水體中硝酸鹽的吸附機理及其殘渣的資源化利用[J].中國環境管理干部學院學報,2011,21(2):13-17.
[10] 張宏華,林建偉.HDTMA改性沸石對鉻酸鹽的吸附作用研究[J].浙江工業大學學報,2010,38(5):494-498.
[11] 何敏禎,胡勇有,雷超,等.HDTMA改性沸石對三氯生的吸附特性研究[J].環境科學學報,2013,33(1):20-28.
[12] ZHOU Qunhui,CABANISS S E,MAURICE P A.Considerations in the use of high-pressure size exclusion chromatography (HPSEC) for determining molecular weights of aquatic humic substances[J].Water Research,2000,34(14):3505-3514.
[13] 馬偉.固水界面化學與吸附技術[M].北京:冶金工業出版社,2011.
[14] 錢吉彬,楊朗,張華,等.鎮江斜發沸石對氨氮的吸附動力學及熱力學研究[J].環境工程學報,2011,5(2):327-330.
[15] 楊慧芬,張偉娜,胡瑞娟.十六烷基三甲基溴化銨改性沸石對水中Cr(Ⅵ)的吸附去除率[J].硅酸鹽學報,2010,38(11):2144-2146.
[16] ANIRUDHAN T S,RAMACHANDRAN M.Surfactant-modified bentonite as adsorbent for the removal of humic acid from wastewaters[J].Applied Clay Science,2007,35(3):276-281.

