鏈狀亞歷山大藻不同生長狀態差異表達microRNA的篩選和驗證*
耿慧利, 隋正紅, 任源源, 杜青偉, 劉 源
(中國海洋大學海洋生物遺傳學與育種教育部重點實驗室, 山東 青島 266003)
?
鏈狀亞歷山大藻不同生長狀態差異表達microRNA的篩選和驗證*
耿慧利, 隋正紅**, 任源源, 杜青偉, 劉源
(中國海洋大學海洋生物遺傳學與育種教育部重點實驗室, 山東 青島 266003)
摘要:從鏈狀亞歷山大藻(Alexandrium catenella)延遲期、對數期2個小RNA文庫中選擇了2個差異表達的microRNA(osa-miR2876和rgl-miR5139),設計f/2培養下延遲期、對數期和高氮、高磷、高錳對數期5個條件,用qPCR的方法對其表達進行了檢測。研究建立了以5.8srRNA為內參基因,以 SYBR Green I 為熒光染料,用加尾法熒光定量PCR檢測microRNA在不同生長狀態相對表達的方法。microRNA的表達量在對數期和誘導下對數期均低于延遲期,高錳條件下對數期均為最低,且延遲期的表達量分別是高錳條件表達量的18.63和14.12倍。microRNA負調控靶基因的表達,而osa-miR2876和rgl-miR5139在對數期均為下調表達,說明其靶基因參與的細胞生理過程:DNA復制、修復、嘌呤、嘧啶堿基的代謝、RNA聚合酶的代謝等過程呈現激活狀態,而上述生理過程的激活均有利于藻細胞增殖。這些結果表明:osa-miR2876和rgl-miR5139可能在鏈狀亞歷山大藻的快速分裂和增殖中發揮著非常重要的調控作用。本文研究結果為甲藻兼性營養型正確性提供了進一步的證據,同時rgl-miR5139在細胞快速生長階段的下調表達提示在該階段下異養營養型可能占優勢。本研究說明了microRNA在鏈狀亞歷山大藻快速生長過程中可能發揮著重要的調節作用。也為其他物種microRNA的研究和檢測提供了快速簡便、特異性好的研究方法。
關鍵詞:鏈狀亞歷山大藻; microRNA; qPCR; 差異表達
甲藻是一類具有2個鞭毛能夠自由游動的單細胞原生生物,在海洋生態系統的初級生產中發揮著重要的作用[1]。最初,甲藻被認為只能進行自養作用,但在近二十年來,研究發現甲藻是兼性營養型的,既能夠進行光合作用又能通過鞭毛孔分泌細胞質到胞外形成捕食籠將獵物包裹并進行消化[2]。甲藻是數量最多的能夠產生毒素的物種類型,占有害赤潮藻類的75%[3]。由產毒甲藻引起的赤潮給漁業生產、海洋環境和人類的健康帶來了嚴重的影響。甲藻屬中的許多物種都能夠產生一種神經性麻痹貝毒PSTs(Paralytic shellfish toxins),能夠引發貝類麻痹性中毒,而誤食這種貝類將給人的神經系統帶來極大的損害[4]。鏈狀亞歷山大藻(Alexandriumcatenella)是一種典型的能夠產生PSTs的有毒甲藻,屬于甲藻門,甲藻綱,多甲藻目,膝溝藻科,亞歷山大藻屬,研究者做了很多努力以期找到鏈狀亞歷山大藻爆發性增殖的分子機制,包括:轉錄組測序及分析[5],蛋白質組分析[6],與藻細胞增殖有關基因[7]的表達分析等。但是,至今在赤潮爆發過程中藻細胞大量增殖的機制仍然不清楚。
microRNA(Micro ribonucleic acids)是真核生物中普遍存在的一類長約18~25個核苷酸的內源性非編碼RNA,它能在轉錄水平或轉錄后水平通過mRNA剪切和抑制蛋白質翻譯的方式負調控靶基因的表達[8]。在植物中,microRNA基因首先被轉錄成microRNA前體(pri-microRNA)的初級轉錄物,隨后pri-microRNA經過Dicer酶的剪切產生成熟的microRNA,成熟的microRNA會選擇性整合入RISC(RNA induced silencing complex)中特異性識別靶基因。絕大多數植物microRNA都與靶基因mRNA近乎完全匹配進而引發靶mRNA的降解[9]。研究表明,microRNA在植物的多種生長代謝過程中發揮著至關重要的調節作用,如植物的生長、發育、細胞的分化、信號轉導及響應各種生物的或非生物的脅迫[10]。
目前,microRNA已成功地在多種高等植物中得到鑒定,如:擬南芥、花生、水稻,小麥等[11-14]。但是關于藻類microRNA的發現僅僅在近幾年才有報道,單細胞藻類的更少,僅有萊茵衣藻,三角褐指藻等[15-16]。為了研究microRNA在鏈狀亞歷山大藻不同生長時期的調控作用,我們構建了延遲期、對數期2個小RNA文庫,并用Illumina測序平臺進行了高通量測序,從中發現了在2個不同生長時期差異表達的microRNA: osa-miR2876和rgl-miR5139,經靶基因預測和KEGG注釋推測它們可能在該藻快速生長過程中具有重要調控作用[17]。
在本研究中,為驗證高通量測序結果及解析osa-miR2876和rgl-miR5139的調控作用,用qPCR的方法對其在鏈狀亞歷山大藻中的不同生長時期的表達進行了檢測,并對其調控功能進行了分析。這是首次在甲藻類群中用實驗的方法對microRNA 的表達進行的檢測。我們的研究結果不僅能夠證實microRNA在甲藻中的存在,及在鏈狀亞歷山大藻不同生長時期差異表達,而且為闡明鏈狀亞歷山大藻爆發性增殖的分子機理提供了依據。
1材料與方法
1.1 藻細胞的培養和收集
鏈狀亞歷山大藻種來自于中國海洋大學海洋生命學院教育部遺傳育種重點實驗室。用f/2培養基(不含硅)對藻進行培養,溫度為(20±1)°C,光暗周期控制在12 h/12 h,光量子密度為30~35μmol·m-2·s-l[18]。用于實驗的藻首先經過48 h的黑暗處理,即同步化處理[19],隨后處理過的藻細胞以2×106細胞/升的密度接入新的f/2培養基。在中午分別收集生長至延遲期(培養2d)和對數期(分別培養至第7天和第12天)的藻細胞,每個樣品約含5×106個藻細胞。有研究表明,高濃度的氮、磷、錳能促進藻細胞的生長[20-21],因此除延遲期、對數期2個樣品外,又選擇了3個誘導對數期進行qPCR試驗,分別是:高氮誘導對數期(NaNO3終濃度為2.304mmol/L),高磷誘導對數期(NaH2PO4·2H2O終濃度為0.144mmol/L)高錳誘導對數期(MnCl2·4H2O終濃度為2.730μmol/L)。5個不同生長時期和條件的樣品(約含5×106個藻細胞)用離心機以4 000g的速度離心6 min,然后將形成藻球的1.5mL EP管及時放入液氮中并于-80 °C冰箱保存。
1.2 引物設計
本實驗采用的是加尾法qPCR[22],反向通用引物由試劑盒采用SYBR○RPrimeScriptxTMmiRNA RT-PCR Kit (日本的TaKaRa公司)。特異的正向引物根據miRNA的序列進行設計,基本與miRNA的序列一致。當退火溫度Tm值偏低時,在序列5′端增加幾個G或者C堿基,保證PCR的退火溫度在60 °C左右。設計好的引物由華大公司進行合成。引物序列見表1。
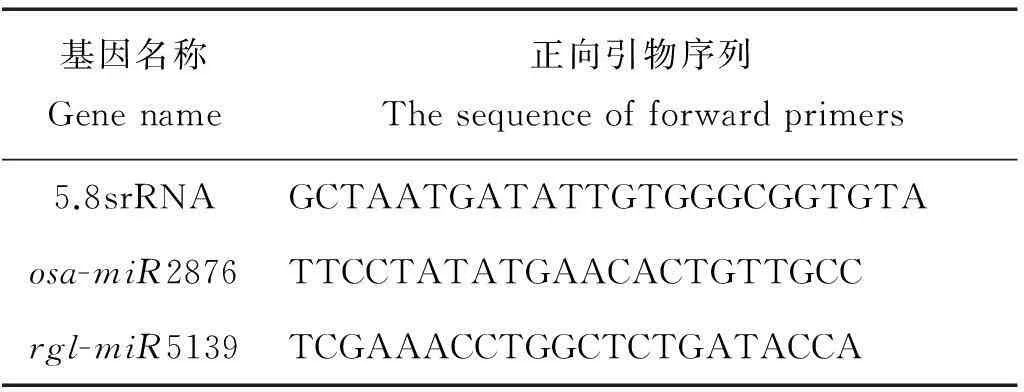
表1 用于熒光定量PCR的引物序列
1.3 樣品RNA的提取及反轉錄
采用日本的TaKaRa公司提供的RNAiso for Small RNA試劑對20~200個核苷酸的小RNA進行提取。提取的RNA樣品用1.5%的瓊脂糖凝膠電泳對其完整性進行檢測,并用NanoDrop 2000檢測其純度和濃度。僅高質量的RNA(OD 260/280在1.9 ~2.1之間))才能被用來進行實驗。依據試劑盒SYBR○RPrimeScriptxTMmiRNA RT-PCR Kit,反轉錄體系如下所示:10 μL 的 2× miRNA Reaction Buffer Mix, 2μL 的 0.1%BSA, 2μL 的 miRNA PrimeScript○RRT Enzyme Mix, 大約 1μg 的 總 RNA以及 5 μL 的RNase-free ddH2O。合成的cDNA保存于-20 °C冰箱。用內參5.8srRNA檢測cDNA的合成效率。3%瓊脂糖凝膠電泳檢測PCR結果。
1.4 目的序列的回收和克隆測序
將內參5.8srRNA及osa-miR2876和rgl-miR5139的PCR產物按照普通瓊脂糖凝膠DNA回收試劑盒(天根公司提供)所提供的說明進行膠回收,對回收得到的DNA進行濃度和純度檢測。并將連接好的產物導入大腸桿菌DH5α進行克隆并送給華大公司進行測序。測序完全正確的引物才可被用來進行qPCR實驗。
1.5 qPCR溶解曲線和標準曲線的制作
依據TaKaRa公司所提供的miRNA定量試劑盒制qPCR體系:SYBR○RPremix Ex TaqTMII 10L,10 mmol/L 特異的正向引物0.4L, 10mmol/L 通用反向引物0.4L, RNase-free H2O 7.2L,cDNA約2L。制備好的體系在ABI 7500 熒光定量PCR儀上進行反應。反應程序為:95 °C 30 s, 95 °C 5 s, 65 °C 34 s,40個循環。反應結束后對擴增曲線、溶解曲線進行分析,每個反應包括3個重復。若溶解曲線峰單一尖銳,則將目的片段克隆后根據天根的質粒小提試劑盒(提供公司提供)說明步驟進行質粒的提取。將5.8srRNA及osa-miR2876和rgl-miR5139的質粒逐級稀釋10倍,作為qPCR的模板進行PCR反應(體系及程序同上),通過各級反應的Ct值進行標準曲線的繪制。
1.6 qPCR檢測基因的差異表達
以延遲期、對數期、以及高氮、高磷、高錳誘導對數期為5個樣品進行RNA的提取及cDNA的合成(同1.3,1.4),以5.8srRNA為內參基因,用1.2中設計的引物進行熒光定量PCR,每個樣品設置3個生物學重復,3個技術重復(反應體系及測序見1.6)對實驗結果用2-△△CT相對定量法進行計算[23]。
2結果分析
2.1 osa-miR2876和rgl-miR5139高通量測序差異結果
通過對延遲期、對數期2個小RNA文庫高通量測序結果分析發現,osa-miR2876和rgl-miR5139 2個microRNA在延遲期均呈上調表達狀態,且延遲期的表達量分別是對數期的正無窮倍和1.12倍。具體結果如表2所示。

表2 osa-miR2876和rgl-miR5139測序結果
2.2 一鏈合成效率的檢測
使用內參基因5.8srRNA的引物對所合成的一鏈cDNA進行檢測(見圖1)。不同時期的一鏈cDNA進行檢測結果說明RNA的完整性較好,且cDNA的合成效率較高。

(1:延遲期cDNA; 2:對數期cDNA; 3:高磷誘導對數期; 4:高氮誘導對數期; 5:高錳誘導對數期;M:DNA分子標記DL2000.)
圖1用內參5.8srRNA的引物對cDNA進行檢測電泳圖
Fig.1Gel analysis of the resulting cDNA by
the reference gene 5.8srRNA
2.3 質粒的檢測
將5.8srRNA及osa-miR2876和rgl-miR5139目的片段克隆后,分別提取的質粒電泳圖見圖2A。提取帶有目的片段的質粒,然后利用PCR通過目的片段的特異引物對相應的質粒進行檢測,電泳結果顯示,得到的5.8srRNA、osa-miR2876和rgl-miR5139長度分別為140 bp和約100 bp(見圖2B),與預設的長度相同,說明質粒可用。
2.4 目的基因溶解曲線和標準曲線的制作
經分析,5.8srRNA,osa-miR2876和rgl-miR5139溶解曲線的峰單一尖銳,說明擴增產物單一,無非特異性擴增。用無菌的超純水對獲得的質粒按101、102、103、104和105梯度逐級稀釋后,作為熒光定量PCR的模板進行PCR反應。每個梯度都會有一個Ct值,以此為縱坐標,以相應的稀釋倍數為橫坐標,繪制標準曲線。得到的5.8srRNA的R2值為0.998 5,擴增效率為101%;osa-miR2876的R2值為0.993,擴增效率為101%;rgl-miR5139的R2值為0.994,擴增效率為105%。目的基因和內參基因的擴增效率接近100%,且差值在5%以內,滿足熒光定量體系的要求[24](見圖3)。
2.5 2個差異microRNA表達量的變化
應用熒光定量PCR對osa-miR2876和rgl-miR5139在鏈狀亞歷山大藻延遲期、f/2對數期和3個誘導下對數期(高磷、高氮和高錳)的RNA表達量進行相對定量分析。結果顯示,microRNA的表達量在對數期和誘導下對數期均低于延遲期,osa-miR2876的表達量在高錳條件下對數期最低,在延遲期時表達量最高,是高錳條件表達量的18.63倍。rgl-miR5139的表達量同樣在高錳條件下最低,在延遲期表達量最高,是高錳條件表達量的14.12倍。經過SPSS軟件分析,osa-miR2876和rgl-miR5139在延遲期的表達量均顯著高于誘導條件下對數期的表達量(P<0.05)。
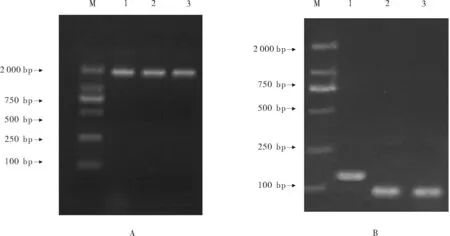
(M:DNA分子標記DL2000,DNA marleer DL 2000,1:5.8s;2:osa-miR2876;3:rgl-miR5139)

(A:5.8s溶解曲線;B:osa-miR2876溶解曲線;C:rgl-miR5139溶解曲線;D:5.8s標準曲線;E:osa-miR2876標準曲線;F:rgl-miR5139標準曲線。A:The dissociation curve of 5.8 s,B:The dissociation curve of osa-miR2876,C:The dissociation curve of rgl-miR5139,D:The standard curve of 5.8 s,E:The standard curve of osa-miR2876,F:The standard curve of rgl-miR5139.)
圖3內參基因和目的基因的溶解曲線和標準曲線
Fig.3The melting curves and standard curve
3討論
3.1 加尾法qPCR驗證microRNA的優越性
高通量測序提供一種快速高效的鑒定microRNA的方法,但所得到的microRNA具有一定的假陽性,因此通過實驗的方法對測序鑒定出來的microRNA進行驗證是非常必要而且重要的。目前,microRNA本身的驗證方法有多種:如real-time PCR(qPCR)、Northern blotting、原位雜交和基因芯片等。Northern blotting驗證方法可靠性高,但要使用放射性同位素,而且難以檢測低豐度的microRNA,大大降低了其使用范圍。原位雜交方法因其操作復雜、耗時長而應用較少,同樣的,基因芯片方法需要以大量已知的miRNA序列為前提設計探針而且成本較高使用較少[25]。qPCR因具有特異性強、通量高、靈敏度高、操作簡便、成本較低等優點而成為大量使用的microRNA檢測方法。但microRNA不僅表達量低且長度只有16~28個核苷酸,沒有Poly(A)尾,因此無法用普通的反轉錄和熒光定量PCR檢測miRNA。目前,microRNA的反轉錄主要有莖環反轉錄法和加尾反轉錄法。前者因需要合成特異的莖環結構引物而使成本相對較高。后者利用Poly(A)聚合酶為成熟的microRNA加上多聚Poly(A)尾,同時引入通用引物的結合為位點,具有成本較低,操作簡便,結果可靠等優點,也是檢測microRNA的最常用的方法[26]。

(*標識的為經SPSS軟件分析得出的與延遲期表達量具有顯著差異(p<0.05)的生長條。The significant difference resulted from SPSS was marked by *.)
圖4osa-miR2876和rgl-miR5139在不同
生長時期和生長條件中的相對表達情況
Fig.4Relative expression level of different growth stages and
different growth conditions of osa-miR2876 and rgl-miR5139
SYBR Green I因成本較低、簡單易行、熒光信號強,不需要特別優化條件和不需要另外設計熒光探針等優點而被本實驗采用。但該染料專一性不如探針法,對引物的特異性要求較高。因為熒光染料可嵌入任何雙鏈DNA中,如翻譯組有非特異性擴增或引物二聚體也會產生假陽性信號[27]。因此本實驗通過引物設計、調整退火溫度和引物濃度來確保無非特異性擴增。首先對PCR產物進行瓊脂糖電泳檢測,條帶單一正確后再進行溶解曲線分析。經電泳和溶解曲線分析,本實驗設計的引物無非特異性擴增,可用于osa-miR2876和rgl-miR5139在不同生長時期表達量的定量分析。
3.2 osa-miR2876的qPCR實驗結果與高通量測序結果比較分析
通過高通量測序得到的osa-miR2876在延遲期、對數期2個不同生長時期差異表達倍數是正無窮,而qPCR得到的結果是2.28倍,二者差異較大的原因主要有以下2點:第一,2種方法對差異表達倍數的計算方法不同:高通量序技術單次反應可以對數以百萬計的序列進行分析,其表達量可從1個拷貝至數10萬個不等,因而為了比較2個樣品間microRNA表達量是否存在顯著性差異,首先將2個樣品歸一化到同一數量級,方法是該microRNA的實際表達量/該樣品總的表達量;然后對2個樣本進行Fisher檢驗和T檢驗(得出p值)以及計算差異倍數(log2fold change):延遲期表達量/對數期表達量[28],同時滿足|log2fold change|>1和P< 0.05的microRNA被認為是差異表達的[29]。由于osa-miR2876在對數期的實際表達量為3個拷貝,對數期microRNA總的表達量為7 226,因而均一化后其表達量約為0,所以差異倍數(log2fold change)為無窮大。該結果反映了osa-miR2876在延遲期和對數期的表達趨勢,即對數期的表達量遠低于延遲期。而在本次qPCR實驗中,作者對實驗數據的分析采用的是相對定量2-△△CT,以內參5.8s的表達量校準osa-miR2876在延遲期和對數期的表達量,其結果更接近實際。第二是高通量測序技術的原理與qPCR實驗原理的不同。二代高通量測序的基本思想是邊合成邊測序( Sequencing by synthesis),即生成新DNA互補鏈時直接加入被熒光標記的dNTP或半簡并引物,在合成或連接生成互補鏈時釋放出熒光信號,通過捕獲光信號并轉化為一個測序峰值,獲得互補鏈序列信息[30]。在信號讀取過程中,會遇到N堿基等無信號采集的情況,且測序質量從5’到3’逐漸降低,因而在獲得大批量數據的背后也存在著一定的假陽性。高通量測序的數據為我們研究基因的差異表達提供了方向和表達趨勢,但必須結合生物學實驗的驗證才能更深層次地挖掘其功能信息。關于高通量測序所得的差異倍數與實驗所得相差較大的結果在microRNA高通量測序的研究中相對是常見的,如在Eriocheirsinensis[31]中高通量測序得到的差異倍數接近300,而qPCR結果也在10以下。
本實驗中,對高通量測序的結果進行了分析,并通過qPCR實驗驗證了osa-miR2876的相對表達量,二者差異趨勢是一致的,也為研究其功能提供了一定的證據。
3.3 osa-miR2876和rgl-miR5139對藻細胞快速生長的調節作用
靶基因KEGG注釋結果顯示osa-miR2876的靶基因為DNA復制過程中的DNA復制執照因子MCM5和限制性核酸內切酶。DNA復制執照因子作為DNA復制過程中一種重要的起始因子,在細胞周期的M期,核膜破裂后可與染色質結合從而確保細胞周期進入S期[32]。研究表明:DNA復制執照因子可通過阻止染色體DNA的重復制從而精確控制每個細胞周期只能進行1次DNA復制[33];并且osa-miR2876的靶基因參與堿基錯配修復過程的調節。
rgl-miR5139的靶基因涉及嘌呤、嘧啶堿基的代謝、RNA聚合酶的代謝、多種氨基酸合成、細胞骨架的調節、及氧化磷酸化、光合作用、三羧酸循環等多種與藻細胞生長密切相關的代謝過程。嘌呤、嘧啶等堿基的合成、氨基酸的合成與氧化磷酸化、光合作用等為細胞的快速分裂和增殖提供必備的原料和能量;而細胞骨架不僅可以維持細胞形態,保持細胞內部結構的有序性而且在細胞分裂中染色體的分離中發揮著重要的牽引作用[34]。
microRNA負調控靶基因的表達,osa-miR2876和rgl-miR5139在對數期均為下調表達,說明其靶基因參與的細胞生理過程:DNA復制、修復、嘌呤、嘧啶堿基的代謝、RNA聚合酶的代謝、多種氨基酸合成、細胞骨架的調節、及氧化磷酸化、光合作用、三羧酸循環過程呈現激活狀態,而上述生理過程的激活均有利于藻細胞增殖。這些結果表明:osa-miR2876和rgl-miR5139可能在鏈狀亞歷山大藻的快速分裂和增殖中發揮著非常重要的調控作用。
3.4 甲藻的兼性營養型
近二十年來,研究證明甲藻是兼性營養型的,即:甲藻既能通過光合作用進行自養又能通過吞噬攝食其他浮游生物進行異養,打破了之前甲藻只能進行自養的結論[2]。KEGG注釋結果顯示rgl-miR5139參與吞噬作用的調節,我們的研究結果為甲藻兼性營養型正確性提供了進一步的證據,同時rgl-miR5139在細胞快速生長階段的下調表達提示在該階段下異養營養型可能占優勢。
本研究建立了 microRNA 加尾法實時定量 PCR 的檢測方法,具有成本較低、特異性好、快速準確、靈敏度高等特點,不僅證明了鏈狀亞歷山大藻中osa-miR2876和rgl-miR5139在不同生長時期和生長條件下的差異表達水平,而且為其他物種microRNA的研究和檢測提供了切實可靠的方法。同時,osa-miR2876和rgl-miR5139在鏈狀亞歷山大藻的快速增殖生長中發揮的重要調控作用將有助于我們研究有赤潮爆發的分子機理,從而為可能的赤潮預報提供科學依據。
4結語
本文選擇了2個在延遲期、對數期文庫中差異表達的microRNA(osa-miR2876和rgl-miR5139),研究了其在5個不同生長條件下的相對表達情況,并對其功能進行了分析。2個microRNA在對數期和誘導下對數期的表達量均低于延遲期,且高錳條件下對數期的表達量均為最低。由于microRNA負調控靶基因的表達,而osa-miR2876和rgl-miR5139在對數期均為下調表達,這說明其靶基因參與的有利于藻細胞增殖的生理過程如DNA復制、修復、嘌呤、嘧啶堿基的代謝等過程均呈現激活狀態,因此這些結果表明:osa-miR2876和rgl-miR5139在鏈狀亞歷山大藻的快速分裂和增殖中可能發揮著非常重要的調控作用。且本文的研究結果也為甲藻兼性營養型的正確性提供了進一步的證據。同時,本研究也為其他物種microRNA的研究和檢測提供了快速簡便、特異性好的研究方法。
參考文獻:
[1]Sournia A. Red tide and toxic marine phytoplankton of the world ocean: an inquiry into biodiversity [C]. Harmful Marine Algal Blooms. Paris: Technique et Documentation -Lavoisier, Intercept Ltd, 1995: 103-112.
[2]Stoecker D K. Mixotrophy among Dinoflagellates [J]. Journal of Eukaryotic Microbiology, 1999, 46: 397-401.
[3]Toulza E, Shin M S, Blanc G, et al. Gene expression in proliferating cells of the dinoflagellateAlexandriumcatenella(Dinophyceae) [J]. Applied and Environmental Microbiology, 2010, 76: 4521-4529.
[4]Burkholder J M. Implications of harmful microalgae and heterotrophic dinoflagellates in management of sustainable marine fisheries [J]. Ecological Applications, 1998, 8: S37-S62.
[5]Zhang S, Sui Z H, Chang L P, et al. Transcriptome de novo assembly sequencing and analysis of the toxic dinoflagellateAlexandriumcatenellausing the Illumina platform [J]. Gene, 2014, 537: 285-293.
[6]Wang D Z, Lin L, Wang M H, et al. Proteomic analysis of a toxic dinoflagellateAlexandriumcatenellaunder different growth phases and conditions[J]. Chinese Science Bulletin, 2012, 57: 3328-3341.
[7]Huang J, Liang S, Sui Z H, et al. Cloning and characterization of proliferating cell nuclear antigen gene ofAlexandriumcatenella(Dinoflagellate) with respect to cell growth[J]. Acta Oceanologica Sinica, 2010, 29: 90-96.
[8]Bartel D P. MicroRNAs: Genomics, biogenesis, mechanism, and function[J]. Cell, 2004, 116: 281-297.
[9]Jones-Rhoades M W, Bartel D P, Bartel B. MicroRNAs and their regulatory roles in plants[J]. Annu Rev Plant Biol, 2006, 57: 19-53.
[10]Kidner C A and Martienssen R A. The developmental role of microRNA in plants [J]. Current Opinion in Plant Biology, 2005, 8: 38-44.
[11]Fahlgren N,Howell M D, Kasschau K D, et al. High-Throughput Sequencing ofArabidopsismicroRNAs: Evidence for for frequent birth and death of MIRNA Genes evidence for frequent birth and death of MIRNA Genes [J]. PloS One, 2007, 2: e219.
[12]Chi X Y, Yang Q L, Chen X P, et al. Identification and characterization of microRNAs from peanut (ArachishypogaeaL. ) by high-throughput sequencing [J]. Plos One, 2011, 6: e27530.
[13]Sunkar R, Zhou X F, Zheng Y, et al. Identification of novel and candidate miRNAs in rice by high throughput sequencing [J]. BMC Plant Biology, 2008, 8: 25.
[14]Su C, Yang X Z, Gao S Q, et al. Identification and characterization of a subset of microRNAs in wheat (TriticumaestivumL. )[J]. Genomics, 2014, 103: 298-307.
[15]Zhao T, Li G L, Mi S J, et al. A complex system of small RNAs in the unicellular green algaChlamydomonasreinhardtii[J]. Genes & Development, 2007, 21: 1190-1203.
[16]Huang A Y, He L W and Wang G C. Identification and characterization of microRNAs fromPhaeodactylumtricornutumby high-throughput sequencing and bioinformatics analysis[J]. BMC Genomics, 2011, 12: 337.
[17]耿慧利. 鏈狀亞歷山大藻microRNA高通量測序及生物信息學分析[D]. 青島: 中國海洋大學, 2015.
Geng H L. Identification of MicroRNAs in the Toxigenic DinoflagellateAlexandriumcatenellaby High-Throughput Illumina Sequencing and Bioinformatic Analysis[D]. Qingdao: Ocean University of China, 2015
[18]Guillard R R L. Cultureof phytoplankton for feeding marine invertebrates[C]. In Smith W L. Chanley M H. Culture Ofmarine Invertebrate Animals. Plenum: New York Press, 1975: 29-60.
[19]Galleron C. Synchronization of the marine dinoflagellateamphidiniumcarteriin dense clutures[J]. Journal of Phycology, 1976, 12(1): 69-73.
[20]Matsuda A, Nishijima T, Fukami K. Effects of nitrogenous and phosphorus nutrients on the growth of toxic dinoflagellateAlexandriumcatenella[J]. Nippon Suisan Gakkaishi, 1999, 65: 847-855.
[21]Brand L E, Sunda W G, Guillard R R. Limitation of marine phytoplankton reproductive rates by zinc, manganese, and iron[J]. Limnology and Oceanography, 1983, 28: 1182-1198.
[22]Shi R, Chiang V L. Acile means for quantifying microRNA expression by real-time PCR[J]. BioTechniques, 2005, 39: 519-525
[23]Yao C L, Kong P, Wang Z Y, et al. Molecular cloning and expression of MyD88 in large yellow croaker,Pseudosciaenacrocea[J]. Fish & Shellfish Immunology, 2009, 26(2): 249-255.
[24]張吉鳳. Rho激酶對大鼠海馬神經元CRMPs mRNA表達的調節[D]. 暨南大學, 2009.
Zhang J F. The expression regulation of Rho kinase on rat hippocampal neurons CRMPs mRNA[D]. Jinan University, 2009.
[25]王磊, 范云六. 植物微小RNA(microRNA)研究進展[J]. 中國農業科技導報, 2007, 9(3): 18-23.
Wang L, Fan Y L. The research advances in plant mocroRNA [J]. Journal of Agricultural Science and Techology , 2007, 9(3): 18-23.
[26]成永強, 李正平, 王愈聰 . MicroRNA分析方法進展[J]. 化學進展, 2010, 8, 22 (8): 1509-1517. Cheng Y Q, Li Z P, Wang Y C. The advance of microRNA analysis method[J]. Progress in Chemistry, 2010, 22(8): 1509-1517.
[27]趙麗媛, 于志剛, 甄毓. 東海原甲藻線粒體細胞色素 b( Cy t b) 基因的定量檢測[J]. 中國海洋大學學報(自然科學版), 39(3) : 448-452.
Zhao L Y, Yu Z G, Zhen L. The quantitative detection of mitochondrial cytochrome b (Cytb) [J]. Periodical of Ocean University of China, 39(3) : 448-452.
[28]D’haene B, Mestdagh P, Hellemans J, et al. MiRNA expression profiling: From reference genes to global mean normalization[J]. Methods Mol Biol, 2012, 822: 261-272.
[29]Audic S and Claverie JM. The significance of digital gene expression profiles[J]. Genome Research, 1997, 7: 986-995.
[30]王興春, 楊致榮, 王敏, 等. 高通量測序技術及其應用 [J]. 中國生物工程雜志, 2012, 32(1): 109-114.
Wang X C, Yang Z R, Wang M, et al. High-throughput sequencing technology and its application [J]. China Biotechnology, 2012, 32(1): 109-114.
[31]Ou J, Meng Q, Li Y, et al. Identification and comparative analysis oftheEriocheirsinensismicroRNA transcriptome response toSpiroplasmaeriocheirisinfection using a deep sequencing approach[J]. Fish & Shellfish Immunology, 2012, 32(2): 345-352.
[32]Alberts B, Bray D, Lewis J, et al. Molecular Biology of the Cell [M]. 3rd Ed. NewYork: Garland Publishing , 1994: 139-194.
[33]Th?mmes P, Kubota Y, Takisawa H, et al. The RLF-M component of the replication licensing system forms complexes containing all six MCM/P1 polypeptides [J]. The EMBO Journal, 1997, 16: 3312-3319.
[34]李蘭. 兩個棉花 (Gossypiumhirsutum) LIM 蛋白調控肌動蛋白細胞骨架及其在花藥發育中的功能研究[D]. 武漢: 華中師范大學, 2014.
Li L. The Regulation of TwoGossypiumhirsutumLIM Protein on Actin Cytoskeleton and Iits Function Research on Anther Development[D]. Wuhan: Central China Normal University, 2014.
責任編輯高蓓
The Screen and Verification of Differentially Expressed MicroRNAs Under Different Growth Conditions inAlexandriumcatenella
GENG Hui-Li, SUI Zheng-Hong,REN Yuan-Yuan, DU Qing-Wei, LIU Yuan
(The Key Laboratory of Marine Genetics and Breeding, Ministry of Education, Ocean University of China, Qingdao 266003, China)
Abstract:As a class of relatively conservative regulator, accumulated reports demonstrated that miRNAs play an important role in a large variety of biological and metabolic processes, including cell proliferation, organ maturation, signal transduction and response to stress. Dinoflagellates is a kind of important organisms that can cause harmful algal blooms (HABs). Alexandrium catenella is a representative of dinoflagellates that is widely spread all over the world and has the ability of producing PSTs. In this paper, two differentially expressed microRNAs (osa-miR2876 and rgl-miR5139) were selected from constructed small RNA libraries of A. catenella under the lag and the logarithmic phases. Five conditions including the lag phase and the logarithmic phase under f/2 medium, high N, high P and high Mn induced logarithmic phase were designed for expression detection via qPCR technique. The study established a poly(A)-tailing qPCR method with SYBR Green I to detect the differential expression of microRNA under different growth conditions in A. catenella. 5.8srRNA gene was used to normalize the expression of microRNAs. The expression level of microRNA under the logarithmic and induced logarithmic (eg. high N, high P and high Mn induced logarithmic phase) phases were all lower than those under the lag phase. The lowest expression level was shown in the loagrithmic phase under high Mn. The expression level in the lag phase was 18.63 (for osa-miR2876) and 14.12 (for rgl-miR5139), respectively of that under high Mn condition. microRNA regulated gene expression via a negative pattern. The result of real-time PCR was consist with high-throughput sequencing. osa-miR2876 and rgl-miR5139 in the logarithmic phase were both down-regulated, which suggested that the target genes of two microRNAs involved, eg. DNA replication, repairing, the metabolism of purine and pyrimidine, the metabolism of RNA polymerase, may be activated. The activation of the above physiological processes were all benefit for the proliferation of the cells. Our results suggested that osa-miR2876 and rgl-miR5139 might play important roles during the process of rapid division and proliferation of A. catenella. Moreover our study provided further evidence of mixotrophic modes in dinoflagellates. The heterotrophic mode may be dominate in the logarithmic phase as revealed by the down regulation of rgl-miR5139 under fast growth phases of the cells. The study demonstrated that microRNAs played an important role in the blooming growth of A. catenella and provided an rapid, simple and specific method to detect and study microRNA in other organisms.
Key words:Alexandrium catenella; microRNAs; qPCR; differential expressed
中圖法分類號:S917.3
文獻標志碼:A
文章編號:1672-5174(2016)01-064-08
作者簡介:耿慧利(1989-),女,碩士生。E-mail:genghuili2009@163.com
收稿日期:2015-03-11;
修訂日期:2015-04-18
*基金項目:國家自然科學基金項目(41176098);山東省自然科學基金重點項目(ZR2011DZ002)資助
DOI:10.16441/j.cnki.hdxb.20150069
引用格式:耿慧利, 隋正紅, 任源源, 等. 鏈狀亞歷山大藻不同生長狀態差異表達microRNA的篩選和驗證[J]. 中國海洋大學(自然科學版), 2016, 46(1):64-71.
GENG Hui-Li, SUI Zheng-Hong,REN Yuan-Yuan,et al.The screen and verification of differentially expressed microRNAs under different growth conditins inalexandriumcatenella[J]. Periodical of Ocean University of China, 2016, 46(1): 64-71.
Supported by the Natural Science Foundation of China(41176098);The key research project supported by Shan Dong Natural Science Foundation(ZR2011DZ002)
**通訊作者:E-mail:suizhengh@ouc.edu.cn

