三乙烯四胺基淀粉的合成及抗癌活性
程如梅,步葉旭
(溫州醫科大學 眼視光學院,納米生物材料研究所,浙江 溫州 325027)
?
三乙烯四胺基淀粉的合成及抗癌活性
程如梅,步葉旭
(溫州醫科大學 眼視光學院,納米生物材料研究所,浙江 溫州 325027)
[摘 要]目的:設計合成高分子基多胺抗癌藥物(三乙烯四胺基淀粉,CTS),研究其對人端粒DNA d[G3(T2AG3)3]的作用機制和細胞毒性,提供高分子靶向抗癌藥物的另一種開發思路。方法:以三乙烯四胺為出發點,通過環氧氯丙烷為橋梁連接到廉價淀粉上獲得化合物CTS,通過各種光譜手段對CTS進行表征,運用圓二色CD光譜研究其與人端粒DNA的相互作用機制,采用CCK-8方法研究CTS對人眼脈絡膜黑色素瘤(OCM-1)細胞的抑制作用。結果:CTS可以誘導人端粒DNA形成反平行G-四鏈體,對于OCM-1細胞具有較強的毒性,可以抑制其生長,而CTS對正常的人視網膜色素上皮(ARPE-19)細胞毒性極低,表明CTS可以作為以G-四鏈體為靶點的癌細胞潛在的靶向藥物。結論:CTS可以促進G-四鏈體的生成,并對OCM-1細胞具有較強的抑制性,而對正常細胞影響微小。
[關鍵詞]三乙烯四胺基淀粉;G-四鏈體;CD光譜;抗癌
端粒DNA是位于染色體末端的特殊DNA結構,高度重復的[TTAGGG]n序列具有防止染色體末端重組、融合和降解的功能[1]。端粒酶是一類逆轉錄核糖核蛋白酶,它能夠以自身攜帶的一段RNA為模板在染色體端粒末端合成端粒DNA并逐漸加入到染色體末端[2],以補足在每次細胞分裂中丟失的端粒DNA而使染色體保持穩定。研究[3]發現,約90%的惡性腫瘤細胞的端粒酶都表達較高的活性,而正常體細胞內幾乎檢測不到,因此近年來對于端粒酶活性的抑制成為了設計新型抗腫瘤藥物的靶點[4-5]。人端粒DNA d[G3(T2AG3)3]序列中連續鳥嘌呤(GGG)通過Hoogsteen氫鍵形成的平面結構經表面堆積后形成端粒G-四鏈體構型[6],這種端粒G-四鏈體結構的DNA能夠抑制端粒酶的活性。如果藥物分子能夠穩定G-四鏈體結構或誘導其形成,則可使端粒酶難以發揮其逆轉錄酶活性合成端粒DNA,從根本上抑制端粒酶活性和阻斷端粒DNA合成,最終導致腫瘤細胞的凋亡或死亡。
多胺化合物能與DNA產生較強作用并具有抗癌活性[7]。研究表明癌細胞表面的負電荷比正常細胞多,多胺化合物易帶上正電荷而在癌細胞表面凝集。脂肪多胺可以調控c2m yc基因表達,穩定G-四鏈體的形成[8]。精胺也可以促進DNA的定性排列,調控DNA的表達[9]。然而,許多多胺化合物在抑制癌細胞的同時,對正常細胞也產生嚴重的傷害,多胺化合物的抗癌活性與其結構、代謝過程、靶向性等相關[10]。本研究將多胺化合物修飾到淀粉上,合成表征了三乙烯四胺改性淀粉衍生物(CTS,分子示意見圖1),通過光譜發現了其與G-四鏈體的作用和抑制癌細胞的作用,為高分子抗癌藥物的開發提供了另一種思路,并揭示了多胺淀粉化合物與端粒DNA的作用機制。
1 材料和方法
1.1主要試劑 馬鈴薯淀粉、三乙烯四胺、環氧氯丙烷、高氯酸、氫氧化鈉、三羥甲基氨基甲烷Tris緩沖溶液、磷酸系PBS緩沖溶液和乙醇均購自國藥集團上海試劑公司;PAGE純化d[G3(T2AG3)3]購自上海基康生物有限公司;含10%胎牛血清和50 μg/mL慶大霉素的DMEM/F12(1:1)完全培養液、含10%胎牛血清和50 μg/mL慶大霉素的1640細胞培養液均購自美國Hyclone公司;CCK-8試劑盒購自上海酶聯生物科技有限公司。
1.2實驗儀器 紅外光譜儀(Nicolet FT-IR NEXUS,溴化鉀壓片),熱重分析儀(STA 409 PC/4/H Luxx,氮氣氣氛,升溫速度為10 ℃/min),圓二色CD光譜(Jascol 810),自動溫控細胞培養箱(Thermo Scientific Form),酶標儀(Thermo Multiskan MK3)。
1.3實驗細胞 人視網膜色素上皮(ARPE-19)細胞和人眼脈絡膜黑色素瘤(OCM-1)細胞購自中科院細胞生物學研究所上海細胞庫。
1.4CTS的合成 取10 g淀粉置于三頸瓶中,置于20 mL水溶液中,攪拌均勻后加入環氧氯丙烷溶液1.0 mL,用高氯酸調節溶液pH至2,水浴40 ℃加熱,在磁力攪拌器上加熱攪拌10 h;所得的醚化淀粉在堿性水溶液環境中繼續與5 mL多胺溶液作用,將所得產物調至中性,過濾,分別用蒸餾水、乙醇洗滌3次,低溫烘干,保存,即得到CTS。
1.5CD光譜測試 所有測試均在pH=7.4的Tris/ HCl緩沖溶液中進行,將d[G3(T2AG3)3]的濃度固定在5 μmol/L,測試前將CTS溶液和d[G3(T2AG3)3]溶液混合后放置6 h,再進行CD光譜測定,測定200~320 nm范圍的光譜吸收。
1.6細胞毒性研究 ARPE-19細胞利用含10%胎牛血清、50 μg/mL慶大霉素的DMEM/F12(1:1)完全培養液培養,OCM-1細胞利用含10%胎牛血清、50 μg/mL慶大霉素的1640細胞培養液培養,并置于37 ℃、5% CO2及飽和濕度的恒溫培養箱中。培養時加入不同濃度的樣品進行培養。細胞培養使用標準96孔板,采用CCK-8方法測定細胞增殖[11]。
2 結果
2.1CTS表征 淀粉和CTS的紅外光譜示意見圖2,可以看出兩個物質的紅外光譜比較接近,均在3 384 cm-1附近出現典型的發生氫鍵作用的多羥基O-H伸縮振動峰,在931 cm-1附近出現葡萄糖環的C1-H完全振動,證明了環的完整性。從熱分析(見圖3)看CTS的分解速率要低于原淀粉。

圖2 淀粉和CTS的紅外光譜
2.2CD光譜 圖4顯示了化合物CTS與人端粒DNA序列d[GGG(TTAGGG)3]作用。該DNA序列在Tris緩沖溶液中(無金屬離子存在下)于295 nm處出現正的最大吸收峰,同時在252 nm附近出現了另外一個正的強度吸收峰,強度稍弱,另外在240 nm附近產生負的最大吸收,這種特征為平行和反平行混合的G-四鏈體共存,表明了該DNA序列在無金屬離子存在時形成了2種混合的G-四鏈體,而且比例相當。接著研究了不同濃度CTS對不含金屬離子人端粒DNA序列體系的影響。

圖3 淀粉和CTS的熱重分析圖

圖4 多種體系中G-四鏈體的CD光譜
由圖5可以看到,隨著CTS濃度的增大,體系在252 nm處的正的吸收逐漸減弱,當CTS的濃度增大到DNA的5倍時,在252 nm處的吸收為0,而在260 nm處出現了明顯的負的吸收,濃度繼續增大,260 nm處負的吸收繼續增強,在CTS濃度為DNA的10倍時達到最大,而后濃度增大觀察不到明顯的變化,說明體系達到飽和。而260 nm處的負的吸收是反平行G-四鏈體的典型特征。這表明CTS可以誘導反平行G-四鏈體結構的形成。
2.3細胞毒性 為了進一步研究CTS對正常細胞和腫瘤細胞的作用,利用ARPE-19細胞和OCM-1細胞調查研究淀粉、醚化淀粉、CTS對不同細胞的毒性。各個樣品的濃度均為200 μg/mL。ARPE-19細胞的毒性結果見圖6A,相比于其他樣品,無論24 h還是48 h,淀粉在ARPE-19細胞的孵化中都表現出最高的存活率,CTS在ARPE-19細胞的孵化中細胞存活率仍達到80%以上,而醚化淀粉的存活率反而是最低的。我們進一步調查了不同濃度CTS對OCM-1細胞的毒性影響。圖7結果顯示,當CTS濃度低于100 μg/mL時,體現出較低的細胞毒性。當濃度高至200 μg/mL時,分別孵化24 h和48 h后發現,OCM-1細胞的存活率分別低于50%和40%,隨著濃度的加大,OCM-1細胞的存活率進一步降低。對正常細胞影響較小,CTS顯示了較高的生物相容性,而對癌細胞具有一定的靶向性,對OCM-1細胞的抑制作用比較明顯。與淀粉和醚化淀粉相比,CTS的這種抑制作用和其中的多胺基基團密不可分。

圖5 不同濃度CTS存在下人端粒DNA序列d[GGG(TTAGGG)3]形成的G-四鏈體的CD光譜圖
3 討論
CTS和淀粉的最大區別在于CTS具有多個氨基,而淀粉沒有氨基,因此其光譜和熱行為發生了變化。從紅外光譜(見圖2)看出淀粉在1 656 cm-1的峰為結合水的δH2O彎曲振動峰,而CTS在1 645 cm-1振動峰顯得稍弱,且向低頻移動,歸屬為δN-H和δH2O彎曲振動峰。CTS還有一處典型的變化,就是位于1 231 cm-1處的νC-N。而熱分析(見圖3)表明淀粉和CTS的熱分解過程均可以分為四個過程。第一階段失重發生在50~110 ℃之間,為化合物失去結晶水的過程。第二階段失重發生在220~260 ℃區間,部分羥基發生了斷裂脫水[12]。第三階段則發生了高分子鏈的斷裂和葡萄糖單元環的剪切裂解,處于260~380 ℃之間[13]。最后發生高分子材料的碳化[14]。CTS的分解速率要低于淀粉,可能是由于氨基的加入,增加了分子鏈之間的作用,比如氫鍵增強了鏈的纏繞,使得分解速率下降。而最后的CTS的碳化率低于淀粉,原因仍在于引入了氨基,在高溫下容易生成氮氧化物揮發掉。多胺基的引入,增強了CTS與其他分子產生氫鍵的能力,因此我們將CTS與富含鳥嘌呤的端粒DNA來作用,研究形成G-四鏈體的可能性以及抑制腫瘤的特性。
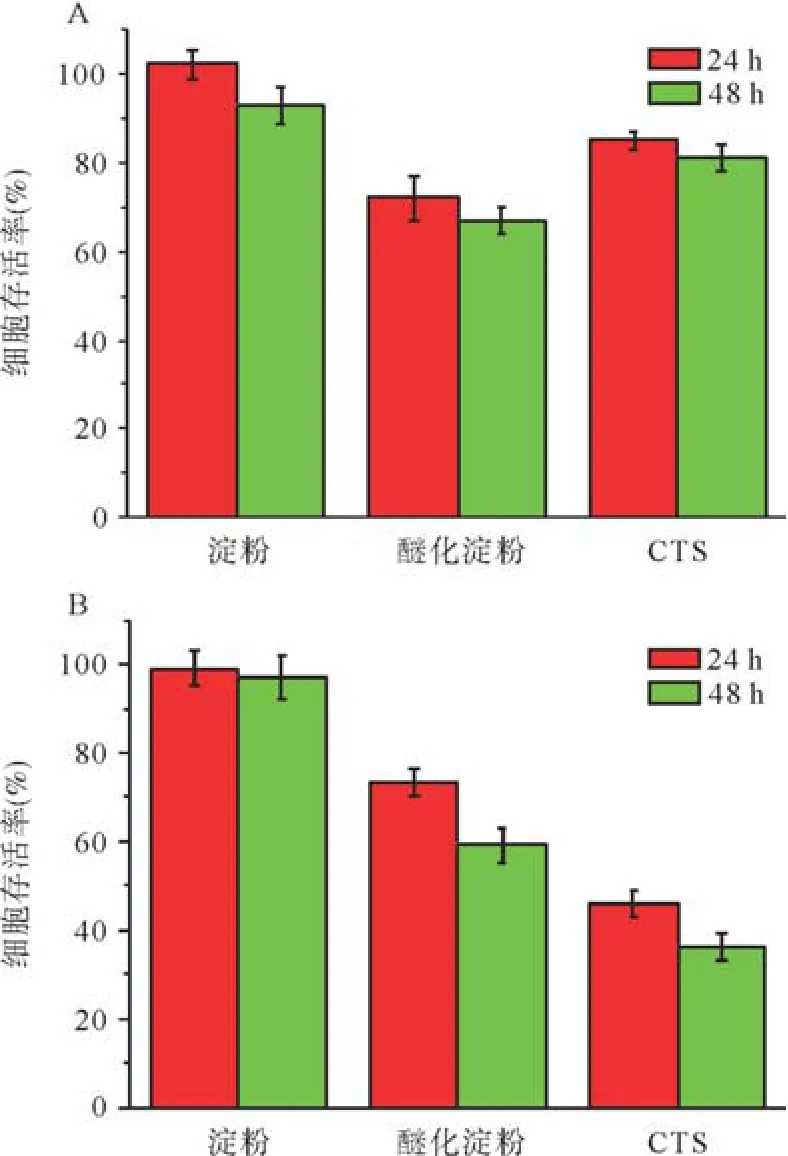
A:ARPE-19細胞;B:OCM-1細胞圖6 200 μg/mL不同樣品的溶液對不同細胞毒性的結果

圖7 不同濃度的CTS化合物對OCM-1細胞的毒性
G-四鏈體是一種特殊的DNA二級結構,它是在特定的條件下形成的,因此研究小分子與G-四鏈體相互作用首先需要確認G-四鏈體結構的存在。CD光譜被廣泛用來研究G-四鏈體的熱力學行為。CD光譜顯示該DNA序列在無金屬離子存在時形成了2種混合的G-四鏈體,平行G-四鏈體在260 nm有正的最大cotton吸收,而在240 nm有負的最大cotton吸收,而反平行G-四鏈體在295 nm有正最大的cotton吸收,260 nm有負的最大cotton吸收,這種特殊的cotton效應使我們很容易將G-四鏈體同其他DNA二級結構相區別[15]。圖4表明當體系中存在0.1 mol/L 的Na+時,DNA體系在295 nm處出現正的最大吸收,同時在265 nm處出現了負的最大吸收,為典型的反平行G-四鏈體的特征。在0.1 mol/L的K+存在下,體系在290 nm處出現正的最大吸收,235 nm有負的最大吸收,在260 nm附近出現一對正的肩峰,這表明G-四鏈體是以平行和反平行混合的形式存在的,比較與無金屬離子的情況,反平行的比例大一些;當在含0.1 mol/L K+的體系中同時加入2.5 μmol/L的CTS后,體系的cotton吸收發生明顯的變化,260 nm附近的一對肩峰強度明顯減弱,這表明了CTS誘導G-四鏈體發生變化,朝著反平行的G-四鏈體方向變化,因此CTS能夠與G-四鏈體產生相互作用。
細胞毒性實驗顯示了淀粉、醚化淀粉、CTS 對ARPE-19細胞和OCM-1細胞不同的細胞毒性結果。ARPE-19細胞在醚化淀粉中較低的細胞存活率,可能與醚化淀粉有未反應的環氧基團有關,經過胺化后環氧基打開,降低了環氧基攻擊細胞的DNA、蛋白的不良反應。而對于腫瘤細胞,醚化淀粉由于環氧基的存在,也對腫瘤細胞造成一定的損傷,使得48 h后的存活率幾乎降低到50%。但CTS對腫瘤細胞的影響更大,可以使得OCM-1細胞的存活率下降到35%,這可能是由CTS與DNA的相互作用引起。
綜上所述,我們合成得到了一種潛在的抗癌高分子藥物CTS,與淀粉和醚化淀粉相比,其主要顯現的官能團為三乙烯四胺,造成了CTS對OCM-1細胞較強的生長抑制性,而對正常細胞影響不大。CTS可以誘導人端粒DNA形成反平行的G-四鏈體,從而預防了腫瘤細胞的快速增殖,為高分子抗癌藥物的開發提供了另一種思路。
參考文獻:
[1]BOCHMAN M L,PAESCHKE K,ZAKIAN V A.DNA secondary structures:stability and function of G-quadruplex structures [J].Nat Rev Genet,2012,13(11):770-780.
[2]CHOW T T,ZHAO Y,MAK S S,et al.Early and late steps in telomere overhang processing in normal human cells:the position of the fi nal RNA primer drives telomere shortening [J].Genes Dev,2012,26(11):1167-1178.
[3]DINSHAW J P,ANH T P,VITALY K.Human telomere,oncogenic promoter and 5’-UTR G-quadruplexes:diverse higher order DNA and RNA targets for cancer therapeutics[J].Nucleic Acids Res,2007,35(22):7429-7455.
[4]LIU T,LIANG X,LI B,et al.Telomerase reverse transcriptase inhibiton stimulates cyclooxygenase 2 expression in cancer cells and synergizes with celocoxib to exert anti-cancer effects [J].Br J Cancer,2013,108(11):2272-2280.
[5]MOCELLIN S,POOLEY K A,NITT D.Telomerase and the search for the end of cancer[J].Trends Mol Med,2013,19(2):125-133.
[6]BIFFI G,TANNAHILL D,MCCAFFERTY J,et al.Quantitative visualization of DNA G-quadruplex structures in human cells [J].Nat Chem ,2013,5(3):182-186.
[7]MELCHIORRE C,BOLOGNESI M L,MINARINI A,et al.Polyamines in drug discovery:from the universal template approach to the multitarget-directed ligand design strategy[J].J Med Chem,2010,53(16):5906-5914.
[8]LIU J,GUO L,YIN F,et al.Characterization and antitumor activity of triethylene tetramine,a novel telomerase inhibitor [J].Biomed Pharmacother,2008,62(7):480-485.
[9]IGARASHI K,KASHIWAGI K.Modulation of cellular function by polyamines[J].Int J Biochem Cell Biol,2010,42(1):39-51.
[10]WONG P E,TETLEY L,DUFES C,et al.Polyamine azacyclic compounds demonstrate anti-proliferative activity in vitro but fail to control tumour growth in vivo[J].J Pharm Sci,2010,99(11):4642-4657.
[11]褚茂平,胡晨,周愛華,等.川崎病血清特異相關miR-23a對人臍靜脈內皮細胞生長及遷移的影響[J].溫州醫科大學學報,2015,45(5):321-326.
[12]ATHWALE V D,LELE V.Thermal studies on granular maize starch and its graft copolymers with vinyl monomers[J].Starch,2000,52(6-7):205-213.
[13]ZHANG X,GOLDING J,BURGAR I.Thermal decompositon chemistry of starch studied by 13C high resolution solidstate NMR spectroscopy[J].Polymer,2002,43(22):5791-5796.
[14]LIU X,YU L,LIU H,et al.In situ thermal decomposition of starch with constant moistrue in a sealed system[J].Polym Degrad Stability,2008,93:260-262.
[15]WILLIAMSON J R,RAGHURAMAN M K,CECH T R.Monovalent cation-induced structure of telomeric DNA:the G-quartet model[J].Cell,1989,59(5):871-880.
(本文編輯:吳昔昔)
·消 息·
Synthesis of triethylenetetramine-starch and its antitumor effects
CHENG Rumei,BU Yexu.School ofOphthalmology & Optometry,Wenzhou Medical University,Institute of Advanced Materials for Nano-Bio Applications,Wenzhou,325027
Abstract:Objective:To design and synthesize the potential antitumor drug,CTS (triethylenetetraminestarch).Its interactions with the human telomere DNA (d[G3(T2AG3)3series]) and cytotoxicity to OCM-1 tumor cells are investigated.As a consequence,it provides a new strategy to develop targeted antitumor drugs.Methods:The triethylenetetramine reacted with the epichlorohydrin crosslinked-starch (CS) to produce the CTS.It was characterized by various methods.The circular dichroism (CD) spectra were used to clarify the interaction mechanism between the CTS and human telomere DNA.Its cytotoxity to OCM-1 cells was determined by CCK-8 method.Results:The antiparallel G-quadruplex could be induced and stabilized by CTS.This may be the reason that CTS inhibited the growth of OCM-1 cells,and moreover it showed very low cytotoxicity to ARPE-19 human cells.Such observations indicated that CTS was a promising antitumor drug.Conclusion:The CTS can stabilize the G-quadruplex and has higher cytotoxicity to OCM-1 cells.It has insignifi cant effects on the growth of normal human cells.
Key words:triethylenetetramine-starch; G-quadruplex; CD spectra; antitumor
作者簡介:程如梅(1978-),女,河北邯鄲人,助理研究員,博士。
基金項目:國家自然科學基金資助項目(21405115);浙江省醫藥衛生科研項目(2015KYB254);溫州市科技局科技計劃項目(Y20120218);溫州醫科大學附屬眼視光醫院項目(YNCX2014 08)。
收稿日期:2015-09-01
[中圖分類號]R979.1
[文獻標志碼]A
DOI:10.3969/j.issn.2095-9400.2016.01.004

