EDTA滴定法快速測定酸法生產金屬鎵的液體物料中鎵含量
宋世娣 張 輝 楊 波
(1 中國鋁業遵義氧化鋁股份有限公司 分析化驗中心,貴州 遵義 563100; 2 貴州師范大學 材料與建筑工程學院,貴陽 550025)
EDTA滴定法快速測定酸法生產金屬鎵的液體物料中鎵含量
宋世娣1張 輝2楊 波1
(1 中國鋁業遵義氧化鋁股份有限公司 分析化驗中心,貴州 遵義 563100; 2 貴州師范大學 材料與建筑工程學院,貴陽 550025)
建立了在酸法生產金屬鎵過程中,用NH4F掩蔽溶液中的鋁,加入過量的EDTA標準溶液使之與鎵元素完全絡合,調整條件試劑硼酸溶液和無水乙醇的加入量,保證終點的準確判斷,過量EDTA以PAN為指示劑用硫酸銅標準溶液回滴求得液體物料中鎵含量的分析方法。實驗表明,方法的相對標準偏差(RSD)為2.8%~6.5%,加標回收率為97.14%~104.0%。方法有較高的準確性和可靠性,且測定結果精密度高,可實現酸法生產金屬鎵液體物料中鎵含量的快速檢測。
酸法生產金屬鎵;液體物料;鎵元素;EDTA容量法
前言
拜耳法氧化鋁生產中鋁酸鈉溶液的鎵含量以及金屬鎵生產過程中液體物料中的鎵含量,主要采用EDTA容量法進行快速分析[1-2]。但是由于氧化鋁礦石成份的不同和生產工藝的差異,使得鋁酸鈉溶液的成分非常復雜[3],而鎵含量本身較低,所以必須科學合理地選用掩蔽劑NH4F掩蔽溶液中的鋁,加入適量硼酸溶液使溶液變清[4],增加緩沖溶液的用量便于判斷終點,從而對鎵含量進行準確的測定;而樹脂吸脫后的硫酸鎵溶液及通過富集除雜處理的電解鎵酸鈉溶液等均比較干凈[5],干擾小,只需要按原方法快速分析即可。通過加標回收實驗和精密度實驗表明,方法具有較高的準確性和可靠性,能夠完全滿足實時指導生產的需要。
1 實驗部分
1.1 實驗原料
鎵標準溶液[1 g/L,GSB G62026-90(3101),國家鋼鐵材料測試中心鋼鐵研究總院];鹽酸(1+1);硝酸(1+1);氨水(1+1);氟化銨溶液(100 g/L);硼酸溶液(30 g/L);二甲酚橙指示劑(2.5 g/L)。
PAN酒精溶液(1 g/L):0.1 g PAN[1-(2-吡啶-偶氮)-2-苯酚]溶于100 mL酒精中。
溴甲酚綠指示劑(1 g/L,無水乙醇溶液):稱0.1 g溴甲酚綠于300 mL燒杯中,加100 mL無水乙醇溶解,用NaOH(0.05 mol/L)調pH值至藍色,變色范圍pH=3.8~5.4。
HAc-NaAc緩沖溶液(pH=5.2~5.9):稱取無水乙酸鈉82 g(或者結晶乙酸鈉NaAc·3H2O)溶解于水,加入7.7 mL冰乙酸,用水稀釋至1 L,充分混勻。用間隔為0.2的pH試紙檢驗其pH值。
EDTA標準溶液(0.007 464 mol/L):稱取166.7 g乙二胺四乙酸二鈉鹽(分析純)于1 L裝有500 mL熱水的燒杯中,攪拌使其溶解(或者加熱攪拌加速溶解),用水轉入60 L的試劑桶中,攪勻,待標定。
硫酸銅標準溶液(0.003 732 mol/L):稱取56.0 g五水硫酸銅(分析純)溶于60 L水中,加入400 mL硫酸(1+1),攪勻,放置待標定。
鋅標準溶液(0.012 44 mol/L):將金屬鋅粒(質量分數為99.99%以上)先用硝酸(1%)浸泡除去表面上的氧化膜至光亮,然后用水沖洗三次,再用少量無水乙醇洗滌兩次,在105 ℃烘干(不宜烘時間太長,以免又產生氧化膜),取出置于干燥器中冷卻后,保存于磨口瓶中。準確稱取0.813 4 g處理過的鋅粒,于250 mL燒杯中,加20 mL水,加入20 mL硝酸(1+1),在電熱板上低溫溶解,體積蒸發至10 mL(如溶解不完全,可適量再加一些硝酸)將燒杯取下,冷卻移入1 L容量瓶中,以水定容,搖勻供標定EDTA用。
稱取13.513 5 g三氧化二鎵于已加入350 mL氫氧化鈉溶液(8 mol/L)的1 000 mL燒杯中,加熱攪拌溶解完全,冷卻后轉移至500 mL容量瓶中,用水稀釋至刻度,搖勻,鎵含量為20 g/L。
鋁酸鈉溶液采于拜耳法氧化鋁生產現場;鎵生產過程液態物料采于氧化鋁廠金屬鎵車間。
1.2 標準溶液的標定
1.2.1 EDTA標準溶液的標定
準確移取待標定的EDTA標準溶液50.00 mL于500 mL錐形瓶中,加水至體積約80 mL,滴加3滴二甲酚橙指示劑(2.5 g/L),用氨水(1+1)調節溶液呈紫紅色,然后用鹽酸(1+1)調節溶液剛呈黃色即可,再加10 mL HAc-NaAc緩沖溶液,用硝酸鋅標準溶液(0.012 44 mol/L)滴定至紫紅色即為終點,計算并調整EDTA溶液濃度為0.007 464 mol/L。
1.2.2 硫酸銅標準溶液的標定
準確移取10.00 mL EDTA標準溶液(0.007 464 mol/L)于500 mL錐形瓶中,加水至體積約100 mL,滴加3滴溴甲酚綠指示劑(1 g/L),用氨水(1+1)調節溶液呈藍色過量3滴,煮沸2 min,加10 mL HAc-NaAc緩沖溶液、8滴PAN指示劑,用硫酸銅標準溶液滴定至橙紅色為終點。計算并調整硫酸銅溶液濃度為0.003 732 mol/L。
1.3 實驗方法
用NH4F掩蔽溶液中的鋁,加入過量的EDTA標準溶液,使之與鎵完全絡合。過量EDTA以PAN為指示劑,用硫酸銅標準溶液回滴,求得鎵的含量。
鋁與氟的絡合反應,在堿性(鋁酸鈉)溶液中:
NaAl(OH)4+6NH4F+2NaOH=AlF3·3NaF+6NH3+6H2O
在酸性溶液中:
AlCl3+6NH4F+3HCl=AlF3·3HF+6NH4Cl
鎵與EDTA的絡合反應:
Ga3++H2Y2-=GaY-+2H+
滴定反應:
H2Y+Cu2+=CuY+2H+
Cu2++PAN→Cu-PAN
(黃色) (紫紅色)
移取5 mL樣品于100 mL容量瓶中以水定容,移取10 mL放入已加10 mL EDTA的500 mL錐形瓶中,加10 mL氟化銨,用少量水沖洗瓶壁,加3滴溴甲酚綠后用鹽酸調至亮黃色,再用氨水調至藍色過量3滴加100 mL水,煮沸2 min后(煮沸溶液時防止爆沸可以在溶液中加入少量的碎紙屑)加10 mL緩沖溶液,8滴PAN指示劑用硫酸銅標準溶液滴定至紫紅色為終點(分析鋁酸鈉溶液時酸堿調色過后加8 mL硼酸(30 g/L),15 mL緩沖溶液,80 mL水,煮沸2 min,加指示劑直接滴定,終點顏色不好看時可適當加少量的無水乙醇,約5~8滴)。隨樣做空白實驗。
1.4 結果計算
按下式計算溶液中鎵的含量:
式中cGa—鎵含量,g/L;C1—EDTA標準溶液濃度,0.007 464 mol/L;C2—硫酸銅標準溶液濃度,0.003 732 mol/L;V—分取試樣的量,mL;V0—滴定空白所消耗硫酸銅標準溶液的體積,mL;V1—加入EDTA標準溶液的體積,mL;V2—滴定試樣所消耗硫酸銅標準溶液的體積,mL;M鎵—鎵的摩爾質量,69.72 g/mol。
2 結果與討論
2.1 氟化銨用量的選擇
根據實驗原理,加入氟化銨的目的是為了掩蔽分析樣品中的鋁,其加入量的選擇非常重要,樣品1#為鎵標準溶液(認定值1.00),其中三氧化二鋁含量為0,樣品2#(認定值1.98 g/L)是三氧化二鋁含量為2~3 g/L的硫酸鎵溶液,樣品3#(認定值0.30 g/L)和4#(認定值0.29 g/L)是三氧化二鋁含量為98~102 g/L的鋁酸鈉溶液,改變氟化銨用量,鎵的測定結果如表1。
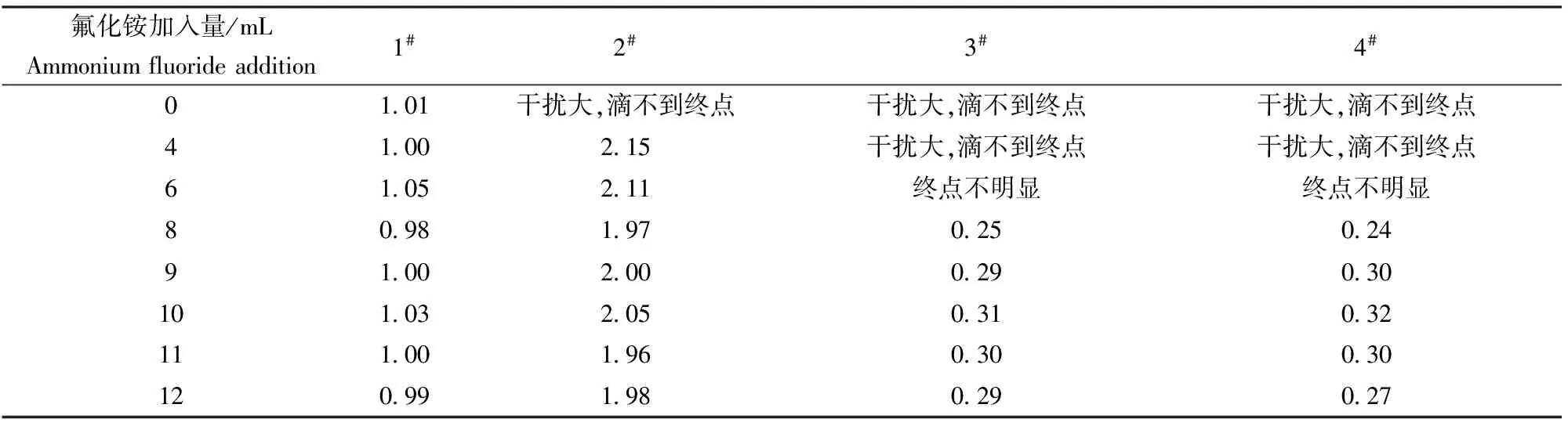
表1 氟化銨用量改變后鎵的測定結果
氟化銨加入量按質量計,不得小于樣品中氟化鋁含量的22倍,一般在25倍為宜;所以實驗選擇加入10 mL氟化銨溶液。
2.2 樣品溶液體積的選擇
試劑的加入需要按順序按量加入,最后用一定量的去離子水沖洗瓶壁,使溶液的總體積控制在150 mL左右為宜。體積小,終點提前,結果偏高,反之結果偏低,具體實驗結果見表2。
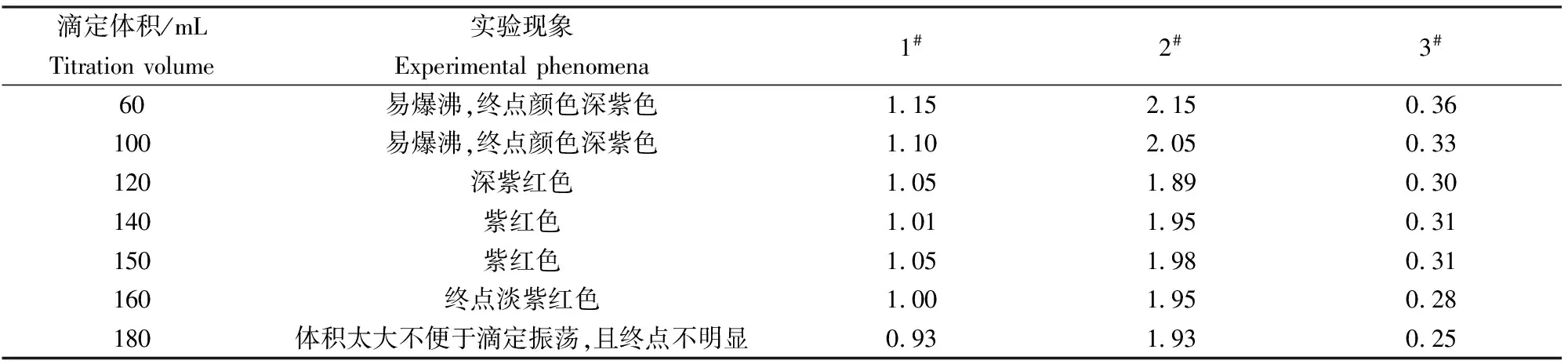
表2 樣品溶液的體積實驗
2.3 指示劑的用量選擇
實驗證明PAN指示劑的加入量8滴比較適宜(表3)。在分析鋁酸鈉溶液時,如果指示劑的量加合適了仍然變色不明顯,是指示劑“僵化”所致,可滴加少量無水乙醇,增加PAN反應靈敏度[4]。
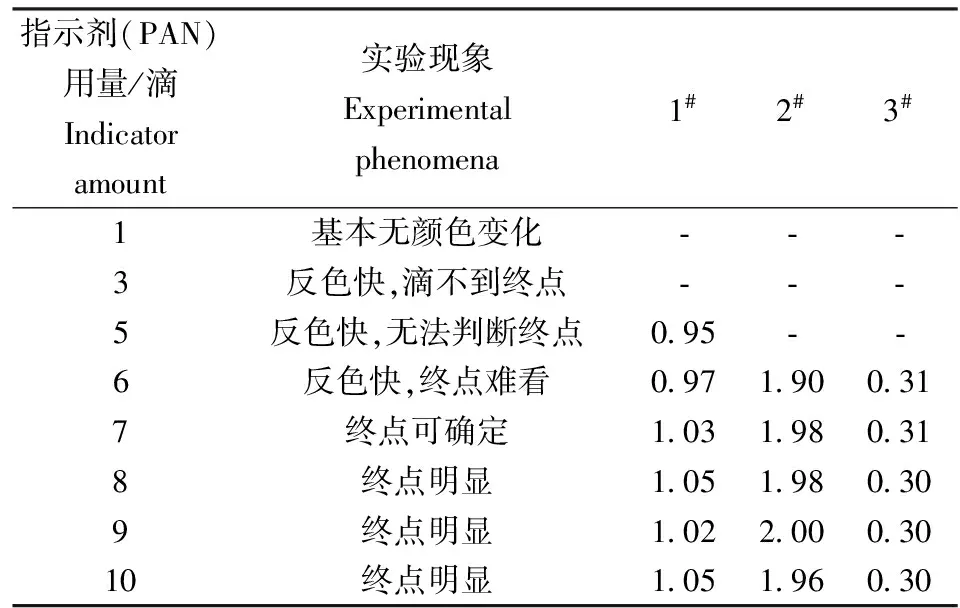
表3 指示劑(PAN)的用量實驗
2.4 硼酸(30 g/L)的用量選擇
在鋁酸鈉溶液里鎵的定量分析過程中,由于溶液基體復雜,雜質干擾較大,溶液易渾濁。實驗選擇加入8 mL硼酸(30 g/L),如果量過多就會改變溶液的pH值,影響指示劑的變色,為了控制好溶液的pH值,增加5 mL緩沖溶液。實驗證明加入硼酸使溶液變清的效果良好,便于終點判斷,實驗結果見表4。

表4 硼酸的影響實驗
2.5 精密度和準確度實驗
選取鎵含量不同的3個有代表性的樣品鎵酸鈉溶液A#、硫酸鎵溶液B#、鋁酸鈉溶液C#進行加標回收率實驗。根據樣品中待測元素的濃度分別添加3個不同水平的標準溶液,每個水平測定4次,結果見表5,鎵的加標回收率在97.14%~103.6%,相對標準偏差小于7%。本方法測定酸法生產金屬鎵中的液體物料有良好的準確度,可以滿足鎵酸鈉溶液的測定要求。
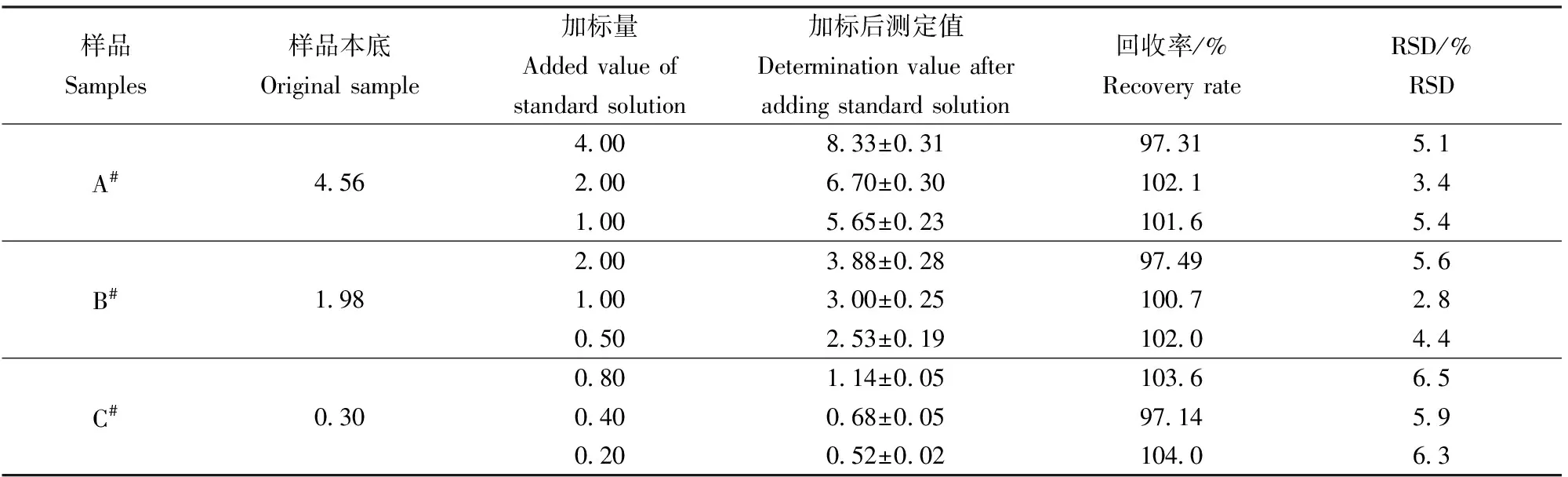
表5 加標回收率及相對標準偏差
3 結論
使用EDTA滴定法對酸法生產金屬鎵液體物料中鎵含量進行分析,不僅精密度和準確度能達到要求,而且能夠簡捷快速、準確穩定地提供鎵的分析數據用于指導生產,是酸法生產金屬鎵分析較理想的分析方法。
[1] 張進才.EDTA容量法測定富鎵料中鎵[J].冶金分析(MetallurgicalAnalysis),1992,12(4):1.
[2] 王安紅,高風光,賈立勝.容量法測定鋁酸鈉溶液中氧化鎵的方法[J].有色金屬分析通迅(NewsletterofNonferrousMetalAnalysis),2002(4):5-8.
[3] 李旺興.氧化鋁生產理論與工藝[M].長沙:中南大學出版社,2010:97-98.
[4].劉珍.化驗員讀本第四版上冊[M].北京:化學工業出版社,2004:237.
[5]宋世娣,楊波,張輝.X射線熒光光譜法測定鎵酸鈉溶液中的鎵和釩含量[J].中國無機分析化學(ChineseJournalofInorganicAnalyticalChemistry),2016,6(3):87-90.
Rapid Determination of Gallium in Liquid Materials Used in Acid Method for Gallium Production by EDTA Titrimetric Method
SONG Shidi1, ZHANG Hui2, YANG Bo1
(1.Chalco.ZunyiAlumina.Co.LtdAnalyticalLaboratoryCenter,Zunyi,Guizhou563100,China; 2.GuizhouNormalUniversityMaterialandArchitectureCollege,Guiyang,Guizhou550025,China)
In the acid method for gallium production, aluminum in the solution was masked by NH4F, then gallium was completely form a complex with EDTA when excess EDTA standard solution was added. The volume of boric acid and anhydrous ethanol were adjusted to accurately judge titration terminal points. The excessive EDTA solution was titrated using copper sulfate standard solution with PAN as an indicator so as to obtain Ga content. The results showed that the relative standard deviation (RSD) was 2.8%-6.5% with the recovery of 97.1%-104%. The proposed method has high accuracy and precision, and it is suitable for rapid determination of Ga in liquid materials used in Ga production by acid method.
process for Ga production; liquid materials; gallium; EDTA titrimetric method
10.3969/j.issn.2095-1035.2016.04.018
2016-02-25
2016-05-25
宋世娣,女,工程師,主要從事分析化驗及生產管理研究。E-mail: 1165847484@qq.com
O655.2
A
2095-1035(2016)04-0068-04

