dGFP-GUS基因標記新疆棉花黃萎病原菌的研究
孔德真,華東來,王秀珍,劉步倉,祝建波,王愛英
(新疆石河子大學生命科學學院,新疆石河子 832000)
dGFP-GUS基因標記新疆棉花黃萎病原菌的研究
孔德真,華東來,王秀珍,劉步倉,祝建波,王愛英
(新疆石河子大學生命科學學院,新疆石河子 832000)
【目的】研究棉花黃萎病原菌的入侵機理。【方法】以帶有潮霉素抗性篩選基因的PUCCATPH載體以及pCAMBIA1304載體作為骨架,構建trpc啟動子驅動的GFP-GUS基因的新疆棉花黃萎病菌表達載體1304-P-ORF,導入農桿菌GV3101和AGL-1中。通過農桿菌介導(ATMT)法分別轉入新疆棉花黃萎病原菌VD-1和VD-278中,對表達效果進行檢測。【結果】篩選的潮霉素B濃度為30 μg/mL,農桿菌AGL-1對黃萎病菌的轉化效率比GV3101高40%。T0代經含有潮霉素B的PDA培養基篩選,獲得了T1代轉基因大麗輪枝菌VD-12株,VD-2 784株。通過GUS組織染色,在轉基因VD-1和VD-278的菌絲和孢子中均可觀察到GUS基因的表達。對轉基因黃萎菌進行PCR分子檢測,均可檢測到GFP和潮霉素B基因。GUS-GFP和潮霉素B基因已成功轉入新疆棉花黃萎菌VD-1和VD-278中。【結論】建立了新疆棉花黃萎菌的遺傳轉化體系,為進一步利用GFP-GUS基因研究新疆棉花黃萎菌對棉花侵染的過程奠定基礎。
trpc啟動子;農桿菌介導轉化;GFP-GUS;棉花黃萎病菌
0 引 言
【研究意義】棉花黃萎病是由大麗輪枝菌(Verticilliumdahliae)引起的一種真菌性維管束系統病害[1]。當生長正常的植物被大麗輪枝菌侵染后,在植物木質部的導管系統中大量繁殖,使植物水分運輸蒸騰阻力增大,從而減少植物葉片組織中水分供應,進而使植物的光和速率和蒸騰速率減慢[2]。機械障礙和毒素作用現在已經被認為是黃萎病菌致病的兩個主要原因。但是在毒素作用中黃萎病菌產生的多糖蛋白是主要的萎蔫毒素,毒素通過刺激植物微管周圍的薄壁細胞,從而使植物細胞產生大量的代謝物,造成了植物正常代謝系統紊亂,最終導致了棉花植株的死亡[3]。雖然這兩種觀點已經有很多試驗證據證明了黃萎病菌的致病機理,但黃萎病菌如何侵入植物體,并且在植物體內怎樣繁殖和生長還不清楚,所以需要引入一種觀察和事實檢測定的方法,揭示棉花黃萎病菌和棉花之間的互作。 【前人研究進展】GFP和GUS基因作為兩種最為常用的報告基因,已經成功用于目的基因的表達定位,活細胞蛋白的定量觀察和動力學研究等方面[4-5]。Andrie等[6]和Vallad等[7]利用sGFP基因,分別在馬鈴薯和萵苣中分離的大麗輪枝菌菌株中成功標記了綠色熒光,依賴菌體上的綠色熒光,對病原菌侵染的不同階段進行了觀察。【本研究切入點】由于黃萎病菌對植物的侵染是通過微管進行擴展的,致病力不同的黃萎病菌對植物的侵染過程是不同的,為了研究致病力不同黃萎病在植物中侵染過程,構建了含有明顯標記的真菌表達載體,通過標記來研究病菌的侵染過程。報告基因dGFP-GUS是由植物表達載體pCAMBIA1304載體攜帶的融合表達基因,通過對植物表達載體的改造,去除了植物表達載體,在報告基因上游加入了黃萎病菌識別的,在黃萎病菌中啟動報告基因,并且連有啟動子和潮霉素B的開放閱讀框,構建含有dGFP-GUS的真菌表達載體,通過點擊轉化法轉入農桿菌AGL-1中。通過農桿菌介導的轉化方法,轉化已從烏蘇地區分離的落葉型和非落葉型黃萎病菌Vd-1和Vd-278,得到已經轉化成功的黃萎病菌,通過GUS組織染色,得到已經轉化成功的黃萎病菌。【擬解決的關鍵問題】為研究大麗輪枝菌侵染棉花過程的組織學和致病機理研究奠定基礎。
1 材料與方法
1.1 材 料
1.1.1 菌株、質粒及試劑
農桿菌GV3101、AGL-1,大麗輪枝菌菌株VD-1和VD-278均由新疆烏蘇地區棉區分離獲得,采用鑒定棉花大麗輪枝菌特異引物zhu-1/zhu-2(5’-CATCAGTCTCTCTGTTTATACCAACG-3’/5’-CGATGCGAGCTGTAACTACTACGCAA-3’),大麗輪枝菌落葉型和非落葉型引物D-1/D-2(5’-CATGTTGCTCTGTTGACTGG-3’/5’-GACACGGTATCTTTGCTGAA-3’)和ND-1/ ND-2(5’-CAGGGGATACTGGTACGAGACG-3’/5’-ATGAGTATTGCCGATAAGAACA-3’)引物進行PCR鑒定,鑒定結果為非落葉型大麗輪枝菌。質粒PUCCATPH由河北農業大學李繼剛教授饋贈,植物表達載體pCAMBIA1304由石河子大學農業生物技術重點實驗室保存,在研究中構建載體所需要的分子試劑均購自TaKaRa(Japan)公司;引物合成和序列的測定由北京華大基因公司完成。
1.1.2 基本培養基和培養條件
大腸桿菌用LB培養,37℃,200 r/min 振蕩培養過夜。農桿菌用LB常規培養基培養,200 r/min、28℃,振蕩培養 2 d。基本培養基 MM[8]和誘導培養基 IM[9]用于農桿菌的遺傳轉化培養。大麗輪枝菌用CM[10]和 Czapek 培養基的培養,25℃,150 r/min培養4~7 d。抗生素卡那霉素(Km)、利福平(Rif)和氨噻肟頭孢霉素(Cef)用量為 100 μg/mL;潮霉素(hyg)用量為30 μg/mL。
1.2 方 法
1.2.1 含有trpc啟動子潮霉素B開放閱讀框和trpe啟動子的克隆與鑒定
在以質粒DNA PUCCATPH為模板,克隆含有潮霉素 B的反應體系如下:1 μL質粒DNA,5 μL 10×TaqDNA聚合酶Buffer,4 μL dNTP,上游引物ORF-F(5’-CGAGCTCGGTCGACAGAAGATGATATTGAA-3’)和下游引物 ORF-R (5’-CAAGCTTGCAGGGGCTGGTGACGGAATTTT-3’)各1 μL(虛線標注部分為SacⅠ和HindⅢ酶切位點),TaqDNA聚合酶 1 μL,ddH2O補齊,總體積為50 μL,PCR反應程序為:94℃預變性5 min,進入循環94℃變性30 s,63℃退火45 s,72℃延伸2 min,30個循環,72℃終延伸7 min;啟動子的克隆按照上述程序反應,trpc啟動子上游引物Ptrpc-F(5’-CAAGCTTGGTCGACAGAAGATGATATTGAA-3’)和下游引物(5’-CCCATGGGGATCGAGGCTTGGGTAGAATAG-3’),虛線標注部分為HindⅢ和NocⅠ酶切位點。PCR反應結束后,在1%的瓊脂糖凝膠電泳中對目的片段進行檢測,切下目的條帶,采用瓊脂糖凝膠回收試劑盒對目的片段純化回收,將目的片段連接到pMD19-T載體上,連接產物轉化于DH5α感受態細胞中,利用藍白斑篩選的方法挑選陽性菌落獲得的重組質粒命名為構建成pMD19-T:ORF和pMD19-T:Ptrpc。
1.2.2 含有Ptrpc啟動子和潮霉素B抗性的表達載體的構建
測序正確的質粒pMD19-T:ORF和PMD19-T:trpc,分別采用SacⅠ和HindⅢ、HindⅢ和NocⅠ酶切回收ORF和Ptrpc。將pCAMBIA1304-35S-GFP-GUS-OCS載體用HindⅢ和NocⅠ雙酶切后回收質粒大片段,將回收質粒的大片段和回收的啟動子小片段經T4連接酶相互連接后,連接產物轉化于DH5α感受態細胞,通過抗生素篩選和酶切鑒定,成功構建載體Ptrpc-GFP-GUS-OCS。然后將Ptrpc-GFP-GUS-OCS載體用SacⅠ和HindⅢ雙酶切回收質粒大片段,將回收的載體大片段和回收的小片段經T4DNA連接酶相互連接后,轉化大腸桿菌感受態細胞,通過抗生素篩選和酶切鑒定,構建棉花黃萎菌表達載體:1304-P-ORF。
1.2.3 潮霉素B對野生型大麗輪枝菌的抑制測定
將野生型棉花黃萎病菌VD-1和VD-278活化,接種于PDA培養基上,在25℃下培養8 d,采用0.5 cm的打孔器,打取菌餅接種在濃度為0、10、20、30、40、50、70、100 μg/mL的潮霉素B的PDA培養基上,每個培養皿中放置3個,在25℃下培養8 d,每個濃度重復3次,進行觀察記錄。
1.2.4 棉花黃萎病菌的純化和培養
將棉花黃萎病菌株VD-1和VD-278接在PDA平板培養基上,在25℃、暗培養10 d后,采用微生物單孢分離的方法對兩株菌進行純化培養。
1.2.5 不同農桿菌對新疆棉花黃萎病菌轉化效率的影響
構建真菌表達載體1304-P-ORF后,將表達載體采用電擊轉化法轉入兩種農桿菌GV3101和AGL-1中,用于棉花黃萎病菌的遺傳轉化,農桿菌介導轉化真菌的方法參照kang等[11]和Mullins 等[12]方法進行,在兩種菌轉化共培養時選用的介質為微孔濾膜(上海新亞水溶性微孔濾膜0.45 μm)。在25℃共培養5 d后,在濾膜的表面長出具有潮霉素B抗性的白色菌落,將白色菌落挑取,轉接到含有相同濃度潮霉素B的PDA平板上進行純化培養。分別記錄這兩種農桿菌獲得的新疆棉花黃萎病菌陽性轉化子的個數。
1.2.6 PCR鑒定轉化陽性的黃萎病菌
轉基因菌株的DNA提取[13],以提取的轉基因菌株的DNA為模板,對GFP和潮霉素基因進行檢測,GFP所用的正向引物(5'-GACAAACAAAAGAATGGAATCA-3')反義引物:(5'-TCAAGAAGGACCATGTGG-3');PCR擴增潮霉素B檢測引物的900序列進行分子驗證,所用的正向引物(5’-GCAGACAGGAACGAGGACAT-3’)反義引物(5’-GCTCCATACAAGCCAACCAC-3’)。
1.2.7 轉基因棉花黃萎病菌GUS組織化學檢測
挑取少許繼代4~5次長勢良好的轉基因黃萎病菌菌塊放于Eppendorf管中,加入一定量的GUS染色液,使染色的菌落組織快完全浸沒在液體中,在37℃下保溫染色4~5 h后,在顯微鏡下觀察染色結果。選取呈現藍色較深的菌株繼續培養。
2 結果與分析
2.1 含有trpc啟動子潮霉素B開放閱讀框和trpc啟動子的克隆與真菌表達載體的構建
根據質粒PUCCATP報導的基因序列,通過TaqDNA聚合酶擴增trpc啟動子和開放閱讀框ORF基因。經克隆測序后分析表明,克隆得到的啟動子和開放閱讀框的大小和核苷酸序列與原載體上的一致,全長為480 bp和2 000 bp。首先把trpc啟動子連接到植物表達載體pCAMBIA1304-35S-OCS上。經過轉化、PCR鑒定和連接載體的雙酶切后,經電泳檢測得到了與預測大小相同的目的條帶。然后把連接開放閱讀框ORF的質粒和已連接啟動子的質粒,采用雙酶切后連接,轉化大腸桿菌,挑選10個克隆經過夜搖菌提取質粒雙酶切后,經瓊脂糖凝膠電泳檢測獲得預期大小的目的片段。表明成功地構建了真菌表達載體1304-P-ORF。該載體在真菌中的篩選標記基因為潮霉素B,是含有構巢曲霉 trpc啟動子,章魚堿合成酶基OCS基因作為終止子。將質粒1 304-P-ORF轉入農桿菌GV3101和GAL-1對轉化的菌落通過PCR鑒定,證明目的基因已轉入。擴繁菌落,用于以下后續試驗的遺傳轉化。圖1~3

M:DNA markerⅢ;1:陽性對照;2、3:質粒酶切

M:DNA marker 5K;6:陽性對照;1-5:質粒酶切
2.2 潮霉素對黃萎病菌菌落生長速度的影響
將直徑0.5 cm的黃萎病菌菌餅接種于8種不同的潮霉素濃度的PDA培養基中(3次重復),在25℃的恒溫箱中培養8 d后,測定每個濃度下的菌落直徑。研究表明,隨著培養基中潮霉素B的濃度逐漸升高,菌落的生長速率逐漸減小。當潮霉素B的濃度達到30 μg/mL時,菌落停止生長,在這個濃度下兩種棉花黃萎病菌的生長完全受到了抑制。表1
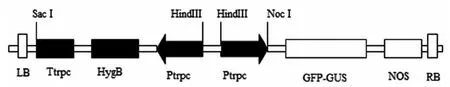
圖3 1304-P-ORF載體構建示意
表1 不同潮霉素濃度對黃萎菌病菌落生長抑制情況
Table 1 The inhibitory effect of differentverticillumdahliacolony growth under the different concentrations of hygromycin

黃萎菌菌株VD-Strain潮霉素濃度Concentrationofhygromycin(μg/mL)0102030405070100VD-12 9±0 021 5±0 060 8±0 030±00±00±00±00±0VD-2782 8±0 021 5±0 030 6±0 070±00±00±00±00±0
2.3 農桿菌AGL-1和GV1303對黃萎病菌轉化效率的影響
農桿菌的類型直接影響黃萎病菌的轉化效率。能夠轉化絲狀真菌的農桿菌有很多種包括AGL-1、EHA105、LBA1100、LBA4401、GV3101等,它們之間對轉化受體的毒性有著明顯地差異。一般而言,農桿菌對轉化的受體材料具有一定的選擇性,農桿菌毒性越強,對材料中T-DNA的插入效率也越高,但對受體材料的毒害越強,在進行篩選時,受體材料的成活率也越低,從而對受體的轉化效率降低。應用潮霉素B和羧芐青霉素篩選時,農桿菌的抗性越強,最終農桿菌斑干擾轉化子的純度和增加篩選轉化子的難度。研究表明,農桿菌菌株AGL-1對兩種非落葉型新疆棉花黃萎病菌的轉化效率顯著高于農桿菌菌株GV3101。圖4
2.4 轉基因黃萎病菌的分子鑒定
以轉接4~5代的陽性黃萎病菌VD-1和VD-278遺傳穩定的轉化子基因組DNA為模板,以GFP和潮霉素B基因特異性引物進行PCR分子檢測,結果表明:4個轉化子中均擴增出擴增出243 bp左右的特異性GFP基因片段以及900 bp的特異性潮霉素B基因片段,野生菌株中沒有擴增出相應的基因片段,證明GFP-GUS融合基因和潮霉素B抗性基因已整合到轉化子基因組中。將轉化子繼續進行培養,選取部分菌落的菌絲和孢子進行GUS染色,研究表明,GFP-GUS融合基因已經被整合到棉花黃萎病菌的基因組中,并能夠在構巢曲霉色氨酸啟動子(Ptrpc)調控下正常表達。圖5
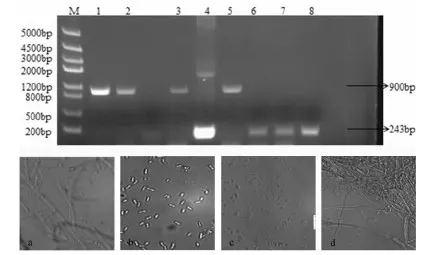
M:DNA marker 5K;1、2、4、5:潮霉素B基因;5、7-9:GFP基因PCR結果;3:未轉化菌株;a、b未轉化菌絲和孢子染色結果;c、d轉基因孢子和菌絲染色結果
3 討 論
棉花黃萎病菌(Verticilliumdahliae)不能識別CaMV35S啟動子,植物表達載體不能直接用于黃萎病菌的遺傳轉化[14]。目前,常見的真菌啟動子有構巢曲霉的 GPD 啟動子、trpc啟動子和偃麥草核菌(PyrenopHora tritici-repentis)的 ToxA 啟動子等[15]。實驗中采用trpc啟動子,NOS終止子、HygB為篩選標記、綠色熒光蛋白GFP和GUS為報告基因,以植物表達載體pCAMBIA1304為框架構建成真菌表達載體,通過農桿菌介導的方法把GFP-GUS和抗性篩選基因HygB插入到黃萎菌基因組中,并在黃萎菌中成功的表達。表明構巢曲霉色氨酸啟動子Ptrpc能被黃萎菌所識別。
棉花黃萎病菌為一種土傳真菌病害,侵染植物主要從根部或傷口進入體內,病原菌在植物體內的移動主要是依靠植物的水分運輸系統,孢子隨著植物水分和養分的運輸,移動到植物的每個組織中。迄今為止,國內外對V.dahliae致病性研究多采用紙缽撕底蘸根法、針刺接種法或其它相類似的方法[16-19],這些方法只能從棉花發病的表型上判斷黃萎病菌對植株的致病性,不能從機理上解釋棉花發病的原因。從生菜、馬鈴薯、棉花中分離的黃萎病菌已經被成功的用熒光所標記[19]。新疆棉花黃萎病菌屬于大麗輪枝菌,在不同地區已經產生了許多生理小種,研究使用的非落葉型菌株VD-1和VD-278是近期從新疆北疆棉花生產病區分離并鑒定的菌株,VD-1為菌核型,VD-278為中間型,可作為新疆北疆棉花抗性鑒定標準菌株之一。高興喜等[20]進行了對木霉用農桿堿性菌株AGL-1遺傳轉化成功,而章魚堿性農桿菌LBA4404卻轉化失敗。Eynck等采用農桿菌介導法將 pGV04 載體成功地轉入大麗輪枝菌,獲得了穩定表達GFP的大量轉化子[21]。在多數前人研究大麗輪枝菌主要針對落葉型黃萎病菌,對非落葉型黃萎病菌研究較少。因此,研究通過用農桿菌AGL-1和GV3101介導的孢子轉化體系將綠色熒光蛋白GFP和GUS基因轉入新疆非落葉型黃萎病菌VD-1和VD-278,成功獲得了陽性轉化子,發現農桿菌AGL-1對新疆非落葉型黃萎病菌的轉化效率顯著高于GV3101。這表明農桿菌的毒性和其轉化寄主之間的相互識別和感應,可以在提高轉化效率時選擇農桿菌的類型。
研究構建的綠色熒光標記載體1304-P-ORF通過農桿菌介導的轉化,其T-DNA區可穩定整合到新疆棉花黃萎病菌菌株VD-1和VD-278的基因組中,挑選GFP-GUS表達量高與野生菌株致病性相似的、并能進行性穩定的遺傳表達,通過GUS組織染色,被標記菌株的菌絲體和分生孢子呈現出明顯的藍色。轉GFP-GUS基因的黃萎病菌的獲得為深入研究棉花黃萎病入侵的機理奠定了基礎,能夠較為直觀的了解新疆非落葉型黃萎菌的致病過程,為黃萎病菌在大田防治中提供一個理論基礎。
4 結 論
構建了含有GFP-GUS融合基因的真菌表達載體,并通過農桿菌介導轉入兩株致病性不同的非落葉型黃萎病菌,陽性轉化子的孢子和菌絲,通過GUS組織化學染色,都能表現出藍色,表明GUS-GFP融合基因成功的整合到新疆棉花黃萎病菌的基因組中,并能穩定的遺傳表達。在農桿菌介導轉化兩株非落葉型的新疆黃萎病菌時,選用啟動子的表達、篩選抗生素的濃度、農桿菌的類型等諸多因素影響非落葉型黃萎病菌。弱毒菌株一般都為非落葉型黃萎病菌,現在在病原菌中又出現了中間型的菌株,在弱毒株轉變為強毒株的過程中,中間型的菌株成為一個過渡類型,其轉變過程是多方面因素決定的,但是轉變機理未知,通過轉基因的非落葉型黃萎病菌能直觀的了解菌株之間的轉化過程。
References)
[1] 劉學堂,宋曉軒.棉花黃萎病菌的研究及最新進展[J].棉花學報,1998,10(1):6-13.
LIU Xue-tang, SONG Xiao-xuan. (1998). The research and the latest progress of cotton verticillium wilt[J].CottonScience, 10(1): 6-13. (in Chinese).
[2] Adams S. S Rouse D. I Bowden R. Performance of alternative versions of POTWIL: a computer model that simulates the seasonal growth of Verticillium-infected potato ,Am.PotatoJ, 1987, 64: 429-435.
[3] 李淑英,吳德祥,路羲結,等.棉花黃萎病致病機理及抗病育種研究進展[J].安徽農業科學, 2001, 29(4): 477-479.
LI Shu-ying, WU De-xiang, LU Xi-jie, et al. (2001). Advanceed researches on the mechanis of virulence of Verticillum dahliae and resistance breeding in cotton [J].JournalofAnhuiAgriculturalSciences, 29(4): 477-479. (in Chinese).
[4] Garas, N. A. (1986). Relationship of cultivar resistance to distribution of verticillium dahliae in inoculated cotton plants and to growth of single conidia on excised stem segments.Phytopathology, 76(10):1,005-1,010.
[5] Weller, R. (2003). Nitric oxide: a key mediator in cutaneous physiology.Clinical&ExperimentalDermatology, 28(5):511-514.
[6] Andrie, R. M., & Martinez, J. P. L. M. (2005). Development of toxa and toxb promoter-driven fluorescent protein expression vectors for use in filamentous ascomycetes.Mycologia, 97(5):1,152-1,161.
[7] Vallad, G. E., & Subbarao, K. V. (2008). Colonization of resistant and susceptible lettuce cultivars by a green fluorescent protein-tagged isolate of verticillium dahliae.Phytopathology, 98(8):871-885.
[8] Hooykaas, P. J. J., Roobol, C., & Schilperoort, R. A. (1979). Regulation of the transfer of ti plasmids of agrobacterium tumefaciens.JournalofGeneralMicrobiology, 110(1):99-109.
[9] Bundock, P. ,., Dulk-Ras, A. D., Beijersbergen, A.,& Hooykaas, P. J. (1995). Trans-kingdom t-dna transfer from agrobacterium tumefaciens to saccharomyces cerevisiae.EmboJournal, 14(13):3,206-3,214.
[10] Rauyaree, P., Ospina-Giraldo, M. D., Kang, S., Bhat, R. G., Subbarao, K. V., & Grant, S. J., et al. (2005). Mutations in vmk1, a mitogen-activated protein kinase gene, affect microsclerotia formation and pathogenicity in verticillium dahliae.CurrentGenetics, 48(2):109-116.
[11] Martyn, R. D. (1991). Resistance to races 0, 1, and 2 of fusarium wilt of watermelon in citrullus sp. pi-296341-fr.HortscienceAPublicationoftheAmericanSocietyforHorticulturalScience, 26(4):429-432.
[12] Mullins, E. D., Chen, X.,Romaine, P.,Raina, R.,Geiser, D. M., & Kang, S. ,. (2001). Agrobacterium-mediated transformation of fusarium oxysporum: an efficient tool for insertional mutagenesis and gene transfer.Phytopathology, 91(2):173-180.
[13] Huang, H. C., & Hanna, M. R. (1991). An efficient method to evaluate alfalfa cultivars for resistance to verticillium wilt.CanadianJournalofPlantScience, 71(3):871-875.
[14] 徐旗榮.棉花黃萎病菌T-DNA插入突變體表型特征及側翼序列分析[D].北京.中國農業科學院生物技術研究所博士論文,2009.
XU Qi-rong. (2009).PhenotypecharacteristicsandflankingsequenceanalysisofT-DNAinsertionalmutantsonverticilliumdahliae[D]. PhD Dissertation. Biotechnology Research Institute, Beijing. (in Chinese).
[15] 趙風軒.綠色熒光蛋白標記的大麗輪枝菌的獲得及其在棉花中侵染過程的研究[D]. 北京.中國農業科學院生物技術研究所碩士論文, 2012.
ZHAO Feng-xuan. (2012).Productionofverticilliumdahliaeklebtaggedbygreenfiuorescenceproteinanditsinfectionprocessincotton[D]. Master Dissertation. Biotechnology Research Institute, Beijing. (in Chinese).
[16] Sink, K. C., & Grey, W. E. (1999). A root-injection method to assess verticillium wilt resistance of peppermint ( mentha × piperita l.) and its use in identifying resistant somaclones of cv. black mitcham.Euphytica,106(3):223-230.
[17] 馬 平, Huang H C,李社增,等.一種新的棉花黃萎病快速接種技術及其在病原菌致病力和寄主抗病性鑒定上的應用[J]. 植物病理學報, 2004, 34(6): 536-541.
MA Ping, HUANG H C , LI She-zeng, et al. (2004). A new inoculation method forVerticilliumwilton cotton and its application in evaluating pathogenesis and host resistance [J].ActaPhytopathologicaSinica, 34(6): 536-541. (in Chinese).
[18] 王省芬,馬峙英.一種新的棉花黃萎病抗性鑒定方法[J].棉花學報,2002, 14(4): 231-233.
WANG Xing-fen, MA Chi-ying. (2002). A new method for indification of cotton Verticillium wilt resistance [J].CottonScience, 14(4): 231-233. (in Chinese).
[19] 陳天子,袁洪波,楊郁文.等.農桿菌介導轉化大麗輪枝菌的體系優化[J].棉花學報,2011,23(6):507-514.
CHEN Tian-zi, YUAN Hong-bo, YANG Yu-wen, et al. (2011). Optimization of Agrobacterium tumefaciens-mediated transformation ofVerticilliumdahile[J].CottonScience, 23(6): 507-514. (in Chinese).
[20] 高興喜,楊謙.根癌農桿菌介導的CryIA(b)基因在哈茨木霉菌中的轉化[J].科學通報,2004,49(21):2 193-2 197.
GAO Xing-xi, YANG Qian. (2004). CryIA(b) gene transformationTrichodermaharzianumbyAgrobacteriumtumefaciens-mediated transformation[J].ChineseScienceBulletin, 49(21): 2,193-2,197.(in Chinese).
[21] Eynck, C., Koopmann, B., Grunewaldt-Stoecker, G., Karlovsky, P., & Tiedemann, A. V. (2007). Differential interactions of verticillium longisporum and v. dahliae with brassica napus detected with molecular and histological techniques.EuropeanJournalofPlantPathology, 118(3):259-274.
Fund project:Ministry of Agriculture transgenic major projectsenvironmental safety assessment of transgenic cotton technology(2016ZX08011)
dGFP-GUSGenes Tagged ofVerticilliumDahliaeof Cotton in Xinjiang
KONG De-zhen, HUA Dong-lai ,WANG Xiu-zhen, LIU Bu-cang, ZHU Jian-bo, WANG Ai-ying
(CollegeofLifeScience,ShiheziUniversity,ShiheziXinjiang832000,China)
【Objective】 In order to analyze theVerticilliumdahliaeingression mechanism.【Method】A novel vector 1304-P-ORF was constructed from the plasmids of PUCCATPH, pCAMBIA1304, which includedGFP-GUSgene driven by the trpc promoter, which induced wild-type agrobacterium tumefaciens AGL-1 and GV3101.Vector 1304-P-ORF was transformed intoVerticilliumdahliaestrain VD-1 and VD-278 by agrobacterium tumefaciens-mediated transformation (ATMT).【Result】The result showed that screening concentration of hygromycin was 30 mg/ml, and agrobacterium AGL-1 to conversion efficiency was 40% higher than GV1301 toVerticilliumdahliae. 2 independent strains of T1generation of transgenic VD-1 and 6 independent strains of T1generation VD-278 were screened on PDA medium containing hygromycin.GUSenzyme could be detected in spore and hyphae ofVerticilliumdahliaeby tissue staining.GFPand hygromycin genes were confirmed by PCR amplification by using DNA of transgenic strains, which indicated thatGFP-GUSand hygromycin genes had been successfully transformed into transgenic strains.【Conclusion】The study laid foundations for further using ofGFP-GUSgene and genetic transformation system of XinjianngVerticilliumdahliae, which will benefit a lot in further study ofVerticilliumdahliaeinfection of cotton.
Ptrpc promoter; ATMT;GFP-GUS; cottonVerticilliumdahliae
10.6048/j.issn.1001-4330.2016.01.001
2015-05-08
農業部轉基因重大專項“轉基因棉花環境安全評價技術”(2016ZX08011)
孔德真(1987-),男,甘肅臨夏人,碩士研究生,研究方向為環境生物技術,(E-mail)kongdezhen1746@163.com
王愛英(1972-),女,山東成武人,副研究員,研究方向為環境生物技術以及安全性評價,(E-mail)way-sh@126.com
S435.62
A
1001-4330(2016)01-0001-08

