大慶鹽堿地九種植物根際土壤微生物群落結構及功能多樣性
杜瀅鑫, 謝寶明, 蔡洪生, 唐 璐, 郭長虹
哈爾濱師范大學生命科學與技術學院, 分子細胞遺傳與遺傳育種黑龍江省重點實驗室, 哈爾濱 150025
?
大慶鹽堿地九種植物根際土壤微生物群落結構及功能多樣性
杜瀅鑫, 謝寶明, 蔡洪生, 唐璐, 郭長虹*
哈爾濱師范大學生命科學與技術學院, 分子細胞遺傳與遺傳育種黑龍江省重點實驗室, 哈爾濱150025
摘要:鹽堿土是陸地表面生態脆弱區域。它與荒漠化過程相伴而生,不但造成了資源的破壞、農業生產的巨大損失,而且還對生物圈和生態環境構成威脅。研究鹽堿地植物根際土壤微生物群落的多樣性,對于鹽堿土壤的植被恢復和生態重建具有重要意義。運用PCR-DGGE技術和Biolog微平板法,對大慶鹽堿地9種不同植物根際土壤微生物結構和功能的多樣性進行了分析。結果表明,不同植物根際土壤微生物組成不同,同一科的植物具有相似的微生物組成。對11個克隆進行了序列測定,發現這一地區植物根際優勢微生物菌群為變形菌門(Proteobacteria)和酸桿菌門(Acidobacteria)。利用Biolog微平板法分析了微生物群落功能多樣性。結果表明,不同植物根際土壤細菌群落對底物碳源的代謝特征存在著一定的差異,其中豆科的野大豆根際土壤細菌對底物碳源的代謝能力最強。
關鍵詞:鹽堿地; 植物根際; 微生物群落; PCR-DGGE; Biolog微平板法
土地鹽堿化是土地退化的主要形式,同時是生態環境的一種惡化現象,嚴重影響農業的發展。中國現有鹽漬土地總面積為10000×104hm2[1]。大慶地區鹽堿化總面積42.9955×104hm2,其中大慶鹽堿化面積14.8687×104hm2,肇州鹽堿化面積4.8113×104hm2,肇源鹽堿化面積8.769×104hm2,林甸鹽堿化面積4.6833×104hm2,杜蒙鹽堿化面積9.8592×104hm2[2]。
鹽生植物因為生境惡劣,生物量小,經濟效益低,所以沒有得到人們的足夠重視,鹽生植物的開發利用程度不夠,嚴重影響了鹽漬土的利用和改良。但是大多數鹽生植物則是鹽漬土上唯一能夠生存的植物,它們對鹽漬土的開發與利用,以及維持生態平衡起著至關重要的作用,它們的生態價值是不可以被忽略的。隨著人口的增長和經濟的發展以及改善生態環境的迫切需要,鹽漬土資源和耐鹽植物資源將會變得日益重要[3]。
土壤是許多土壤微生物的生存寄居場所,由于土壤有機質含量酸堿度水分及土質的不同,與此環境相適應的土壤微生物種類也千差萬別,在同一地區,不同的植物根際土壤微生物種類和數量也不一樣[4]。鹽堿土壤中植物的根際微生物群落研究對于加強對鹽生植物資源的開發和利用,以及改良鹽堿土壤具有十分重要的意義。
本文從鹽堿土壤中植物的根際微生物群落研究入手,以大慶鹽堿地區不同植物根際土壤為實驗材料,利用PCR-DGGE和Biolog微平板法分析,評價鹽堿地不同植物根際微生物群落結構及功能多樣性,為鹽堿土壤的植被恢復奠定基礎。
1研究區域
鹽堿樣地位于黑龍江省大慶市采油三廠第五礦區周圍草地,地理為46°41′—46°42′N,124°59′—124°60′E。該地屬于大陸性半干旱溫帶草原氣候,降水量最大時期為7月份。土壤為鹽堿土,pH值為8.7—9.3,主要優勢植物有鵝觀草(Roegneriakamoji)、羊草(Leymuschinensis)、虎尾草(Chlorisvirgata)、黃芪(Astragalusmembranaceus)、野大豆(Glycinesoja)、甘草(Glycyrrhizauralensis)、菊芋(Helianthustuberosus)、大籽蒿(Artemisiasieversiana)、堿地膚(Kochiascoparia)等。
2樣品來源與研究方法
2.1樣品來源
于2013年8月1日對鹽堿樣地進行土壤樣品采集。在鹽堿樣地內隨機選取3個樣點,按五點采樣法采集0—20 cm土壤樣品,用鐵鍬將植物從土壤中連根挖出,將植物根際土壤自然抖落,混合均勻,用標本采集袋將植物裝好,將土壤樣品放在便攜式冰盒中帶回實驗室,用于Biolog微平板法分析的土樣取根際鮮土立即用于實驗,用于DGGE分析的土樣,放在-20 ℃冰箱保存。
2.2研究方法2.2.1土壤DNA的提取
提取方法在Zhou[5]的基礎上進行了改進,取土壤樣品0.25 g,置50 mL離心管中,偏磷酸鈉(pH值8.5,含1% PVP)洗滌3次,攪拌均勻,10000 r/min離心5 min,轉移沉淀至1.5 mL離心管中,貯存于-20 ℃冰箱。取沉淀,重懸于500 μL DNA提取緩沖液,加入溶菌酶(50 mg/mL)至1 mg/mL,顛倒混勻,37 ℃水浴1 h,加入蛋白酶K至100 μg/mL,65 ℃水浴1 h;中間反復凍融3次;加入等體積的氯仿/異戊醇抽提,12000 r/min離心10 min,取上清加入0.5倍體積PEG 8000,12000 r/min離心10 min,-20 ℃過夜,沉淀用70%乙醇洗滌,8000 r/min離心5 min,晾干,溶于100 μL pH值8.0 TE緩沖液。得到土壤總DNA。
2.2.2PCR擴增
PCR擴增的引物采用細菌通用性引物,序列是:B968FGC(5′ -CGCCCGCCGCGCGCGGCGGGCGGGGCGGGGGCACGGGGGGAACGCGAAGAACCTTAC-3′),B1401R(5′-GCGTGTGTACAAGACCC-3′)[6]。PCR的反應體系是50 uL,PCR反應條件為:94 ℃預變性5 min;94 ℃變性1 min,55 ℃退火1 min,72 ℃延伸1 min,30個循環;最后在72 ℃延伸7 min。擴增結果用2%的瓊脂糖凝膠進行檢測。
2.2.3PCR產物的DGGE
在Muyzer的方法進行優化[7]。DGGE采用BIO-RAD Dcode Universal Mutation Detection System進行,丙烯酰胺凝膠強度為8%,變性劑梯度為40%—60%,100%的變性劑含有7 mol/L尿素和40%的去離子甲酰胺。每孔加入10 μL的PCR產物和6 μL的6 × Loadding buffer,加樣完成后,接通電泳電源,在70 V、60 ℃條件下電泳13 h。電泳結束后,DGGE凝膠放在SYBR Green中浸泡30 min,脫水10 min后,最后利用Bio-Rad凝膠成像系統進行拍照并分析。
2.2.4DGGE圖譜分析
圖譜分析采用Bio-Rad公司的凝膠定量軟件Quantity One 4.6.5。對樣品條帶分析。根據DGGE圖譜中條帶分布用UPGMA(Unweighted pair group method Using arithmetic averages)進行聚類分析。
2.2.5條帶的切膠、克隆和測序
切膠、克隆和測序主要參照王小芬[8]等的方法。擴增出來的產物送交到上海生工生物工程股份有限公司測序。將測序結果遞交RDP(Ribosomal Database Project)數據庫進行菌種鑒定。
2.2.6Biolog-ECO微平板分析
稱取5 g土壤加入到裝有45 mL滅菌NaCl溶液的三角瓶中(濃度為0.85%),然后在旋轉振蕩器上震蕩30 min搖勻。土壤溶液依次稀釋至10-3,向Biolog微平板(美國BIOLOG公司)上每孔加入150 μL土壤稀釋液,然后在室溫條件下(28 ℃),將微孔板放在保濕容器中避光培養,每隔24 h用酶標儀讀取在590 nm(顏色+濁度)和750 nm(濁度)波長的數值。
單孔平均光密度(AWCD)計算按照Garland和Mills的方法[9],即AWCD(590—750)nm=∑(C590—750)/31,式中31為Biolog微平板上供試碳源的種類數。

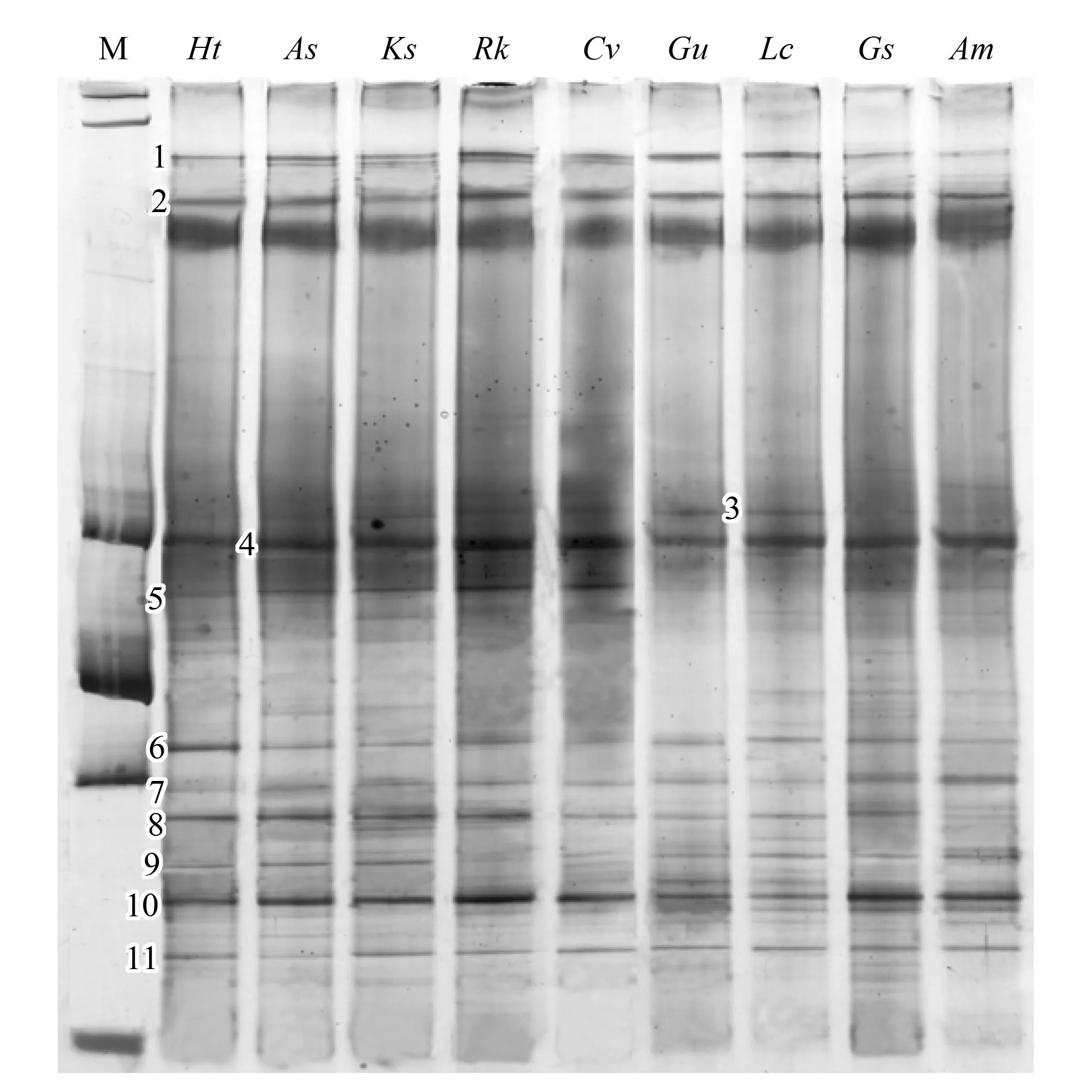
圖1 16S rDNA擴增片段的DGGE圖譜Fig.1 DGGE profiles of the PCR products M:Marker,Ht:菊芋,As:大籽蒿,Ks:堿地膚,Rk:鵝觀草,Cv:虎尾草,Gu:甘草,Lc:羊草,Gs:野大豆,Am:黃芪
2.2.7數據分析
所有數據均用軟件Excel和SPSS 19.0軟件用Duncan檢驗方法進行數據分析處理和差異顯著性分析(P< 0.05差異顯著)。同列數據后具有相同字母者,表示在0.05水平上差異不顯著。
3結果與分析
3.1PCR-DGGE結果分析3.1.1鹽堿地植物根際土壤細菌PCR-DGGE分析
對大慶鹽堿地區9種不同植物根際土壤細菌多樣性進行了DGGE分析(圖1)。結果表明,DGGE條帶數目、強度、均勻度都存在不同的差異。大慶鹽堿地區九種不同植物根際土壤樣品之間具有公共的條帶,說明供試土壤根際微生物之間可能存在一些共有的細菌類群,然而有些公共條帶的亮度存在差異,表明不同植物根際細菌具有數量上的差異。
從圖1和表1可以看出,1、2、4、8、10、11是研究樣本的共有細菌,其中3菊芋、大籽蒿、甘草和黃芪樣本中不存在,其他樣本中均存在;5甘草和羊草樣本中不存在,其他樣本中均存在;6堿地膚中不存在,其他樣本中均存在;7菊芋、大籽蒿和堿地膚中不存在,其他樣本中都存在。
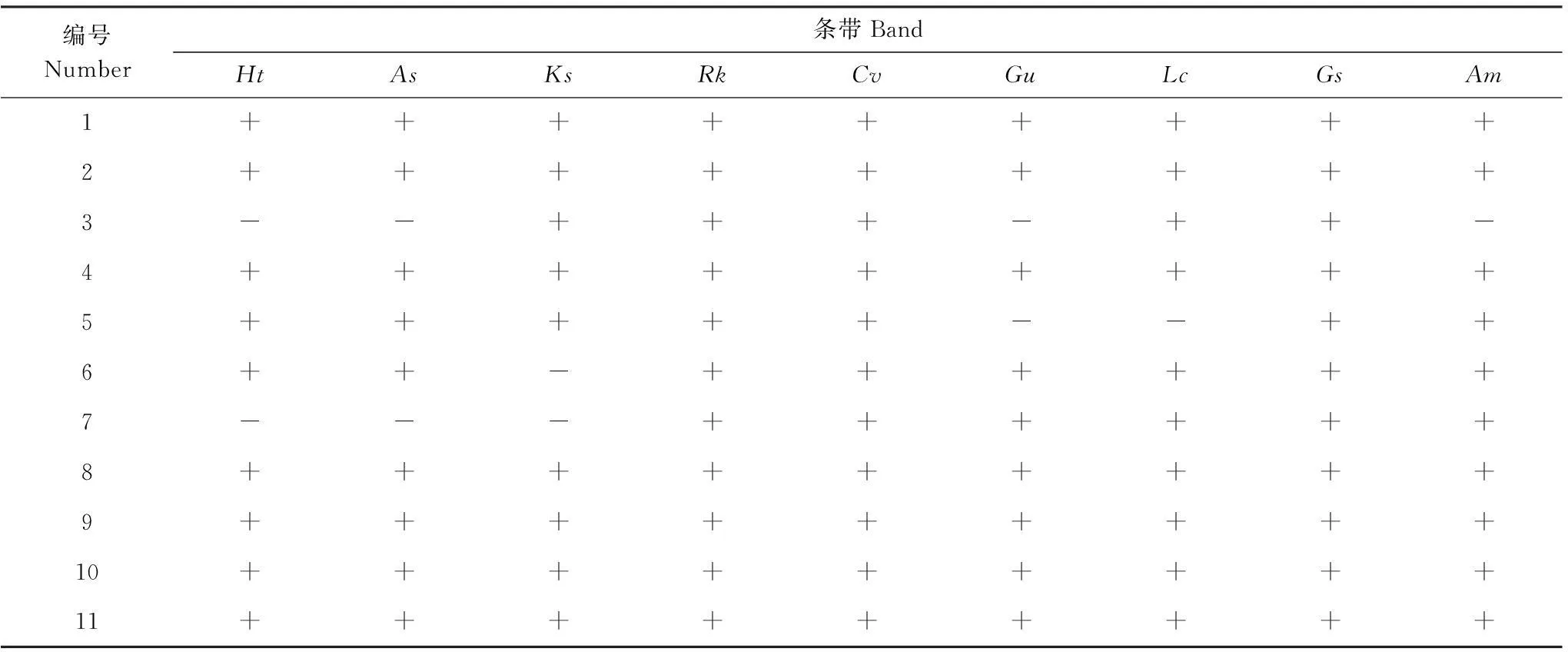
表1 土壤細菌PCR-DGGE電泳圖譜條帶分析
Ht:菊芋,As:大籽蒿,Ks:堿地膚,Rk:鵝觀草,Cv:虎尾草,Gu:甘草,Lc:羊草,Gs:野大豆,Am:黃芪
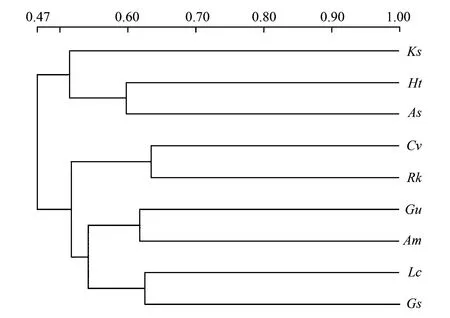
圖2 DGGE圖譜聚類分析Fig.2 Cluster analysis of DGGE banding patterns Ht:菊芋,As:大籽蒿,Ks:堿地膚,Rk:鵝觀草,Cv:虎尾草,Gu:甘草,Lc:羊草,Gs:野大豆,Am:黃芪
3.1.2DGGE聚類分析
運用Bio-Rad公司Quantity One分析軟件繪制出不同植物根際微生物之間的遺傳簇關系(圖2)和遺傳距離與群落差異(表2)。根據群體間不同的遺傳距離,對其進行聚類分析(UPGMA),結果表明,當取值水平在0.55以上時,菊芋和大籽蒿,虎尾草與鵝觀草,甘草與黃芪根際微生物分別屬于同一簇。說明同一科植物根際微生物的類群比較接近。
3.1.3DGGE條帶測序分析
將測序結果遞交RDP數據庫進行鑒定,結果表明,1、2、4為酸桿菌門(Acidobacteria),5、8、9、10、11為變形菌門(Proteobacteria),其他為未知菌種。
3.2Biolog微平板結果分析
3.2.1不同植物根際土壤微生物利用總碳源的動力學特征
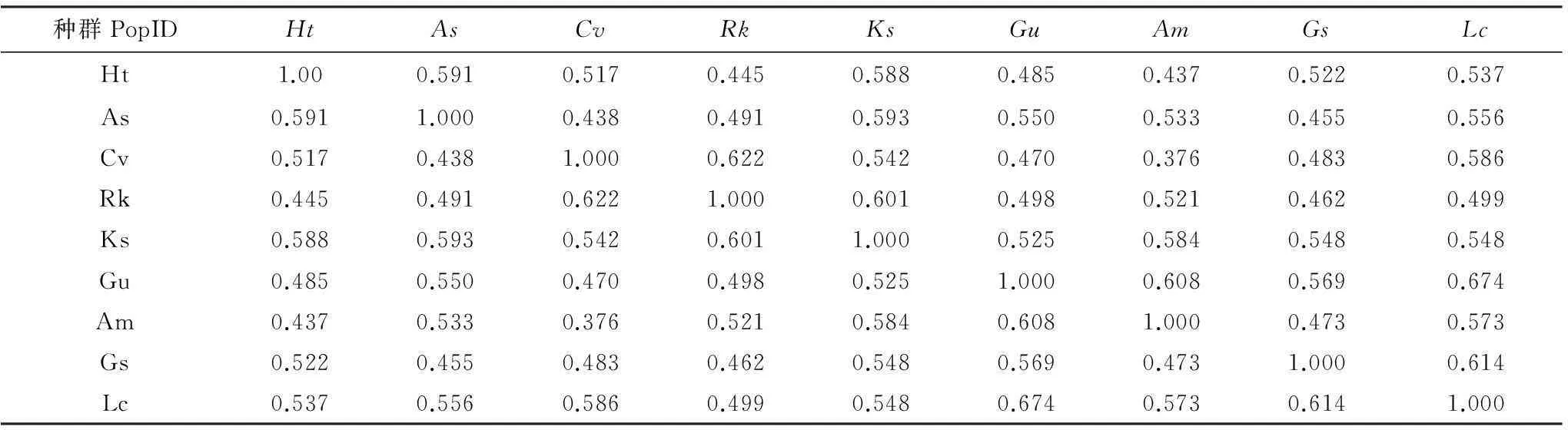
表2 不同植物的遺傳距離和細菌群落差異
Ht:菊芋,As:大籽蒿,Ks:堿地膚,Rk:鵝觀草,Cv:虎尾草,Gu:甘草,Lc:羊草,Gs:野大豆,Am:黃芪
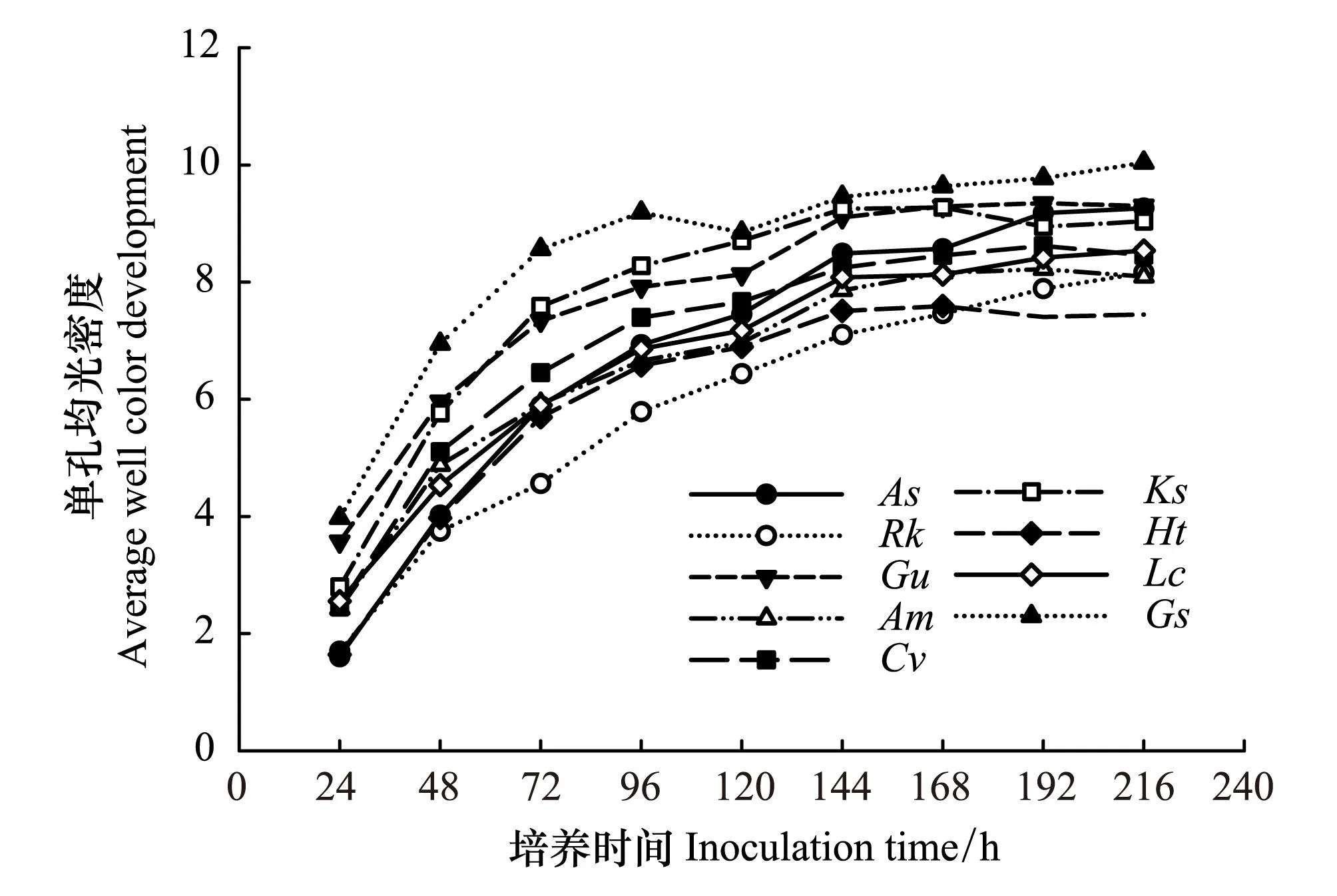
圖3 不同植物根際土壤微生物AWCD隨時間的變化曲線 Fig.3 Ariation in AWCD of rhizosphere soil microbial communities over time for different plantsHt:菊芋,As:大籽蒿,Ks:堿地膚,Rk:鵝觀草,Cv:虎尾草,Gu:甘草,Lc:羊草,Gs:野大豆,Am:黃芪
對9種植物根際土壤微生物進行了Biolog微平板分析(圖3)。AWCD曲線反映土壤細菌在Biolog微平板中的生長情況,通常認為,曲線變化幅度越大的樣品碳源利用能力較高,也具有比較高的豐富度。結果表明,9種植物中根際微生物對碳源利用能力最強的是野大豆,其他植物對碳源的利用能力比較接近。
3.2.2土壤微生物功能多樣性的主成分分析
進一步對不同植物土壤細菌群落底物碳源代謝主成分進行了分析(圖4)。結果表明,野大豆和堿地膚與其他植物沒有交集,說明野大豆和堿地膚根際土壤細菌群落對底物碳源的代謝特征與其他植物有顯著差異。鵝觀草除了與菊芋有交集外,同其他植物沒有交集,說明鵝觀草根際土壤細菌群落對底物碳源的代謝特征只與菊芋無明顯差異,同其他植物都有明顯差異。
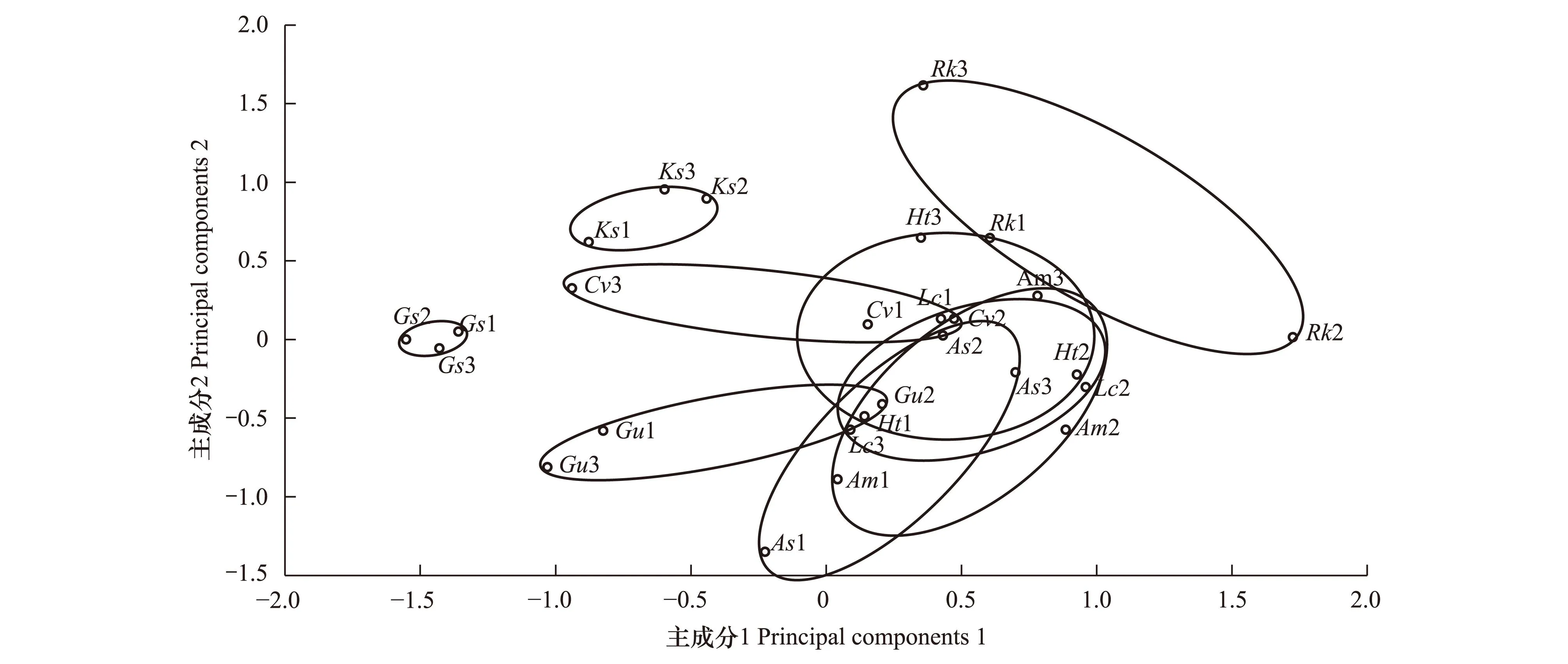
圖4 不同植物根際土壤細菌群落的主成分分析Fig.4 Principal component analysis (PCA) of soil bacteria communities in rhizosphere for different plantsHt1-3:菊芋,As1-3:大籽蒿,Ks1-3:堿地膚,Rk1-3:鵝觀草,Cv1-3:虎尾草,Gu1-3:甘草,Lc1-3:羊草,Gs1-3:野大豆,Am1-3:黃芪
3.2.3土壤微生物群落多樣性指數分析
對不同植物根際土壤微生物在培養96 h的多樣性指數進行了分析(表3)。Shannon多樣性指數是研究個體數及群落種群數和分布均勻度的綜合指標,它是目前應用最廣泛的群落多樣性指數之一。Simpson指數較多反映了微生物群落中最常見的物種優勢度,MicIntosh指數則是群落物種均一性的度量。從表3可以看出,Shannon多樣性指數與Simpson指數均以野大豆土壤樣本最高,鵝觀草土壤樣本最低,不同植物根際土壤樣本間存在一定的差異。MicIntosh指數的變化與Shannon多樣性指數正相反,鵝觀草土壤樣本最高,野大豆土壤樣本最低。
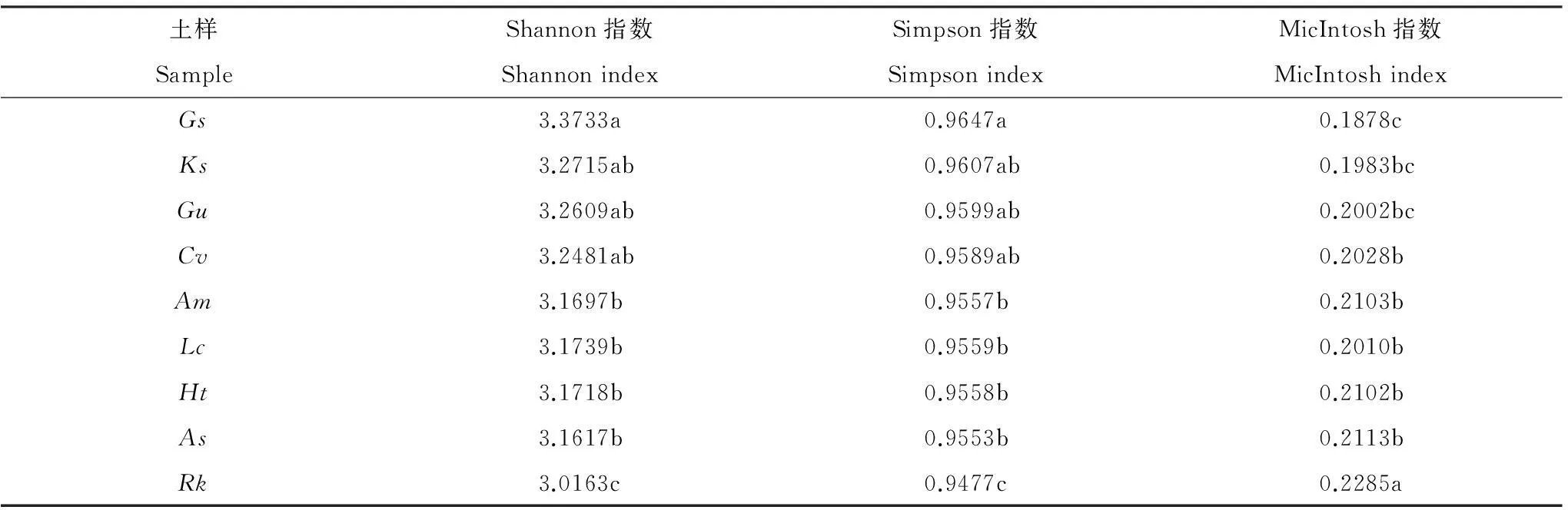
表3 不同植物根際土壤微生物群落多樣性指數
不同字母表示統計學上的差異性(P< 0.05);Ht:菊芋,As:大籽蒿,Ks:堿地膚,Rk:鵝觀草,Cv:虎尾草,Gu:甘草,Lc:羊草,Gs:野大豆,Am:黃芪
4討論
土壤中絕大多數的微生物是不可培養的[11]。所以,傳統的稀釋平板涂布方法不能真實和準確的反應出土壤中微生物的結構組成,這就需要運用更先進的分子生物學方法來了解土壤中微生物的結構和組成[12]。
本文通過DGGE方法,研究了大慶鹽堿地植物根際土壤群落結構多樣性,結果表明,不同的植物之間土壤微生物群落結構相似性比較高,但也存在著一些差異。DGGE指紋圖譜的聚類分析顯示,同一科的植物,它們的根際土壤微生物群落結構歸為同一簇,表明植物本身對根際土壤微生物群落有一定的調節作用。DGGE圖譜中的優勢條帶進行測序結果表明,其中共有的1、2、4細菌屬于酸桿菌門(Acidobacteria),5、8、9、10、11細菌屬于變形菌門(Proteobacteria),具有差異的3、6、7細菌均為未知菌種。這與Fierer等[13]和Deangelis等[14]的研究類似,他們推測變形菌門在各種植物根際微生物占優勢菌群的原因是它們在各種植物的根際中增長的速度很快。同時,本研究出現了酸桿菌門的菌群與Kielak等[15]和Yergeau等[16]的研究相類似。他們認為酸桿菌門細菌是微生物生態系統中穩定的組成部分,因為它們所需的營養物質很少或者營養物質不變。Duineveld等[17]也曾證明這些是由它們貧營養的性質所決定的,這使得它們能慢慢的應對植物根環境的變化,包括那些由根分泌物產生的影響。這與鄭賀云等[18]的研究有所不同,鄭賀云等發現29個序列屬于不可培養的微生物,43個序列分屬粘球菌目(Myxococcales)、假單胞菌目(Pseudomonadales)、根瘤菌目(Rhizobiales)、芽孢桿菌目(Bacillales)、伯克氏菌目(Burkholderiales)、放線菌目(Actinomycetales)、海洋螺菌目(Oceanospirillales)、黃桿菌目(Flavobacteriales)、交替單胞菌目(Alteromonadales),21個屬,因為研究的地域不同,所以出現不同的研究結果。
Biolog微平板法廣泛用于評價土壤微生物群落的功能多樣性。微生物功能多樣性對同一環境下不同植物根際微生物群落具有重要意義。通過Biolog微平板AWCD分析,可以看出豆科植物根際土壤微生物群落對碳底物利用的能力明顯強于其他科植物,滕應等[19]在研究復墾紅壤中牧草根際微生物群落時,推測植物向根際土壤分泌的碳水化合物越多,根際微生物對碳底物利用的能力越強。本研究的結果表明,豆科植物野大豆向根際土壤分泌的碳水化合物要超過其他植物,同一科的植物根際土壤細菌群落對底物碳源的代謝特征比較相似(如黃芪和甘草,虎尾草和羊草,菊芋和大籽蒿),不同科植物根際土壤細菌群落對底物碳源的代謝特征存在著一定的差異(如堿地膚與其他植物)。Shannon多樣性指數反應物種的豐富度,Simpson指數反應常見物種的優勢度,野大豆無論在物種的豐富度,還是物種的優勢度上都處于最高數值。豆科植物黃芪和甘草的Shannon和Simpson指數也相對較高,這與Perez-Montan等[20]的研究結果相似,他認為豆科植物和根瘤菌共生系統可以很好的完成生物固氮,從而提高根際微生物的數量。
DGGE技術對根際土壤進行檢測時存在一些難題,微生物群落中數量小于1%的種群不能采用DGGE技術進行檢測分析[7]。兩個微生物16S rRNA的GC含量相同,可是序列組成卻不同,如果從DGGE圖譜上看,它們都是同一個條帶,這就不能準確的分析微生物群落的多樣性,容易產生錯誤的分析結果[21]。所以,為了降低由于分析方法產生的誤差,分析微生物群落多樣性時可以將幾種不同的分析方法結合使用[22]。目前許多研究正在利用宏基因組學的方法分析微生物的多樣性,它是直接提取全部微生物的DNA,構建宏基因組文庫,利用基因組學研究微生物的群落功能和遺傳組成[23],是一種研究微生物多樣性的新理念和新方法,在未來可能會有廣泛的應用。
本研究運用PCR-DGGE技術和Biolog微平板法,分析了大慶鹽堿地區9種不同植物根際微生物結構和功能的多樣性,為鹽堿地土壤的開發利用和生物修復提供了重要參考。
參考文獻(References):
[1]張寶賢, 王光明, 譚德云, 劉紅光, 楊云峰, 孫麗娟. 蓖麻雜交種耐鹽堿能力評價試驗初報. 中國農學通報, 2012, 28(33): 88- 92.
[2]陳建軍, 張樹文, 陳靜, 唐俊梅. 大慶市土地鹽堿化遙感監測與動態分析. 干旱區資源與環境, 2003, 17(4): 101- 106.
[3]劉陽春, 何文壽, 何進智, 沈振榮. 鹽堿地改良利用研究進展. 農業科學研究, 2007, 28(2): 68- 71.
[4]李鳳霞, 郭永忠, 許興. 鹽堿地土壤微生物生態特征研究進展. 安徽農業科學, 2011, 39(23): 14065- 14067, 14174- 14174.
[5]Zhou J, Bruns M A, Tiedje J M. DNA recovery from soils of diverse composition. Applied and Environmental Microbiology, 1996, 62(2): 316- 322.
[6]Heuer H, Smalla K. Evaluation of community-level catabolic profiling using BIOLOG GN microplates to study microbial community changes in potato phyllosphere. Journal of Microbiological Methods, 1997, 30(1): 49- 61.
[7]Muyzer G, De Waal E C, Uitterlinden A G. Profiling of complex microbial populations by denaturing gradient gel electrophoresis analysis of polymerase chain reaction-amplified genes coding for 16S rRNA. Applied and Environmental Microbiology, 1993, 59(3): 695- 700.
[8]王小芬, 王偉東, 高麗娟, 崔宗均. 變性梯度凝膠電泳在環境微生物研究中的應用詳解. 中國農業大學學報, 2006, 11(5): 1- 7.
[9]Garland J L, Mills A L. Classification and characterization of heterotrophic microbial communities on the basis of patterns of community-level sole-carbon-source utilization. Applied and Environmental Microbiology, 1991, 57(8): 2351- 2359.
[10]楊永華, 姚健, 華曉梅. 農藥污染對土壤微生物群落功能多樣性的影響. 微生物學雜志, 2000, 20(2): 23- 25.
[11]Amann R I, Ludwig W, Schleifer K H. Phylogenetic identification and in situ detection of individual microbial cells without cultivation. Microbiological Reviews, 1995, 59(1): 143- 169.
[12]Pace N R. A molecular view of microbial diversity and the biosphere. Science, 1997, 276(5313): 734- 740.
[13]Fierer N, Bradford M A, Jackson R B. Toward an ecological classification of soil bacteria. Ecology, 2007, 88(6): 1354- 1364.
[14]Deangelis K M, Brodie E L, Desantis T Z. Selective progressive response of soil microbial community to wild oat roots. International Society for Microbial Ecology Journal, 2009, 3(2): 168- 178.
[15]Kielak A, Pijl A S, Veen J A, Kowalchuk G A. Differences in vegetation composition and plant species identity lead to only minor changes in soil-borne microbial communities in a former arable field. FFFS Microbiology Ecology, 2008, 63(3): 372- 382.
[16]Yergeau E, Schoondermark-Stolk S A, Brodie E L, Déjean S, DeSantis T Z, Gon?alves O, Piceno Y M, Andersen G L, Kowalchuk G A. Environmental microarray analyses of Antarctic soil microbial communities. International Society for Microbial Ecology Journal, 2009, 3(3): 340- 351.
[17]Duineveld B M, Rosado A S, van Elsas J D, van Veen J A. Analysis of the dynamics of bacterial communities in the rhizosphere of the chrysanthemum via denaturing gradient gel electrophoresis and substrate utilization patterns. Applied and Environmental Microbiology, 1998, 64(12): 4950- 4957.
[18]鄭賀云, 黎志坤, 李超, 張鮮姣, 胡建偉, 朱紅惠. 新疆阿克蘇地區鹽堿地細菌類群多樣性及優勢菌群分析. 微生物學通報, 2012, 39(7): 1031- 1043.
[19]滕應, 黃昌勇, 龍健, 姚槐應. 復墾紅壤中牧草根際微生物群落功能多樣性. 中國環境科學, 2003, 23(3): 295- 299.
[21]周小奇, 王艷芬, 蔡瑩, 黃祥忠, 郝彥賓, 田建卿, 柴團耀. 內蒙古典型草原細菌群落結構的PCR-DGGE檢測. 生態學報, 2007, 27(5): 1674- 1689.
[22]吳永勝, 馬萬里, 李浩, 盧萍, 呂桂芬. 內蒙古退化荒漠草原土壤細菌群落結構特征. 生態學報, 2010, 30(23): 6355- 6362.
[23]李慧, 何晶晶, 張穎, 徐慧, 陳冠雄. 宏基因組技術在開發未培養環境微生物基因資源中的應用. 生態學報, 2008, 28(4): 1762- 1773.
Structural and functional diversity of rhizosphere microbial community of nine plant species in the Daqing Saline-alkali soil region
DU Yingxin, XIE Baoming, CAI Hongsheng, TANG Lu, GUO Changhong*
LaboratoryofMolecularCytogeneticsandGeneticBreedingofHeilongjiangProvince,CollegeofLifeScienceandTechnology,HarbinNormalUniversity,Heilongjiang150025,China
Abstract:Saline-alkali soils are particularly ecologically fragile. They generally form following desertification, which destroys natural resources and causes heavy losses to agriculture production. Daqing, a city in the northern province of Heilongjiang, is renowned for its vast oil reserves. Exploitation of these reserves has led to soil contamination by petroleum-derived products, and this is becoming serious ecological problem in this city. Saline-alkali soil is another factor that contributes to rendering most of its agricultural land unusable. In recent years, bioremediation, especially microbial remediation, has been a global focus of research. It is more effective, safer, and more environmentally friendly than other remediation strategies, such as chemical or physical methods. The rhizosphere—the layer of soil influenced by plant roots—is much richer in microbial diversity than the surrounding bulk soil. Exploring the diversity of plant rhizosphere microbial communities in Saline-alkali soils can therefore provide a scientific basis for vegetation restoration and ecological reconstruction in this region. This study focused on plant rhizosphere microbial communities in Saline-alkali soils in the Daqing region. Using Biolog EcoPlate methods, denaturing gradient gel electrophoresis (DGGE) analysis, and subsequent DNA sequencing, we investigated the structural and functional diversity of rhizosphere microbial communities associated with nine plant species in Daqing Saline-alkali soils. The structure of the rhizosphere microbial community associated with each plant species was analyzed by DGGE. Plants in the same family tended to have similar rhizosphere microbial community compositions. Rhizosphere bacteria were dominated by Proteobacteria andAcidobacteria,based on the analysis of 16S rRNA. Pairwise rhizosphere population genetic distances between plant species were calculated using Quantity One software (Bio-Rad Laboratories). In combination with clustering analysis based on the unweighted pair group method with arithmetic mean, it was confirmed that rhizosphere microbial communities reflect relationships among the plant species tested. Biolog EcoPlate was used to investigate the functional diversity of rhizosphere microbial communities. This method is more sensitive to changes in the environment than the other methods such as phospholipid fatty-acid analysis. Changes in functional diversity patterns can be statistically analyzed via principle component analysis of average well color development data. The capacity of rhizobacteria to metabolize carbon sources was higher in communities associated with wild soybean than in other plant species tested. The data also suggest that rhizobacteria from different plant species have distinct carbon metabolism characteristics. While there are limitations in the methods used in this study, they nevertheless provided useful information. Metagenomics—the study of genetic material recovered directly from environmental samples—is becoming increasingly popular as a research tool. It provides a powerful lens for viewing the microbial world that has the potential to revolutionize the understanding of the entire living world. The results of this study offer advanced insights in the field of microbial ecology and provide a theoretical basis for future practical applications.
Key Words:saline-alkali soil; rhizosphere; microbial community; PCR-DGGE; biolog-ECO
DOI:10.5846/stxb201404020621
*通訊作者
Corresponding author.E-mail: kaku3008@126.com
收稿日期:2014- 04- 02; 網絡出版日期:2015- 06- 12
基金項目:國家自然科學基金(31170479, 31470571); 國家科技支撐計劃項目(2011BAD17B04-2-1); 黑龍江省科技攻關計劃項目(GC12B304)
杜瀅鑫, 謝寶明, 蔡洪生, 唐璐, 郭長虹.大慶鹽堿地九種植物根際土壤微生物群落結構及功能多樣性.生態學報,2016,36(3):740- 747.
Du Y X, Xie B M, Cai H S, Tang Lu, Guo C H.Structural and functional diversity of rhizosphere microbial community of nine plant species in the Daqing Saline-alkali soil region.Acta Ecologica Sinica,2016,36(3):740- 747.

