轉基因水稻標準質粒分子的構建與分析
劉 晉 鄧漢超 王學林 侯紅利 李永紅 楊啟鵬 陳惠芳 周向陽
(農業(yè)部農作物種子質量監(jiān)督檢驗測試中心(深圳)/深圳市農業(yè)科技促進中心,廣東深圳518040)
轉基因水稻標準質粒分子的構建與分析
劉 晉 鄧漢超 王學林 侯紅利 李永紅 楊啟鵬 陳惠芳 周向陽
(農業(yè)部農作物種子質量監(jiān)督檢驗測試中心(深圳)/深圳市農業(yè)科技促進中心,廣東深圳518040)
針對目前轉基因(GM)產品檢測標準分子的缺乏,構建適用于轉基因水稻的標準質粒分子pMDSPS和pMDTheli,其中包含水稻內源基因SPS通用序列,耐鹽基因ThST3和Ubiquitin啟動子序列的構建特異性Theli序列。對其特異性及制備標準曲線的可靠性進行鑒定研究,研究結果顯示,在進行普通PCR擴增時,采用質粒標準分子為陽性對照,均能特異擴增目的條帶。以標準質粒分子構建的標準曲線,SPS基因的定量標準曲線的相關系數(shù)平均為0.9993,PCR擴增效率在1.0004~1.034之間;ThST3基因的定量標準曲線的相關系數(shù)平均為0.9937,PCR擴增效率在0.9358~0.9486之間。因此,構建的標準分子pMDSPS和pMDTheli既能作為普通PCR的陽性對照,也能用于定量標準曲線的構建,為轉基因水稻的定量檢測提供簡便、價格低廉的標準分子打下基礎。
標準質粒分子;實時熒光PCR;標準曲線;PCR效率
隨著轉基因(GM,genetically modified)技術的不斷發(fā)展,產生(獲得)更多優(yōu)良的作物品種有望在解決全球糧食危機方面作出貢獻,然而轉基因產品的出現(xiàn)也引發(fā)公眾對轉基因產品影響食品安全與環(huán)境安全的擔憂。因此,世界各國政府和組織都非常重視轉基因作物及產品的食用安全的監(jiān)管,紛紛建立轉基因標識的制度。檢測技術的發(fā)展為轉基因作物及產品的監(jiān)管提供了重要的技術保障,基于核酸的檢測方法是目前轉基因檢測最為常用的檢測方法。無論是基于核酸還是蛋白質的轉基因檢測方法,都需要陽性對照物質。標準物質既可以作為陽性對照,也可以用來繪制標準曲線用于定量分析。然而目前我國使用的大部分標準物質都是購買國外的產品,這些產品價格貴、針對轉基因的品種少、貨期長等,顯然難以滿足我國對不斷增加的轉基因產品監(jiān)督檢測的需求[1-2]。
質粒標準分子(plasmid standard molecule),是在質粒中重新組裝目標基因或片段的分子。一般整合轉基因的目標基因、序列(包括內源基因、外源基因、篩選基因、構建特異片段、品系特異片段等)。由于構建質粒標準分子的生產成本低、操作簡便、技術成熟等特點,質粒標準分子已經(jīng)公認成為一種解決轉基因檢測標準物質缺乏的有效方法[3-4]。這種方法已經(jīng)大量地應用于轉基因及其產品的定量檢測之中。本研究旨在構建適用于轉基因水稻檢測的標準分子,并對其在特異性及制備標準曲線的可靠性進行檢測。
1 材料與方法
1.1 材料轉基因材料 轉Theli基因水稻,非轉基因水稻。
試劑 質粒DNA提取溶液Ⅰ、溶液Ⅱ、溶液Ⅲ;pMD-T載體連接試劑盒購自TaKaRa公司,TaKaRa Premix PCR試劑盒,100mg/mL氨芐青霉素、IPTG和X-Gal為大連寶生物公司產品,DH5α大腸桿菌為全式金產品,Qiagen Dneasy Plant Mini Kit DNA提取試劑盒,PCR產物純化試劑盒為上海生工產品。
1.2 方法
1.2.1 DNA提取使用試劑盒Qiagen Dneasy Plant Mini Kit提取植物DNA,采用Neno1000檢測DNA的濃度和純度,將DNA稀釋到10~50ng/μ L,-20℃保存?zhèn)溆谩?/p>
1.2.2 引物和探針設計轉Theli基因水稻的特異性引物(耐鹽基因ThST3和Ubiquitin啟動子序列),內源基因SPS引物使用L.X.Jiang等[5]引物。利用Primer5軟件設計目標基因的引物和探針。設計的引物和探針由生工合成,詳見表1。

表1 普通PCR及定量PCR所用引物和探針序列
1.2.3 質粒標準分子的構建普通PCR擴增目標基因片段 PCR擴增體系中Primex Ex Taq 10μL,F(xiàn)引物(10μmol/L)0.4μL,R引物(10μmol/L)0.4μL,DNA(10~50ng/μL)2μL,補充ddH2O至總體積20μL。PCR擴增程序為:94℃預變性2 min;40個循環(huán)(95℃ 30s,58℃30s,72℃ 40s);72℃延伸 2min;20℃10min。PCR產物電泳后采用PCR產物純化試劑盒說明書進行回收。
連接 使用pMD-T克隆載體進行連接,1μL的10×T4 DNA Ligase Buffer,2μL的pMD-T載體,0.5μL的50μg/mL DNA,0.4μL的 T4 DNA Ligase,補充ddH2O至總體積10μL,在4℃冰箱中過夜連接。
轉化 取連接產物5μ L加入含有100μ L的感受態(tài)細胞中,冰浴30min,然后42℃熱激90s,于離心管加入500μ L LB液體培養(yǎng)基,將混勻離心管置于37℃搖床(220r/min,60min),最后用100μ L菌液涂板,37℃培養(yǎng)16h。
單克隆PCR鑒定 挑取單個白色克隆,于10μL雙蒸水中稀釋,取1μL稀釋液作為模板進行PCR擴增,在2%瓊脂糖凝膠中電泳PCR產物,凝膠成像鑒定,大小片段一致的單克隆送測序。
質粒標準DNA拷貝數(shù)測定與計算 大量表達制備標準質粒分子,采用Neno1000測定質粒DNA濃度,按下列公式計算拷貝數(shù):質粒DNA拷貝數(shù)=質粒DNA濃度×上樣質粒體積/質粒DNA分子量×6.02×1023(阿佛加德羅常數(shù))。
1.2.4 實時熒光定量PCR(RT-PCR)定量PCR在ABI 7500熒光PCR儀上進行,反應體系為Primex Ex Taq 10μL,F(xiàn)引物(10μmol/L)0.4μL,R引物(10μmol/L)0.4μL,探針(10μmol/L)0.4μL,DNA(10~50ng/μL)2μL,補充ddH2O至總體積20μL。RT-PCR反應程序:95℃10s;40個循環(huán)(95℃5s,60℃ 34s)。
1.2.5 標準曲線的制作取5×109copies/μL的質粒DNA以10倍濃度梯度進行稀釋,取稀釋梯度為10-1~10-7共7個梯度的DNA為模板,每個梯度重復3次,進行RT-PCR反應。以拷貝數(shù)的對數(shù)為橫坐標,Ct均值為縱坐標,繪制標準曲線,并獲得定量的線性方程。
2 結果與分析
2.1 轉基因標準質粒分子的構建及鑒定為了構建適用于轉Theli基因水稻的特異性檢測標準分子,分別將內源基因SPS(277bp)和外源基因Theli(1108bp)克隆到pMD-T載體中,得到pMDSPS(圖1A)和pMDTheli(圖1B)2個標準質粒分子,大小分別為2969bp和3800bp,質粒分子經(jīng)基因測序,結果與目的序列完全一致。
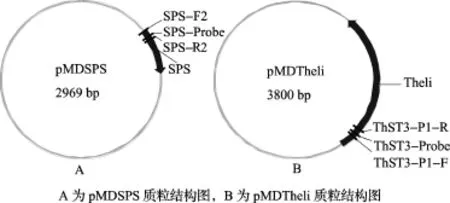
圖1 質粒標準分子結構圖
2.2 質粒標準分子的特異性采用非轉基因水稻基因組DNA、轉Theli基因水稻基因組DNA、質粒標準分子為擴增模板,進行PCR擴增,經(jīng)2%瓊脂糖電泳顯色,其結果見圖2和圖3。內源基因SPS均能在非轉基因水稻基因組DNA、轉Theli基因水稻基因組DNA、質粒標準分子特異擴增,對Theli序列的擴增(圖3)可見轉Theli基因水稻基因組DNA和pMDTheli質粒標準分子能特異擴增,而非轉基因水稻和空白對照未見擴增。
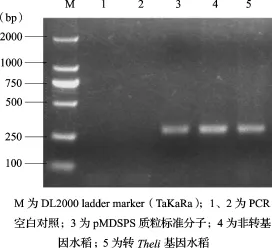
圖2 SPS基因擴增檢測結果
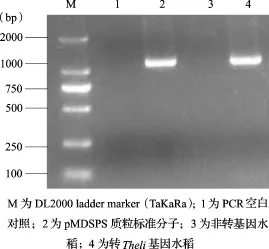
圖3 Theli序列擴增檢測結果
2.3 質粒標準曲線的可靠性分析使用質粒標準分子10倍梯度稀釋產物,每個重復3次進行PCR擴增,獲取的CT值與拷貝數(shù)對數(shù)分別繪制內源基因與目標基因的標準曲線,結果見擴增曲線及標準曲線(圖4、圖5),相關系數(shù)和PCR效率見表2。SPS基因的定量標準曲線(圖4)的相關系數(shù)在0.9993~0.9994之間,平均為0.9993,PCR擴增效率在1.0004~1.034之間,平均為1.02;ThST3基因的定量標準曲線(圖5)的相關系數(shù)在0.9876~0.9996之間,平均為0.9937,PCR擴增效率在0.9358~0.9486,平均為0.94。
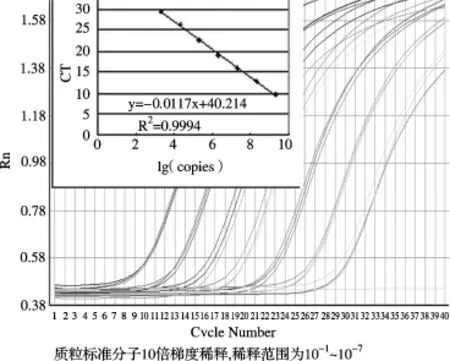
圖4 SPS實時擴增曲線及標準曲線
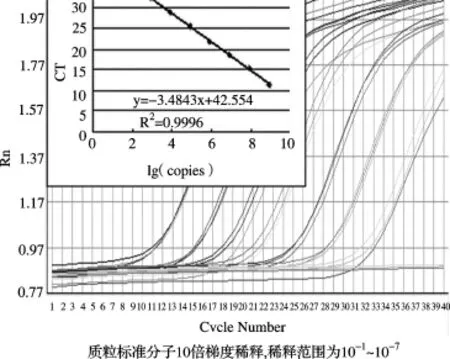
圖5 ThST3實時擴增曲線及標準曲線
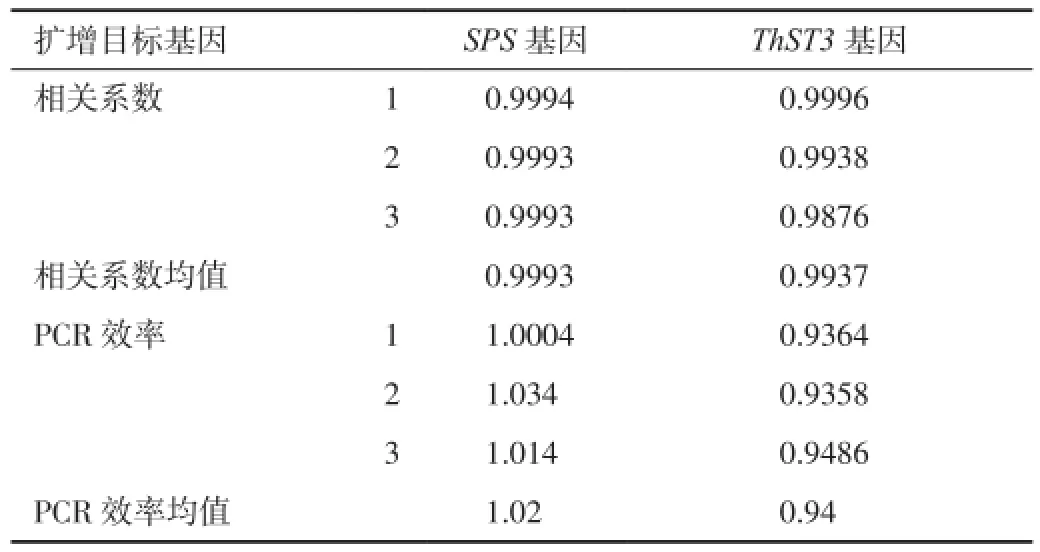
表2 質粒標準分子擴增目標基因的相關系數(shù)和PCR效率
3 結論與討論
目前,檢測轉基因植物及其產品較為通用的標準物質主要來源于植物原材料本身,而且制備標準物質的過程非常復雜,需要精度很高的設備、生產成本較高、保存環(huán)境要求高等,為此難以獲得全面的不同轉基因植物的標準樣品,市場上已經(jīng)商業(yè)化的轉基因標準物質僅有30種左右[6-8]。轉基因成分的實時熒光定量檢測依賴于標準物質,標準物質的缺乏直接制約轉基因作物定量檢測技術的發(fā)展和應用。近年來發(fā)展起來的質粒標準分子技術有望能解決這個難題,該方法已經(jīng)不斷的被研究者所接受[9-11]。因此,本研究著力構建適用于轉基因水稻的標準質粒分子pMDSPS和pMDTheli,其中包含水稻內源基因SPS通用序列,耐鹽基因ThST3和Ubiquitin啟動子序列的構建特異性Theli序列。對其特異性及制備標準曲線的可靠性進行檢測,結果表明,以質粒標準分子為標準陽性對照的普通PCR擴增中,均能特異擴增目的條帶。以標準質粒分子構建的標準曲線,SPS基因的定量標準曲線的相關系數(shù)平均為0.9993,PCR擴增效率在1.0004~1.034之間;ThST3基因的定量標準曲線的相關系數(shù)平均為0.9937,PCR擴增效率在0.9358~0.9486。因此,構建的標準分子pMDSPS和pMDTheli既能作為普通PCR的陽性對照,也能用于定量標準曲線的構建,為轉基因水稻的定量檢測提供簡便、價格低廉的標準分子打下基礎。
[1] 敖金霞,高學軍.轉基因大豆、玉米和水稻外源基因檢測通用標準分子的構建.中國農業(yè)大學學報,2008,13(6):19-24
[2] Yang L T,Guo J C,Pan A H,et al.Event-specific quantitative detection of nine genetically modified maizes using one novel standard reference molecule.J Agric Food Chem,2007,55(1):15-24
[3] 沈愷琳,李想,王姝,等.四種轉基因玉米新型質粒標準分子協(xié)同實驗驗證.中國農業(yè)科技導報,2009,11(5):2-6
[4] Zhang H,Yang L,Guo J,et al.Development of one novel multiple-target plasmid for duplex quantitative PCR analysis of roundup ready soybean. J Agric Food Chem,2008,56(1):5514-5520
[5] Jiang L X,Yang L T,Zhang H B,et al.International collaborative study of the endogenous reference gene,Sucrose Phosphate Synthase(SPS),Used for qualitative and quantitative analysis of genetically modified rice. J Agric Food Chem,2009,57:3525-3532
[6] Vaitilingom M,Pijnenburg H,Gendre F,et al. Real-time quantitative PCR detection of genetically modified Maximizer maize and Roundup Ready Soybean in some representative foods. J Agric Food Chem,1999,47(12):5261-5266
[7] Huang C,Pan T. Event-specific real-time detection and quantification of genetically modified Roundup Ready soybean. J Agric Food Chem,2005,53(10):3833-3839
[8] Liu G M,Li Q G,Wang Q L,et al. Multiplex fluorescence PCR method for detecting transgenic component 35S and nos simultaneously. Jorunal of Xiamen University(Natural Science),2002,41(4):493-497
[9] H?hne M,Santisi C,Meyer R. Real-time multiplex PCR:An accurate method for the detection and quantification of 35S-CaMV promoter in genetically modified maize-containing food. European Food Research and Technology,2002,215(1):59-64
[10] Yang X K,Guo L Y,Yang D Y,et al. Progress in quantitative analysis technology of genetically modified organisms. Chinses Journal of Health Laboratory Technology,2008,18(8):1682-1686
[11] Salvi S,D′orso F,Morelli G. Detection and quantification of genetically modified organisms using very short,locked nucleic acid TaqMan probes. J Agric Food Chem,2008,56(12):4320-4327
2016-10-13)
深圳市技術創(chuàng)新項目(CXZZ20120614165508810);轉基因新品種培育重大專項(2009ZX08001-023B)
鄧漢超

