氨基胍對氧-糖剝奪大鼠皮質神經元一氧化氮及半胱氨酸天冬氨酸蛋白酶3表達的影響研究
唐仕軍,趙 冬,朱立倉,李曉天,朱文學,楊 鵬,王業忠
832000新疆石河子市,石河子大學醫學院第一附屬醫院神經外科
?
·論著·
氨基胍對氧-糖剝奪大鼠皮質神經元一氧化氮及半胱氨酸天冬氨酸蛋白酶3表達的影響研究
唐仕軍,趙 冬,朱立倉,李曉天,朱文學,楊 鵬,王業忠
832000新疆石河子市,石河子大學醫學院第一附屬醫院神經外科
【摘要】目的探討氨基胍對氧-糖剝奪大鼠皮質神經元一氧化氮(NO)及半胱氨酸天冬氨酸蛋白酶3(Caspase-3)表達的影響。方法2014年11月—2015年7月選取新生24 h內SD大鼠12只,分離及培養大鼠皮質神經元,取原代培養8 d的皮質神經元,分為3組:正常對照組、氧-糖剝奪組、氨基胍組。正常對照組皮質神經元采用Neurobasal培養液+2%B27培養液添加劑培養,氧-糖剝奪組皮質神經元缺氧、缺糖處理45 min后,換Neurobasal培養液+2%B27培養液添加劑培養;氨基胍組皮質神經元缺氧、缺糖處理45 min后,換Neurobasal培養液+2%B27培養液添加劑培養的同時加入終濃度為10 mmol/L的氨基胍溶液。各組培養2、6、12 h,采用硝酸還原法檢測細胞上清液中NO表達水平,采用Western blotting法檢測Caspase-3表達水平。結果各組培養2、6、12 h時細胞上清液中NO、Caspase-3表達水平比較,差異均有統計學意義(P<0.05);其中氧-糖剝奪組、氨基胍組不同時間點細胞上清液中NO、Caspase-3表達水平較正常對照組升高(P<0.05);氨基胍組不同時間點細胞上清液中NO、Caspase-3表達水平較氧-糖剝奪組降低(P<0.05)。結論氨基胍可抑制氧-糖剝奪大鼠皮質神經元NO及神經元凋亡相關基因Caspase-3表達水平,從而抑制皮質神經元的凋亡,對皮質神經元具有保護作用。
【關鍵詞】神經元;一氧化氮;半胱氨酸天冬氨酸蛋白酶3;氨基胍
唐仕軍,趙冬,朱立倉,等.氨基胍對氧-糖剝奪大鼠皮質神經元一氧化氮及半胱氨酸天冬氨酸蛋白酶3表達的影響研究[J].中國全科醫學,2016,19(12):1429-1434.[www.chinagp.net]
Tang SJ,Zhao D,Zhu LC,et al.Effect of aminoguanidine on the expression of NO and Caspase-3 in rat cortical neurons after oygen glucose deprivation[J].Chinese General Practice,2016,19(12):1429-1434.
缺血性腦血管病是由于各種原因導致部分腦組織的血流減少或中斷,引起神經元功能障礙和結構損害的一組疾病。《中國腦卒中防治報告(2015)》[1]顯示,腦卒中已經成為我國人口死亡和致殘的第一原因,腦卒中具有高發病率、高病死率和高致殘率,給我國的社會經濟發展帶來了沉重負擔。如何預防和治療腦血管病,尋求一種合適的藥物減輕腦損傷,一直是全社會共同關注的問題。動物實驗顯示,缺血、缺氧可誘導腦組織產生一氧化氮(NO),過量的NO與腦損傷有關[2]。在體外培養皮質神經元中,氧-糖剝奪可導致皮質神經元產生過量NO,并造成神經元的損傷,缺氧、缺糖環境下所產生的NO在神經元凋亡中可能發揮著重要作用[3]。因此,本研究以體外原代培養皮質神經元為實驗對象,采用氨基胍對氧-糖剝奪大鼠皮質神經元進行干預,觀察培養液中NO表達水平與神經元凋亡相關基因半胱氨酸天冬氨酸蛋白酶3(Caspase-3)表達水平的時相變化,探討氨基胍在氧-糖剝奪大鼠皮質神經元凋亡中的作用。
1材料與方法
1.1動物2014年11月—2015年7月選取新生24 h內SD大鼠12只,其中雄性8只,雌性4只;體質量35~50 g;購于新疆醫科大學實驗動物中心。
1.2儀器二氧化碳(CO2)細胞恒溫培養箱(美國Thermo Forma),Thermo超凈工作臺(美國Thermo Electron Corporation),缺氧培養箱(浙江省新安江分析儀器二廠),倒置相差顯微鏡及照相系統(Olympus),半干式轉印系統(Bio-Rad公司),全能型凝膠成像分析系統(Bio-Rad公司)。
1.3主要試劑DMEM高糖培養液(HyClone公司),胎牛血清(杭州四季青集團公司),DMEM無糖培養液、Neurobasal培養液、2%B27培養液添加劑、0.25%胰酶、氨基胍、青霉素和鏈霉素(10 000 U/ml)、L-谷氨酰胺(GIBCO公司),神經元特異性烯醇化酶(NSE)多克隆抗體、Caspase-3抗體(Abcam 公司),L-多聚賴氨酸(PDL)、磷酸鹽緩沖液(PBS)〔生工生物工程(上海)股份有限公司〕,NO試劑盒(南京建成生物工程研究所)。接種培養基:DMEM高糖培養液+10%胎牛血清+雙抗(青霉素和鏈霉素,100 U/ml);無血清培養液:Neurobasal培養液+2%B27培養液添加劑+0.5 mmol/L L-谷氨酰胺+雙抗(青霉素和鏈霉素,100 U/ml);L-多聚賴氨酸溶液(PLL,1 mg/ml):25 mg PDL溶于250 ml PBS中,0.22 μm濾器濾菌,4 ℃冰箱保存備用。
1.4方法
1.4.1大鼠皮質神經元分離及培養在文獻[4]基礎上稍作改動,取出生24 h內的新生乳鼠12只,在盛有75%乙醇溶液的燒杯中清洗2次,1 min/次,在超凈臺下迅速斷頭取腦,置入預冷的玻璃皿中。在體視顯微鏡下小心剝離皮質表面的腦膜和血管,換用另一把眼科鑷小心夾取額部一薄層皮質組織,置于盛有1 ml DMEM高糖培養液的培養皿中,培養皿置于冰上。用眼科剪將皮質組織剪成約1 mm×1 mm碎塊,加入0.25%胰酶,使其終濃度為0.125%,充分混勻胰酶,在37 ℃CO2細胞恒溫培養箱中消化15 min,5 min時輕輕搖晃培養皿,15 min時加入等量接種培養基終止消化。用1 ml進口槍頭輕輕吹打細胞,將吹打后的細胞懸液用200目篩網過濾,4 ℃ 1 000 r/min離心5 min(離心半徑13.5 cm),棄上清液,加入2 ml接種培養基重懸細胞,以≥1×106/ml接種到提前經PLL包被的6孔板中,使每孔有2 ml接種培養基,沿前后、左右、左上左下、右上右下方向充分混勻細胞,置于37 ℃ CO2細胞恒溫培養箱中培養。4 h后用無血清培養液全量換液1次,以后每3 d半量換液。
1.4.2皮質神經元的鑒定培養8 d的皮質神經元,以抗NSE多克隆抗體作為一抗,采用免疫熒光雙重染色方法鑒定皮質神經元:(1)用0.01%預冷的PBS浸洗細胞爬片2次,吸盡PBS,4%多聚甲醛溶液固定5 min,PBS浸洗2次,5 min/次;(2)3%H2O2溶液封閉30 min以消除內源性過氧化物酶活性;(3)PBS浸洗3次,5 min/次;(4)山羊血清封閉30 min;(未浸洗)加入一抗(NSE,1∶500),4 ℃冰箱孵育隔夜(約12 h);(5)PBS浸洗3次,5 min/次,加入二抗;(6)避光孵育60 min后PBS浸洗3次,5 min/次;(7)滴加碘化丙啶(PI)染液(1∶1 000稀釋)100 μl,30 s后用PBS浸洗2次,2 min/次;(8)甘油(約30 ml)封固,激光共聚焦顯微鏡下觀察。
1.4.3實驗分組分為3組:正常對照組、氧-糖剝奪組、氨基胍組。正常對照組皮質神經元采用Neurobasal培養液+2%B27培養液添加劑培養;氧-糖剝奪組皮質神經元缺氧、缺糖處理45 min后,換Neurobasal培養液+2%B27培養液添加劑培養;氨基胍組皮質神經元缺氧、缺糖處理45 min后,換Neurobasal培養液+2%B27培養液添加劑培養的同時加入終濃度為10 mmol/L氨基胍溶液。
1.4.4氧-糖剝奪模型的建立參照文獻[5-6],培養8 d的皮質神經元,吸盡培養液,用PBS輕輕沖洗3次,換用DMEM無糖培養液造成缺糖環境,在細胞缺氧培養箱(37 ℃,充滿95%N2和5%CO2)中培養45 min,換Neurobasal培養液+2%B27培養液添加劑培養,在37 ℃ CO2細胞恒溫培養箱中培養。實驗重復6次。
1.4.5NO表達水平測定分別在培養2、6、12 h時留取各組細胞培養液上清液,置于-80 ℃凍存,采用硝酸還原酶法測定各組不同時間點細胞上清液中NO表達水平,按照試劑盒說明書操作進行。
1.4.6Western blotting法檢測Caspase-3表達水平提取蛋白,用BCA法進行蛋白定量,取50 μg總蛋白上樣行10%十二烷基磺酸鈉(SDS)-聚丙烯酰胺凝膠電泳(PAGE),然后電轉至聚偏二氟乙烯(PVDF)膜上,5%脫脂牛奶封閉1 h后加入一抗Caspase-3(1∶1 000),4 ℃孵育過夜,用TBS洗滌6次,5 min/次,加入辣根過氧化物酶標記的二抗(山羊抗兔IgG抗體1∶20 000)室溫孵育2 h。再用TBS洗滌6次,5 min/次,加入化學發光試劑(ECL)顯色。以β-actin為內參照。實驗重復6次,目的條帶為32 Ku。采用全能型凝膠成像分析系統Quantity One軟件對蛋白條帶灰度值進行分析。

2結果
2.1皮質神經元形態學觀察皮質神經元接種時形態小,透亮,呈圓形,單個散在分布(見圖1A,本文圖1、2彩圖見本刊官網www.chinagp.net電子期刊相應文章附件)。皮質神經元接種后有少量皮質神經元開始貼壁,2h左右皮質神經元貼壁較多,少量皮質神經元伸出短小的突起,4h左右皮質神經元已基本貼壁,大量皮質神經元伸出突起,周圍光暈明顯。3d時皮質神經元突起明顯伸長,相互交織,皮質神經元透亮,立體感強,呈圓形、橢圓形、梭形(見圖1B)。5~6d時皮質神經元細胞體增大,突起交織成網狀(見圖1C)。7~8d時,皮質神經元細胞體飽滿,細胞質透亮,細胞核大而明顯,細胞體周圍折光性強,立體感好,突起交織成致密的網狀結構(見圖1D)。
2.2免疫熒光雙重染色法鑒定皮質神經元培養8d的皮質神經元,經NSE和PI染液免疫熒光雙標染色呈強陽性,激光共聚焦顯微鏡下觀察,細胞質和軸突被染成綠色且細胞核被染成紅色的為皮質神經元,細胞核被染成紅色而細胞質無染色的為非皮質神經元。經鑒定此分離培養的是皮質神經元,且純度高、密度大,皮質神經元細胞核染色清晰,形態呈網狀結構,陽性率為(93.5±2.3)%(見圖2)。
2.3各組不同時間點細胞上清液中NO表達水平比較各組不同時間點細胞上清液中NO表達水平比較,差異均有統計學意義(P<0.05);其中氧-糖剝奪組、氨基胍組不同時間點細胞上清液中NO表達水平較正常對照組升高,差異均有統計學意義(P<0.05);氨基胍組不同時間點細胞上清液中NO表達水平較氧-糖剝奪組降低,差異均有統計學意義(P<0.05,見表1)。
2.4各組不同時間點Caspase-3表達水平比較各組不同時間點Caspase-3表達水平比較,差異均有統計學意義(P<0.05);其中氧-糖剝奪組、氨基胍組不同時間點Caspase-3表達水平較正常對照組升高,差異均有統計學意義(P<0.05);氨基胍組不同時間點,Caspase-3表達水平較氧-糖剝奪組降低,差異均有統計學意義(P<0.05,見表2、圖3)。
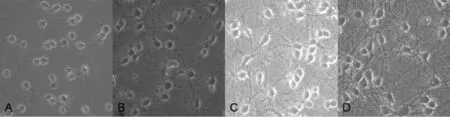
注:A為接種1 d,B為接種3 d,C為接種5~6 d,D為接種7~8 d
圖1倒置相差顯微鏡下不同時期皮質神經元形態觀察(×200)
Figure 1Morphological changes of rat cortical neurons at different time points under inverted phase contrast microscope
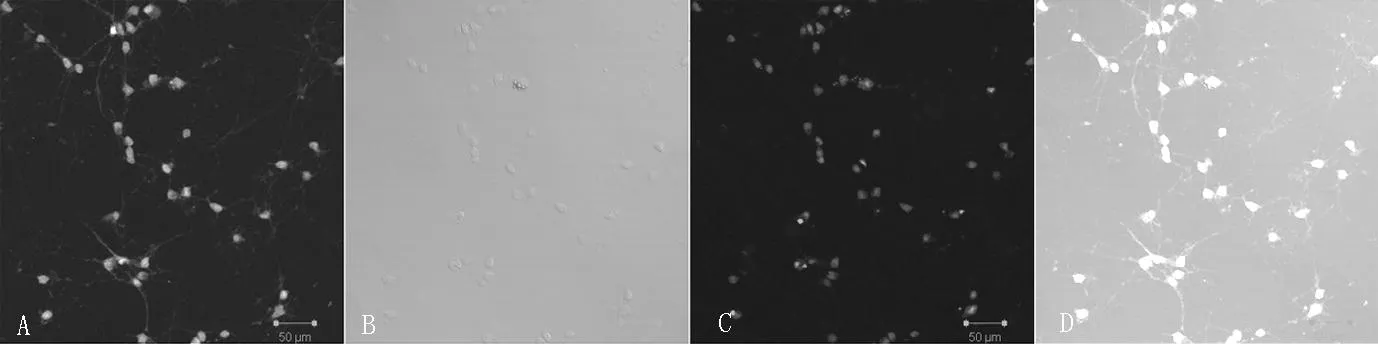
注:A為綠光下NSE對神經元染色;B為白光下神經元形態;C為PI染液對細胞核染色;D為混合光下神經元染色
圖2免疫熒光雙重染色法鑒定皮質神經元(×400)
Figure 2Identification of cortical neurons by immunofluorescence double staining method
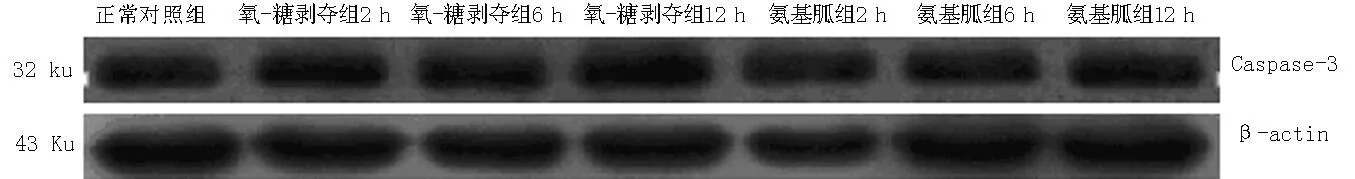
注:Caspase-3=半胱氨酸天冬氨酸蛋白酶3
圖3Western blotting法檢測Caspase-3表達水平
Figure 3Caspase-3 expression detected by Western blotting method
Table1ComparisonofNOexpressionincellsupernatantatdifferenttimepointsamongthethreegroups
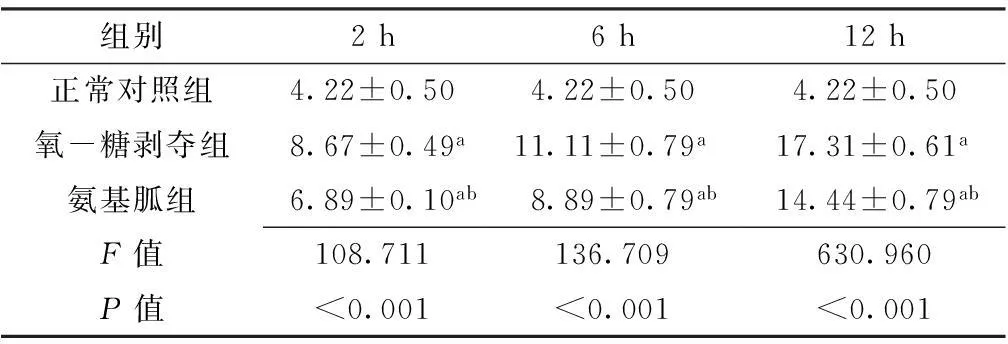
組別2h6h12h正常對照組4.22±0.504.22±0.504.22±0.50氧-糖剝奪組8.67±0.49a11.11±0.79a17.31±0.61a氨基胍組6.89±0.10ab8.89±0.79ab14.44±0.79abF值108.711136.709630.960P值<0.001<0.001<0.001
注:與正常對照組比較,aP<0.05;與氧-糖剝奪組比較,bP<0.05
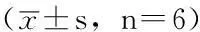
Table2ComparisonofCaspase-3expressionatdifferenttimepointsamongthethreegroups

組別2h6h12h正常對照組0.20±0.010.20±0.010.20±0.01氧-糖剝奪組0.46±0.04a0.53±0.04a0.70±0.01a氨基胍組0.39±0.01ab0.46±0.01ab0.55±0.02abF值117.185216.266588.428P值<0.001<0.001<0.001
注:與正常對照組比較,aP<0.05;與氧-糖剝奪組比較,bP<0.05
3討論
研究表明,NO在缺血性腦損傷中存在雙重作用,與組織損傷發展進程和產生的一氧化氮合酶(nitric oxide synthase,NOS)的類型有關,根據其來源不同,既表現為對神經的保護作用,又表現為對神經的毒性作用[7-8],生理劑量的NO可以降低血管張力、改善微循環、抑制血小板聚集和黏附、降低白細胞黏附和遷移等,大劑量的NO可與超氧陰離O2-結合形成具有極強細胞毒性的ONOO-[9]。NOS是體內合成NO的關鍵和唯一的限速酶,有3種類型:神經源型(nNOS)、內皮型(eNOS)、誘導型(iNOS)[10],在腦缺血早期因eNOS激活產生的NO可通過鳥氨酸環化酶使環磷酸鳥苷(cGMP)水平升高,擴張腦血管,從而增加缺血區腦血流量,對抗凋亡,保護腦組織,而由nNOS及iNOS激活產生的NO激活凋亡級聯反應通向細胞死亡的最后通路,誘導細胞凋亡[11]。iNOS被激活后催化合成大量的NO,高濃度的NO可以與超氧陰離子反應生成超氧亞硝酸陰離子,并進一步分解為OH和NO2等自由基,可對神經元產生神經毒性,最終引起細胞死亡[12]。在氧-糖剝奪20 min離體腦片模型中,iNOS的活性在缺血損傷后2 h開始出現。如僅剝奪10 min,iNOS的活性在缺血損傷后3 h開始出現,在210 min達到高峰[13]。因此,在腦缺血缺氧早期,iNOS活性的激活以及產生的過量NO對神經的毒性作用是缺血缺氧對腦組織損傷的重要因素。
細胞凋亡即程序化細胞死亡,是細胞的一種自殺方式,其信號轉導通路主要有3種:死亡受體通路、內質網通路、線粒體通路[14-15]。這3種信號轉導通路均不可逆,且均與Caspase有關,而在Caspase家族中,Caspase-3是所有凋亡級聯反應中最為關鍵的終末凋亡執行蛋白[16-17],因此通過測定Caspase-3的表達水平可間接反映細胞的凋亡。
氨基胍是一種iNOS特異性抑制劑,其對iNOS的抑制能力比NG-甲基-L-精氨酸(L-NAME)更有效[18],其抑制作用是L-NAME的7倍[19],氨基胍通過抑制iNOS 的活性,可減少NO 水平,降低NO 的毒性損傷作用[20]。實驗研究提示,氨基胍對缺氧、缺糖損傷體外培養人腦微血管內皮神經元具有保護作用[21],氨基胍可以改善糖尿病視網膜病變,且作用途徑與選擇性iNOS有關[22]。氨基胍抑制iNOS的機制可能是:(1)與催化部位的血紅素鐵結合,從而改變活性集團的構象。(2)Bryk等[23]研究發現,氨基胍通過在活性位點上與血紅素殘基共價結合,并將被修飾的亞鐵血紅素殘基以共價鍵形式結合于蛋白的活性位點,從而對iNOS起明顯的抑制作用。(3)氨基胍可產生大量的自殺性產物來抑制iNOS的產生。
目前,國內外對于氨基胍的神經元保護作用研究主要集中于動物體內實驗,而在體外細胞實驗中很少。因此,本文以體外原代培養的皮質神經元為實驗對象,在皮質神經元經氧-糖剝奪后給予氨基胍進行干預,觀察不同時間點NO表達水平及細胞凋亡因子Caspase-3表達水平的變化,從而探討氨基胍在皮質神經元損傷中的作用。
本研究結果顯示,在2、6、12 h氧-糖剝奪組皮質神經元NO表達水平均較正常對照組升高;氨基胍組皮質神經元各時間點NO表達水平均較氧-糖剝奪組降低。提示,缺氧、缺糖引起了皮質神經元的損傷,使NO過度表達,隨著時間的延長,NO表達水平逐漸增加,皮質神經元的損傷逐漸加重;氨基胍干預后,NO表達水平在各時間點均明顯降低,說明皮質神經元的損傷有所減輕。本研究證實,氨基胍可以減少皮質神經元損傷后NO的過度表達,從而減輕皮質神經元的損傷,對皮質神經元具有一定的保護作用,這與Cash等[24]的研究結果一致。本研究結果顯示,在2、6、12 h氧-糖剝奪組皮質神經元Caspase-3表達水平均較正常對照組升高,氨基胍干預后,各時間點皮質神經元Caspase-3表達水平較氧-糖剝奪組均降低。提示,缺氧、缺糖引起了神經元的凋亡,經氨基胍干預后,Caspase-3表達水平在各時間點均明顯降低,說明皮質神經元的凋亡有所減輕。本研究證實,氨基胍可抑制凋亡相關因子Caspase-3 的表達水平,從而抑制缺氧、缺糖后皮質神經元的凋亡,對皮質神經元具有一定的保護作用,與Sun等[25]研究結果一致。其機制可能是:皮質神經元缺氧、缺糖損傷后,iNOS被激活,產生了大量的NO,激活了Caspase家族級聯反應凋亡途徑,致Caspase-3表達水平升高,進而導致皮質神經元發生凋亡。給予氨基胍干預后,氨基胍能選擇性抑制iNOS的活性,從而減少NO過度表達,降低了NO對皮質神經元的毒性損傷作用,從而抑制了凋亡因子Caspase-3表達,進而減少了細胞凋亡,起到了保護皮質神經元的作用。
綜上所述,氨基胍可抑制氧-糖剝奪大鼠皮質神經元NO及凋亡相關基因Caspase-3的表達,從而抑制皮質神經元的凋亡,對皮質神經元具有保護作用。氨基胍可減輕氧-糖剝奪引起的皮質神經元凋亡,其機制可能是氨基胍通過選擇性抑制iNOS活性的表達,減少NO過度表達,從而抑制了凋亡相關基因Caspase-3的表達。本實驗仍處于基礎研究階段,仍需在今后對氨基胍最佳藥物濃度、潛在的藥物不良反應、其他藥物干預及其抑制細胞凋亡的具體機制等問題進行深入研究。
作者貢獻:唐仕軍進行實驗設計與實施、資料收集整理、撰寫論文、成文并對文章負責;趙冬、朱立倉、李曉天、朱文學、楊鵬進行實驗實施、評估、資料收集;王業忠進行質量控制及審校。
本文無利益沖突。
參考文獻
[1]王隴德.中國腦卒中防治報告(2015)[M].北京:中國協和醫科大學出版社,2015:5-15.
[2] Ayer RE,Zhang JH.Oxidative stress in subarachnoid haemorrhage:significance in acute brain injury and vasospasm[J].Acta Neurochir Suppl,2008,104:33-41.
[3] Wang XR,Yang CH,Zhao D,et al,Changes of NO and Caspase-3 in oxygen-glucose deprived cortical neurons[J].Acta Medicinae Universitatis Scientiae et Technologiae Huazhong,2014,43(5):550-553.(in Chinese)
王西冉,楊傳豪,趙冬,等.氧-糖剝奪致皮層神經元一氧化氮的變化及對Caspase-3的影響[J].華中科技大學學報:醫學版,2014,43(5):550-553.
[4]Yang CH,Zhao D,Liu Q,et al.Establishing a serum-free primary culture method for cortical neurons of new-born rats[J].Chongqing Medicine,2014,43(29):3901-3903,3906.(in Chinese)
楊傳豪,趙冬,劉琪,等.新生大鼠皮層神經元體外無血清原代培養[J].重慶醫學,2014,43(29):3901-3903,3906.
[5]Wang CP,Li GC,Shi YW,et al.Neuroprotective effect of schizandrin A on oxygen and glucose deprivation/reperfusion-induced cell injury in primary culture of rat cortical neurons[J].J Physiol Biochem,2014,70(3):735-747.
[6]Zhu QL,Li YX,Zhou R,et al.Neuroprotective effects of oxysophocarpine on neonatal rat primary cultured hippocampal neurons injured by oxygen-glucose deprivation and reperfusion[J].Pharm Biol,2014,52(8):1052-1059.
[7] Garry PS,Ezra M,Rowland MJ,et al.The role of the nitric oxide pathway in brain injury and its treatment-From bench to bedside[J].Exp Neurol,2015(263):235-243.
[8] Tian HL,Zhou LF,Cui YH,et al.NO upgrades expression of VEGF protein and mRNA in local ischemic brain tissues of rabbits [J].Journal of Apoplexy and Nervous Diseases,2006,23(5):588-590.(in Chinese)
田恒力,周良輔,崔宇輝,等.NO增加兔局灶腦缺血后缺血腦組織VEGF表達[J].中風與神經疾病雜志,2006,23(5):588-590.
[9]Hoffman A,Goldstein S,Samuni A,et al.Effect of nitric oxide and nitric oxide SOD-mimic on the recovery of isolated rat heart following ischemia and reperfusion [J].Biochem Pharmacol,2003,66(7):1279-1286.
[10]ArunaDevi R,Ramteke VD,Kumar S,et al.Neuroprotective effect of s-methylisothiourea in transient focal cerebral ischemia in rat [J].Nitric Oxide,2010,22(1):1-10.
[11]Park CO,Yi HG.Apoptotic change and NOS activity in the experimental animal diffuse axonal injury model[J].Yonsei Med J,2001,42(5):518-526.
[12] Jiang EP,Yu CR,Li H,et al.Protective effects of Schisandra Chinensis lignans on oxidative stress injury of PC12 cells and its mechanism of inhibition on NF-kB/iNOS/NO signaling pathway[J].Journal of Jilin University(Medicine Edition),2015,41(3):532-536.(in Chinese)
姜恩平,于春榮,李賀,等.北五味子總木脂素對PC12細胞氧化應激損傷的保護作用及其抑制NF-kB/ions/NO信號通路的機制[J].吉林大學學報:醫學版,2015,41(3):532-536.
[13]Ishikawa K,Calzavacca P,Bellomo R,et al.Effect of selective inhibition of ranal inducible nitric oxide synthase on renal blood flow and function in experimental hyperdynamic sepsis[J].Crit Care Med,2012,40(8):2368-2375.
[14]Pestana CR,Phelippin DP,Polizello AC,et al.Effects on mitochondria of mitochondria-induced nitric oxide release from a ruthenium nitrosyl complex[J].Nitric Oxide,2009,20(1):24-30.
[15]王亞芳,宋春雨.腦缺血再灌注損傷對神經元線粒體DNA影響的研究進展[J].疑難病雜志,2014,13(2):212-214.
[16] Ghavami S,Shojaei S,Yeganeh B,et al.Autophagy and apoptosis dysfunction in neurodegenerative disorders [J].Prog Neurobiol,2014,112(1):24-29.
[17]Kooijman E,Nijboer CH,van Velthoven CT,et al.The rodent endovascular puncture model of subarachnoid hemorrhage:mechanisms of brain damage and therapeutic strategies[J].J Neuroinflammation,2014,11(1):2.
[18]Zhang F,Tadecola C.Temporal characteristics of the protective effect of aminoguanidine on cerebral ischemic damage[J].Brain Res,1998,802(1/2):104-110.
[19]Tilton RG,Chang K,Hasan KS,et al.Prevention of diabetic vascular dysfunction by guanidines.Inhibition of nitric oxide synthase versus advanced glycation end product formation [J].Diabetes,1993,42(2):221-232.
[20]ArunaDevi R,Ramteke VD,Kumar S,et al.Neuroprotective effect of s-methylisothiourea in transient focalcerebral ischemia in rat[J].Nitric Oxide,2010,22(1):1-10.
[21]Li W,Hu Q,Ren X,et al.Aminoguanidine suppresses methylglyoxal-mediated oxygen-glucose deprivation injury in human brain microvascular endothelial cells [J].Zhejiang Da Xue Xue Bao Yi Xue Ban,2013,42(3):261-266.
[22] Luo DW,Zou HD,Liu K,et al.Treat of aminoguanidine in retina of diabetic of rats with selective inhibits induced nitric oxide synthase[J].Chongqing Medicine,2014,43(19):2440-2442.(in Chinese)
羅大衛,鄒海東,劉堃,等.氨基胍高選擇性抑制iNOS在糖尿病大鼠視網膜中的研究[J].重慶醫學,2014,43(19):2440-2442.
[23]Bryk R,Wolff DJ.Mechanism of inducible nitric oxide synthase inactiration by aminoguanidine and L-N6-(l-iminoethyl) lysine [J].Biochemistry,1998,37(14):4844-4852.
[24]Cash D,Beech JS,Rayne RC,et al.Neuroprotective effect of aminoguanidine on transient focal ischaemia in the rat brain [J].Brain Res,2001,905(1/2):91-103.
[25]Sun M,Zhao Y,Gu Y,et al.Neuroprotective actions of aminoguanidine involve reduced the activation of calpain and caspase-3 in a rat model of stroke[J].Neurochem Int,2010,56(4):634-641.
(本文編輯:陳素芳)
Effect of Aminoguanidine on the Expression of NO and Caspase-3 in Rat Cortical Neurons After Oygen Glucose Deprivation
TANGShi-jun,ZHAODong,ZHULi-cang,etal.DepartmentofNeurosurgery,theFirstAffiliatedHospitalofShiheziUniversity,Shihezi832000,China
【Abstract】ObjectiveTo investigate the effect of aminoguanidine on the expression of nitric oxide (NO) and Caspase-3 in rat cortical neurons after oxygen and glucose deprivation.MethodsFrom December 2014 to July 2015,12 SD rats born within 24 hours were selected.The cortical neurons of the rats were separated and cultured,and cortical neurons of primary culture for 8 days were obtained and were divided into three groups:normal control group,oxygen-glucose deprivation group and aminoguanidine group.The cortical neurons of normal control group were cultured by Neurobasal+2%B27 nutrient solution;the cortical neurons of oxygen-glucose deprivation group received 45 min management for hypoxia and lack of sugar,and converted to be cultured by Neurobasal+2%B27 nutrient solution;the cortical neurons of aminoguanidine group received 45 min management for hypoxia and lack of sugar,and converted to be cultured by Neurobasal+2%B27 nutrient solution plus 10 mmol/L aminoguanidine solution.After culture for 2,6 and 12 h,the NO expression in cell supernatant was detected using nitric oxide assay kit,and Caspase-3 expression was detected using Western blotting method.ResultsThe three groups were significantly different in the expression levels of NO in cell supernatant and Caspase-3 at 2,6 and 12 h(P<0.05).Oxygen-glucose deprivation group and aminoguanidine group were higher than normal control group in the expression levels of NO in cell supernatant and Caspase-3 at different time points(P<0.05).Aminoguanidine group was lower than oxygen-glucose deprivation group in the expression levels of NO in cell supernatant and Caspase-3 at different time points(P<0.05).ConclusionAminoguanidine can inhibit the expression of NO and apoptosis related gene Caspase-3 in the rat cortical neurons after oxygen and glucose deprivation,which inhibits the apoptosis of cortical neurons and has a protective effect on the neurons.
【Key words】Neurons;Nitric oxide;Caspase-3;Aminoguanidine
(收稿日期:2015-08-26;修回日期:2016-02-22)
【中圖分類號】R 743.33
【文獻標識碼】A
doi:10.3969/j.issn.1007-9572.2016.12.015
通信作者:王業忠,832000 新疆石河子市,石河子大學醫學院第一附屬醫院神經外科;E-mail:wangyz2008@126.com
基金項目:國家自然科學資金資助項目(81360185);新疆生產建設兵團博士基金資助項目(2011BB016)

