水稻半顯性矮稈基因Si-dd 1的表型分析和精細定位
崔永濤 吳立文 胡時開 任德勇 葛常偉 葉衛軍 董國軍 郭龍彪胡興明
(中國水稻研究所水稻生物學國家重點實驗室,杭州310006;*通訊聯系人,E-mail:guolongb@mail.hz.zj.cn;huxingmingx@126.com)
?
水稻半顯性矮稈基因Si-dd 1的表型分析和精細定位
崔永濤 吳立文 胡時開 任德勇 葛常偉 葉衛軍 董國軍 郭龍彪*胡興明*
(中國水稻研究所水稻生物學國家重點實驗室,杭州310006;*通訊聯系人,E-mail:guolongb@mail.hz.zj.cn;huxingmingx@126.com)
崔永濤,吳立文,胡時開,等.水稻半顯性矮稈基因Si-dd1的表型分析和精細定位.中國水稻科學,2016,30(2):152-160.
摘 要:以粳稻品種日本晴在組織培養過程中分離出來的一個半顯性矮稈突變體Si-dd1為研究對象,通過形態學分析,發現與野生型日本晴相比,矮稈Si-dd1(AA)和半矮稈Si-dd1(Aa)植株的株高降低。結實率下降,生育期延長,一次枝梗和二次枝梗增加。激素處理結果表明突變體Si-dd1(AA)與野生型對油菜素內酯反應基本相同,而在高濃度赤霉素處理下,突變體Si-dd1(AA)表現為一定程度上的鈍感。Western blot對GID2表達量分析也確定這一結果。組織切片實驗表明,突變體Si-dd1(AA)相對于野生型葉片主脈氣孔變小,葉肉細胞增多,莖維管束數目增加。遺傳分析結果表明該突變體基因受一對核基因控制。進一步利用分子標記將該基因定位在水稻第6染色體約244kb區間內,目前該區段并未發現已報道的矮稈相關基因。
關鍵詞:水稻;半顯性;矮稈;遺傳分析;圖位克隆
株高是作物的重要農藝性狀之一,與作物抗倒伏、產量等性狀密切相關。綠色革命是植株半矮化成功利用的典范。目前在水稻育種中廣泛利用的sd1[1]編碼一個缺陷的GA20氧化酶,該酶突變后植株內源赤霉素含量降低,導致了植株半矮化,通過抗倒伏提高了產量。迄今為止在水稻、小麥、玉米等農作物中發現了很多矮稈突變體,雖然大多數矮稈突變體無法直接應用到育種中,但是人們通過研究矮稈材料,對水稻矮稈的理化機制有了新的認識。
水稻矮稈突變體的類型非常豐富,迄今為止已經發現了很多矮稈基因,其中大多和激素如赤霉素、油菜素內酯、獨腳金內酯等相關。例如D1、SD1、SUI3、SUI1、DGL1、DBS1、D18、OsCPS1、GID2、GID 1、OsGA 20OX 1、SLR 1、D 35等屬于與赤霉素途徑相關的矮稈突變體[1-11];基因D1、D61、D-2、SDG725、BRD2、TUD1、BRD1、D11、OsBZR1等參與油菜素內酯的合成與信號傳遞[12-20];基因D3、D10、D-14、HTD1、D53、D-27、FC1等參與獨腳金內酯的合成與信號傳遞[21-27];而基因OsGH3-2、TDD1等屬于生長素途徑的突變體[28-29]。此外也發現了一些與激素不相關的矮稈基因,例如與細胞壁合成相關的矮稈基因D50、OsNST1、OsCD1,突變后都會導致植物矮化或半矮化[30-32]。這些現象說明了水稻的株高受到很多因素的影響,因此,通過研究水稻矮稈突變體有助于人們更好地了解植株的生長發育和形態建成。
本研究利用在日本晴組織培養過程中得到的一個穩定遺傳的半顯性矮稈突變體(semi-dominant dwarf1,Si-dd1),對該突變體的形態學特征、對激素的反應以及細胞形態進行了分析,同時對突變基因進行了遺傳分析和精細定位,從而為Si-DD1基因的進一步克隆與功能研究奠定了基礎。
1 材料與方法
1.1 實驗材料
本研究選用的突變體是粳稻品種日本晴在組織培養過程中分離出來的一個半顯性矮稈突變體Sidd1。收獲突變體種子,持續多代自交種植,確定該突變體能夠穩定遺傳,分別收獲矮稈突變體和半矮稈突變體。矮稈突變體是純合體,結實率低,產生的后代為完全顯性矮稈;半矮稈突變體是雜合體,結實率正常,后代可分離。所有材料均于正季種植于中國水稻研究所富陽實驗基地,種植與管理方法同大田生產。在半矮稈突變體產生的分離群體中隨機選取野生型(WT)、半矮稈(Si-dd1,Aa)和矮稈(Sidd1,AA)各15株,調查株高、結實率、分蘗數、一次枝梗數、二次枝梗數等農藝性狀。每次實驗重復3次,取平均值。
1.2 遺傳分析和基因定位群體的構建
在富陽正季用Si-dd1(AA)分別與秈稻品種9311、南京6號(NJ06)正反交,同年冬天在海南種植F1,收獲F2種子,次年在富陽種植F2群體。在F2群體中,分別調查顯性矮稈、半顯性矮稈和野生型植株的數目,同時用半顯性矮稈植株(Si-dd1,Aa)與9311、南京6號正反交,在F1中調查顯性矮稈、半顯性矮稈和野生型植株的數目。利用SAS軟件進行相關數據的分析,收取F2群體中高稈和顯性矮稈全部葉片,提取DNA用于分子標記分析。
1.3 赤霉素和油菜素內酯處理
收獲顯性矮稈Si-dd1(AA)和野生型植株的種子,用濕潤的毛巾包好放到37℃培養箱暗培養1~2 d。露白后,選取長勢一致的Si-dd1(AA)和野生型的種子均勻播種于沙土中(不添加激素),待水稻幼苗長至3葉期時,分別選取長勢一致的水稻用于水培實驗。水培營養液中加入不同濃度的GA3(最終濃度分別為0μmol/L、1×10-8μmol/L、1×10-7μmol/L、1×10-6μmol/L、1×10-5μmol/L、1×10-4μmol/L),以加入等量蒸餾水作對照,調pH值至5.0,每隔3d換一次培養液,并用同樣方法添加不同濃度的GA3,依次處理10d后,測量不同濃度處理后的水稻株高。另隨機挑選顯性矮稈Si-dd1 (AA)和野生型植株的種子,催芽后播種于沙土中,一周后用不同濃度的油菜素內酯(最終濃度分別為0μmol/L、1×10-7μmol/L、1×10-6μmol/L、1× 10-5μmol/L)點于第1葉葉夾角處,一周后觀察第1葉葉夾角變化情況。
1.4 GA處理后GID2的蛋白表達分析
為了進一步探究該突變體在GA信號傳導途徑中是否起到作用,我們選取了GA信號傳導途徑中的一個相關蛋白GID2作為研究對象,探究GA處理后GID2的表達量是否發生變化。對不同濃度GA3處理過后的WT和Si-dd1(AA)分別取樣,并提取蛋白,分別選取0mol/L、1×10-6mol/L、1× 10-4mol/L GA3處理后的WT和Si-dd1(AA)進行Western blot分析,方法見文獻[34]。
1.5 石蠟切片分析觀察
在分蘗盛期選取新鮮、生長正常且有代表性的矮稈Si-dd1(AA)和野生型植株的劍葉以及倒2節間,用鋒利的刀片用力均勻地切割材料,避免組織破裂,分別將水稻的葉和莖切割成3 mm左右大小。將切下來的材料立刻置于FAA固定液中(70%酒精∶冰醋酸∶36%甲醛的體積比為18∶1∶1)固定,此后石蠟切片具體操作方法見文獻[35]。
1.6 Si-DD1基因的精細定位
利用本實驗室保存的均勻分布于水稻12條染色體的SSR引物對突變體Si-dd1與9311、NJ06進行多態性篩選,分別挑選Si-dd1/9311、Si-dd1/NJ06的F2植株中的高稈和矮稈葉片,提取DNA對Si-DD1展開定位研究。首先用21個Si-dd1/NJ06中F2高稈單株進行連鎖分析,初步確定目標基因所在的染色體位置。進一步在連鎖標記附近開發標記,以2000個高稈和1200個矮稈材料進行精細定位。基因組DNA采取CTAB法提取[33]。PCR體系如下:模板DNA 1μL,正反向引物(10 μmol/L)0.5μL,dNTPs(10μmol/L)0.1μL,10× PCR緩沖液1μL,Taq酶0.2μL,加ddH2O補足10μL。PCR擴增程序如下:94℃下預變性2min;94℃下30s,56℃下30s(復性溫度根據引物Tm值作相應調整),72℃下30s,進行35次循環;72℃下延伸10min。PCR產物使用相應濃度的瓊脂糖凝膠電泳進行檢測。
2 結果與分析
2.1 突變體Si-dd1的表型分析
在大田條件下,本研究中的半矮稈和矮稈材料在3葉期前與野生型并無太大差別。此后,株高差距開始顯現,至抽穗后,差距達到最大。選取抽穗之后的野生型、Si-dd1(Aa)和Si-dd1(AA)植株進行表型觀察。相比野生型(WT),Si-dd1(Aa)和Sidd1(AA)基因型的植株株高都有所降低,其中Sidd1(Aa)材料株高相對于野生型下降20cm,而Sidd1(AA)材料株高明顯變矮,株高平均為40cm,約為野生型的一半(圖1-A、C、D,表1),Si-dd1(Aa)和Si-dd1(AA)都呈現包穗表型(圖1-A)。此外,突變體生育期延長,其中Si-dd1(Aa)生育期比野生型長5d左右,Si-dd1(AA)生育期比野生型長15 ~20d。3種表型植株分蘗數并無明顯差異,但是突變體穗頸節明顯縮短,穗粒明顯變密(圖1-B),并伴隨包穗的表型。野生型、Si-dd1(Aa)和Si-dd1 (AA)的一次枝梗數、二次枝梗數依次升高,結實率依次下降,Si-dd1(AA)下降尤為明顯(表1)。因此,該基因的突變除了影響株高外,對穗部產量性狀也產生了很大的影響。值得一提的是,Si-dd1(Aa)雖然結實率有所下降,但其總粒數有所增加,而且由于它為半矮稈,因此可能具有一定的育種價值。
2.2 突變體的遺傳分析
Si-dd1(Aa)F2群體植株的株高統計分析結果表明,其后代分離比WT∶Si-dd1(Aa)∶Si-dd1 (AA)呈現出1∶2∶1的分離比。用Si-dd1(AA)與9311、NJ06分別進行正反交后發現F1代都呈現出半矮稈表型(表2)。F2群體中植株株高仍呈現出1∶2∶1的分離比;此外,用Si-dd1(Aa)作為母本與9311、NJ06雜交,F1群體并無Si-dd1(AA)的出現,只出現高稈和半矮稈,且比例呈1∶1(表3)。因此,本研究中的突變性狀是由半顯性、單基因控制的質量性狀,且無胞質效應。

A-整株表型;B-穗表型;C-莖節間長;D-各節間對比。從左至右依次為野生型、中間型和突變型。A,Whole plant;B,Panicle;C,Internode;D,Comparison of every internode.From left to right,wild type,Si-dd1(Aa)and Si-dd1(AA)in turn.圖1 Si-dd1突變體成熟期表型Fig.1.Phenotypes of Si-dd1 at maturation stage.

表1 野生型,Si-dd1(Aa)和Si-dd1(AA)分蘗、株高及穗部性狀比較Table 1.Comparison of tiller,plant height and panicle traits among wild type,Si-dd1(Aa)and Si-dd1(AA).

表2 Si-dd1(AA)與NJ06、9311組合F2的遺傳分析Table 2.Genetice analysis of F2population of Si-dd1(AA)/NJ06(9311).

表3 雜合Si-dd1(Aa)與NJ06、9311組合F1遺傳分析Table 3.Genetice analysis of F1population of Si-dd1(Aa)/NJ06and Si-dd1(Aa)/9311.
2.3 目的基因的精細定位
我們對Si-dd1與9311、NJ06兩個秈稻品種雜交的4組F2群體表型進行了觀察記錄以及分析,最終選用這4個F2群體中表現穩定的高稈和矮稈用于后續的圖位克隆。我們所用的標記引物是本試驗室現有的均勻分布于水稻12條染色體上的SSR引物,共計216對。對矮稈、高稈、F1以及F2混池DNA進行連鎖篩選(由于F2代呈1∶2∶1比例分布,因此,我們選取F2中顯性矮稈和野生型高稈作為定位群體取樣)。在以Si-dd1(AA)/NJ06顯性矮稈表型的F2混池進行初定位時發現,在第6染色體的引物標記M1、M2以及M3處(表4),F1電泳呈現雙帶,而混池偏擴增于Si-dd1(AA)的帶型;以高稈表型的F2混池進行初定位時發現,在同樣的引物標記處,F1電泳條帶呈現雙帶,而混池偏擴增于野生型帶型。利用這3對引物對Si-dd1(AA)/9311中 F2突變體表型群體的93個高稈單株進行檢測,進一步確認了該突變基因位于第6染色體的引物標記M2和M3之間。
為進一步對突變體基因進行精細定位,我們擴大了F2群體的數量,并且繼續在F2代植株中選取高稈和矮稈作為定位群體。根據NCBI(http://www.ncbi.nlm.nih.gov/)、RGP(http://rice.plantbiology.msu.edu/index.shtml)和Gramene(http://www.gramene.org/)數據庫公布的9311序列和日本晴序列第6染色體上的序列開發出若干位于M2和M3之間的多態性標記(表5)。以初定位結果為基礎,篩選了以Si-dd1(AA)和9311為雙親的F2分離群體中高稈和矮稈個體用于基因的精細定位和物理作圖。最終將基因Si-DD1定位在標記P3和P4之間,物理距離約為244kb(圖2)。此區間內未發現已報道的矮稈相關基因。

表4 Si-DD1基因初定位的標記Table 4.Makers for primary mapping of Si-DD1.
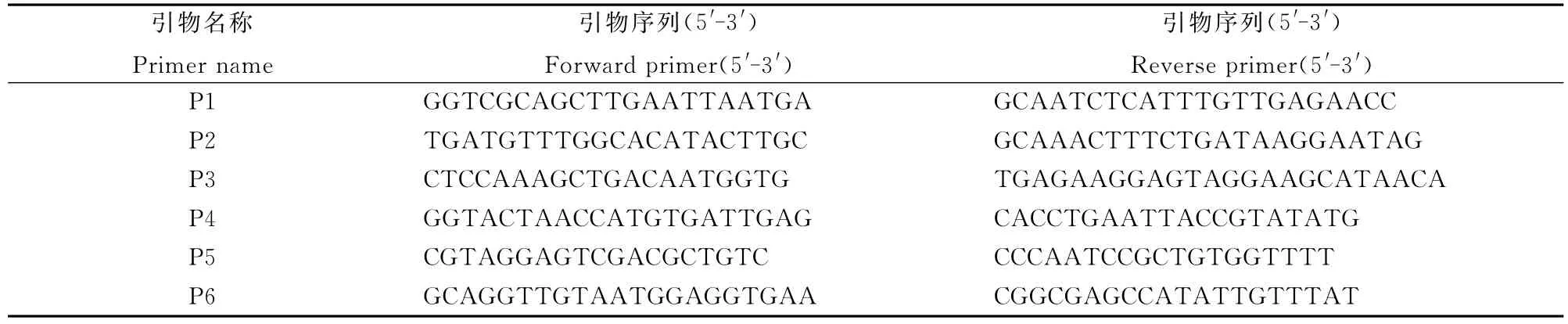
表5 Si-DD1基因精細定位的部分標記Table 5.Makers for fine mapping of Si-DD1.
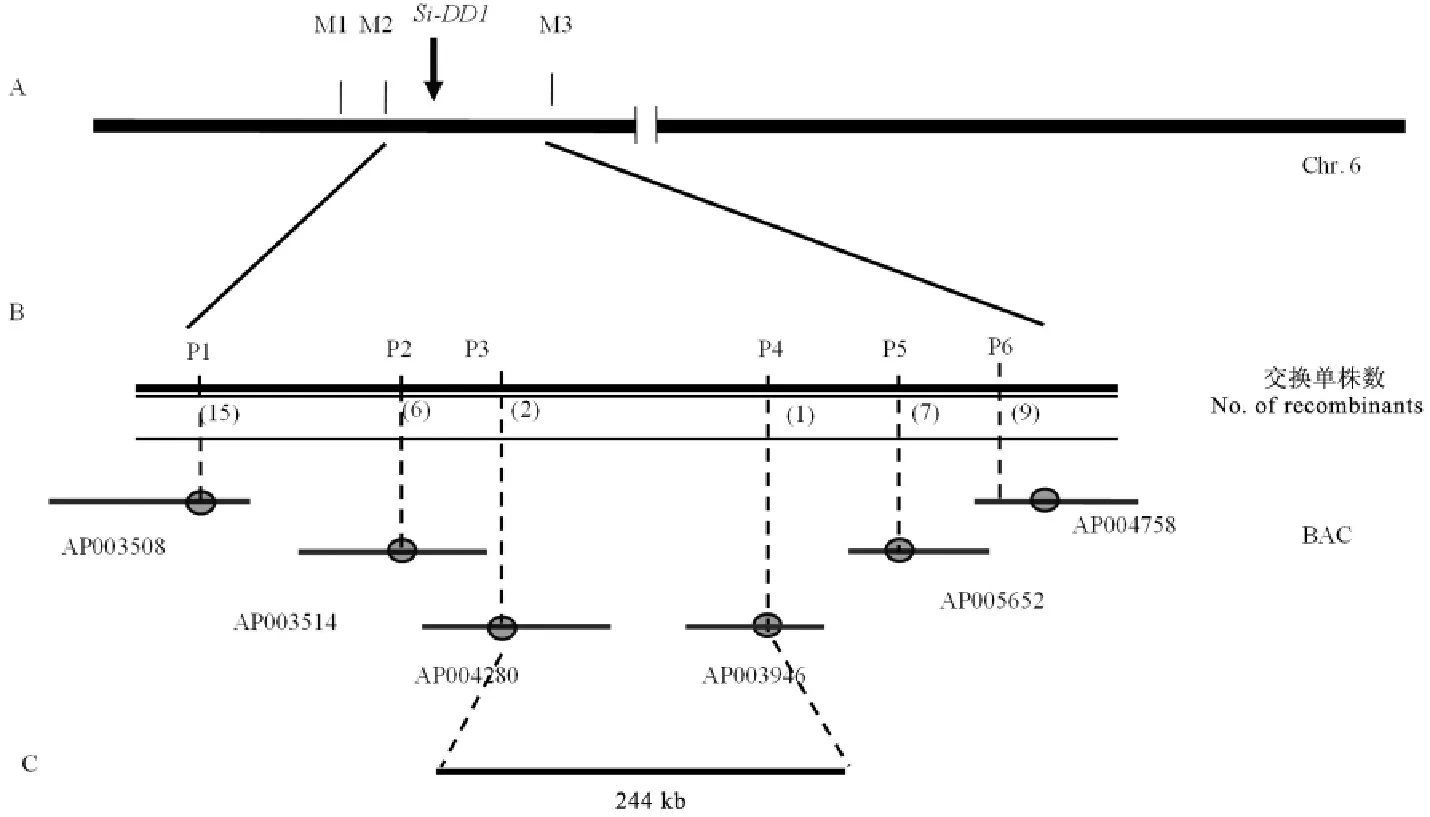
A-Si-DD1與標記M2和M3連鎖;B-利用4500個分離單株將Si-DD1定位到244kb區段內。A,Si-DD1 was linkaged with M2and M3;B,Si-DD1 was mapped to 244kb genome region based on 4500separated plants.圖2 Si-DD1的精細定位Fig.2.Fine mapping of Si-DD1.
2.4 激素處理結果
水稻植株變矮很多都是由于激素合成或信號傳導出現問題,為了驗證該突變體是否也是由于體內某類激素反應異常所致,我們選取了赤霉素和油菜素內酯兩種激素作為研究對象,來探究該突變體是否和這兩種激素相關。激素處理結果表明不同濃度GA3處理WT和Si-dd1(AA)后,WT和Si-dd1 (AA)的株高都呈現逐日增高的趨勢,而當GA3濃度增加到1×10-4mol/L后,WT和Si-dd1(AA)則出現一定程度的生長抑制,說明突變體與野生型在一定濃度的外源赤霉素處理條件下,兩者對赤霉素的反應是基本相同的。值得指出的是,當GA3濃度增加到1×10-4mol/L后,突變體受抑制程度相比野生型小(圖3-A、B),暗示在高濃度下,突變體對赤霉素表現為鈍感。用BR處理后發現不同濃度BR處理WT和Si-dd1(AA),無論是WT還是Sidd1(AA)除了葉夾角都隨BR濃度增加而增加,而且增幅一致,說明了該基因對BR反應與野生型類似。此外,我們在對該突變體形態分析時發現,該突變體突變類型與已經發現的BR類型突變體大不相同,節間突變屬于sh類型,而不是dm這種典型的BR類突變體,因此,我們基本排除該突變體是BR類突變體(圖1-D,圖3-C)。
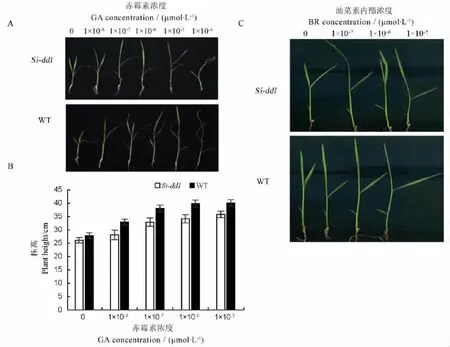
A-不同濃度赤霉素(GA)處理后表型;B-不同濃度GA處理后株高;C-不同濃度油菜素內酯(BR)處理后葉夾角。WT,Wild type;GA,Gibberellic acid;BR,Brassinolide.A,Plant phenotype after GA treatment at different concentrations;B,Plant height after GA treatment at different concentrations;C,Leaf angle after BR treatment at different concentrations.圖3 Si-dd1突變體的GA,BR激素處理結果Fig.3.Si-dd1 exposed to GA and BR.
2.5 GID2蛋白表達量分析
為了進一步探究該突變體在GA信號傳導途徑中是否起作用,我們選取了GA信號傳導途徑中的一個相關蛋白GID2作為研究對象,探究GA處理后GID2的表達量是否發生變化。對不同濃度GA3處理過后的野生型(WT)和Si-dd1(AA)分別取樣,并提取蛋白,分別選取0 mol/L、1×10-4mol/L、1×10-6mol/L GA處理后的WT和Si-dd 1(AA)進行Western blot分析,結果表明,WT和Si-dd1 (AA)中GID2蛋白表達量在0mol/L和1×10-6mol/L GA處理下并無太大差異,而隨著GA濃度升高,GID2蛋白在野生型中的表達量比突變體中少,說明相對于野生型該突變體在高濃度條件下對GA3反應鈍感(圖4)。

圖4 GID2蛋白表達量分析Fig.4.Expression analysis of GID2.
2.6 組織切片的觀察結果
為了探究突變體矮化的生理特征,我們分別選取了野生型、Si-dd1(Aa)和Si-dd1(AA)植株的劍葉和倒2節間作為研究對象進行細胞學觀察。對劍葉的觀察發現,突變體Si-dd1(Aa)和Si-dd1(AA)主葉脈氣腔和薄壁細胞等部位與野生型相比有差異。其中Si-dd1(Aa)和Si-dd1(AA)中脈氣腔相比野生型變小;但是兩氣腔之間的薄壁細胞明顯變大,最終導致總面積增加,而其兩側的薄壁細胞并未出現明顯變化(圖5-A~C)。莖縱切分析表明Sidd1(Aa)和WT的細胞都呈規則形狀(矩形),而Si-dd1(AA)的細胞呈不規則排列,在單位面積下,WT、Si-dd1(Aa)、Si-dd1(AA)的細胞數目依次增多,細胞大小依次變小,但是變化并不明顯。根據WT、Si-dd1(Aa)、Si-dd1(AA)倒2節間長度(圖1-D)推測,雖然突變體單位面積細胞數目增多,而整個倒2節間細胞數目卻明顯變少,因此,我們推測是細胞數目減少導致突變體的莖稈變矮(圖5-D~F)。莖的橫切面結構一般由薄壁細胞和維管束組成,維管束均勻分布于薄壁細胞之間。對倒2節間的觀察表明,在Si-dd1(Aa)和Si-dd1(AA)的外層薄壁細胞層數明顯比WT多;且維管束數目相比WT也有所增加(圖5-G~I)。
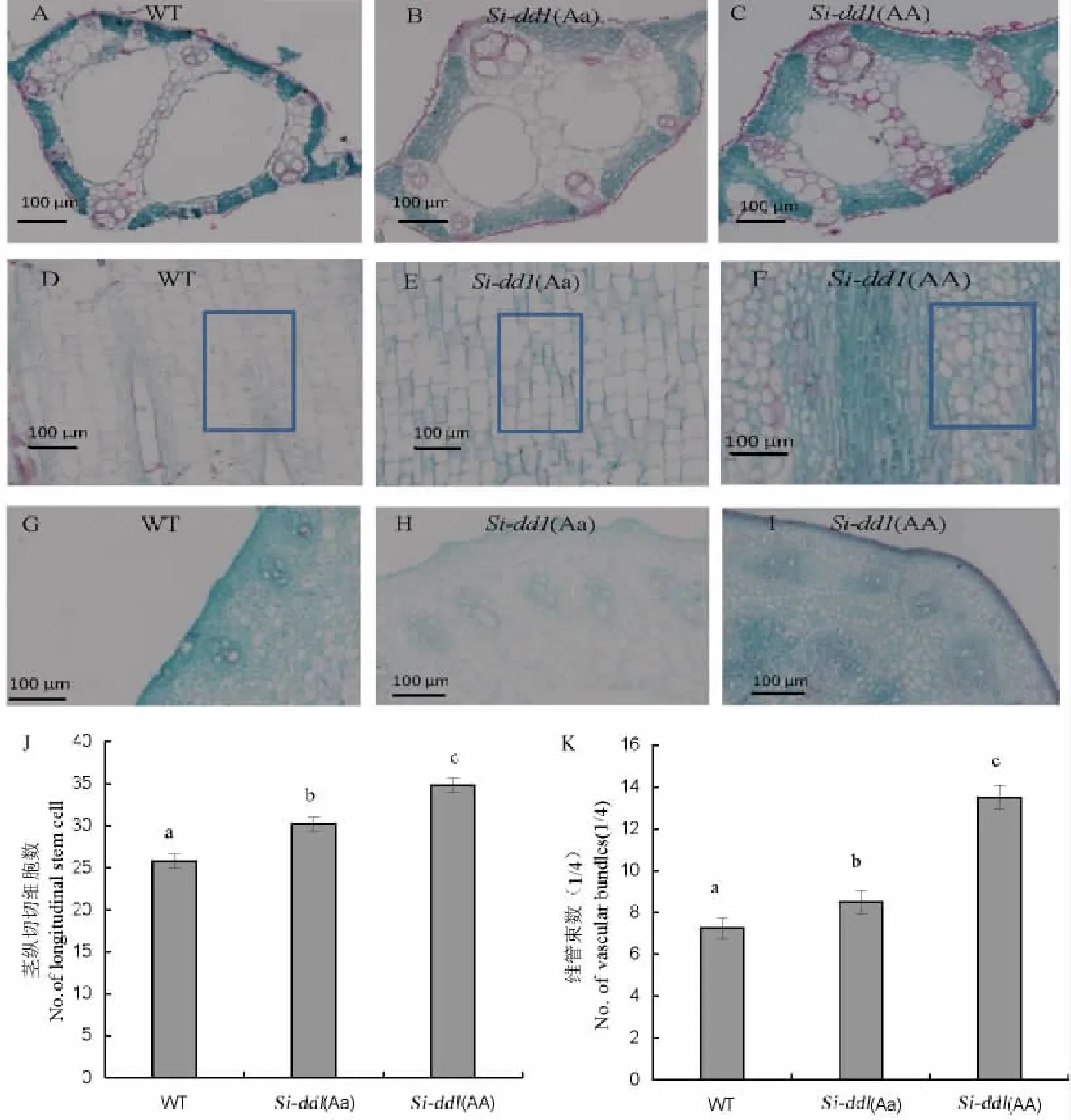
A,B,C-野生型(WT),Si-dd1(Aa)和Si-dd1(AA)葉主脈橫切;D,E,F-野生型,Si-dd1(Aa)和Si-dd1(AA)倒2節間縱切;G,H,I-野生型,Si-dd1(Aa)和Si-dd1(AA)倒2節間橫切;J,K-維管束(1/4)和莖縱切細胞數統計。A,B,C,Cross sections of leaf main vein of WT,Si-dd1(Aa)and Si-dd1(AA);D,E,F,Longitudinal section of the second internode from the top of WT,Si-dd1(Aa)and Si-dd1(AA);G,H,I,Cross sections of the second internode from the top of WT,Si-dd1(Aa)and Si-dd1(AA).J,K,Numbers of vascular bundles and longitudinal stem cells.圖5 野生型,Si-dd1(Aa)和Si-dd1(AA)莖和葉的顯微結構比較Fig.5.Comparison of microscopic structure among WT,Si-dd1(Aa)and Si-dd1(AA).
3 討論
迄今為止,發現的矮稈突變體大部分和激素直接相關,例如赤霉素、油菜素內酯、獨腳金內酯等,但也有與激素不直接相關的矮稈突變體,如細胞壁合成相關突變體D50、OsNST1、OsCD1[30-32]。外源施用激素處理敏感的突變體一般屬于激素合成突變體,不敏感的屬于激素信號突變體。本研究中,激素處理和蛋白分析結果表明,半顯性矮稈突變體可能不屬于赤霉素或油菜素內酯相關途徑突變體,這為矮稈資源又提供了一份寶貴的材料。我們對半顯性矮稈突變體進行遺傳分析和分子標記定位,把該矮稈基因定位在第6染色體短臂上的分子標記P3和P4之間,物理距離約為244kb,該區段尚未有矮稈基因的報道。
本研究中,突變體和野生型對比,兩者地上節間數相同,除倒1節間縮短比例較小外,其余節間縮短的比例都很大,屬于典型的sh突變類型。根據石蠟切片觀察結果來看,相對于野生型,突變體倒2節細胞數目變少,說明了突變體變矮可能是由細胞數目變少導致,在突變體生長過程中細胞分裂速度受到了一定程度的抑制。
株高是作物重要的農藝性狀之一,與作物的產量、抗倒伏、光合效率等密切相關。因此,株高一直受到育種家的重視,水稻第一次綠色革命就是水稻矮化運用的典范,水稻半矮化協調了較高的水肥條件與易倒伏之間的矛盾,從而提高了收獲指數。然而,目前鑒定的大部分矮稈基因除了植株矮化外,都會伴隨一些不良性狀,很難在生產上廣泛應用。如小粒矮稈基因d1[11]、矮稈包穗基因eui2等[36-37]。本研究中雖然顯性突變體伴隨著很多不良性狀,如生育期延長,著粒密度變密,結實率嚴重下降等,但其半矮稈突變體除株高降低外,其莖稈比野生型粗壯,且結實率下降不明顯,可以提高種植密度從而解決結實率問題。因此可以考慮將該半顯性矮稈材料轉化為不育系,或許可以擴大恢復系選擇范圍,提高配組效率,獲得更多優良雜交組合。當然在育種實踐中,該基因是否能夠為生產提供效益還需要進一步研究。
參考文獻:
[1] Spielmeyer W,Ellis M H,Chandler P M.Semidwarf(sd-1),“green revolution”rice,contains a defective gibberellin 20-oxidase gene.Proc Natl Acad Sci USA,2002,99:9043-9048.
[2] Yin H F,Gao P,Liu C W,et al.SUI-family genes encode phosphatidylserine synthases and regulate stem development in rice.Planta,2013,237:15-27.
[3] Komorisono M,Ueguchi-Tanaka M,Aichi I,et al.Analysis of the rice mutant dwarf and gladius leaf 1,aberrant katanin-mediated microtubule organization causes up-regulation of gibberellin biosynthetic genes independently of gibberellin signaling.Plant Physiol,2005,138:1982-1993.
[4] Iwamoto M,Kiyota S,Hanada A,et al.The multiple contributions of phytochromes to the control of internode elongation in rice.Plant Physiol,2011,157:1187-1195.
[5] Toyomasu T,Kagahara T,Hirose Y,et al.Cloning and characterization of cDNAs encoding ent-copalyl diphosphate synthases in wheat:Insight into the evolution of rice phytoalexin biosynthetic genes.Biosc Biotech Biochem,2009,73:772-775.
[6] Hirano K,Asano K,Tsuji H,et al.Characterization of the molecular mechanism underlying gibberellin perception complex formation in rice.Plant Cell,2010,22:2680-2696.
[7] Ueguchi-Tanaka M,Nakajima M,Katoh E,et al.Molecular interactions of a soluble gibberellin receptor,GID1,with a rice DELLA protein,SLR1,and gibberellin.Plant Cell,2007,19:2140-2155.
[8] Oikawa T,Koshioka M,Kojima K,et al.A role of Os-GA20ox1,encoding an isoform of gibberellin 20-oxidase,for regulation of plant stature in rice.Plant Mol Biol,2004,55:687-700.
[9] Hirano K,Kouketu E,Katoh H,et al.The suppressive function of the rice DELLA protein SLR1is dependent on its transcriptional activation activity.Plant J,2012,71:443-453.
[10]Yang M F,Qi W W,Sun F,et al.Overexpression of rice LRK1 restricts internode elongation by down-regulating Os-KO2.Biotech Lett,2013,35:121-128.
[11]Ueguchi-Tanaka M,Fujisawa Y,Kobayashi M,et al.Rice dwarf mutant d1,which is defective in theαsubunit of the heterotrimeric G protein,affects gibberellin signal transduction.Proc Natl Acad Sci USA,2000,97:11638-11643.
[12]Wang L,Xu Y,Ma Q,et al.Heterotrimeric G proteinαsubunit is involved in rice brassinosteroid response.Cell Res,2006,16:916-922.
[13]Hu X,Qian Q,Xu T,et al.The U-box E3ubiquitin ligase TUD1functions with a heterotrimeric Gαsubunit to regulate brassinosteroid-mediated growth in rice.PLoS Gene,2013,9:e1003391.
[14]Sakamoto T,Morinaka Y,Inukai Y,et al.Auxin signal transcription factor regulates expression of the brassinosteroid receptor gene in rice.Plant J,2013,73:676-688.
[15]Hong Z,Ueguchi-Tanaka M,Umemura K,et al.A rice brassinosteroid-deficient mutant,ebisu dwarf(d2),is caused by a loss of function of a new member of cytochrome P450.Plant Cell,2003,15:2900-2910.
[16]Zhi H,Miyako U,Shozo F,et al.The rice brassinosteroid-deficient dwarf2 Mutant,defective in the rice homolog of Arabidopsis DIMINUTO/DWARF1,is rescued by the endogenously accumulated alternative bioactive brassinosteroid,dolichosterone.Plant Cell,2005,17(8):2243-2254.
[17]Thirumurugan T,Ito Y,Kubo T,et al.Identification,characterization and interaction of HAP family genes in rice.Mol Genet Genom,2008,279:279-289.
[18]Hong Z,Ueguchi-Tanaka M,Shimizu-Sato S,et al.Loss-offunction of a rice brassinosteroid biosynthetic enzyme,C-6oxidase,prevents the organized arrangement and polar elongation of cells in the leaves and stem.Plant J,2002,32:495-508.
[19]Tanabe S,Ashikari M,Fujioka S,et al.A novel cytochrome P450is implicated in brassinosteroid biosynthesis via the characterization of a rice dwarf mutant,dwarf11,with reduced seed length.Plant Cell,2005,17:776-790.
[20]Bai M Y,Zhang L Y,Gampala S S,et al.Functions of Os-BZR1and 14-3-3proteins in brassinosteroid signaling in rice.Proc Natl Acad Sci USA,2007,104:13839-13844.
[21]Sang D J,Chen D Q,Liu G F,et al.Strigolactones regulate rice tiller angle by attenuating shoot gravitropism through inhibiting auxin biosynthesis.Proc Natl Acad Sci USA,2014,111:11199-11204.
[22]Ito S,Kitahata N,Umehara M,et al.A new lead chemical for strigolactone biosynthesis inhibitors.Plant Cell Physiol,2010,51:1143-1150.
[23]Arite T,Umehara M,Ishikawa S,et al.d14,a strigolactoneinsensitive mutant of rice,shows an accelerated outgrowth of tillers.Plant Cell Physiol,2009,50:1416-1424.
[24]Zou J H,Zhang S Y,Zhang W P,et al.The rice HIGHTILLERING DWARF1encoding an ortholog of Arabidopsis MAX3is required for negative regulation of the outgrowth of axillary buds.Plant J,2006,48:687-696.
[25]Jiang L,Liu X,Xiong G S,et al.DWARF 53 acts as a repressor of strigolactone signalling in rice.Nature,2014,506:401-405.
[26]Liu W,Kohlen W,Lillo A,et al.Strigolactone biosynthesis in medicago truncatula and rice requires the symbiotic GRAS-type transcription factors NSP1 and NSP2.Plant Cell,2011,23:3853-3865.
[27]Guo S Y,Xu Y Y,Liu H H,et al.The interaction between OsMADS57 and OsTB1 modulates rice tillering via DWARF14.Nat Comm,2013,4(3):1566.
[28]Du H,Wu N,Fu J,et al.A GH3family member,OsGH3-2,modulates auxin and abscisic acid levels and differentially affects drought and cold tolerance in rice.J Exp Bot,2012,63:6467-6480.
[29]Sazuka T,Kamiya N,Nishimura T,et al.A rice tryptophan deficient dwarf mutant,tdd1,contains a reduced level of indole acetic acid and develops abnormal flowers and organless embryos.Plant J,2009,60:227-241.
[30]Sato-Izawa K,Nakaba S,Tamura K,et al.DWARF50 (D50),a rice(Oryza sativa L.)gene encoding inositol polyphosphate 5-phosphatase,is required for proper development of intercalary meristem.Plant Cell Environ,2012,35:2031-2044.
[31]Zhang B C,Liu X L,Qian Q,et al.Golgi nucleotide sugar transporter modulates cell wall biosynthesis and plant growth in rice.Proc Natl Acad Sci USA,2011,108:5110-5115.
[32]Luan W J,Liu Y Q,Zhang F X,et al.OsCD1encodes a putative member of the cellulose synthase-like D sub-family and is essential for rice plant architecture and growth.Plant Biotech J,2011,9:513-524.
[33]Rogers S O,Bendich A J.Extraction of DNA from milligram amountsof fresh,herbarium and mummified plant tissues.Plant Mol Biol,1985,5:69-76.
[34]Huang L M,Sun Q W,Qin F J,et al.Down-regulation of a SILENT INFORMATION REGULATOR2-related histone deacetylase gene,OsSRT1,induces DNA fragmentation and cell death in rice.Plant Physiol,2007,144:1508-1519.
[35]Zhang Q,Xu J,Li Y,et al.Morphological,anatomical and genetic analysis for a rice mutant with abnormal hull.J Genet Genom,2007,34:519-526.
[36]Yang D L,Li Q,Deng Y W,et al.Altered disease development in the eui mutants and Eui overexpressors indicates that gibberellins negatively regulate rice basal disease resistane.Mol Plant,2008,1:528-537.
Phenotypical Analysis and Fine Mapping of a Semi-dominant Dwarfism Gene Si-dd 1in Rice
CUI Yong-tao,WULi-wen,HUShi-kai,RENDe-yong,GEChang-wei,YE Wei-jun,DONGGuo-jun,GUOLong-biao*,HUXing-ming*
(State Key Laboratory of Rice Biology,China National Rice Research Institute,Hangzhou 310006,China;*Corresponding authors,E-mail:guolongb@mail.hz.zj.cn;huxingmingx@126.com)
CUI Yongtao,WU Liwen,HU Shikai,et al.Phenotypical analysis and fine mapping of a semi-dominant dwarfism gene Si-dd1 in rice.Chin J Rice Sci,2016,30(2):152-160.
Abstract:A semi-dominant dwarf rice mutant(termed as Si-dd1)was obtained from japonica rice variety Nipponbare by tissue culture mutagenesis.Morphological analysis showed that Si-dd1(AA)and Si-dd1(Aa)exhibited shorter plant height,decreased seed-setting rate,delayed heading,increased number of primary rachis branch and secondary rachis branch compared to the wild type(WT,Nipponbare).Physiological test results showed Si-dd1 had similar response to 24-Epibrassinosteroid to the WT,while it was insensitive to Gibberellin at 10(-4)μmol/L.Moreover,Western blot results also confirmed GID2expression level in Si-dd1 differed greatly from WT.The cytological analysis showed that Si-dd1 had smaller stomas in the leaf midrib,increased mesophyll cells and stem vascular bundles compared to WT.Genetic analysis and map-based clone showed that the Si-dd1 is controlled by a single semi-dominant gene,and locates in a 244kb region on chromosome 6.
Key words:rice;semi-dominant;dwarf;genetic analysis;map-based clone
中圖分類號:Q755;S511.01
文獻標識碼:A
文章編號:1001-7216(2016)02-0152-09
基金項目:深圳市科技計劃資助項目(JCYJ20140504111101999);國家自然科學基金資助項目(31271700,31461143014)。
收稿日期:2015-07-13;修改稿收到日期:2015-10-18。

