人參莖愈傷組織的誘導和分化研究
邸雪峰, 吳松權, 樸 錦, 呂龍石
(延邊大學農學院,吉林 延吉 133002)
?
人參莖愈傷組織的誘導和分化研究
邸雪峰,吳松權,樸錦,呂龍石*
(延邊大學農學院,吉林 延吉 133002)
摘要:以4年生人參莖為外植體,探討了最適的消毒方法;以MS培養基為基本培養基,用均勻設計的方法探討了2,4-D和6-BA不同濃度組合對人參愈傷組織誘導率的影響;用2,4-D和6-BA不同濃度組合探討了對人參莖愈傷組織分化成再生苗的影響。結果表明:人參莖部最好的消毒方法為自來水沖洗2 h,無菌操作臺內70%酒精溶液浸泡30 s,再用0.1%升汞溶液浸泡 4 min;最適合人參莖外植體誘導愈傷組織的培養基為MS+2.57 mg/L 2,4-D+0 mg/L 6-BA,誘導率可達64.75%;人參莖愈傷組織分化成試管苗的最好培養基為MS+2.00 mg/L 2,4-D+0.05 mg/L 6-BA,分化率達22.22%。
關鍵詞:人參;莖;消毒;愈傷組織;分化
人參(PanaxginsengC. A. Mey.)作為百草之王,又名神草、血參、人微[1]。人參系被子植物門雙子葉植物綱離瓣花亞綱五加科,多年生草本植物,生長于深林,分布在東北三省和河北省北部深山中[2-3]。人參含有多種人參皂苷、氨基酸、多糖及人參酶,具有大補元氣,補脾益肺,養陰清熱,安神經,定魂魄等其他很多療效[4-5]。
然而人參自然生長發育時期過于緩慢,對新品種培育和大規模生產造成了很大困難[6]。人們希望通過組織培養的途徑使人參生產脫離限制性的自然環境條件,縮短生長時間,同時達到快速繁殖新品種的目的[7]。人參組織培養,自本世紀60年代初開展以來,已經有越來越多的研究者投身于這一研究領域[8]。早在1964年羅士韋就開始了人參愈傷組織的研究,并取得初步結果[9]。朱蔚華等1975年開始人參組織培養的系統研究[10],杜令閣等(1987)誘導出人參花粉單倍體植株并建立了體細胞無性系[11],雷秀娟(2013)誘導出人參花藥愈傷組織并建立植株再生體系[12]。人參組織培養雖起步較早,但進展緩慢。人參愈傷組織誘導率較低,分化更加困難,尚未見從人參莖愈傷組織分化出人參再生苗的研究報道。
本文以人參莖為外植體,探討了人參莖外植體的最好消毒方法;采用均勻設計探討了不同生長調節劑(2,4-D和6-BA)濃度處理組合對人參莖愈傷組織誘導率的影響;以不同生長調節劑(2,4-D和6-BA)濃度處理組合探討了人參莖愈傷組織的分化率,為人參組培快繁體系的建立打下基礎。
1材料與方法
1.1材料
采用無病4年生人參莖,由延邊大陽參業有限公司提供。
1.2方法
1.2.1人參莖外植體的消毒方法
取無病人參單株的莖,分成數段,先用自來水沖洗2 h,清除表面泥土,然后用濾紙吸干水分,放入干凈的燒杯中移至無菌操作臺。將人參莖外植體先用70%酒精溶液浸泡30 s,期間不停搖晃,無菌水沖洗2~3次,再用2%次氯酸鈉溶液或0.1%升汞溶液浸泡后,無菌水沖洗3~4次。切去兩端并分成1 cm左右的小段接種于MS+2,4-D 2.0 mg/L+BA 0.05 mg/L+蔗糖30 g/L+瓊脂10 mg/L,pH值為5.8的培養基中。消毒液類型與處理時間如表1。每處理20個培養皿(ф=90 mm),每個培養皿接種1個人參莖外植體,培養室溫度(25±2) ℃,暗室培養。從接種第2天開始統計污染、褐變和存活情況,1個月之后觀察人參愈傷組織的生長情況,并計算出各個處理的污染率、褐變率和存活率。
1.2.22,4-D和6-BA不同濃度配比對人參莖愈傷組織誘導率的影響
以MS培養基為基本培養基,添加蔗糖30 g/L,瓊脂粉10 g/L,pH值5.8,溫度為(25±2) ℃,暗室培養。將經過最適消毒方法處理的人參莖外植體接種到附加不同濃度2,4-D和6-BA培養基中,2,4-D為1.0~3.5 mg/L,6-BA為0.05~0.30 mg/L,接種方法與數量同消毒處理。采用U12*(122)均勻設計表,進行平滑后的實施方案見表2。所得試驗數據用SPSS 19.0統計軟件進行統計分析。
1.2.32,4-D和6-BA不同濃度配比對人參莖愈傷組織分化率的影響
以MS培養基為基本培養基,添加蔗糖30 g/L,瓊脂粉10 g/L,pH值5.8,添加不同濃度的2,4-D和6-BA構成10種不同組合的分化培養基,其代碼為DF1~DF10(表3)。將長勢較好的人參莖愈傷組織轉接至分化培養基上,每處理10個培養皿,每個培養皿接種9個人參愈傷組織,培養室溫度為(25±2) ℃,暗室培養,45 d繼代培養1次,觀察愈傷組織分化情況。參照雷秀娟的方法,將分化出的人參小苗底部切斷轉接至壯苗培養基MS+TDZ 3 mg/L+IBA 0.2 mg/L+GA 3 mg/L繼代培養[12]。
2結果與分析
2.1不同消毒方法對人參莖外植體的消毒效果
分別用2%NaClO2溶液和0.1% HgCl2溶液以不同消毒時間處理人參莖外植體,所得褐變率、污染率及存活率的調查結果見表1。
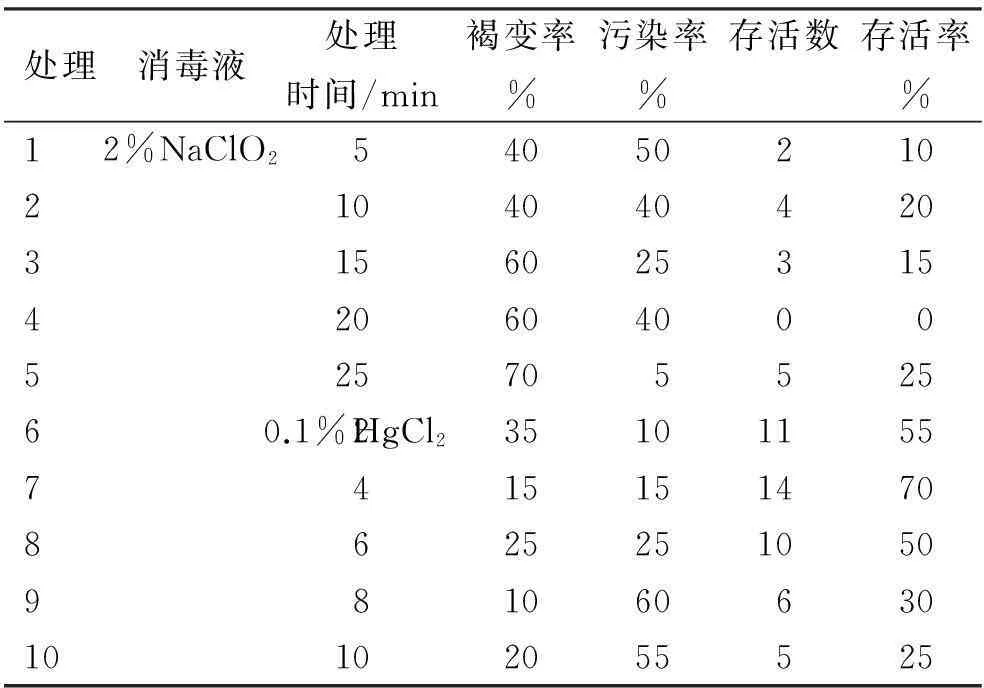
表1 人參莖外植體的消毒處理效果
由表1可知,0.1% HgCl2溶液消毒效果好于2%NaClO2溶液。人參莖外植體消毒效果最好的處理是7號處理(0.1% HgCl24 min),存活率達70%,其次為6號處理(0.1% HgCl22 min)和8號處理(0.1%HgCl26 min),存活率均超過50%。
2.22,4-D和6-BA不同濃度配比對人參莖愈傷組織誘導率的影響
在MS培養基中添加不同濃度2,4-D和6-BA對人參莖外植體愈傷組織誘導率影響的調查結果見表2。


表2 人參莖愈傷組織誘導率
2.32,4-D和6-BA不同濃度配比對人參莖愈傷組織分化率的影響
人參莖愈傷組織轉接至分化培養基,經過3或4次繼代培養后,愈傷組織上部逐漸衰老(圖1-A);在部分衰老愈傷組織上長出不定根,并分化出白色芽點(圖1-B);將其轉移至光下培養,芽點不斷膨大變綠,并分化出叢生芽,此時底部愈傷組織逐漸衰老死亡(圖1-C);從叢生芽上分化出較多人參再生苗(圖1-D);將其單個切取轉接到壯苗培養基,經2次繼代培養,在個別人參再生苗上出現花蕾(圖1-E)并有開花現象(圖1-F)。
在不同濃度2,4-D和6-BA的分化培養基上人參莖外植體愈傷組織分化成再生苗的調查結果如表3所示。
由表3可知,在10種分化培養基中,DF5、DF6和DF7培養基上成功分化出人參再生苗,DF6培養基的分化率最高,達到22.22%。

圖1 人參莖愈傷組織及其分化過程
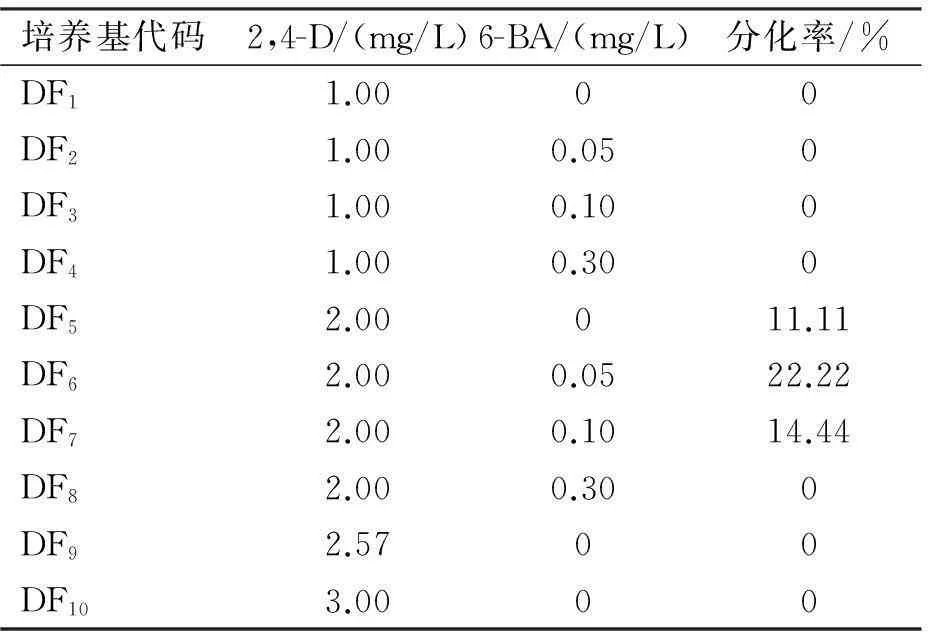
表3 人參愈傷組織分化率
3討論與結論
消毒方法的研究結果表明:人參莖外植體最好的消毒方法為自來水沖洗2 h,無菌操作臺內70%酒精溶液浸泡30 s,無菌水沖洗2~3次,再用0.1%升汞溶液浸泡4 min,無菌水沖洗3~4次。人參主根地下生長,環境復雜,不僅表皮帶菌,各種菌物常常侵染至其內部形成內生菌。組織培養消毒劑多為表面消毒劑,若消毒時間過短,往往消毒不徹底;若消毒時間過長,常常殺死組培外植體。人參莖在地面生長,帶菌較少,用表面消毒劑可較好的消除健康植株莖表面的菌物。

人參莖愈傷組織分化率的研究結果表明:在DF5、DF6和DF73種培養基上分化出人參再生苗,在DF6處理組合(2,4-D 2 mg/L,6-BA 0.05 mg/L)的分化率最高,達22.22%。人參愈傷組織分化困難一直是阻礙人參組織培養的難關,本文初步摸索出人參莖愈傷組織再分化的2,4-D和6-BA的不同濃度組合,但尚未能分化出人參再生苗的根部,對此還有待于進一步研究。
參考文獻:
[1]彭亮亮,劉強,董宇,等.人參的組織培養中通過對Whit、MS、FOX培養基分別加入10%椰乳然后接種誘導發生的情況變化研究[J].人參研究,2012(4):43.
[2]樸春驛,趙麗琴,李春英.人參不同部位無機元素含量測定[J].黑龍江八一農墾大學學報,1998,10(1):68-69.
[][]
[3]安永輝,郭昶,孫振雷,等.人參的組織培養及快繁體系的建立[J].安徽農業科學,2008,36(27):11656-11657.
[4]左北梅,高文遠,董艷艷,等. 藥用植物人參的組織培養研究進展[J].中國現代中藥,2012, 14(1):34.
[5]李鵬飛,劉春瑩,郭俊瑩,等.不同種類人參莖葉中皂苷成分的比較[J].安徽農業科學,2010,38(24):13077-13079.
[6]劉賢旺.人參組織培養研究的進展[J].江西中醫學院學報,1993,5(2):51-54.
[7]史芳芳,汪泉,王小平.人參莖段組織培養研究[J].現代農業科技,2012(14):56.
[8]陸文梁,夏小娣.人參組織與細胞培養研究的進展[J].植物學通報,1991,8(1):14-21.
[9]羅士韋,黃文徽,曹國儀,等.人參組織培養[J].植物生理學通訊,1964(2):26.
[10]朱蔚華,張蔭麟,李新蘭,等.人參愈傷組織培養的初步研究[J].藥學學報,1979,14(9):541-547.
[11]杜令閣,侯艷華,常維春,等.人參花粉植株的誘導及體細胞無性系的建立[J].中國科學(B輯),1987(1):35-41.
[12]雷秀娟.人參花藥、雜種胚培養及基于皂苷含量的特性評價[D].長春:中國農業科學院特產研究所,2013.
Study on Panax ginseng stem callus induction and the differentiation
(.*)
(AgriculturalCollegeofYanbianUniversity,YanjiJilin133002,China)
Abstract:Using four years’ old ginseng stems as explants, the optimum disinfection method was studied, and MS medium as basic medium, the effects of 2,4-D and 6-BA concentration on ginseng callus rate with uniform design and the effect of ginseng callus induction into plantlets with different concentrations of 2,4-D in combination with 6-BA were examined. The results showed that the best disinfection method of ginseng stems was that tap water kept washing 2 h, a sterile solution of 70% alcohol soaked console 30s, and then 0.1% mercuric chloride solution soaked 4min. The most suitable ginseng stem explants callus induction medium was MS + 2,4-D 2.57mg/L + 6-BA 0 mg/L, the inducing rate was 64.75%. The best ginseng callus differentiation into tube seedlings medium was MS + 2,4-D 2.00mg/ L + 6-BA 0.05 mg/L, the differentiation rate was 22.22%.
Key words:Panax ginseng;stem;disinfection;callus;differentiation
中圖分類號:S567.53
文獻標識碼:A
文章編號:1004-7999(2016)01-0031-04
DOI:10.13478/j.cnki.jasyu.2016.01.006
作者簡介:邸雪峰(1990—),女,吉林洮南人,在讀碩士,研究方向為中藥材栽培與育種。 呂龍石為通信作者,
收稿日期:2016-01-15基金項目:吉林省教育廳重點項目(吉教科合字[2009]第1號;吉教科合字[2010]第1號)
E-mai:nxlls@ybu.edu.cn

