蕹菜葉過氧化物酶功能基團的化學修飾
王紅揚, 孫才云, 黃 忙, 唐云明(西南大學生命科學學院,重慶400715)
?
蕹菜葉過氧化物酶功能基團的化學修飾
王紅揚,孫才云,黃忙,唐云明*
(西南大學生命科學學院,重慶400715)
摘要:為研究蕹菜葉面的的功能基團,將分離純化得到的電泳純的蕹菜過氧化物酶,分別用乙酰丙酮、順丁烯二酸酐,二巰基蘇糖醇、氯胺-T、溴代乙酸、對氯汞苯甲酸、苯甲基磺酰氟、N-乙酰咪唑選擇性地對其進行化學修飾,并測定修飾前后酶活力變化。結果表明:精氨酸殘基、賴氨酸殘基、組氨酸殘基和巰基可能是蕹菜過氧化物酶發揮活性的必需基團,而甲硫氨酸硫醚基、絲氨酸殘基和酪氨酸酚羥基可能不是蕹菜過氧化物酶活性中心的必需基團。
關鍵詞:蕹菜;過氧化物酶;功能基團;化學修飾
過氧化物酶(Peroxidase,POD)是一類在生物體內普遍存在的以血紅素為輔基可催化由過氧化氫(H2O2)參與的氧化還原反應的氧化酶,例如參與胺類[1]和酚類[2]化合物的氧化反應。POD作為一種抗氧化劑,參與分解吲哚乙酸[3]、合成木質素[4]和植物體內防御反應[5]等多種生理反應。當今,該酶不僅廣泛用于免疫印跡[6]、酶聯反應[7]和電鏡技術[8]等生物學研究,而且在污水處理[9]、生物傳感器[10]等領域發揮重要作用。
蛋白質化學結構和空間結構共同決定其生物活性,在大多數情況下,蛋白質化學結構的改變將導致生物活性的下降,甚至完全喪失[11]。蛋白質的化學修飾中側鏈基團的修飾是最成熟、最廣泛使用的技術,包括巰基修飾、氨基修飾、羧基修飾和其它側鏈修飾。因此,作者采用特定的化學修飾劑,分別為乙酰丙酮、二硫蘇糖醇、氯汞苯甲酸、順丁烯二酸酐、氯胺-T、苯甲基磺酰氯、N-乙酰咪唑和溴乙酸,破壞或者掩蔽側鏈基團,通過測定該蛋白酶的酶活力是否受到抑制,判斷該側鏈基團與該酶發揮活性的必需基團的關系。由于該酶的主要來源辣根生長條件苛刻,在我國種植范圍有限,價格昂貴,因此選取蕹菜這種種植范圍廣、產量高的植物作為提取原料分離純化過氧化物酶,并且對其功能基團進行化學修飾,為深入了解其理化性質及進一步大規模工業生產提供理論基礎。
1 材料與方法
1.1實驗材料
作者所在實驗室分離純化得到的蕹菜葉過氧化物酶純品,其中該酶的比活力為35 972.96 U/mg。
1.2主要試劑與設備
對氯汞苯甲酸:Sigma公司產品;苯甲基磺酰氟:Merck公司產品;溴代乙酸、二巰基蘇糖醇、乙酰丙酮、順丁烯二酸酐、氯胺-T、N-乙酰瞇唑以及其余試劑:國產分析純。UV-2550分光光度計:島津;Mill-Q plus超純水儀:Millipore;SevenEasy精密pH計:Mettler-Toledo。
1.3實驗方法
分別配置濃度為10 mmol/L的NAI、BD、pCMB、PMSF、BrAc、DTT、順丁烯二酸酐、氯胺-T溶液,作為母液。參考陳貽竹[12]等的方法,反應體系為3 mL,包括2.775 mL、50 mol/L磷酸鹽緩沖液(pH 7.0)、0.1 mL、1% H2O2、0.1 mL 4%愈創木酚和0.025 mL酶液。將各種母液按一定比例分別加入到測酶活力緩沖體系中,得到不同濃度的化學修飾劑溶液,最后加入蕹菜POD,25℃下作用30 min后,測定過氧化物酶的活性。
酶活測定過程如下:在加入底物和緩沖液后,再加入0.025 mL酶液并混勻,在25℃下測定2 min 內OD470的變化值。以測定條件下每分鐘光吸收值變化0.01所需要的酶量作為一個酶活力單位(U)。以相同條件下不加化學修飾劑時測得的酶活力作為100%對照。
2 結果與分析
2.1精氨酸胍基的化學修飾
在堿性條件下,蛋白質分子中的精氨酸殘基與乙酰丙酮(BD)能夠特異性地作用,影響側鏈基團的結構,進而改變整個蛋白質分子的性質。在pH 8條件下,用乙酰丙酮(BD)處理蕹菜POD,結果表明:隨著乙酰丙酮(BD)濃度的增大,酶活力逐漸下降,當濃度達到5 mmol/L時,活力只剩50%左右,見圖1。由此說明精氨酸殘基可能是蕹菜葉POD活性中心的必需基團。

圖1 BD濃度對蕹菜葉POD酶活力的影響Fig. 1 Effect of BD on activity of POD from Ipomoea aquatica Forsk leaves
2.2賴氨酸殘基的化學修飾
順丁烯二酸酐與蛋白質氨基酸殘基側鏈上的氨基相互作用,可以與氨基共價結合或者發生脫氨基作用,從而將氨基屏蔽起來[13]。結果表明:隨著濃度的增大,酶活逐漸降低。說明賴氨酸殘基有可能是該酶活性中心的必需基團,見圖2。
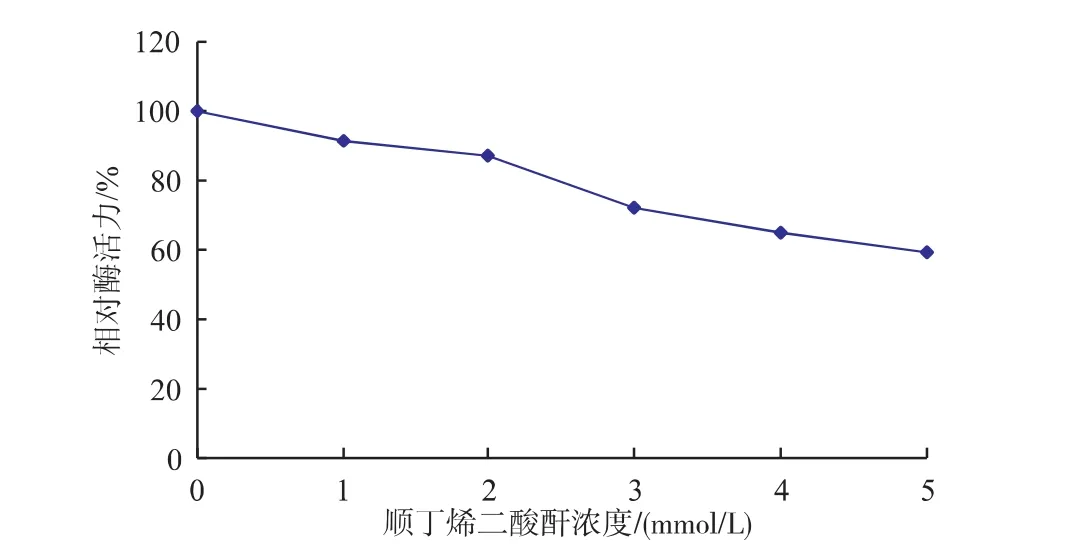
圖2 順丁烯二酸酐濃度對蕹菜葉POD酶活力的影響Fig. 2 Effect of maleic anhydride on activity of POD from Ipomoea aquatica Forsk leaves
2.3組氨酸殘基的化學修飾
溴乙酸(BrAc)在偏酸性的條件下與組氨酸中的咪唑基相互作用,生成羧甲基衍生物[14]。在pH 6條件下,用溴乙酸(BrAc)處理蕹菜。實驗結果顯示:隨著BrAc濃度的增加,酶活力急劇降低,當BrAc濃度為0.3 mmol/L時,酶活接近于0。由此說明組氨酸殘基可能是該酶活性中心的必需基團,見圖3。

圖3 BrAc濃度對蕹菜葉POD酶活力的影響Fig. 3 Effect of BrAc on activity of POD from Ipomoea aquatica Forsk leaves
2.4巰基的化學修飾氯汞苯甲酸(pCMB)做為巰基的常用修飾劑[15],在酸性條件下,與蛋白質分子中的巰基反應。在pH 5條件下,用氯汞苯甲酸(pCMB)處理蕹菜POD。隨著氯汞苯甲酸(pCMB)濃度的增大,酶活急劇降低,在pCMB濃度為0.5 mmol/L時,酶活幾乎為零。說明巰基很有可能是該酶活性中心的必需基團,見圖4。

圖4 pCMB濃度對蕹菜葉POD酶活力的影響Fig. 4 Effect of pCMB on activity of POD from Ipomoea aquatica Forsk leaves
2.5甲硫氨酸硫醚基的化學修飾
氯胺-T能在堿性條件下與甲硫氨酸的硫醚基相互作用。當pH 8時,用氯胺-T處理蕹菜POD,結果表明:氯胺-T對酶活無影響,說明甲硫氨酸硫醚基可能不是該酶活性中心的必需基團,見圖5。

圖5 氯胺-T濃度對蕹菜葉POD酶活力的影響Fig. 5 Effect of Chloramine-T on activity of POD from Ipomoea aquatica Forsk leaves
2.6絲氨酸殘基的化學修飾
苯甲基磺酰氟(PMSF)可以與蛋白質中的絲氨酸殘基相互作用[16]。實驗結果表明:PMSF對蕹菜葉POD酶活幾乎無影響,說明絲氨酸殘基可能不是該酶活性中心的必需基團,見圖6。

圖6 PMSF濃度對蕹菜葉POD酶活力的影響Fig. 6 Effect of PMSF on activity of POD from Ipomoea aquatica Forsk leaves
2.7酪氨酸酚羥基的化學修飾
N-乙酰咪唑(NAI)能對蛋白質中酪氨酸殘基的酚羥基進行修飾,從而改變蛋白質的空間構象和特性[17]。實驗結果表明:N-乙酰咪唑(NAI)對蕹菜葉POD活性幾乎無影響,見圖7。由此說明酪氨酸的酚羥基可能不是該酶活性中心的必需基團。
2.8二硫鍵的化學修飾
巰基化合物二硫蘇糖醇(DTT)是一種強的還原劑,能特異性的與蛋白質中二硫鍵作用,阻止半胱氨酸之間形成分子內或分子間二硫鍵,并穩定了蛋白質內部的巰基。當DTT濃度升高時,酶活力逐漸升高,進一步說明巰基很有可能是蕹菜POD活性中心的必需結構,見圖8。

圖7 NAI濃度對蕹菜葉POD酶活力的影響Fig. 7 Effect of NAI on activity of POD from Ipomoea aquatica Forsk leaves

圖8 DTT濃度對蕹菜葉POD酶活力的影響Fig. 8 Effect of DDT on activity of POD from Ipomoea aquatica Forsk leaves
3 結語
蛋白質化學結構和空間結構共同決定其生物活性,如果其化學結構不變,而空間結構遭到破壞從而導致蛋白質生物學功能的喪失,稱為蛋白質變性或去折疊;反之,如果蛋白質化學結構發生改變才稱為蛋白質的化學修飾。在有些情況下,蛋白質化學結構改變并不影響本身的活性,這些修飾是非必需部分的修飾。但是在大多數情況下,蛋白質化學結構的改變將導致生物活性的下降,甚至完全喪失[11]。因此,為了分析蛋白質中處于活性部位并為蛋白質發揮特定功能所必需的氨基酸,人們研制出各種小分子化學修飾劑。常見的修飾劑包括乙酰咪唑、鹵代乙酸、N-乙基馬來酰亞胺、焦碳酸二乙酯、四硝基甲烷、聚乙烯吡咯烷酮、乙二酸/丙二酸的共聚物、羧甲基纖維素、乙烯/順丁烯二酰肼共聚物、聚氨基酸、葡聚糖、環糊精、PEG等[18-19]。
作者利用專一性化學修飾劑乙酰丙酮(BD)、二巰基蘇糖醇(DTT)、氯胺-T、溴代乙酸(BrAc)、對氯汞苯甲酸(PCMB)、苯甲基磺酰氟(PMSF)、N-乙酰咪唑(NAI)分別對精氨酸殘基、二硫鍵、甲硫氨酸硫醚基、組氨酸殘基、巰基、賴氨酸殘基、絲氨酸、酪氨酸酚羥基進行了修飾。結果表明:精氨酸殘基、賴氨酸殘基、組氨酸殘基和巰基是蕹菜過氧化物酶發揮活性的必需基團,而甲硫氨酸硫醚基、絲氨酸殘基和酪氨酸酚羥基可能不是蕹菜葉過氧化物酶活性中心的必需基團。
參考文獻:
[ 1 ] Liu W,Kumar J,Tripathy S,et al. Enzymatically synthesized conducting polyaniline[J]. J Am Chem Soc,1999,121(1):71-78.
[ 2 ] Nakamoto S,Machida N. Phenol removal from aqueous solutions by peroxidase 2 catalyzed reaction using additives [J]. Wat Res,1992,26(1):49-54.
[ 3 ] Zheng X,Van Huystee R B. Oxidation of tyrosine by peroxidase isozymes derived from peanut suspension culture medium and by isolated cell walls[J]. Plant Cell,Tissue and Organ Culture,1991,25:35-44.
[ 4 ] Christensen J H,Bauw G,et al. Purification and characterization of peroxidases correlated with lignification in poplar xylem[J]. Plant Physiology,1998,118:125-135.
[ 5 ] Passardi F,Penel C,Dunand C. Performing the paradoxical:how plant peroxidases modify the cell wall [J]. Trends in Plant Science,2004,9:534-540.
[ 6 ]丁薪源,曹建康.果蔬過氧化物酶酶學特性研究進展[J].食品科技,2012,37(10):62-66. DING Xinyuan,CAO Jiankang. Characteristics of peroxidase from fruit and vegetable research progress [J]. Food Science,2012,37(10):62-66.(in Chinese)
[ 7 ]李宗妍,曹立民,林洪,等.水產品中恩諾沙星殘留的一步法酶聯免疫檢測研究[J].食品科學,2009,30(10):231-235. LI Zongyan,CAO Limin,LIN Hong,et al. Development of one-step enzyme-linked immunoassay for determining enrofloxacinresidues in sea foods[J]. Food Science,2009,30(10):231-235.(in Chinese)
[ 8 ]鐘薇,秦培勇,劉長霞,等.辣根過氧化物酶修飾電極的電化學研究[J].北京化工大學學報:自然科學版,2009,36(2):18-22. ZHONG Wei,QIN Peiyong,LIU Changxia,et al. Electrochemistry of horseradish peroxidase immobilized on a modified electrode [J]. Journal of Beijing University of Chemical Technology:Natural Science Edition,2009,36(2):18-22.(in Chinese)
[ 9 ] LA ROTTA C E,BON E P. 4-Chlorophenol degradation by chloroperoxidase from Caldariomyces fumago:formation of insoluble products[J]. Applied Biochemistry and Biotechnology,2002,98(3):191-204.
[10]馮東,李雪梅,王丙蓮,等.用辣根過氧化物酶生物傳感器測定啤酒中的過氧化氫[J].釀酒科技,2011,12:37-39. FENG Dong,LI Xuemei,WANG Binglian,et al. Determination of hydrogen peroxide in beer by immobilized horseradish peroxidase biosensor[J]. Liquor-making Science&Technology,2011,12:37-39.(in Chinese)
[11]嚴銳,黃金營.蛋白質化學修飾的研究進展[J].化學工業與工程,2005,22(1):53-55,76. YAN Rui,HUANG Jinying. Progress in chemical modification of protein [J]. Chemical Industry and Engineering,2005,22 (1):53-55,76.(in Chinese)
[12] CHEN Y Z,WANG Y R. A study on peroxidase in latches pericarp [A]. In:Acta Botanical Austro Sinica Vol.5 [C]. Beijing:Science Press,1989:47-52.(in Chinese)
[13]郭勇.酶工程[M].北京:科學出版社,2004:162.
[14] William M,Eberhard U M. Chemical modification of histidine residues of rabbit hemopexin [J]. Archives of Biochemistry and Biophysics,1976,176(2):431-441.
[15]陳清西,陳素麗,朱凌翔,等.長毛對蝦堿性磷酸酶功能基團的研究[J].廈門大學學報:自然科學版,1996,35(4):587-591. CHEN Qingxi,CHEN Suli,ZHU Lingxiang,et al. Functional group research of alkaline phosphatase from Penaeu spenicillatus [J]. Journal of Xiamen University:Natural Science,1996,35(4):587-591.(in Chinese)
[16]張洪淵,劉克武,姜云,等.背角無齒蚌堿性磷酸酶的功能基團研究[J].水生生物學報,1997,21(4):347-352. ZHANG Hongyuan,LIU Kewu,JIANG Yun,et al. Functional groups research of alkaline phosphatase from anodonta woodiana heude[J]. Acta Hydrobiologica Sinica,1997,21(4):347-352.(in Chinese)
[17]劉穩,方靖,高培基.豆殼過氧化物酶的鹽酸胍變性與化學修飾研究[J].中國生物化學與分子生物學報,1999,15(5):804-805.LIU Wen,FANG Jing,GAO Peiji.The effects of Guanidine Hydrochloride on denature and chemical modification of Soybeanhull peroxidase(SHP)[J]. Chinese Journal of Biochemistry and Molecular Biology,1999,15(5):804-805.(in Chinese)
[18] Inada Y 1,Furukawa M,Sasaki H,et al. Biomedical and biotechnological applications of PEG- and PM-modified proteins[J]. Trends Biotechnol,1995,13(3):86-91.
[19] Veronese F M. Peptide and protein PEGylation:a review of problems and solutions[J]. Biomaterials,2001,22(5):405-417.
Chemical Modification of Functional Groups of Peroxidase from Leaves of Ipomoea aquatica Forsk
WANG Hongyang,SUN Caiyun,HUANG Mang,TANG Yunming*
(School of Life Science,Southwest University,Chongqing 400715,China)
Abstract:In order to identify the functional groups of peroxidase from the leaves of Ipmoea aquatica Forsk,peroxidas were isolated,purifiedandselectively modified by using BD,DTT,pCMB,Maleic anhydride,Chloramine-T,PMSF,NAI and BrAc separately and the change on activity were determined. The result showed that Arg,Lys,His and sulfhydryl involving in the composition of the enzyme active center should be considered as indispensable functional groups of peroxidase,while Met,Ser and Tyr residues should not be because they were not directly related to the activity of peroxidase from Ipomoea aquatica Forsk.
Keywords:Ipomoea aquatica Forsk,peroxidase,functional groups,chemical modification
*通信作者:唐云明(1960—),男,四川武勝人,農學博士,教授,主要從事蛋白質與酶工程方面的研究。E-mail:tbright@swu.edu.cn
基金項目:重慶市重點科技攻關項目(CSTC,2011AB1027)。
收稿日期:2014-07-29
中圖分類號:Q 55
文獻標志碼:A
文章編號:1673—1689(2016)02—0192—05

