鎂對人血管平滑肌細胞鈣化的作用
孫文學,張明慧,劉毅,蘇震(.溫州醫科大學附屬第一醫院 腎內科,浙江 溫州 3505;.東營市勝利油田中心醫院 腎內科,山東 東營 57000)
?
鎂對人血管平滑肌細胞鈣化的作用
孫文學1,張明慧2,劉毅1,蘇震1
(1.溫州醫科大學附屬第一醫院 腎內科,浙江 溫州 325015;2.東營市勝利油田中心醫院 腎內科,山東 東營 257000)
[摘 要]目的:研究鎂對高鈣高磷誘導的人血管平滑肌細胞(hVSMC)鈣化的影響。方法:無菌條件下提取胎兒臍動脈平滑肌細胞,分為正常對照組(A組)、高鈣高磷組(B組)、高鈣高磷+硫酸鎂組(C組)。B組、C組培養3 d后,部分(B1組、C1組)繼續高鈣高磷培養液培養,部分(B2組、C2組)換用普通培養液培養。于12 h、24 h、72 h、第4、第7、第10天測定細胞層鈣含量,并采用Western blot法測定核心結合因子1(cbfa1)、磷酸核糖焦磷酸合成酶2(Prps2)蛋白表達水平。結果:B組鈣含量升高,C組較B組、C1組較B1組、C2組較B2組,鈣含量均明顯下降(P<0.05)。Western blot結果顯示,12 h、24 h、72 h B組Cbfa1表達升高,C組表達降低(P<0.05);第4、第7、第10天,C1組較B1組、C2組較B2組,Prps2表達升高,差異有統計學意義(P<0.05)。結論:高鈣高磷促進hVSMC鈣化,鎂抑制了hVSMC鈣化進展,激活了Prps2蛋白表達,促進了鈣化消退。
[關鍵詞]鎂;平滑肌細胞;成骨樣轉化;鈣化;核心結合因子1;磷酸核糖焦磷酸合成酶2
終末期腎病(end stage renal disease,ESRD)即尿毒癥已成為重要的公共衛生問題。心血管疾病(cardiovascular disease,CVD)是尿毒癥患者的首位死亡原因。研究顯示,血管鈣化尤其是中膜鈣化是導致尿毒癥患者CVD病死率升高的主要原因之一,同時,也是CVD的獨立危險因素及預測因素[1]。目前研究已證實血管鈣化是一個受多因素調控的、與骨發生類似的、主動的可調節過程,其中心環節是血管平滑肌細胞(vascular smooth muscle cell,VSMC)轉分化為成骨樣細胞,表達骨化及礦化相關蛋白及發生凋亡的過程[2]。而核心結合因子a1(core-binding factor a1,Cbfa1)是VSMC轉分化為成骨樣細胞的標志性蛋白,且已證實停止鈣化干預措施后血管鈣化是可以主動消退的[3-4]。鎂除了參與許多酶的活化外,在骨骼、礦物質代謝、血管鈣化方面也起著重要作用。研究發現鎂可以減輕牛VSMC的鈣化[5],對人VSMC(hVSMC)的鈣化也有抑制作用[6-8],但具體機制尚不清楚。本課題組前期研究[9-10]發現磷酸核糖焦磷酸合成酶2(phosphoribosyl pyrophosphate synthetase 2,Prps2)是促進大鼠血管鈣化消退的焦磷酸合成相關基因,而Prps2激活劑絕對需要Mg2+,故本研究觀察鎂對高鈣高磷條件下hVSMC成骨樣轉化的作用及其可能機制。
1 材料和方法
1.1主要試劑 DMEM高糖培養基、胰蛋白酶(美國Gibco公司),胎牛血清(美國Hyclone公司),5%山羊封閉血清(北京Solarbio公司),二甲基亞砜、茜紅素S(美國Sigma公司),鈣離子檢測試劑盒(南京建成科技有限公司),引物(美國Invitrogen公司),SYBR Green real-time PCR MasterMix(Toyobo公司),蛋白Marker、BCA蛋白分析試劑盒(上海碧云天生物技術有限公司),抗GAPDH單抗、抗α-SMA單抗、抗Cbfa1單抗(美國Abcam公司),抗Prps2單抗(美國Abgent公司),辣根過氧化物酶標記山羊抗兔和IgG辣根過氧化酶標記山羊抗小鼠IgG(美國Bioworld公司),硫酸鎂(上海博蘊生物科技有限公司)。
1.2實驗方法
1.2.1細胞提取及培養:無菌條件下取溫州醫科大學附屬第一醫院產科胎兒(男嬰,足月)臍帶,長約5 cm,于超凈工作臺上操作,將臍帶置于10 cm培養皿中,剝離臍動脈(2條),眼科剪將剩余血管組織剪成1 mm×1 mm組織小塊,無菌吸管吸取組織塊至0.25%胰酶中消化離心,用1 mL移液器吸出上清液,用含20%胎牛血清、100 U/mL青霉素和100 U/mL鏈霉素的高糖DMEM培養液培養沖懸離心管內細胞,并將細胞懸液轉移至5 mL培養瓶中;細胞培養于5% CO2培養箱中,37 ℃恒溫培養,3 d后倒置顯微鏡下觀察細胞,細胞貼壁后予高糖DMEM培養液換液。
1.2.2細胞鑒定:細胞培養6 d后,采用SP法對hVSMC a肌動蛋白(a-smooth muscle actin,a-SMA)進行免疫組織化學染色,貼壁于血蓋片上的原代及第4代hVSMC依次作處理。a-SMA陽性染色以胞質出現棕黃色或棕褐色為準。
1.2.3實驗分組:實驗分空白組(A組)、高鈣高磷組(B組)、高鈣高磷+硫酸鎂組(C組)3組。B組、C組hVSMC培養至細胞融合70%左右時換用含高鈣高磷(磷3.0 mmol/L,鈣2.5 mmol/L)培養液繼續培養以誘導鈣化。培養3 d后,一部分(B1組、C1組)繼續培養于高鈣高磷培養液中,另一部分(B2組、C2組)換用普通培養液繼續培養。硫酸鎂溶液濃度為3.0 mmol/L。
1.2.4鈣化模型鑒定:倒置顯微鏡下觀察細胞形態,茜紅素S染色法觀察鈣沉積。
1.2.5鈣含量測定:六孔板培養細胞,分別于12、24、72 h及4、7、10 d后,收集各組細胞,吹打成懸浮狀態后,用無菌PBS液洗滌各組細胞3次,每次3 min,各孔加入0.6 mol/L鹽酸0.5 mL,37 ℃脫鈣24 h,收集鹽酸懸液,鹽酸懸液中鈣含量用甲氧-酚酞絡合酮方法測定。將脫鈣后的細胞用1×PBS洗滌3次后,用0.1 mmol/L氫氧化鈉0.1 mL與1% SDS(十二烷基硫酸鈉)溶解細胞,測細胞內鈣含量,BCA法測蛋白含量,并以蛋白含量標準化鈣含量。
1.2.6Western blot法檢測Cbfa1、Prps2的表達:按照試劑盒要求,分別于12 h、24 h、72 h提取各組細胞總蛋白,置于-80 ℃保存,BCA法測定蛋白濃度,每個樣本取30 μg蛋白,經SDS-PAGE凝膠轉移至PVDF膜上,封閉2 h,分別加入抗體,4 ℃過夜,TBST洗膜(10 min,3次),再加入山羊抗兔的二抗(1∶5 000稀釋),孵育2 h,TBST洗3次后,試劑盒顯色,底片經掃描儀透掃后,Quantity One軟件進行定量分析,測得Cbfa1蛋白表達;第4、第7、第10天提取各組總蛋白,置于-80 ℃保存,BCA法測定蛋白濃度,經蛋白定量、轉膜、免疫反應、化學發光、顯影、定量和圖像分析測得Prps2蛋白表達。
1.3統計學處理方法 采用SPSS18.0軟件進行統計分析。計量資料以±s表示,各組間比較采用單因素方差分析,C1與C2、B1與B2組間比較采用獨立樣本t檢驗。P<0.05為差異有統計學意義。
2 結果
2.1hVSMC的鑒定 原代培養獲得的細胞呈典型的hVSMC形態:細胞長梭形或多邊形,胞質豐富,細胞核居中,倒置顯微鏡下觀察細胞生長呈典型的“峰谷樣”。免疫組織化學α-SMA染色見細胞胞漿內α-SMA表達豐富(見圖1)。α-SMA染色陽性率超過95%,純度符合實驗要求。
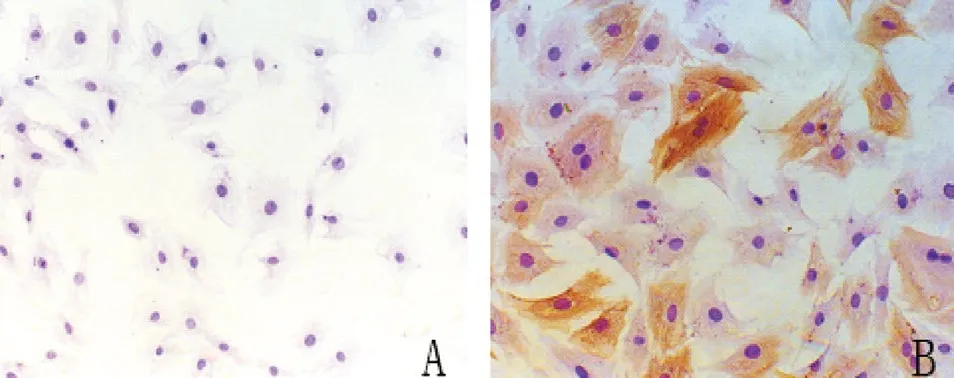
圖1 hVSMC的α-SMA鑒定(×200)
2.2hVSMC的鈣化鑒定 平滑肌細胞生長至70%左右時換用鈣化培養液,繼續培養9 d,倒置顯微鏡下觀察,細胞由長梭形變為短桿狀或不規則形態。茜紅素S染色,可見鈣化的平滑肌細胞有橘紅色團塊狀沉積(見圖2)。
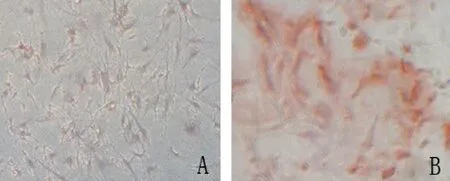
圖2 茜紅素S染色(×200)
2.3各組平滑肌細胞鈣含量比較 培養12、24、72 h后,與A組比較,B組鈣含量明顯升高,差異有統計學意義(P<0.05)。培養12、24、72 h后C組與B組比較,鈣含量明顯下降,差異有統計學意義(P<0.05)。培養4、7、10 d后C1組與B1組比較,C2組與B2組比較,鈣含量均明顯下降,差異有統計學意義(P<0.05)。說明硫酸鎂對VSMC鈣化的進展及消退均有作用(見表1-2)。
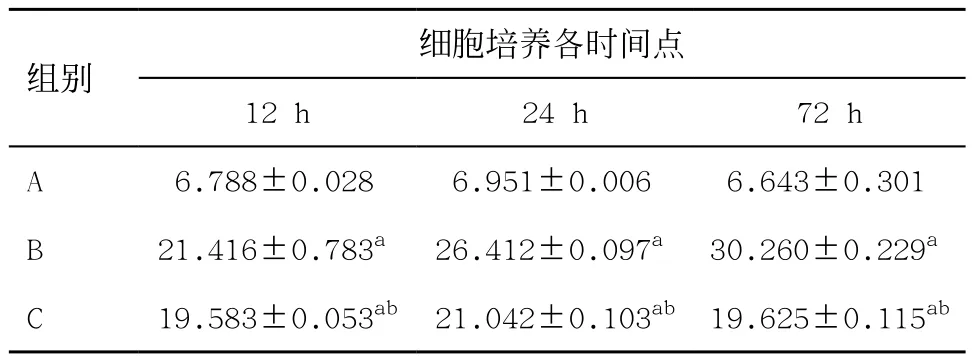
表1 12、24、72 h各組平滑肌細胞鈣含量測定(n=3,±s,μg/mg)
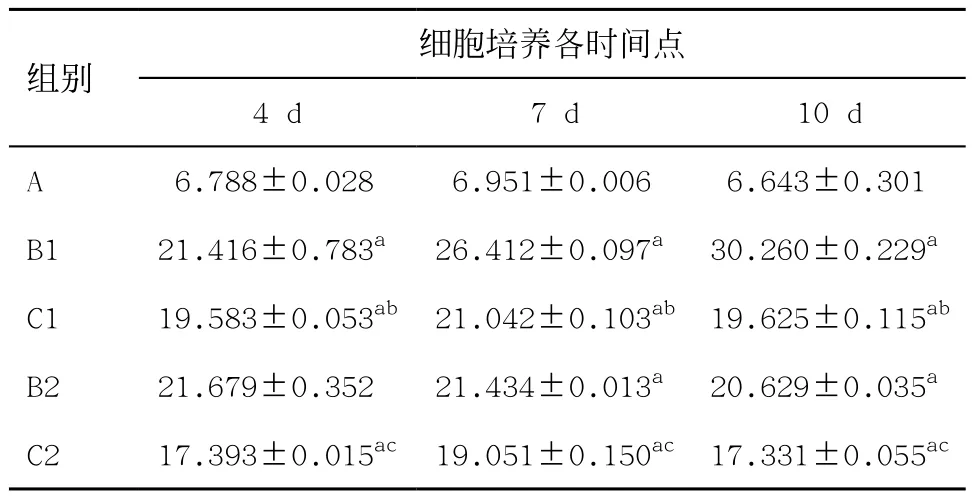
表2 4、7、10 d各組平滑肌細胞鈣含量測定(n=3,±s,μg/ mg)
2.4各組鈣化相關蛋白的表達 A組hVSMC中Cbfa1蛋白表達量較低,細胞培養24、72 h B組Cbfa1表達較A組升高,差異有統計學意義(P<0.05),培養12、24、72 h時C組較B組表達降低,差異有統計學意義(P<0.05),見表3。
表3 不同時間點平滑肌細胞Cbfa1蛋白的表達(n=3,±s)
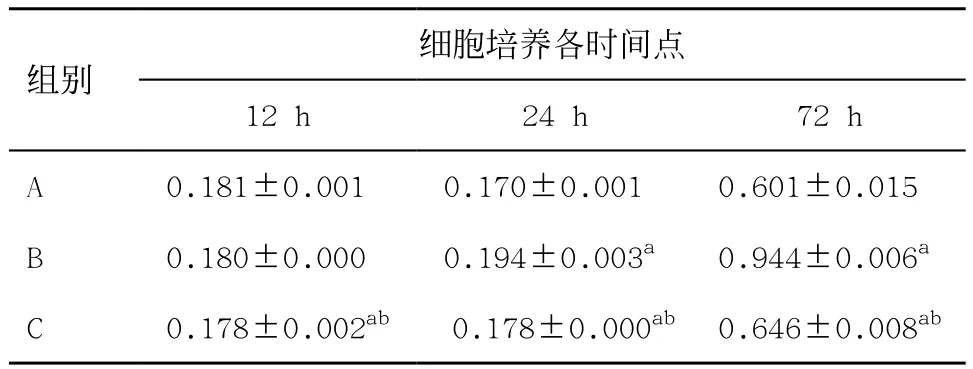
表3 不同時間點平滑肌細胞Cbfa1蛋白的表達(n=3,±s)
與A組比:aP<0.05;與B組比:bP<0.05
細胞培養各時間點12 h 24 h 72 h A 0.181±0.001ab 0.170±0.001ab 0.601±0.015abB 0.180±0.000ab 0.194±0.003ab 0.944±0.006abC 0.178±0.002ab 0.178±0.000ab0.646±0.008ab組別
各組細胞培養4、7、10 d,C1組Prps2表達較B1組升高,差異有統計學意義(P<0.05),且隨著時間延長增加明顯;C2組較B2組,在4、10 d時Prps2表達升高,差異有統計學意義(P<0.05),見表4。
表4 不同時間點平滑肌細胞Prps2蛋白的表達(n=3,±s)
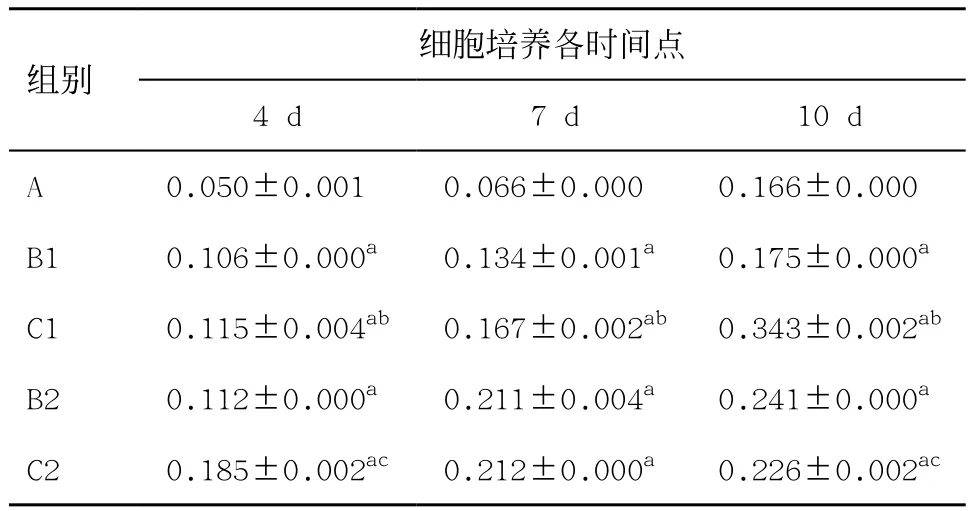
表4 不同時間點平滑肌細胞Prps2蛋白的表達(n=3,±s)
與A組比:aP<0.05;C1與B1組比:bP<0.05;C2與B2組比;cP<0.05
細胞培養各時間點4 d 7 d 10 d A 0.050±0.001ac 0.066±0.000ac 0.166±0.000acB1 0.106±0.000ac 0.134±0.001ac 0.175±0.000acC1 0.115±0.004ab 0.167±0.002ab 0.343±0.002abB2 0.112±0.000ac 0.211±0.004ac 0.241±0.000acC2 0.185±0.002ac 0.212±0.000ac 0.226±0.002ac組別
3 討論
血管鈣化是一種異位鈣化,在ESRD患者中十分常見,尤其是維持性血液透析后,血管鈣化發生早、發展迅速,導致CVD的病死率明顯增加。礦化的促進力和礦化的抑制力之間是否維持著動態平衡,決定著血管鈣化的產生和消退。因此聚焦礦化的抑制因素將有助于尋找防治血管鈣化的新途徑。
鎂為大約300種酶的輔助因子和天然鈣通道阻滯劑,在生理和病理生理方面,扮演重要角色。研究顯示,鎂缺乏與增加代謝綜合征和2型糖尿病風險及慢性心力衰竭中致命性心臟事件以及血液透析患者動脈粥樣硬化和血管鈣化有關[11]。低鎂血癥與腎臟病發生及血管鈣化關系密切[12]。研究發現,補充鎂可延緩血液透析患者動脈鈣化的進展[13]。低劑量和高劑量硫酸鎂明顯緩解維生素D3加尼古丁誘導的SD大鼠心血管組織的鈣化,以劑量依賴性的方式降低血管鈣化和減少血管損傷[14]。鎂逆轉血管鈣化的可能機制有:①逆轉VSMC中鈣的沉積、羥磷灰石結晶的發生、生長[15];降低Cbfa1、堿性磷酸酶的表達,抑制并部分逆轉血管鈣化;②通過抑制鈣通道活性,抑制VSMC成骨樣轉分化[16];③通過短暫受體潛能通道家族(transient receptor potential melastatin,TRPM)7抑制鈣轉移入細胞內及基質小泡中,從而下調Pit1,抑制磷進入細胞,抑制Cbfa1介導的VSMC轉分化[17]。
本課題組前期研究[9-10]顯示,焦磷酸鹽合成相關基因Prps2等基因在大鼠血管鈣化消退過程中差異表達,在原組織中表達增高,促進血管鈣化消退。Prps屬于激酶類,是催化從ATP和核糖-5-磷酸合成磷酸核糖焦磷酸的一個酶家族[18]。Prps2基因位于x染色體短臂p22.2-p22.3區[19],Prps家族編碼的Prps蛋白是體內嘌呤、嘧啶核苷酸從頭合成和補救合成的關鍵酶,是核苷酸代謝的重要調節因子,在細胞增殖中發揮重要作用[19]。Prps2在增殖較快的組織(如胸腺、肺、胃、小腸等)中表達量高[20]。其中Prps2激活劑絕對需要Mg2+,包括與ATP形成Mg2+-ATP及游離的Mg2+。Mg2+與Prps的結合促進Mg2+-ATP與Prps的結合。Ca2+對重組Prps2起抑制作用,無機磷為維持Prps活性所必需[21]。
本實驗培養胎兒臍動脈平滑肌細胞作為觀察對象,采用高鈣高磷環境(鈣2.5 mmol/L,磷3.0 mmol/L)誘導hVSMC鈣化,結果顯示:12 h開始B、 B1、B2組hVSMC的鈣含量開始明顯增加,一直持續至第10天,且隨著時間的延長,鈣含量升高明顯,形成明顯的鈣鹽沉積,茜素紅S染色可見細胞團塊處有橘紅色的鈣鹽沉積形成,說明高鈣高磷誘導VSMC鈣化成功。加入硫酸鎂后(C、C1、C2組)在鈣化進展及消退過程中hVSMC鈣含量明顯降低,說明硫酸鎂抑制了hVSMC血管鈣化的進展,且促進了血管鈣化的消退。
正常情況下,hVSMC中Cbfa1蛋白表達量較低,高鈣高磷誘導后,B組12、24、72 h均表達增高(P<0.05),且隨著時間延長增加明顯,與B組比較,C組Cbfa1蛋白表達量降低,說明高鈣高磷誘導hVSMC鈣化成功,硫酸鎂抑制了hVSMC鈣化進展早期Cbfa1蛋白表達,抑制了血管鈣化。第4天開始各組Prps2蛋白表達均增高;C1較B1,C2較B2組Prps2蛋白表達增高明顯,說明硫酸鎂在hVSMC鈣化進展及消退過程中激活了Prps2蛋白表達,抑制了hVSMC成骨樣轉化,促進了hVSMC鈣化的消退。
綜上所述,ESRD患者的高鈣高磷環境對hVSMC有主動調節骨轉化的作用,而外源性硫酸鎂可能通過激活Prps2蛋白表達,抑制hVSMC鈣化進展,促進鈣化消退。
參考文獻:
[1]TOELLE M,RESHETNIK A,SCHUCHARDT M,et al. Arteriosclerosis and vascular calcification: causes,clinical assessment and therapy[J]. Eur J Clin Invest,2015,45(9): 976-985.
[2]DALFINO G,SIMONE S,PORRECA S,et al. Bone morphogenetic protein-2 may represent the molecular link between oxidative stress and vascular stiffness in chronic kidney disease[J]. Atherosclerosis,2010,211(2): 418-423.
[3]BAS A,LOPEZ I,PEREZ J,et al. Reversibility of calcitriolinduced medial artery calcification in rats with intact renal function[J]. J Bone Miner Res,2006,21(3): 484-490.
[4]吳秀娟,劉毅,孫文學,等. 篩選大鼠血管鈣化消退差異表達基因及初步分析[J]. 中國應用生理學雜志,2011,27(4):465-470.
[5]KIRCELLI F,PETER M E,SEVINC OK E,et al. Magnesium reduces calcification in bovine vascular smooth muscle cells in a dose-dependent manner[J]. Nephrol Dial Transplant,2012,27(2): 514-521.
[6]LOUVET L,BüCHEL J,STEPPAN S,et al. Magnesium prevents phosphate-induced calcification in primary human aortic vascular smooth muscle cells (HAVSMC)[J]. Nephrol Dial Transplant,2012,27(suppl 2): 153-154.
[7]LOUVET L,BüCHEL J,STEPPAN S,et al. Magnesiumprevents phosphate-induced calcification in human aortic vascular smooth muscle cells[J]. Nephrol Dial Transplant,2013,28(4): 869-878.
[8]ZELT,J G,MCCABE K M,SVAJGER B,et al. Magnesium modifies the impact of calcitriol treatment on vascular calcification in experimental chronic kidney disease[J]. J Pharmacol Exp Ther,2015,355(3): 451-462.
[9]吳秀娟,劉毅,孫文學,等. 抑制性消減雜交法篩選大鼠血管鈣化相關基因的研究[J]. 中華腎臟病雜志,2010,26(7):543-549.
[10]JIANG Z M,WU X J,LIU Y,et al. Changes of gene expression profiles across different phases of vascular calcification in rats[J]. Genet & Mol Res Gmr,2012,12(4): 5945-5957.
[11]KIKUCHI K,TANAKA H,GIMA M,et al. Abnormalities of magnesium (Mg) metabolism and therapeutic significance of Mg administration in patients with metabolic syndrome,type 2 diabetes,heart failure and chronic hemodialysis[J]. Clin Calcium,2012,22(8): 1217-1226.
[12]VAN LAECKE S,VAN BIESEN W,VANHOLDER R. Hypomagnesaemia,the kidney and the vessels[J]. Nephrol Dial Transplant,2012,27(11): 4003-4010.
[13]TZANAKIS I P,STAMATAKI E E,PAPADAKI A N,et al. Magnesium retards the progress of the arterial calcifications in hemodialysis patients: a pilot study[J]. Int Urol & Nephro,2014,46(11): 2199-2205.
[14]PEN J X,LI L,WANG X,et al. The effect of the magnesium supplementation on vascular calcification in rats[J]. Zhongguo Ying Yong Sheng Li Xue Za Zhi,2012,8(1): 20-23.
[15]VILLA-BELLOSTA R,MILLAN A,SORRIBAS V. Role of calcium-phosphate deposition in vascular smooth muscle cell calcification[J]. Am J Physiol Cell Physiol,2011,300 (1): C210-C220.
[16]MONTES dE OCA A,GUERRERO F,MARTINEZMORENO J M,et al. Magnesium inhibits Wnt/beta-catenin activity and reverses the osteogenic transformation of vascular smooth muscle cells[J]. PLoS One,2014,9(2): e89525.
[17]MONTEZANO A C,ZIMMERMAN D,YUSUF H,et al. Vascular smooth muscle cell differentiation to an osteogenic phenotype involves TRPM7 modulation by magnesium[J]. Hypertension,2010,56(3): 453-462.
[18]BECKER M A. Phosphoribosylpyrophosphate synthetase and the regulation of phosphorribosylpyrophosphate production in human cells[J]. Prog Nucleic Acid Res Mol Biol,2001,69: 115-148.
[19]BECKER M A,HEIDLER S A,BELL G. Cloning of cDNAs for human phosphoribosylpyro-phosphate synthetases 1 and 2 and X chromosome localization of PRPS1 and PRPS2 genes[J]. Genomics,1990,8(3): 555-561.
[20]TAIRA M,IIZASA T,YAMADA K. Tissue-differential expression of two distinct genes for phosphoribosylpyrophosphate synthetaseand existence of the testis-specific transcript [J]. Biochim Biophys,1989,1007(2): 203-208.
[21]FOX I H,KELLEY W N. Human phosphoribosylpyrophosphate synthetase: distribution,purification,and Properties[J]. J Biol Chem,1971,246(18): 5739-5748.
(本文編輯:丁敏嬌)
Effect of magnesium on calcification of human vascular smooth muscle cells
SUN Wenxue1,ZHANG Minghui2,LIU Yi1,SU Zhen1. 1.Departmant of Nephrology,the First Affiliated Hospital of Wenzhou Medical University,Wenzhou,325015; 2.Departmant of Nephrology,the Central Hospital,Shengli Oil Field,Dongying,257000
Abstract:Objective: To investigate the effect of magnesium on calcification of vascular smooth muscle cells (VSMCs) induced by elevated calcium (Ca++) and phosphate (P) culture. Methods: The fetus’s umbilical artery VSMCs were extracted under aseptic conditions and cultured in vitro. Cells were divided into three groups: normal control group (normal concentration of Ca++and P,group A),positive control group (high calcium and phosphate,group B),treatment groups (high calcium and phosphate + magnesium sulfate,group C). The cells were cultured for 3 days,then Part (B1,C1) were continued to develop in high calcium and phosphate culture medium,Part (B2,C2) were changed to develop in ordinary solution. Respectively the calcium content of cell layer were determinated in calcium content test in the 4,7,10 days. Meanwhile,the protein expression of Cbfa1 and Prps2 were observed by Western bloting. Results: The primary cells were identified,purity of cultures was assessed by positive immunostaining for α-SMA. Compared with negative control group,the sedimentary on the cells layer of experimental group (B) was observed. The calcium content in calcium content test showed that the high calcium and high phosphorus group (B,B1 and B2) increased significantly (P<0.05),compared with the B,B1 and B2 group,magnesium sulfate group (C,C1 and C2) showed a lower intracellular calcium levels. Western blot test results confirmed that: compared with control group (A),the expression of Cbfa1 increased in B group in 24 hours,72 hours; compared with B group,the expression of Cbfa1 declined in C group in 12 hours,24 hours,72 hours. compared with B1,B2 group,the expression of Prps2 increased in C1,C2 group in 4 days,7 days,10 days,was statistically significant (P<0.05). Conclusion: High calcium and high phosphorus promote the VSMCs’calcification. While magnesium has a significant effect to inhibit the VSMCs calcification,activate the Prps2 protein expression,promote the calcification fade.
Key words:magnesium; smooth muscle cell; osteogenesis sample transdifferentiation; calcification; corebinding factor α1; phosphoribosyl pyrophosphate synthetase 2
作者簡介:孫文學(1976-),女,浙江溫州人,主治醫師,碩士。
基金項目:浙江省自然科學基金資助項目(LY15H270017);溫州市科技局科研基金資助項目(Y20120020)。
收稿日期:2016-01-08
[中圖分類號]R453.9
[文獻標志碼]A
DOI:10.3969/j.issn.2095-9400.2016.05.009

