以唑草·苯磺隆為模型研究酮類小分子與牛血清白蛋白的相互作用
王 珊,高豐琴,楊小玲
(咸陽師范學院 化學與化工學院,陜西 咸陽 712000)
蛋白質是組成生命的主要物質之一,各種生命活動與蛋白質都分不開。迄今為止在生命科學,化學等眾多領域的研究中,蛋白質的研究一直都占有舉足輕重的地位,特別是對小分子與蛋白質的探究[1-2]。
關于蛋白質構象的研究最主要的是熒光光譜法,從不同的角度來研究分子結構和鍵與鍵之間的結合效果,以此反映蛋白質的功能。近幾年唑草酮殺草范圍廣、效果明顯、對后茬作物沒太大的影響,因此在麥田里得到廣泛應用[3-6]。這種方法之所以被應用于研究唑草酮與牛血清白蛋白之間的相互作用是由于其有很多優點,比如靈敏度高,運用起來較方便以及用量比較少等。
對于藥物中小分子與蛋白質相互作用的反應過程中響應信號的變化,通過具體的分析,確定該響應信號和系統參數之間的數學關系,或通過查找探針和合適的蛋白質體系結構,改變現有的反應模型的缺點,進一步得到蛋白質的結構,建立一個更清晰的圖像反應,為識別、篩選和解毒劑的研制提供強有力的依據。研究農藥與血清白蛋白之間的結合作用,有利于深入了解農藥對人、畜的中毒機制,對指導科學有效的使用農藥具有重要意義[7-8]。
1 實驗部分
1.1 試劑與儀器
牛血清白蛋白:分析純,百靈威試劑公司;草甘膦銨鹽:質量分數30%,分析純,鎮江江南化工有限公司;唑草·苯磺隆:分析純,浙江新安化工集團股份有限公司; 三羥甲基氨基甲烷:分析純,天津化學試劑廠。
SPECORD 50型紫外可見吸收光譜儀:德國耶拿公司;RF-5301型熒光分光光度計:日本島津公司。
1.2 實驗步驟
1.2.1 配制緩沖溶液
(1) 先稱3.634 2 g三羥甲基氨基甲烷(C4H11NO3),以少量蒸餾水溶解,配成0.1 mol/L的Tris溶液;
(2) 取1 mol/L鹽酸加水配成0.1 mol/L的鹽酸溶液;
(3) 取250 mL 0.1 mol/L的三羥甲基氨基甲烷溶液于燒杯中,再加入210 mL 0.1 mol/L的鹽酸溶液,用鹽酸和氫氧化鈉調節混合溶液pH至7.40,最后用蒸餾水加至刻度處,于陰涼干燥處保存備用;
(4) 在天平上稱量氯化鈉固體1.2 g,然后加入41 mL蒸餾水,攪拌使氯化鈉固體溶解,配制成濃度為0.5 mol/L的氯化鈉溶液;
(5) 量取250 mL 0.1 mol/L的三羥甲基氨基甲烷溶液于燒杯中,再加入210 mL 0.1 mol/L的鹽酸溶液,用鹽酸和氫氧化鈉調節混合溶液pH至7.40,最后用蒸餾水加至刻度處。
1.2.2 配制唑草·苯磺隆溶液
在分析天平上稱量0.143 7 g唑草·苯磺隆固體,加入200 mL蒸餾水,在水浴鍋中加熱溶解配制成2×10-3mol/L的溶液。
1.2.3 配制牛血清白蛋白
在分析天平上,準確稱取0.065 g牛血清白蛋白晶體,用配好的濃度為2.0×10-6mol/L 的Tris-HCl緩沖溶液配成備用液。
1.2.4 不同濃度溶液的配制
(1) 取8個容量相同的比色管,先分別依次加入2 mL BSA、2 mL NaCl、2 mL Tris-HCl緩沖溶液;
(2)依次加入唑草·苯磺隆除草劑的濃度分別為0、4×10-6、8×10-6、12×10-6、16×10-6、20×10-6、24×10-6、28×10-6mol/L,最后用蒸餾水定容到刻度線處,來回搖晃使其混合均勻,在一定溫度下固定放置一段時間。
1.3 不同濃度唑草·苯磺隆與牛血清白蛋白熒光光譜的測定
(1) 將濃度不同且已經配好的溶液依次倒入石英比色皿中,熒光發射與激發狹縫寬度是5∶5,固定波長在280 nm處,依次測定300~450 nm間光譜,每次記錄最大熒光強度和對應波常數;
(2) 在相等溫度下掃描混合溶液的同步熒光光譜等。
2 結果與討論
2.1 唑草·苯磺隆與牛血清白蛋白的相互作用
不同濃度的唑草·苯磺隆溶液中BSA的熒光發射光譜見圖1。從圖1可以知道,BSA最大的吸收峰在347 nm處,BSA的熒光強度隨著唑草·苯磺隆濃度的增大,而顯示有規律降低的趨勢,但BSA的峰形沒有發生大的變化。表明唑草·苯磺隆與BSA之間發生了相互作用,使熒光物質發生猝滅。
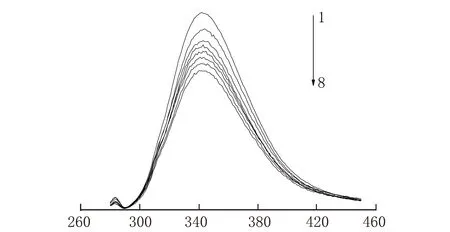
λ/nm1-BSA;2-BSA+ c(藥物)=4×10-6mol/L;3-BSA+ c(藥物)=8×10-6 mol/L;4-BSA+ c(藥物)=12×10-6 mol/L;5-BSA+ c(藥物)=16×10-6 mol/L;6-BSA+ c(藥物)=20×10-6 mol/L;7-BSA+ c(藥物)=24×10-6 mol/L;8-c(藥物)=28×10-6 mol/L,c(BSA)=2×10-6 mol/L圖1 不同濃度唑草·苯磺隆與BSA的發射熒光光譜
當某些小分子與蛋白質結合,其熒光強度有所下降,這種現象稱為熒光猝滅作用[7-8]。基態分子和猝滅劑之間的結合是動態猝滅,它依照Stern-Volmer方程[9]:
F0/F=1+Kqτ0c=1+Ksvc
(1)
式中,c為猝滅劑濃度;τ0為熒光分子的平均壽命,不含有猝滅劑時其數值是10-8s;F0為沒有猝滅劑時熒光物質的熒光強度;F為含有猝滅劑時的熒光強度;Kq為動態熒光猝滅速率常數,L/mol·s,是大分子的熒光壽命和分子擴散的衰減速度與相互碰撞的反應。
已知生物大分子熒光壽命約為10-8s,各類猝滅劑對生物大分子最大動態熒光猝滅速率常數為2.0×1010L/mol·s[10];由(1)式能夠得到BSA和唑草·苯磺隆反應的Stern-Volmer曲線見圖2,其中c(藥物)=4×10-6、8×10-6、12×10-6、16×10-6、20×10-6、24×10-6、28×10-6mol/L。
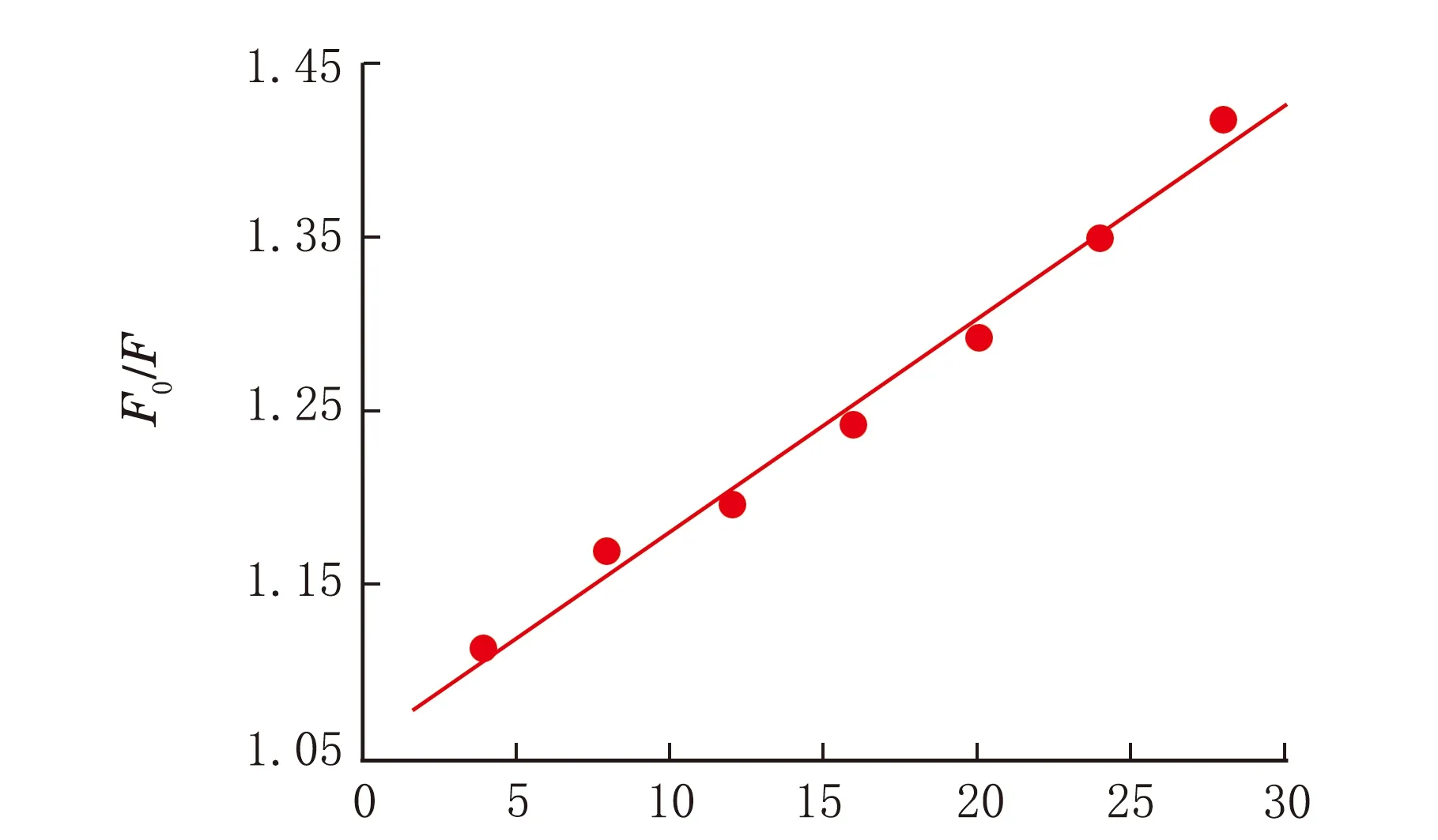
c(藥物)×10-6/(mol·L-1)圖2 唑草·苯磺隆與BSA的Stern-Volmer曲線
由直線斜率可求得Ksv=1.5×104L/ mol,進一步求得Kq=1.5×1012L/mol·s,因此可知,動態猝滅的假設不成立,故酮類小分子對BSA的熒光猝滅是靜態猝滅[11]。
靜態熒光猝滅作用見圖3,根據Lineweaver-Burk雙倒數方程[12],即:
(2)
可得出靜態猝滅結合常數KLB=1.5×104mol/L。
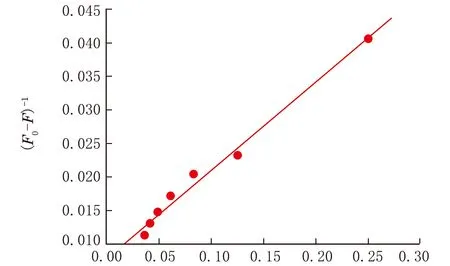
c-1×106/(L·mol-1)圖3 BSA和唑草·苯磺隆的雙倒數曲線
2.2 唑草·苯磺隆與牛血清白蛋白的同步熒光光譜
唑草·苯磺隆與牛血清白蛋白的同步熒光光譜見圖4。

λ/nm1-BSA;2-BSA+ c(藥物)=4×10-6 mol/L;3-BSA+ c(藥物)=8×10-6mol/L;4-BSA+ c(藥物)=12×10-6 mol/L;5-BSA+ c(藥物)=16×10-6 mol/L;6-BSA+ c(藥物)=20×10-6 mol/L;7-BSA+ c(藥物)=24×10-6mol/L;8-c(藥物)=28×10-6 mol/L,c(BSA)=2×10-6 mol/L圖4 不同濃度唑草·苯磺隆與BSA的同步熒光光譜
由圖4可見,明顯具有蛋白質的光譜特征。隨著唑草·苯磺隆濃度增大,熒光光譜強度逐漸降低。這說明唑草·苯磺隆與牛血清白蛋白可能形成了新的化合物,而因此發生了猝滅作用。目前酮類小分子與牛血清白蛋白的相互作用已有較多研究[13-15]。
熒光分子與猝滅劑之間的結合常數見圖5,其中c(藥物)=4×10-6、8×10-6、12×10-6、16×10-6、20×10-6、24×10-6、28×10-6mol/L。
關系式為:
lg[(F0-F)/F]=lgK0+nlgc
(3)
其中,F0、F和c的意義與式(3)相同;K0為熒光猝滅反應的平衡常數;n為結合點位數。以lg[(F0-F)/F]對lgc作雙對數圖,其線性方程的斜率和截距分別為為結合點位數n=1和lgK0=4.98。
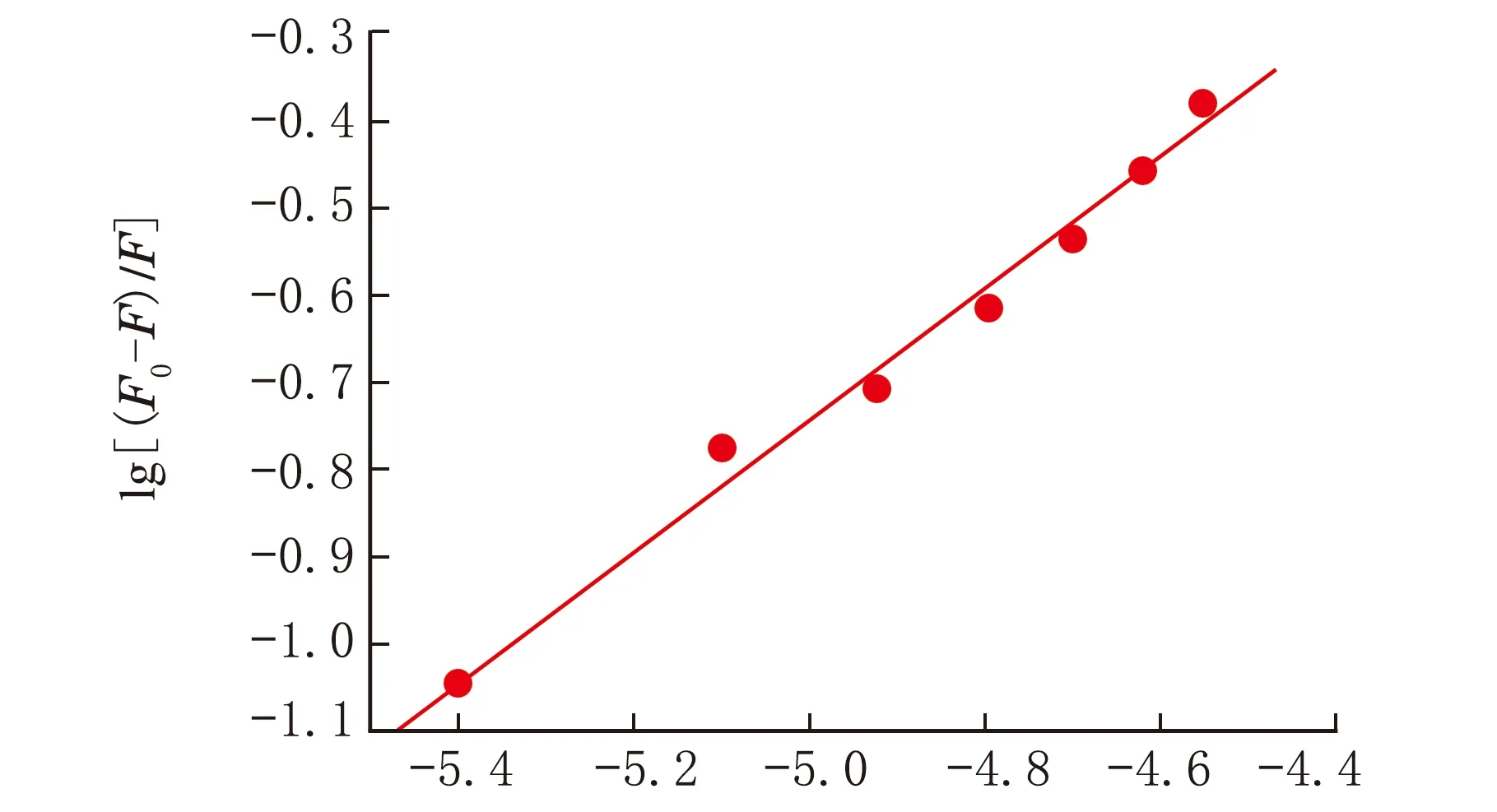
lgc×10-6圖5 BSA和唑草·苯磺隆的的雙對數曲線
2.3 唑草·苯磺隆與牛血清白蛋白的紫外光譜
不同濃度的唑草·苯磺隆與牛血清白蛋白的紫外光譜圖見圖6。由圖6可知,隨著藥物濃度的增加,紫外峰的強度逐漸降低。
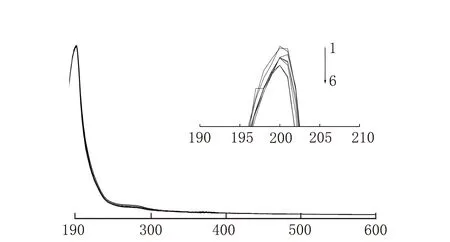
λ/nm1-BSA;2-BSA+ c(藥物)=4×10-6 mol/L;3-BSA+ c(藥物)=8×10-6mol/L;4-BSA+ c(藥物)=12×10-6 mol/L;5-BSA+ c(藥物)=16×10-6 mol/L;6-BSA+ c(藥物)=20×10-6 mol/L;7-BSA+ c(藥物)=24×10-6mol/L;8-c(藥物)=28×10-6 mol/L,c(BSA)=2×10-6 mol/L圖6 BSA和唑草·苯磺隆的紫外可見吸收光譜
純BSA和純唑草·苯磺隆的紫外可見光譜圖的對比見圖7。由圖7可知純BSA沒有猝滅作用,說明猝滅作用是由于唑草·苯磺隆與BSA結合引起的。

λ/nm1-c(藥物)=2×10-3 mol/L;2-c(BSA)=2×10-6 mol/L圖7 純BSA和純唑草·苯磺隆的紫外可見吸收光譜
3 結 論
通過模擬動物體的生理條件,研究唑草·苯磺隆與牛血清白蛋白之間存在的相互作用。由實驗結果分析可知,BSA與唑草·苯磺隆之間的猝滅方式是靜態猝滅,得出其靜態猝滅結合常數是KLB=1.5×104L/(mol·s),其結合點位數n=1。可以為研究唑草·苯磺隆除草劑的藥理、毒理提供依據,為進一步研制解藥提供基礎。
參 考 文 獻:
[1] 顏承農, 張華新,劉義,等.百草枯與牛血清白蛋白結合作用的熒光光譜[J].化學學報,2005,63(18):1727-1732.
[2] 吳漢東,史雪巖,梁沛.順式氰戊菊酯與牛血清白蛋白相互作用的熒光光譜研究[J].光譜實驗室,2008,25(4):694-699.
[3] ULRICH K H.Molecular aspects of ligand binding to serum albumin[J],Pharmacol Rev,1981,33:17-53.
[4] 陳克海,王玉蓮,郭明,等.長春新堿與牛血清白蛋白相互作用[J].光譜學與光譜分析,2008,28(6):1375-1378.
[5] 張國文,陳秀霞,潘軍輝,等.桑色素與牛血清白蛋白結合反應的熱力學分析[J].南昌大學學報(工科版),2008,30(3):229-233.
[6] 陳國珍.熒光分析法[M].北京:科學出版社,1990:217-221.
[7] CHENG Z J,ZHANG Y T.Fluorometric investigation on the interaction of oleanolic acid with bovine serum albumin[J].Science Direct,2008,879:81-87
[8] WANG N,YE L,YAN F,et al.Spectr oscopic studies ontheinter action of azelnidipine w ith bovine serum albumin [J].International Journal of Pharmaceutics,2008,351(1):55-60.
[9] 王雪瑞,韓大鋒,賈燕.有機磷農藥與牛血清白蛋白的相互作用以及分析應用[J].煙臺大學學報,2015(3):194-199.
[10] 王玲,屈凌波,楊冉,等.槲皮素和蘆丁與牛血清白蛋白相互作用研究[J].分析科學學報,2006,22(6):719-722.
[11] 顏承農,上官云風,潘祖亭,等.吡羅昔康與蛋白質作用特征的熱力學研究[J].分析化學,2004,32(3):317-319.
[12] 王春,吳秋華,王志,等.槲皮素與牛血清白蛋白相互作用的研究[J].光譜學與光譜分析,2006,26(9):1672-1675.
[13] 欒尼娜,吳錦繡,宋玉民,等.蘆丁與血清白蛋白結合作用的熱力學研究[J].光譜學與光譜分析,2008,28(4):856-859.
[14] 張朝紅,臧樹良,耿兵,等.三苯基錫化合物與牛血清白蛋白作用光譜[J].應用化學, 2005,22(5):489-493.
[15] 鄧世心,楊冬季.熒光法研究牛血清白蛋白與中性紅的相互作用[J].分析科學學報. 2005,21(2):184-188.

