動態軸向壓縮色譜制備高純度斷氧化馬錢子苷的研究*
宋亞玲,倪付勇,王雪晶,黃文哲,王振中,蕭 偉**
(1.江蘇康緣藥業股份有限公司 連云港 222000;2.中藥制藥過程新技術國家重點實驗室連云港 222000;3. 中藥提取精制新技術重點研究室 連云港 222000)
動態軸向壓縮色譜制備高純度斷氧化馬錢子苷的研究*
宋亞玲1,2,3,倪付勇1,2,3,王雪晶1,2,3,黃文哲1,2,3,王振中1,2,3,蕭 偉1,2,3**
(1.江蘇康緣藥業股份有限公司 連云港 222000;2.中藥制藥過程新技術國家重點實驗室連云港 222000;3. 中藥提取精制新技術重點研究室 連云港 222000)
目的:本研究旨在建立動態軸向壓縮色譜法分離制備高純度斷氧化馬錢子苷的方法。方法:金銀花70%乙醇提取液先經大孔吸附樹脂除雜富集后,采用動態軸向壓縮色譜柱分離,以正相硅膠為填料,二氯甲烷-甲醇系統為洗脫劑,對斷氧化馬錢子苷進行精制純化,分別運用HPLC、1H-NMR、13C-NMR和HR-ESI-MS對斷氧化馬錢子苷進行含量測定和結構表征。結果:產品經分析確定為斷氧化馬錢子苷,質量分數達98.76%。結論:采用動態軸向壓縮工業色譜法制備斷氧化馬錢子苷的方法操作簡便、快速、高效,為制備高純度的斷氧化馬錢子苷提供了一條新途徑。
斷氧化馬錢子苷 大孔樹脂 動態軸向 工業色譜 高效液相色譜
斷氧化馬錢子苷(secoxyloganin)是環烯醚萜類化合物,是中藥金銀花Flos L. japonicae中的一個主要活性成分,該類成分具有抗病毒[1]、抗炎[2],抗菌[3]、抗血栓[4]、保肝利膽、增強免疫等作用,也可用于治療心血管疾病、糖尿病及其并發癥的原料藥,具有很高的開發價值。金銀花的常規鑒定是以其醇提物中的綠原酸為指標成分[5-8],但在其傳統水煎劑中,發現含有大量環烯醚萜類化合物[9],因此綠原酸并不能代表金銀花所含有的全部成分;故增加斷氧化馬錢子苷為質控指標,可以更全面地控制金銀花藥材質量。現有文獻[9-11]中,關于斷氧化馬錢子苷的分離制備方法主要是萃取或樹脂純化以及硅膠、凝膠等反復純化,步驟繁瑣。因此,有必要尋找一種簡便快速的制備方法,以便更好地開發利用斷氧化馬錢子苷。
本實驗采用動態軸向壓縮工業色譜技術,以正相硅膠為填料,實現斷氧化馬錢子苷的精制純化,建立了一種快速大量制備高純度斷氧化馬錢子苷的方法,且分離制備的斷氧化馬錢子苷達到了對照品的要求,為常規的分析檢測和金銀花藥材及制劑的質量標準研究提供對照品,也為從其他植物中制備斷氧化馬錢子苷提供一條新的思路和方法。
1 材料與儀器
金銀花藥材經南京中醫藥大學吳啟南教授鑒定為忍冬科植物忍冬L. japonicaThunb.的干燥花;斷氧化馬錢子苷為本實驗室自制,純度98.0%(江蘇康緣藥業股份有限公司,批號:131228)。D-101、HPD-100型大孔吸附樹脂(天津海光化工有限公司);AB-8大孔樹脂(南開大學化工廠);柱層析硅膠,200-300目(青島海洋化工廠);甲醇,色譜純(瑞典Oceanpak公司);甲酸,分析純(南京化學試劑有限公司);95%乙醇,食用級(連云港長和酒業有限公司);雙蒸水(自制)。Bruker-AV-400型核磁共振光譜儀(德國布魯克公司);Agilent 1100高效液相色譜儀(美國Agilent公司),配自動進樣器、四元泵、VWD檢測器;AE240電子分析天平(瑞士Mettler公司);Agilent 1290-6538液質聯用儀(美國Agilent公司);DAC-HB 80型動態軸向壓縮工業色譜系統,80 mm×600 mm(江蘇漢邦科技有限公司)。
2 方法與結果
2.1 色譜條件
色譜柱為Acuity C18柱(250 mm×4.6 mm,5 μm),流動相為甲醇(A)-0.1%甲酸溶液(B)。梯度洗脫程序如下:0-40 min,15%-50%A;40-45 min,50%-100%A。流速1.0 mL·min-1,進樣體積10 μL,檢測波長242 nm。
2.2 質譜條件
干燥氣溫度350℃,毛細管電壓4 000 V,分離器電壓65 V,傳輸電壓135 V,質荷比掃描范圍50-1 300,負離子模式,流動相甲醇-水(1:1),流速0.5 mL·min-1,不經過色譜柱。
2.3 提取工藝
取金銀花10.0 kg,依次用10倍量、8倍量70%乙醇回流提取2次,合并提取液,濾過,濾液減壓濃縮至相對密度1.05 g·mL-1(25℃)。攪拌加入乙醇至乙醇體積分數為80%,靜置過夜,濾過,濾液減壓濃縮至無醇味,加水稀釋至1:1,靜置過夜,濾過,棄去不溶物,即得金銀花提取液,備用。斷氧化馬錢子苷的轉移率為91.2%。
2.4 純化工藝
2.4.1 樹脂篩選
由于“2.3”項下制備的提取液含大量極性雜質成分,需要用樹脂工藝純化。考察D101、AB-8、HPD100 3種大孔樹脂對樣品中斷氧化馬錢子苷的吸附、解吸附效果。取3種經預處理的樹脂各5 g(D101、AB-8、HPD100)置于100 mL具塞錐形瓶中,取金銀花提取濃縮液加入瓶中,于室溫靜置24 h,吸附平衡后,濾去樹脂,定量移取清液,測定斷氧化馬錢子苷的含量,計算吸附率。結果吸附率依次為72.1%、54.3%、62.7%,因此選擇D101型大孔吸附樹脂為應用樹脂。
2.4.2 洗脫溶劑的篩選
取D101大孔吸附樹脂40 g,取“2.3”項下的提取液100 mL上樣,平行5份進行樣品吸附后,水洗脫至Molish反應呈陰性后,分別用10%、20%、 30%、40%、60%乙醇溶液200 mL進行洗脫,收集洗脫液,減壓濃縮并干燥,HPLC法測定,計算洗脫率及斷氧化馬錢子苷含量,結果見表1。
由表1可知,5倍樹脂量10%乙醇洗脫液的斷氧化馬錢子苷含量最高,但洗脫不完全,30%、40%和60%乙醇洗脫液洗脫率雖高,但雜質也多,綜合成本等因素考慮,確定選擇20%乙醇作為洗脫溶劑,洗脫體積與樹脂質量比為5:1。
2.4.3 樹脂柱分離
2.4.3.1 樹脂預處理
D101型大孔樹脂用5%氫氧化鈉溶液4 BV浸泡24 h,加4 BV水洗至中性,加5%鹽酸溶液4 BV浸泡6 h,水洗至中性,加95%乙醇浸泡12 h后洗脫,至流出乙醇液與水混合不產生白色渾濁為止,用足量水洗至無醇味,備用。
2.4.3.2 吸附洗脫[12]
取預處理好的D101型大孔樹脂柱(200 mm× 1 000 mm),取“2.3”項下提取液上樣,吸附完成后先用水洗脫至Molish反應呈陰性后,再以5倍樹脂量20%乙醇洗脫,收集20%乙醇洗脫液,減壓濃縮,真空干燥,得斷氧化馬錢子苷粗品145.2 g(斷氧化馬錢子苷的質量分數為23.7%),備用。
2.5 動態軸向壓縮色譜分離
2.5.1 柱填料的選擇
實驗以正相硅膠(200-300目)和十八烷基硅烷鍵合硅膠(YMG-C18,75 μm)為填料,進行色譜分離,結果表明正相硅膠不僅成本低而且有較好的分離度,得到的目標產品性狀好,而十八烷基硅烷鍵合硅膠本身填料昂貴,并且所用色譜試劑成本太高,綜合考慮選擇以正相硅膠為分離填料。
2.5.2 色譜洗脫劑的選擇[13]
以薄層色譜法(TLC)為依據,根據不同溶劑的性質,選擇洗脫體系,比較分別以氯仿、二氯甲烷、乙酸乙酯與甲醇適當配比,對“2.4.3”項下的斷氧化馬錢子苷粗品進行單向展開,Rf值控制在0.2-0.8。結果表明,氯仿-甲醇、二氯甲烷-甲醇系統對樣品均有較好的分離作用,結合工業化生產實際,最終選擇二氯甲烷-甲醇系統作為色譜分離的洗脫劑。通過TLC最終確定柱色譜洗脫劑為二氯甲烷-甲醇系統,先用二氯甲烷-甲醇(12:1)洗脫除雜,然后用二氯甲烷-甲醇(9:1)洗脫,斷氧化馬錢子苷主要集中在9:1洗脫部位。
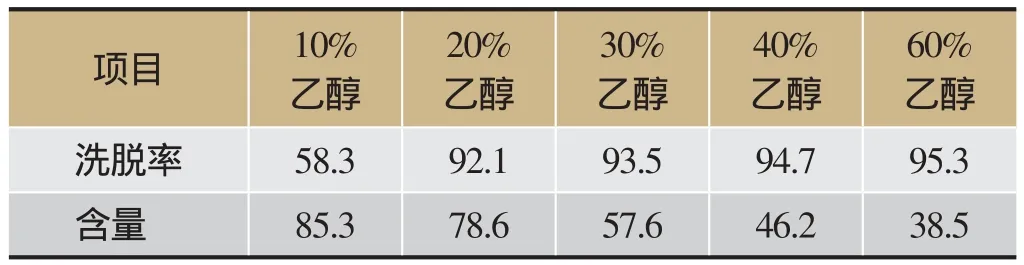
表1 不同濃度乙醇對斷氧化馬錢子苷的洗脫率和含量/%
2.5.3 正相工業色譜分離
采用動態軸向壓縮工業色譜柱(80 mm×600 mm),以正相硅膠為填料制備純化斷氧化馬錢子苷。將“2.4.3”項下斷氧化馬錢子苷粗品用流動相溶解,加適量硅膠拌樣,干燥,干法上樣,流動相為二氯甲烷-甲醇系統。洗脫程序如下:0-10 L,二氯甲烷-甲醇(12:1,V/V);10-20 L,二氯甲烷-甲醇(9:1,V/V)。體積流量30 mL·min-1,收集二氯甲烷-甲醇(9:1)洗脫的流分,濃縮干燥,即得白色粉末24.15 g,收率70.2%。
2.6 質量分數測定
2.6.1 對照品溶液的制備
精密稱取斷氧化馬錢子苷對照品5.1 mg置于25 mL容量瓶中,用甲醇溶解定容至刻度,搖勻,即得。
2.6.2 供試品溶液的制備
精密稱取“2.5.3”項下白色粉末5.3 mg至25 mL容量瓶中,用甲醇溶解稀釋至刻度,搖勻,10 000 r·min-1離心5 min,取上清液,即得。
2.6.3 樣品中斷氧化馬錢子苷的測定
分別取斷氧化馬錢子苷對照品和供試品溶液10 μL,按“2.1”項下色譜方法測定,用面積歸一化法計算斷氧化馬錢子苷質量分數為98.76%,保留時間30.5 min。色譜圖見圖1-4,峰1為斷氧化馬錢子苷。
2.7 結構鑒定
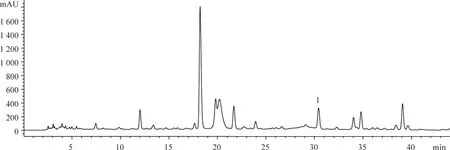
圖1 金銀花提取液的HPLC圖
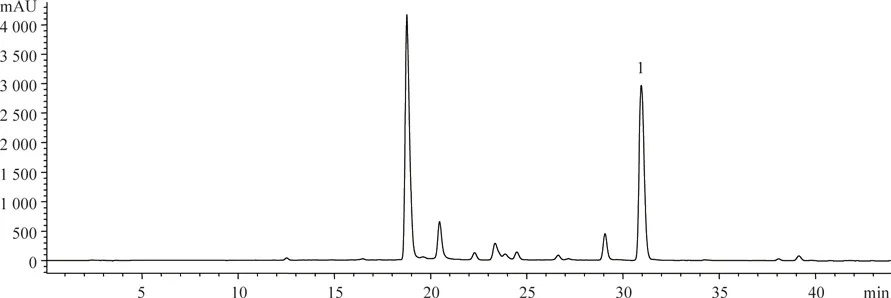
圖2 D-101大孔樹脂純化后樣品的HPLC圖
斷氧化馬錢子苷,白色粉末(甲醇),HR-ESIMSm/z:403.126 [M-H]-,807.261 [2M-H]-(ESI-MS圖見圖5),分子式為C17H24O11。1H-NMR(400 MHz,CD3OD)δ:7.47 (1H,d,J=1.8 Hz,H-3),5.49(1H,d,J= 3.8 Hz,H-1),4.66(1H,d,J= 7.9 Hz,H-1′),3.68(3H,s,-OCH3),5.65(1H,ddd,J= 10.1,9.9,17.1 Hz,H-8),2.95(1H,dd,J= 16.5,4.9 Hz,H-6),2.27(1H,dd,J=9.0,16.5 Hz,H-6),2.82(1H,m,H-9).13C-NMR(100MHz,CD3OD)δ: 176.7(C-7),169.4(C-11),154.1(C-3),135.0(C-8),121.0(C-10),110.6(C-4),100.5(C-1′),98.1(C-1),78.9(C-5′),78.5(C-3′),75.1(C-2′),72.0(C-4′),63.2(C-6′),52.1(-OCH3),45.8(C-9),35.6(C-6),29.1(C-5)。以上數據與文獻[14]報道一致,確定其為斷氧化馬錢子苷(secoxyloganin)。
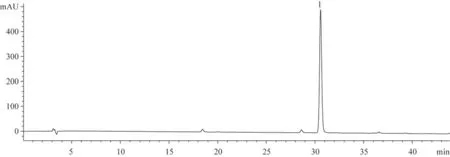
圖3 工業色譜純化后樣品的HPLC圖
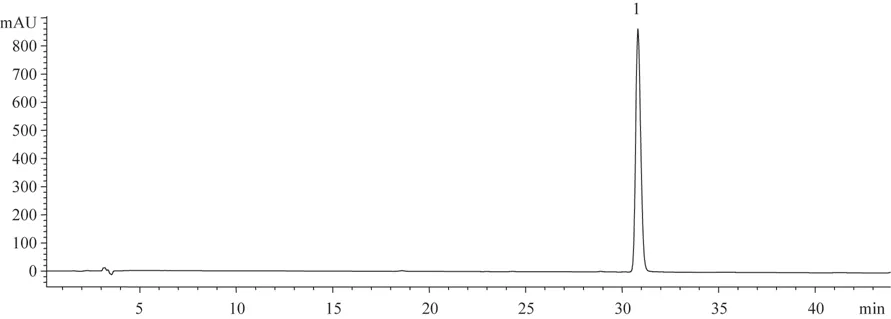
圖4 斷氧化馬錢子苷對照品的HPLC圖
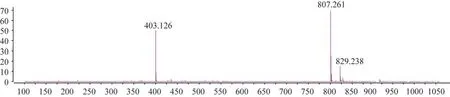
圖5 斷氧化馬錢子苷供試品溶液的ESI-MS圖
3 討論
由于斷氧化馬錢子苷具有較強的藥理活性,對該化合物的研究具有較大的實用價值。考慮到大規模制備成本和分離效果兩方面因素,本實驗以金銀花為原料,提取液先經醇沉、水沉及大孔樹脂等工藝除去大量雜質,然后采用動態軸向壓縮工業色譜分離制備斷氧化馬錢子苷,制備速度快、效率高,克服了傳統硅膠柱色譜洗脫時間長、有機溶劑用量大、得率低等缺點,且制備量大;而且以正相硅膠為填料不僅成本低而且有較好的分離度,得到的斷氧化馬錢子苷純度高。本方法操作簡單,重現性好。
斷氧化馬錢子苷為金銀花中的活性成分,但是在藥材中含量并不是很高,因此該化合物的標準品比較昂貴,直接用來研究其藥效、藥理活性等成本較高,因此本研究建立了一種快速大量制備高純度的斷氧化馬錢子苷的方法,分離制備的斷氧化馬錢子苷質量分數達98.76%,符合對照品的要求,為斷氧化馬錢子苷的制備提供了技術參考,對新藥研究及進一步控制金銀花藥材及其制劑的質量標準研究具有重要意義。
1 Chen J L, Blanc P, Stoddart C A,et al. New Iridoids from the Medicinal Plant Barleriaprionitis with potent activity against respiratory syncytial virus.J Nat Prod, 1998, 61(10): 1295-1297.
2 李醫明,曾華武,賀祥,等.玄參中環烯醚萜甙和苯丙素甙對LTB4產生及血小板聚集的影響.第二軍醫大學學報, 1999, 20(5): 301-303.
3 Tasdemir D, Scapozza L, Zerbe O,et al. Iridoid glycosides of leonuruspersicus.J Nat Prod, 1999, 62(6): 811-816.
4 Suzuki Y, Kondo K, Ikeda Y,et al. Antithrombotic effect of geniposide and genipin in the mouse thrombosis model.Planta Med, 2001, 67(9): 807-810.
5 國家藥典委員會.中華人民共和國藥典(一部).北京:化學工業出版社, 2010: 205-206.
6 邢俊波,李萍,劉云.不同產地、不同物候期金銀花中綠原酸的動態變化研究.中國藥學雜志, 2003, 38(1): 19-21.
7 高紅宇,金萬勤,郭立瑋.不同精致工藝對金銀花水提液中綠原酸含量的影響.世界科學技術-中醫藥現代化, 2010, 12(2): 241-244.
8 高曉艷,凌婭,蕭偉. 不同產地加工方法的金銀花中綠原酸、木犀草苷含量及指紋圖譜比較. 世界科學技術-中醫藥現代化, 2010, 12(2): 291-293.
9 畢躍峰,田野,裴姍姍.金銀花中裂環環烯醚萜苷類化學成分研究.中草藥, 2008, 39(1): 18-21.
10 田野.金銀花化學成分研究.鄭州:鄭州大學碩士學位論文, 2007.
11 陳雨,趙友誼,吳雙,等.灰氈毛忍冬花蕾水溶性化學成分研究.中藥材, 2012, 35(2): 231-234.
12 朱浩,侯世祥,孫毅毅,等.大孔吸附樹脂吸附純化不同中藥有效部位特性研究.中國中藥雜志, 1998, 23(10): 607-609.
13 王倩,朱靖博,顧豐穎,等.萃取與工業色譜相結合批量制備丹參中丹酚酸B.中國中藥雜志, 2007, 32(21): 2317-2318.
14 李暢,戴毅,張金博,等.金銀花中1個新的環烯醚萜苷類化合物.中草藥, 2013, 44(21): 2951-2954.
Isolation of High-Purity Secoxyloganin from Flos Lonicera Japonica by Industrial Dynamic Axial Compression Preparative Chromatography
Song Yaling1,2,3, Ni Fuyong1,2,3, Wang Xuejing1,2,3, Huang Wenzhe1,2,3, Wang Zhenzhong1,2,3, Xiao Wei1,2,3
(1.Jiangsu Kanion PharmaceuticalCo., Ltd., Lianyungang 222000, China; 2.State Key Laboratory of New-tech for Chinese Medicine Pharmaceutical Process, Lianyungang 222000, China; 3. The Key Laboratory for the New Technique Research of TCM Extraction and Purification, Lianyungang 222000, China)
This study was aimed to establish an industrial chromatographic separation technology of high-purity secoxyloganin. The 70% alcohol extract of Flos L. japonica was separated and concentrated by macroporous resin and industrial chromatography. Normal phase silica gel was taken as solid phase, and methylene chloridemethanol system as eluent for the dynamic axial compression column. The determination and characterization of secoxyloganin was detected by HPLC,1H-NMR,13C-NMR and HR-ESI-MS. The results showed that the content of secoxyloganin reached to 98.76%. It was suggested that the industrial chromatographic separation technology of secoxyloganin was convenient, rapid and efficient, which provided a new method for the preparation of highpurity ecoxyloganin.
Secoxyloganin, macroporous resin, dynamic axial compression, industrial chromatography, HPLC
10.11842/wst.2016.03.031
R284
A
(責任編輯:朱黎婷 張志華,責任譯審:朱黎婷)
2014-10-28
修回日期:2014-11-07
* 科學技術部“重大新藥創制”科技重大專項(2013ZX09402203):現代中藥創新集群與數字制藥技術平臺,負責人:王振中。
** 通訊作者:蕭偉,本刊編委,研究員級高級工程師,博士,主要研究方向:中藥新藥的研究與開發。

